肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一[1]。肝切除术是HCC的首选根治性治疗方法。目前用于肝脏切除手术的器械较多,但多数价格昂贵,难以普及[2-4]高频电刀(60 W)在传统手术中作为普通钳夹法的辅助器械[5],主要用于术中止血。笔者回顾分析2013年1月—2015年12月采用大功率高频电刀(120 W,high-power electrocautery,HPE)进行肝切除术的病例资料,并与钳夹法加超声刀在肝切除术中的应用进行比较,探究HPE临床应用价值。
1 资料与方法
1.1 一般资料
选取2013年1月—2015年12月在广西医科大学附属肿瘤医院接受肝切除手术治疗的HCC患者386例,根据断肝方式分为观察组(n=199)和对照组(n=187)。观察组采用120 W电凝输出功率电刀进行肝切除术,同时切肝时使用单极电凝法;对照组采用钳夹法加超声刀进行肝切除术。入组标准:所有患者均术后病理确诊为HCC,肝功能Child A~B级,有明确的肝切除手术指证,患者均于术前行CT或MRI检查显示肝脏病灶能够完整切除,无高频电刀、超声刀使用禁忌,无明显的肝肾功能不全、凝血功能障碍等手术禁忌证,历资料完整。观察组与对照组患者基线资料详见表1。
表1 两组患者术前一般资料
Table 1 General data of the two groups of patients
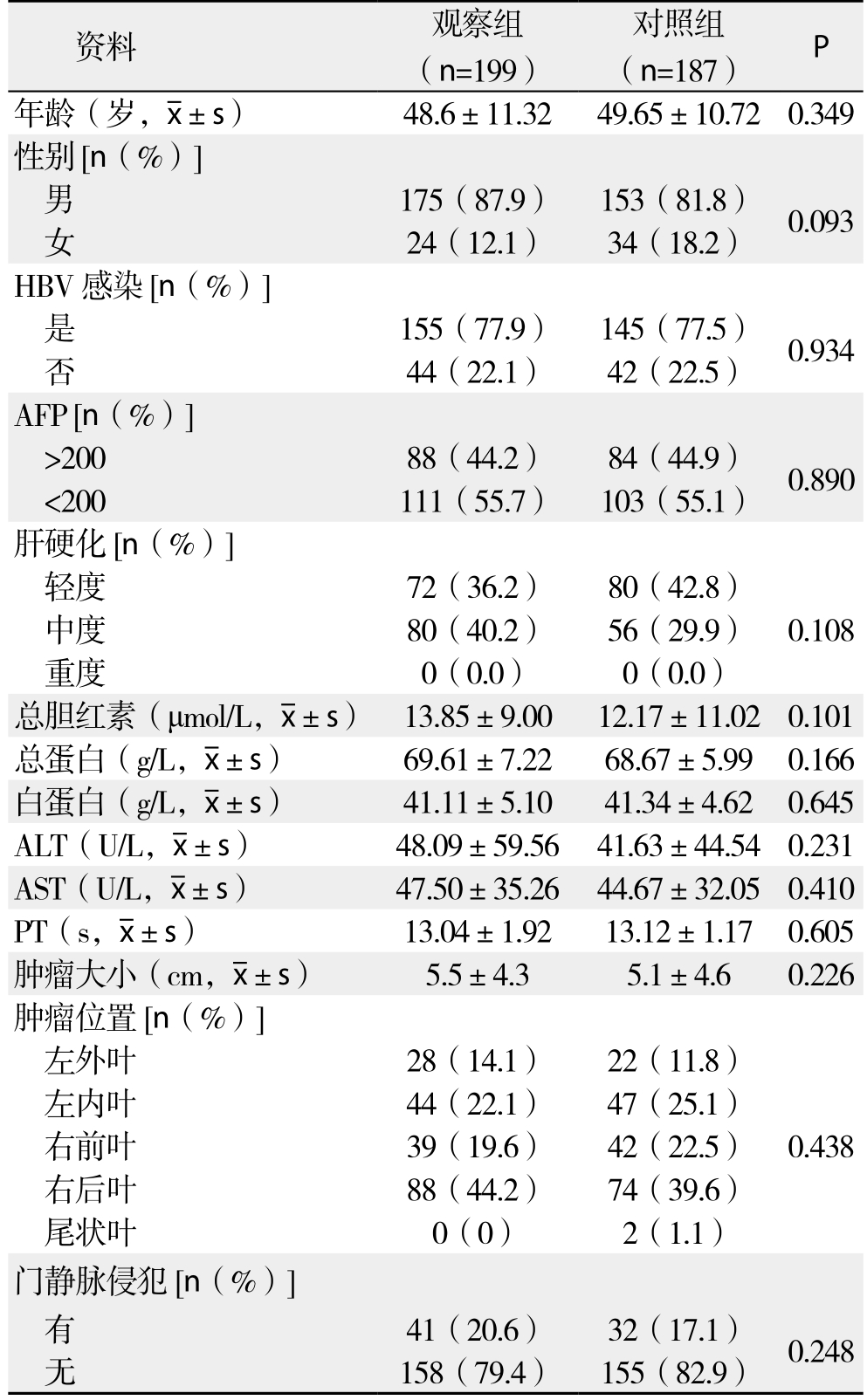
资料 观察组(n=199)对照组(n=187) P年龄(岁, ±s) 48.6±11.32 49.65±10.72 0.349性别 [n(%)]男175(87.9) 153(81.8) 0.093女24(12.1) 34(18.2)HBV感染 [n(%)]是155(77.9) 145(77.5) 0.934否44(22.1) 42(22.5)AFP [n(%)]>200 88(44.2) 84(44.9) 0.890<200 111(55.7) 103(55.1)肝硬化[n(%)]轻度 72(36.2) 80(42.8)0.108中度 80(40.2) 56(29.9)重度 0(0.0) 0(0.0)总胆红素(μmol/L,
±s) 48.6±11.32 49.65±10.72 0.349性别 [n(%)]男175(87.9) 153(81.8) 0.093女24(12.1) 34(18.2)HBV感染 [n(%)]是155(77.9) 145(77.5) 0.934否44(22.1) 42(22.5)AFP [n(%)]>200 88(44.2) 84(44.9) 0.890<200 111(55.7) 103(55.1)肝硬化[n(%)]轻度 72(36.2) 80(42.8)0.108中度 80(40.2) 56(29.9)重度 0(0.0) 0(0.0)总胆红素(μmol/L, ±s) 13.85±9.00 12.17±11.02 0.101总蛋白(g/L,
±s) 13.85±9.00 12.17±11.02 0.101总蛋白(g/L, ±s) 69.61±7.22 68.67±5.99 0.166白蛋白(g/L,
±s) 69.61±7.22 68.67±5.99 0.166白蛋白(g/L, ±s) 41.11±5.10 41.34±4.62 0.645 ALT(U/L,
±s) 41.11±5.10 41.34±4.62 0.645 ALT(U/L, ±s) 48.09±59.56 41.63±44.540.231 AST(U/L,
±s) 48.09±59.56 41.63±44.540.231 AST(U/L, ±s) 47.50±35.26 44.67±32.050.410 PT(s,
±s) 47.50±35.26 44.67±32.050.410 PT(s, ±s) 13.04±1.92 13.12±1.17 0.605肿瘤大小(cm,
±s) 13.04±1.92 13.12±1.17 0.605肿瘤大小(cm, ±s) 5.5±4.3 5.1±4.6 0.226肿瘤位置[n(%)]左外叶 28(14.1) 22(11.8)0.438左内叶 44(22.1) 47(25.1)右前叶 39(19.6) 42(22.5)右后叶 88(44.2) 74(39.6)尾状叶 0(0) 2(1.1)门静脉侵犯[n(%)]有41(20.6) 32(17.1) 0.248无158(79.4) 155(82.9)
±s) 5.5±4.3 5.1±4.6 0.226肿瘤位置[n(%)]左外叶 28(14.1) 22(11.8)0.438左内叶 44(22.1) 47(25.1)右前叶 39(19.6) 42(22.5)右后叶 88(44.2) 74(39.6)尾状叶 0(0) 2(1.1)门静脉侵犯[n(%)]有41(20.6) 32(17.1) 0.248无158(79.4) 155(82.9)
1.2 方法及要点
1.2.1 观察组 手术均由同一术者主刀完成,切肝时使用单极电凝法,不采用混凝或喷凝及电切等其他模式。手术方法:全麻下经上腹部反“L”型切口入腹,充分游离肝脏,术中超声定位确定肝切除线,肿瘤边缘至少保留0.5cm正常肝组织。高频电刀切肝组采用120 W电凝输出功率电刀直接进行肝切除。主要步骤包括:用电刀沿预切线切开肝包膜和浅层肝组织,在保持两断面间一定张力下,继续用电刀切开深面的肝组织,电刀保持恒定速度,以能顺利切开肝组织且创面无明显出血为标准;助手须与主刀医师配合熟练,保持肝切面良好张力,切肝过快或过慢均会导致创面止血不彻底、肝组织过度凝固、碳化,且肝组织易于黏连于刀头,影响肝组织的顺利切开。电刀切线要呈相对直线。切肝过程中一般1 mm以下的管道大多可迅速凝固,断面无出血或胆汁漏,不必结扎。2~3 mm肝静脉可完全凝固,2 mm以上的Glisson系统的管道建议电刀解剖清楚后行结扎离断。接近肝门或重要管道结构时,首先应使用高功率电刀进行解剖出重要管道后再切肝组织。肝切除后, 肝断面出血点予以120 W电凝或缝扎止血,胆汁漏应予以缝扎,肝断面处理满意可不对拢缝合以减少肝组织的损伤。高频电刀切肝组切肝过程中不采用血管钳钳夹肝组织,解剖更精准、创面更清晰。
1.2.2 对照组 按传统肝切技术在肝门阻断下采用钳夹法联合超声刀进行肝切除。手术方法切肝步骤为:用超声刀沿着预切线切开肝包膜, 采用分离钳钳夹肝组织, 吸引器将碎烂肝组织吸收后,显露肝内管道结构,1 mm及以下管道予以电凝切断,1 mm以上管道予以结扎或缝扎。肝断面渗血以电凝止血,重要管道结构皆经解剖、显露后另行处理。肝切除后肝断面处理同观察组。两组患者肝断面皆经严密止血并确认无胆汁漏后,表面覆盖止血纱布。放置引流管后关腹。
1.2.3 术后处理 所有患者术后均给予抗感染、止血、护肝营养支持及外科术后常规护理等。每日仔细观察患者恢复情况,记录每日引流量、引流性状、体温变化、术后1、3、5、7 d血常规、肝肾功能、凝血功能等相关血液指标及观察并发症等情况。
1.2.4 评价指标 比较两组术中肝门阻断时间(近似于切肝时间,多次阻断者计算累积时间)、手术时间、术中出血量、术中及术后输红细胞情况、术后拔管时间、术后肝功能丙氨酸氨基转移酶(ALT)、谷氨酸氨基转移酶(AST)及凝血酶原时间(PT)、术后并发症发生率及术后住院时间等指标。
1.3 统计学处理
计量资料以均数±标准差( ±s)表示,采用独立样本t检验;计数资料采用χ2检验或精确概率法。SPSS 11.5统计软件进行统计学处理,P<0.05为差异有统计学意义。
±s)表示,采用独立样本t检验;计数资料采用χ2检验或精确概率法。SPSS 11.5统计软件进行统计学处理,P<0.05为差异有统计学意义。
2 结 果
2.1 两组手术相关指标比较
所有患者均顺利切除HCC,观察组手术过程中均未出现因大功率高频电流引起的灼伤、心电异常等;术后均恢复顺利,两组患者均无围手术期死亡。两组术中输血比例无统计学差异(P=0.958),观察组术中出血量低于对照组,但无统计学差异(P=0.486);观察组肝门阻断时间、手术时间明显低于对照组(均P<0.05)(表2)。
表2 两组手术相关指标比较
Table 2 Comparison of the intraoperative variables between the two groups
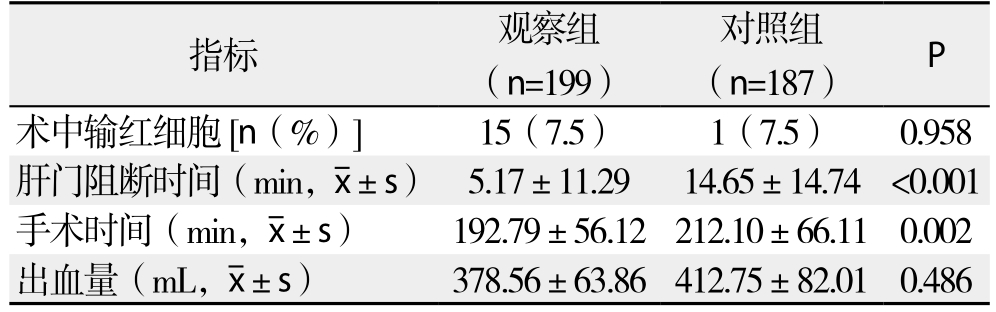
指标 观察组(n=199)对照组(n=187) P术中输红细胞[n(%)] 15(7.5) 1(7.5) 0.958肝门阻断时间(min, ±s) 5.17±11.29 14.65±14.74 <0.001手术时间(min,
±s) 5.17±11.29 14.65±14.74 <0.001手术时间(min, ±s) 192.79±56.12212.10±66.11 0.002出血量(mL,
±s) 192.79±56.12212.10±66.11 0.002出血量(mL, ±s) 378.56±63.86412.75±82.01 0.486
±s) 378.56±63.86412.75±82.01 0.486
2.2 两组术后相关指标比较
两组术后1、3、7 d总胆红素、PT均无统计学差异(均P>0.05);观察组术后第1、3天AST平均值及第3天ALT、AST平均值均低于对照组(均P<0.05);术后第3天,观察组白蛋白平均值高于对照组(P<0.05)。观察组术后输红细胞比例、住院时间均优于对照组(均P<0.05);并发症主要为低蛋白血症、胸腔积液、胆汁漏、腹腔感染,对照组并发症率高于观察组(P<0.05);两组术后引流时间无统计学差异(P>0.05)(表3)。
表3 两组术后肝功能变化及一般情况比较
Table 3 Postoperative liver function changes and other variables the two groups

指标 观察组(n=199)对照组(n=187) P术后第1天总胆红素(μmol/L, ±s) 22.91±24.70 20.69±14.89 0.289总蛋白(g/L,
±s) 22.91±24.70 20.69±14.89 0.289总蛋白(g/L, ±s) 51.97±5.82 51.67±5.86 0.615白蛋白(g/L,
±s) 51.97±5.82 51.67±5.86 0.615白蛋白(g/L, ±s) 31.72±4.42 31.75±4.87 0.947 ALT(U/L,
±s) 31.72±4.42 31.75±4.87 0.947 ALT(U/L, ±s) 297.27±278.75405.22±767.050.064 AST(U/L,
±s) 297.27±278.75405.22±767.050.064 AST(U/L, ±s) 335.28±307.67401.24±339.520.046 PT(s,
±s) 335.28±307.67401.24±339.520.046 PT(s, ±s) 15.40±2.24 15.58±1.92 0.414术后第3天总胆红素(μmol/L,
±s) 15.40±2.24 15.58±1.92 0.414术后第3天总胆红素(μmol/L, ±s) 35.10±141.99 24.10±23.06 0.296总蛋白(g/L,
±s) 35.10±141.99 24.10±23.06 0.296总蛋白(g/L, ±s) 54.75±7.35 53.24±6.78 0.036白蛋白(g/L,
±s) 54.75±7.35 53.24±6.78 0.036白蛋白(g/L, ±s) 32.42±5.14 32.32±3.93 0.839 ALT(U/L,
±s) 32.42±5.14 32.32±3.93 0.839 ALT(U/L, ±s) 258.45±249.27316.02±244.820.023 AST(U/L,
±s) 258.45±249.27316.02±244.820.023 AST(U/L, ±s) 156.25±139.22194.99±205.340.030 PT(s,
±s) 156.25±139.22194.99±205.340.030 PT(s, ±s) 14.61±2.19 14.99±2.02 0.077术后第7天总胆红素(μmol/L,
±s) 14.61±2.19 14.99±2.02 0.077术后第7天总胆红素(μmol/L, ±s) 20.28±27.50 18.48±16.09 0.437总蛋白(g/L,
±s) 20.28±27.50 18.48±16.09 0.437总蛋白(g/L, ±s) 58.97±7.69 58.32±8.54 0.436白蛋白(g/L,
±s) 58.97±7.69 58.32±8.54 0.436白蛋白(g/L, ±s) 32.73±5.09 33.26±5.03 0.303 ALT(U/L,
±s) 32.73±5.09 33.26±5.03 0.303 ALT(U/L, ±s) 93.32±89.51 96.72±78.46 0.692 AST(U/L,
±s) 93.32±89.51 96.72±78.46 0.692 AST(U/L, ±s) 49.84±51.38 43.99±39.39 0.212 PT(s,
±s) 49.84±51.38 43.99±39.39 0.212 PT(s, ±s) 14.24±2.77 14.15±1.97 0.692术后并发症[n(%)] 42(21.1) 64(34.2) 0.043术后输红细胞[n(%)] 48(25.7) 73(36.7) 0.020住院时间(d,
±s) 14.24±2.77 14.15±1.97 0.692术后并发症[n(%)] 42(21.1) 64(34.2) 0.043术后输红细胞[n(%)] 48(25.7) 73(36.7) 0.020住院时间(d, ±s) 8.87±2.55 12.15±3.87 0.032术后拔管时间(d,
±s) 8.87±2.55 12.15±3.87 0.032术后拔管时间(d, ±s) 5.83±5.66 6.29±5.76 0.436
±s) 5.83±5.66 6.29±5.76 0.436
2.3 随访
所有患者均术后2年内每3个月随访1次,2年后每3~6个月随访1次。观察组1、2、3年总生存率为84.1%,73.2%,66.9%;对照组1、2、3年总生存率为83.8%,72.8%,62.7%。两组间的总生存率无统计学差异(P=0.859)。
3 讨 论
术中出血和围术期输血是影响肝切除术预后的重要因素[6]。由于HCC发生时常伴随不同程度肝硬化,HCC术中出血量增加及围术期输血量的增加更容易导致术后慢性肝功能不全及相应并发症发生[7-9]。超声刀、Ligasure、射频消融刀等外科手术能量系统的应用已使“无血切肝技术”成为可能[10-12]。尽管如此,研究[13-15]表明围术期输血率仍达15%~30%。选用合适的电外科器械进行肝切除术仍备受争议[16]。作为肝切除术中最传统且最常用的方法,钳夹法在切肝过程中显露肝脏组织中管道结构不清晰,术中出血及术后胆汁漏等并发症发生的概率较高[16-17]。受高频电刀(80 W)电凝止血的启发,笔者采用120 W高频电刀进行肝癌切除术。结果显示,与传统的钳夹法相比,120 W高频电刀使用可减少术中出血量与降低术后输血率、显著减少肝门阻断时间、缩短手术时间,进而能降低术后并发症发生及对术后肝功能影响更小,缩短住院时间等优点。相关文献[18]报道术中利用普通的手术器械仍能完成精确的肝脏切除,而高频电刀在手术中能更好的显露肝内解剖的结构,达到精确肝切除的目的。能量器械的使用加上精细的 解剖可做到不阻断入肝血流[19];在有经验的中心近年来肝切除术围手术期病死率为零[20]。
我们的观察结果表明,观察组术中出血均值仍然较对照组低。HPE可有效降低术中出血,主要机制如下:⑴ HPE在肝实质离断过程中肝断面形成一厚度大约1.0~1.5 mm凝固碳化保护层,3 mm左右的肝静脉也可迅速凝固,肝断面渗血显著减少;⑵ 对于切除深部肝脏肿瘤经常会受到术野狭小的影响,HPE分离肝断面整齐,切肝的过程同时就是止血的过程,能达到术野止血彻底、清晰、肝脏解剖清晰、减少术中误伤大血管、避免发生较大范围的损伤出血的效果;与此同时,HPE有助于减短切肝时间、减短手术时间,都有助于减少出血量及术中、术后的输血量。
另一方面,本资料观察结果表明术中肝门阻断时间较普通钳夹组明显缩短。HPE在进行切肝手术时,由于大功率高频输出效率,存在电热能加重残肝功能损害的潜在可能性。但本组观测结果表明,观察组患者术后第1、3、7天的AST、ALT、PT等肝功能、凝血功能指标等与对照组相比无统计学差异,两组患者术后肝功能恢复状况未明显差于对照组。其中主要的原因是因为观察组肝门阻断时间显著低于对照组。尽管Pringle肝门阻断法在肝实质离断过程中,对于控制术中出血有较好作用,但长时间、多次肝门阻断造成残肝缺血再灌注损伤,尤其是在肝硬化患者中,其显著影响围术期肝功能恢复[21],甚至造成短期复发[22]。虽然普通钳夹法肝门阻断和电刀的热效应均可造成肝脏的损伤,但本研究的观测结果表明HPE切肝通过缩短阻断肝门时间来减少缺血再灌注对于肝功能的影响,进而促进术后肝功能的恢复。与此同时,HPE具有上述缩短切肝时间、减少出血量、以及术中、术后的输血量等优点,都有助于缓解这些因素对于肝功能的损害。
值得注意的是,高频电刀使用前应正确连接,选用合适的负极板,负极板保持平整;体质量25 kg以下尽量不使用电刀;手术台管理好电刀笔,同时注意防火安全。
术者通过临床应用体会,相对于传统钳夹法,高频电刀具有使用方便,术中解剖清晰,止血效果好,有效缩短肝门阻断时间,手术时间短,术后肝功能恢复快,术后并发症少、输红细胞比例低及住院时间短等优点,并且具有使用安全可靠和较好的临床应用。
参考文献
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108. doi: 10.3322/caac.21262.
[2] 尹震宇, 王付强, 彭友缘, 等. 超声乳化吸引刀联合超声刀在腹腔镜肝肿瘤切除术中的应用[J]. 中华肝胆外科杂志, 2011,17(12):1013–1014. doi: 10.3760/cma.j.issn.1007–8118.2011.12.017.Yin ZY, Wang FQ, Peng YY, et al. Application of cavitron ultrasonic surgical aspirator plus ultrasound knife in laparoscopic hepatectomy for liver tumors[J]. Chinese Journal of Hepatobiliary Surgery, 2011, 17(12):1013–1014. doi: 10.3760/cma.j.issn.1007–8118.2011.12.017.
[3] 姚鹏, 王晓路, Morris DL. 射频消融(RFA)辅助的无血切肝技术[J]. 中华肝胆外科杂志, 2008, 14(5):346–348. doi: 10.3760/cma.j.issn.1007–8118.2008.05.019.Yao P, Wang XL, Morris DL. Bloodless liver resection assisted by radiofrequency ablation[J]. Chinese Journal of Hepatobiliary Surgery, 2008, 14(5):346–348. doi: 10.3760/cma.j.issn.1007–8118.2008.05.019.
[4] 丁义涛. 原发性肝癌外科手术过程无血切肝技术的应用[J]. 中华肝胆外科杂志, 2007, 13(1):7–9. doi: 10.3760/cma.j.issn.1007–8118.2007.01.004.Ding YT. Bleeding control in hepatectomy for primary hepatocellular carcinoma[J]. Chinese Journal of Hepatobiliary Surgery, 2007, 13(1):7–9. doi: 10.3760/cma.j.issn. 1007–8118.2007.01.004.
[5] Fischer L, Seilercm, Broelsch CE, et al. Hemostatic efficacy of TachoSil in liver resection compared with argon beam coagulator treatment: an open, randomized, prospective, multicenter, parallelgroup trial[J]. Surgery, 2011, 149(1):48–55. doi: 10.1016/j.surg.2010.02.008.
[6] Liu L, Wang Z, Jiang S, et al. Perioperative allogenenic blood transfusion is associated with worse clinical outcomes for hepatocellular carcinoma: a meta-analysis[J]. PLoS One, 2013,8(5):e64261. doi: 10.1371/journal.pone.0064261.
[7] Yang T, Zhang J, Lu JH, et al. Risk factors influencing postoperative outcomes of major hepatic resection of hepatocellular carcinoma for patients with underlying liver diseases[J]. World J Surg, 2011,35(9):2073–2082. doi: 10.1007/s00268–011-1161–0.
[8] Aramaki O, Takayama T, Higaki T, et al. Decreased blood loss reduces postoperative complications in resection for hepatocellular carcinoma[J]. J Hepatobiliary Pancreat Sci, 2014, 21(8):585–591.doi: 10.1002/jhbp.101.
[9] Li J, Lei B, Nie X, et al. A comprehensive method for predicting fatal liver failure of patients with liver cancer resection[J].Medicine, 2015, 94(17):e784. doi: 10.1097/MD.0000000000000784
[10] Bodzin AS, Leiby BE, Ramirez CG, et al. Liver resection using cavitron ultrasonic surgical aspirator (CUSA) versus harmonic scalpel: a retrospective cohort study[J]. Int J Surg, 2014, 12(5):500–503. doi: 10.1016/j.ijsu.2014.02.007.
[11] Ikeda M, Hasegawa K, Sano K, et al. The vessel sealing system(LigaSure) in hepatic resection: a randomized controlled trial[J]. Ann Surg, 2009, 250(2):199–203. doi: 10.1097/SLA.0b013e3181a334f9.
[12] Savlid M, Strand AH, Jansson A, et al. Transection of the liver parenchyma with an ultrasound dissector or a stapler device: results of a randomized clinical study[J]. World J Surg, 2013, 37(4):799–805. doi: 10.1007/s00268–012-1884–6.
[13] Imamura H, Seyama Y, Kokudo N, et al. One thousand fifty-six hepatectomies without mortality in 8 years[J]. Arch Surg, 2003,138(11):1198–1206.
[14] Jarnagin WR, Gonen M, Fong Y, et al. Improvement in perioperative outcome after hepatic resection: analysis of 1,803 consecutive cases over the past decade[J]. Ann Surg, 2002, 236(4):397–406.
[15] Takayama T, Makuuchi M, Kubota K, et al. Randomized comparison of ultrasonic vs clamp transection of the liver[J]. Arch Surg, 2001, 136(8):922–928.
[16] Simillis C, Li T, Vaughan J, Becker LA, et al. Methods to decrease blood loss during liver resection: a network metaanalysis[J]. Cochrane Database Syst Rev, 2014, (4):CD010683. doi:10.1002/14651858.CD010683.pub2.
[17] Schwarz RE. Experience with a simple clamp-crush technique devoid of other devices for liver resections in a surgical oncology practice[J]. Am J Surg, 2015, 209(3):503–508. doi: 10.1016/j.amjsurg.2014.09.025.
[18] 贾长库, 翁杰, 陈有科, 等. 以解剖性肝切除为基础的精准肝切除治疗肝胆恶性肿瘤[J]. 中国普通外科杂志, 2013, 22(1):109–112.doi: 10.7659/j.issn.1005–6947.2013.01.025.Jia CK, Weng J, Chen YK, et al. Anatomic hepatectomy as basis for precise hepatectomy in the treatment of malignant hepatobiliary tumors[J]. Chinese Journal of General Surgery, 2013, 22(1):109–112. doi: 10.7659/j.issn.1005–6947.2013.01.025.
[19] Fu SY, Lau WY, Li GG, et al. A prospective randomized controlled trial to compare Pringle maneuver, hemihepatic vascular inflow occlusion, and main portal vein inflow occlusion in partial hepatectomy[J]. Am J Surg, 2011, 201(1):62–69. doi: 10.1016/j.amjsurg.2009.09.029.
[20] Cheung TT, Poon RT, Yuen WK, et al. Long-term survival analysis of pure laparoscopic versus open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: a single-center experience[J]. Ann Surg, 2013, 257(3):506–511. doi: 10.1097/SLA.0b013e31827b947a.
[21] Sugiyama Y, Ishizaki Y, Imamura H, et al. Effects of intermittent Pringle's manoeuvre on cirrhotic compared with normal liver[J]. Br J Surg, 2010, 97(7):1062–1069. doi: 10.1002/bjs.7039.
[22] 夏锋, 王曙光, 别平, 等. Pringle法导致的肝脏缺血再灌注损伤对肝癌肝切除患者预后的影响[J]. 中华消化外科杂志, 2009,8(2):103–106.doi: 10.3760/cma.j.issn.1673–9752.2009.02.010.Xia F, Wang SG, Bie P, et al. Influence of hepatic ischemiareperfusion injury induced by Pringle maneuver on the prognosis of hepatocellular carcinoma patients after hepatectomy[J]. Chinese Journal of Digestive Surgery, 2009, 8(2):103–106.doi: 10.3760/cma.j.issn.1673–9752.2009.02.010.
