胆管癌是最常见的胆道恶性肿瘤之一,约占人类消化道恶性肿瘤总病例的3%[1]。中国胆管癌患者人数众多,在全世界胆管癌患者总数中所占比例约为55%[2],因此在我国研究胆管癌具有特殊的条件和意义。近年来,诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)被报道在多种肿瘤组织中存在高表达[3-5]。iNOS的上调表达与肿瘤的恶性程度相关,并可预测不良预后[6]。笔者[7]前期研究发现iNOS在胆管癌细胞中存在高表达,且与胆管癌的发展呈正相关,但其在胆管癌中的生物学作用及机制尚不明确。本研究通过化学合成iNOS-siRNA沉默iNOS基因,检测胆管癌细胞增殖能力以及凋亡情况的变化,从而探讨iNOS在胆管癌发生发展中的作用机制,为胆管癌的基因治疗提供实验基础和理论依据。
1 材料与方法
1.1 主要材料
人胆管癌细胞株QBC939 由湖南省人民医院临床医学研究所保存。β-actin一抗、羊抗兔二抗、RIPA蛋白裂解液及SDS-PAGE蛋白上样缓冲液购自上海碧云天公司。iNOS抗体购自美国abcam公司。MTT、DMSO及Lipofectamine 2000购自Invitrogen公司。1640培养基、胎牛血清、胰酶购自美国Hyclone公司。免疫组化试剂盒购自博士德公司。RNA提取试剂盒购自美国Omega公司。PrimeScript®RT reagent Kit逆转录试剂盒、PrimeScript®RT reagent Kit逆转录试剂盒购自大连宝生物公司。Annexin V Apoptosis Detection Kit APC流式凋亡试剂盒购自eBioscience公司。
1.2 实验方法
1.2.1 针对iNOS设计合成特异性siRNA序列设计合成的序列分别为siRNA1:CCA TCC GCT CCA CAC TAA A;siRNA2:CAG TGG AAT GAG TCC TTT A;siRNA3:AGA CGT CTT TGG AAT CCA A; 阴 性 siRNA:GCT GGT TAT TGC TAA CAT A。
1.2.2 细胞培养与转染 实验分空白对照组、阴性对照组、iNOS-siRNA转染组(siRNA1、siRNA2、siRNA3)。空白对照组:正常培养的QBC939细胞。阴性对照组:转染阴性siRNA的QBC939细胞。iNOS-siRNA转染组:转染iNOS-siRNA的QBC939细胞。用1640培养基+10%胎牛血清+1%青链霉素溶液培养,5%CO2,37 ℃恒温培养QBC39细胞,将处于对数生长期的QBC939细胞在六孔板中培养。转染在六孔板中进行,细胞铺满70%~90%,转染前4 h换新培养基。将混在一起的siRNA-Lipofectamine 2000混合液体均匀加入六孔板中。轻轻晃动六孔板,使其均匀分布,然后置于37 ℃、5%CO2培养箱中培养24 h。在荧光显微镜下观察,转染效率最高时,筛选并扩大培养稳定表达细胞株。
1.2.3 RT-PCR检测转染后各组QBC939细胞中mRNA的表达 iNOS基因的上游引物序列为5'-GGA GCC AGC TCT GCA TTA TC-3',下游引物序列为5'-ACT CCA TGC CCA GGA AGG AAG G-3';内参基因β-actin的上游引物序列为5'-GAG AGA TGA CCC AGA TCA TGT-3',下游引物序列为5'-TTT TGT CTC CAA GGG ACC AG-3'。收集iNOS-siRNA转染组、阴性对照组及空白对照组QBC939细胞,以Omega RNA提取试剂盒提取各细胞总mRNA,逆转录成cDNA,然后通过PCR扩增。PCR反应条件为95 ℃预变性10 min,95 ℃变形15 s,60 ℃退火 60 s,70 ℃延伸 40 s,共 40个循环。取2 µL产物进行1.5%琼脂糖凝胶电泳检测,将目的基因和内参基因条带的灰度比值作为iNOS mRNA的相对表达量。
1.2.4 Western blot检测转染后各组QBC939细胞中iNOS蛋白的表达 收集iNOS-siRNA转染组、阴性对照组及空白对照组QBC939细胞,提取20 μL细胞总蛋白,进行SDS-PAGE凝胶电泳。用5%的BSA封闭液封闭1 h后,加iNOS抗体(1:1 000)4 ℃过夜,二抗(羊抗兔IgG)室温孵育1 h,BeyoECL Western荧光检测试剂检测蛋白,X光曝光显影。根据条带灰度值计算iNOS蛋白的相对表达水平。
1.2.5 MTT检测转染后各组QBC939细胞的生长消化重悬后用培养液调整细胞浓度为1 000/孔,接种于96孔板,分别处理培养0、12、24、36、60 h用于检测,每组设3个平行复孔。细胞贴壁后开始实验,各组每个取样时间点取3孔,吸除培养液,加入MTT液15 µL,放入培养箱中孵化。吸除MTT液,加入DMSO 150 µL振荡10 min后,在96孔酶标仪上读取OD值。
1.2.6 流式细胞术检测转染后各组QBC939细胞的周期 收集iNOS-siRNA转染组、阴性对照组及空白对照组QBC939细胞,以70%乙醇预冷,4 ℃过夜固定,1 000 r/min离心5 min后沉淀细胞,PBS重悬细胞后再次离心并沉淀细胞。加入碘化丙啶(PI)染色液,37 ℃避光温浴30 min,适当添加1~1.5 mL染色液重悬使细胞通过率达到200~350细胞/s,流式细胞仪检测各细胞周期所占比例。
1.2.7 流式细胞术检测转染后各组QBC939细胞的凋亡 收集iNOS-siRNA转染组、阴性对照组及空白对照组QBC939细胞,PBS重悬并计数,取5~10万重悬的细胞,加入195 μL Annexin V-APC结合液重悬细胞沉淀。加入5 μL Annexin V-APC,混匀后4 ℃避光孵育15 min,再加入5 μL PI染色液,混匀后4 ℃避光孵育5 min,随即进行流式细胞仪检测。
1.3 统计学处理
应用SPSS 16.0统计学软件进行分析,实验得到的结果以均数±标准差(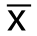 ±s)表示,用Oneway ANOV法分析各组差异,若方差齐性,则采取LSD法进行分析;方差不齐,则采取t检验分析。P<0.05为差异有统计学意义。
±s)表示,用Oneway ANOV法分析各组差异,若方差齐性,则采取LSD法进行分析;方差不齐,则采取t检验分析。P<0.05为差异有统计学意义。
2 结 果
2.1 转染效果鉴定
合成的siRNA经转染试剂Lipofectamin 2000导入人胆管癌QBC939细胞,在显微镜下,转染成功的细胞可见有绿色荧光表达,而未转染成功的细胞则不会见到荧光(图1)。通过计算,实验组细胞的转染率都在70%以上,能满足后续实验要求。
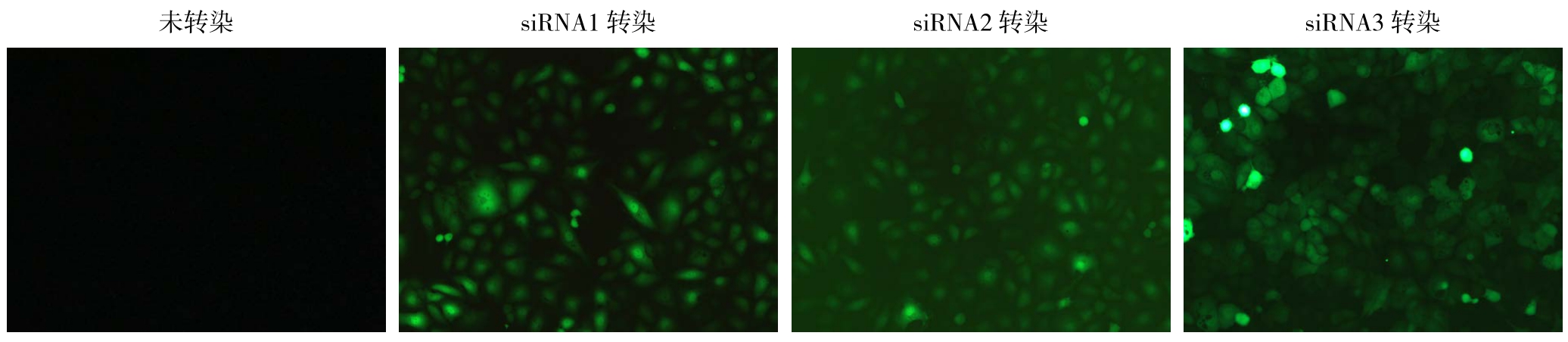
图1 各组细胞的绿色荧光表达情况(×200)
Figure 1 Green fluorescence expressions of each group of cells (×200)
2.2 iNOS干扰效果分析
RT-PCR检测结果显示,3个siRNA转染组QBC939细胞中iNOS mRNA的相对表达量分别为0.46±0.02、0.20±0.04、0.56±0.05;阴性对照组和空白对照组QBC939细胞中iNOS mRNA的相对表达量分别为1.02±0.13、1.00±0.15;转染组QBC939细胞中iNOS mRNA的表达量明显低于阴性对照组和空白对照组(P<0.05),阴性对照组和空白对照组QBC939细胞中iNOS mRNA的表达量差异无统计学意义(P>0.05)(图2)。
Western blot检测结果显示,3个siRNA转染组QBC939细胞中iNOS蛋白的相对表达量分别为0.60±0.07、0.48±0.07、1.07±0.10,阴性对照组和空白对照组QBC939细胞中iNOS蛋白的相对表达量分别为1.42±0.11、1.43±0.14;转染组QBC939细胞中iNOS蛋白的表达量明显低于阴性对照组和空白对照组(均P<0.05),阴性对照组和空白对照组QBC939细胞中iNOS蛋白的表达量差异无统计学意义(P>0.05)(图3)。
转染组中siRNA2对QBC939细胞进行转染后iNOS基因沉默效果最佳,将选择用于后续实验。
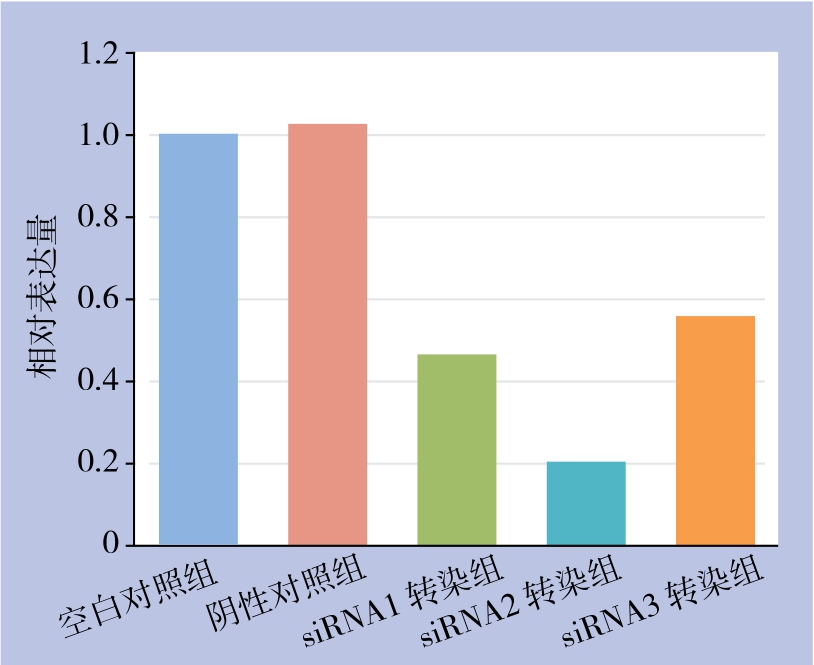
图2 各组细胞iNOS mRNA相对表达水平
Figure 2 Relative level of iNOS mRNA expression in each group of cells
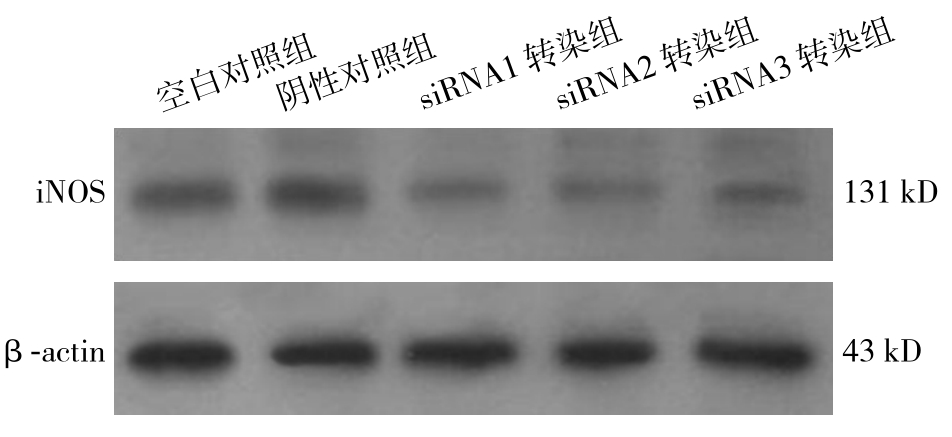
图3 各组细胞iNOS蛋白的表达
Figure 3 The iNOS protein expression in each group of cells
2.3 iNOS-siRNA转染对QBC939细胞的生长的影响
MTT检测结果显示,iNOS-siRNA转染组QBC939细胞的生长速度明显低于阴性对照组和空白对照组(均P<0.05);阴性对照组和空白对照组比较,差异无统计学意义(P>0.05)(图4)。
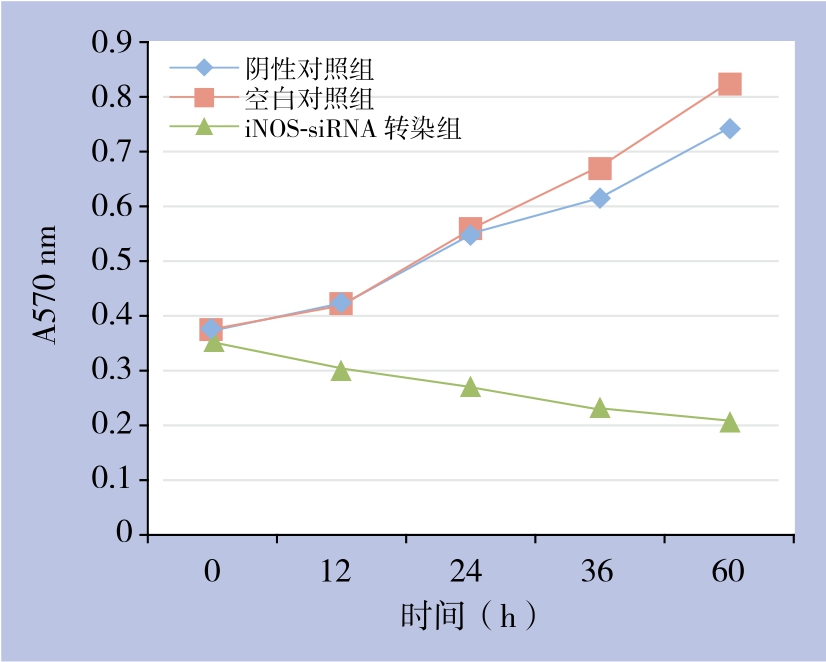
图4 各组细胞生长情况
Figure 4 Proliferation status in each group of cells
2.4 iNOS-siRNA转染对QBC939细胞细胞周期的影响
流式细胞术检测结果显示,iNOS-siRNA转染组、阴性对照组及空白对照组QBC939细胞中,G0/G1期细胞的比例分别为(82.39±3.43)%、(60.61±3.23)%、(59.35±3.11)%,iNOS-siRNA转染组QBC939细胞中G0/G1期细胞的比例明显多于阴性对照组和空白对照组(P<0.05),阴性对照组与空白对照组之间的差异无统计学意义(P>0.05)。iNOS-siRNA转染组QBC939细胞中S期和G2/M期细胞的比例则明显少于阴性对照组和空白对照组(P<0.05),阴性对照组与空白对照组之间的差异无统计学意义(P>0.05)(图5)。iNOS-siRNA转染组、阴性对照组及空白对照组QBC939细胞的增值指数分别为17.61±1.29、39.39±1.26和40.65±1.71,iNOS-siRNA转染组QBC939细胞的增值指数明显低于阴性对照组和空白对照组(均P<0.05),阴性对照组与空白对照组之间的差异无统计学意义(P>0.05)。
2.5 iNOS-siRNA转染对QBC939细胞凋亡的影响
流式细胞术检测结果显示,iNOS-siRNA转染组、阴性对照组及空白对照组QBC939细胞的凋亡率分别为(30.39±5.83)%、(12.51±1.82)%、(6.21±2.13)%,iNOS-siRNA转染组QBC939细胞的凋亡率明显高于阴性对照组和空白对照组(均P<0.05),阴性对照组与空白对照组之间的差异无统计学意义(P>0.05)(图6)。
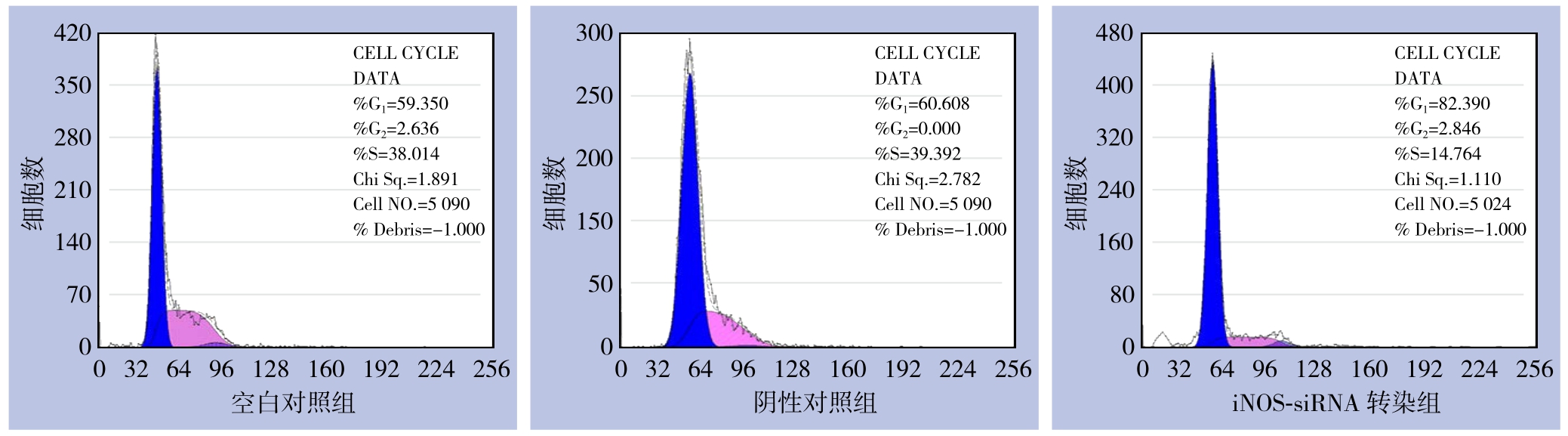
图5 各组细胞周期检测情况
Figure 5 Cell-cycle analysis of each group of cells
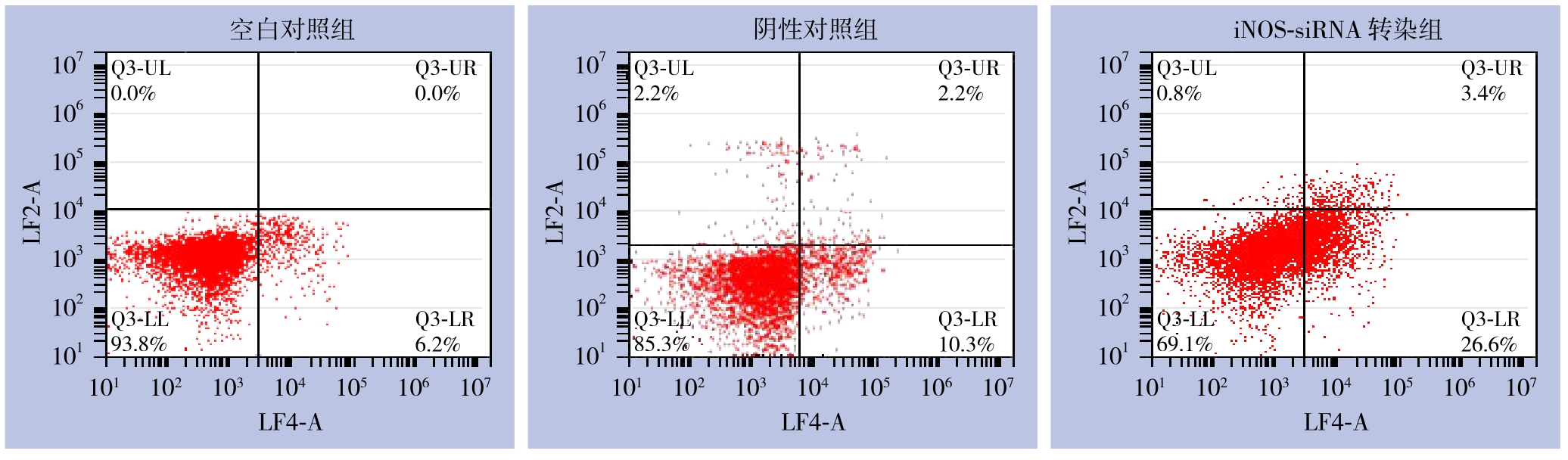
图6 各组细胞凋亡检测情况
Figure 6 Apoptosis analysis of each group of cells
3 讨 论
近年来,胆管癌的发病率呈逐年升高的趋势,在消化道恶性肿瘤中是递增速度最快的[8]。因其较为特殊的病理特点和解剖特点,人们对胆管癌的诊断和治疗尚未取得突破性进展。手术治疗仍然是当前的首选治疗方式。但胆管癌恶性程度高、预后极差,术后复发率也很高[9]。研究者们开始不断探索新的有效的胆管癌治疗途径。随着分子生物学等技术的发展,分子靶向治疗已经成为抗肿瘤研究的一大热点[10]。目前,已有数种胆管癌靶向治疗药物被批准用于临床试验,包括EGFR抑制剂(如西妥昔单抗、埃罗替尼和吉非替尼)、Raf激酶抑制剂(如索拉非尼)、HER-2抑制剂(如曲妥珠单抗、拉帕替尼),还有血管内皮因子抑制剂(如索拉非尼、贝伐单抗)[11]。相关研究[12]显示,应用吉西他滨+奥沙利铂联合埃罗替尼治疗胆管癌,患者拥有5.9个月的平均进展期生存时间,而不联合埃罗替尼的患者为3个月。当然,这些靶向药物的临床疗效还有待于进一步证实。综上所述,我们迫切希望利用RNA干扰技术寻找胆管癌发生、发展过程中关键性的靶向基因,从而为胆管癌的临床治疗开辟新的道路。
iNOS代表诱导型一氧化氮合酶,人iNOS基因定位在17cen-q11.2[13],基因全长37Kb,由26个外显子组成。iNOS通常在炎症、肿瘤等病理情况下由巨噬细胞产生,然后诱导合成大量NO[14],后者被很多学者认为是一类致癌分子。其一,NO可通过介导血管内皮生长因子(VEGF)促进新生血管生成,从而促进肿瘤的发生、发展[15];其二,NO在DNA损伤、癌基因活化、抑制DNA修复酶活性、抑制抑癌基因表达、致细胞凋亡以及促细胞恶变等许多方面起着重要作用[16-17]。iNOS与肿瘤有着千丝万缕的关系,在许多肿瘤中都有着较高的表达。例如肺癌、乳腺癌、卵巢癌等,都有关于iNOS表达增高的研究[5,18-19]。同时,有研究[20-21]表明,iNOS在胃癌、鼻咽癌、恶性淋巴瘤以及骨肉瘤等恶性肿瘤中发挥着重要作用。还有报道,在妇科肿瘤、鱗状细胞癌、肝细胞癌以及黑素瘤等多种疾病中,肿瘤的恶性程度跟iNOS升高程度呈正相关[22]。另一方面,在结肠癌和乳腺癌的临床前研究发现,抑制iNOS的表达能够有效预防肿瘤进展[23]。目前,国际上iNOS基因在胆管癌中的研究报道并不多,在胆管癌的发生发展过程中,iNOS基因是否同样发挥了重要作用,有待于我们进行新的研究。
有研究者[24]设计并构建了靶向survivin基因的shRNA载体,将其转染进入神经胶质瘤U251细胞,结果发现细胞有丝分裂明显发生障碍,凋亡明显增加,并且肿瘤血管的生成也受到了抑制。还有研究者[25]对肺癌A549细胞进行研究,将其转染livin与survivin的shRNA载体,结果显示共转染组对癌细胞的抑生长和促凋亡作用明显优于对照组和单转染组。本研究将化学合成的iNOS-siRNA成功转染人胆管癌QBC939细胞,结果显示,iNOS基因沉默能成功抑制iNOS mRNA和蛋白的表达;iNOS-siRNA转染组QBC939细胞被阻滞于G0/G1期,提示沉默iNOS基因表达后,胆管癌细胞增殖速度受到了抑制;同时,iNOS-siRNA转染组QBC939细胞的凋亡率明显高于阴性对照组和空白对照组,说明沉默iNOS诱导了胆管癌细胞的凋亡。这些结果为胆管癌的基因治疗提供了新的实验基础和理论依据。
总之,通过RNA干扰沉默iNOS基因可明显抑制人胆管癌QBC939细胞的增殖,诱导细胞凋亡。由此可见,iNOS基因是胆管癌发生、发展的促进因素,它可能成为胆管癌治疗的潜在靶点。受条件所限,本研究仅针对胆管癌细胞中单独的基因iNOS进行了沉默,并处体外实验阶段。关于iNOS基因对胆管癌细胞增殖、凋亡等相关作用的具体分子机制,还有许多研究工作需要深入开展。相信在不久的将来靶向基因治疗将成为胆管癌治疗的主攻方向,iNOS基因或将成为胆管癌基因治疗的关键分子靶点。
参考文献
[1] Khan SA, Thomas HC, Davidson BR, et al. Cholangiocarcinoma[J].Lancet, 2005, 366(9493):1303–1314.
[2] 黄志强. 肝胆管外科的发展方向[J]. 外科理论与实践, 2011,16(4):329–331.Huang ZQ. Future trends in biliary surgery of intrahepatic bile ducts[J]. Journal of Surgery Concepts & Practice, 2011, 16(4):329–331.
[3] Friman S. Cholangiocarcinoma--current treatment options[J]. Scand J Surg, 2011, 100(1):30–34.
[4] Hansel DE, Rahman A, Hidalgo M, et al. Identification of novel cellular targets in biliary tract cancers using global gene expression technology[J]. Am J Pathol, 2003, 163(1):217–229.
[5] Zhang L, Liu J, Wang X, et al. Upregulation of cytoskeleton protein and extracellular matrix protein induced by stromal-derived nitric oxide promotes lung cancer invasion and metastasis[J]. Curr Mol Med, 2014, 14(6):762–771.
[6] Nomelini RS, de Abreu Ribeiro LC, Tavares-Murta BM, et al.Production of nitric oxide and expression of inducible nitric oxide synthase in ovarian cystic tumors[J]. Mediators Inflamm, 2008,2008:186584. doi: 10.1155/2008/186584.
[7] 谢博文, 吕品, 聂盛丹, 等. 诱导型一氧化氮合酶抑制剂对胆管癌细胞生物学行为的影响[J]. 中国普通外科杂志, 2016,25(8):1158–1162. doi:10.3978/j.issn.1005–6947.2016.08.012.Xie BW, Lu, P, Nie SD, et al. Effect of inducible nitric oxide synthase inhibitor on the biological behaviors of cholangiocarcinoma cells[J]. Chinese Journal of General Surgery,2016, 25(8):1158–1162. doi:10.3978/j.issn.1005–6947.2016.08.012
[8] Patel T. Cholangiocarcinoma[J]. Nat Clin Pract Gastroenterol Hepatol, 2006, 3(1):33–42.
[9] Gatto M, Bragazzi MC, Semeraro R, et al. Cholangiocarcinoma:update and future perspectives[J]. Dig Liver Dis, 2010, 42(4):253–260. doi: 10.1016/j.dld.2009.12.008.
[10] 储大同. 肿瘤分子靶向治疗的进展及问题[J]. 临床肿瘤学杂志,2006, 11(1):1–6. doi:10.3969/j.issn.1009–0460.2006.01.001.Chu DT. Tumor Molecular Targeted Therapy:Progress and Questions[J]. Chinese Clinical Oncology, 2006, 11(1):1–6.doi:10.3969/j.issn.1009–0460.2006.01.001.
[11] 国际肝胆胰学会中国分会, 中华医学会外科学分会肝脏外科学组. 胆管癌诊断与治疗--外科专家共识[J]. 临床肝胆病杂志,2015, (1):12–16. doi:10.3969/j.issn.1001–5256.2015.01.003.Chinese Society of International Hepato-Pancreato-Biliary Association, Hepatic Surgery Group of Chinese Society of Surgery of Chinese Medical Association. Diagnosis and treatment of cholangiocarcinoma:surgical expert consensus[J].Journal of Clinical Hepatology, 2015, (1):12–16. doi:10.3969/j.issn.1001–5256.2015.01.003.
[12] Sia D, Tovar V, Moeini A, et al. Intrahepatic cholangiocarcinoma:pathogenesis and rationale for molecular therapies[J]. Oncogene.2013, 32(41):4861–4870. doi: 10.1038/onc.2012.617.
[13] Fukumura D, Kashiwagi S, Jain RK. The role of nitric oxide in tumour progression[J]. Nat Rev Cancer, 2006, 6(7):521–534.
[14] Engels K, Knauer SK, Loibl S, et al. NO signaling confers cytoprotectivity through the survivin network in ovarian carcinomas[J]. Cancer Res, 2008, 68(13):5159–5166. doi:10.1158/0008–5472.CAN–08–0406.
[15] Brabletz T, Herrmann K, Jung A, et al. Expression of nuclear beta-catenin and c-myc is correlated with tumor size but not with proliferative activity of colorectal adenomas[J]. Am J Pathol, 2000,156(3):865–870.
[16] Jaiswal M, Larusso N F, Burgart L J, et al. Inflammatory cytokines induce DNA damage and inhibit DNA repair in cholangiocarcinoma cells by a nitric oxide-dependent mechanism[J]. Cancer Res, 2000,60(1):184–190.
[17] Wink DA, Ridnour LA, Hussain SP, et al. The reemergence of nitric oxide and cancer[J]. Nitric Oxide, 2008, 19(2):65–67. doi: 10.1016/j.niox.2008.05.003.
[18] Vakkala M, Kahlos K, Lakari E, et al. Inducible nitric oxide synthase expression, apoptosis, and angiogenesis in in situ and invasive breast carcinomas[J]. Clin Cancer Res, 2000, 6(6):2408–2416.
[19] Ohshima H, Tazawa H, Sylla BS, et al. Prevention of human cancer by modulation of chronic inflammatory processes[J]. Mutat Res,2005, 591(1/2):110–122.
[20] 李建波, 李新民, 詹惟, 等. 胃癌及癌前病变组织中VEGF和iNOS蛋白的表达[J]. 细胞与分子免疫学杂志, 2011, 27(5):561–562.Li JB, Li XM, Zhan W, et al. VEGF and iNOS expressions in gastric cancer and precancerous tissues[J]. Chinese Journal of Cellular and Molecular Immunology, 2011, 27(5):561–562.
[21] 张小艳, 王曙升, 宋瑛, 等. IL-10、iNOS在幽门螺旋杆菌相关性胃炎及胃癌前病变组织中表达的相关性研究[J]. 现代肿瘤医学,2013, 21(8):1830–1833. doi:10.3969/j.issn.1672–4992.2013.08.54.Zhang XY, Wang SS, Song Y, et al. Correlation of Interleukin-10 and inducible nitric oxide synthase in Helicobacter pylori-infected gastritis and precancerous lesions of gastric cancer[J]. Journal of Modern Oncology, 2013, 21(8):1830–1833. doi:10.3969/j.issn.1672–4992.2013.08.54.
[22] Augustine D, Sekar B, Murali S, et al. Expression of inducible nitric oxide synthase in carcinomas and sarcomas affecting the oral cavity[J]. South Asian J Cancer, 2015, 4(2):78–82. doi:10.4103/2278–330X.155686.
[23] Raspollini MR, Amunni G, Villanucci A, et al. Expression of inducible nitric oxide synthase and cyclooxygenase-2 in ovarian cancer: correlation with clinical outcome[J]. Gynecol Oncol, 2004,92(3):806–812.
[24] Zhen HN, Li LW, Zhang W, et al. Short hairpin RNA targeting survivin inhibits growth and angiogenesis of glioma U251 cells[J].Int J Oncol, 2007, 31(5):1111–1117.
[25] Zhao X, Yuan Y, Zhang Z, et al. Effects of shRNA-silenced livin and survivin on lung cancer cell proliferation and apoptosis[J]. J BUON, 2014, 19(3):757–762.