肝门部胆管癌(hilar cholangiocarcinoma)是起源于胆管上皮的恶性肿瘤,系由美国学者Gerald Klatskin于1965年首先描述其症状,又称Klatskin肿瘤,是胆道系统的常见恶性肿瘤之一(约占60%~70%),近年来在亚洲国家的发病率逐年增加[1-4],肝门部胆管癌具有恶性程度高,预后较差,放化疗不敏感等特点,因此目前外科手术仍是治愈肝门部胆管癌的唯一方法,但外科手术切除率较低,约为40%[5-6]。由于其解剖位置特殊以及极易侵犯邻近的胆管、门静脉、肝动脉,因此在术前早期的判断可切除性尤为重要[7-8]。在术前早期评估中,术前影像学的评估尤为重要,目前常见的术前影像学评估为彩色超声,高分辨CT、磁共振、内镜逆行胰胆管造影(ERCP),正电子发射计算机断层扫描(PET-CT)等[8-11]。这其中多排螺旋CT(64排、128排甚至更高)是肝门部胆管癌诊断中最常见首选的影像学方法[12],近年来,随着计算机技术的发展,医学可视化技术特别是高分辨CT的三维重建技术在外科学中得到蓬勃发展[12-16],三维可视化技术(三维重建技术)能准确的呈现肝门部占位的复杂的解剖毗邻关系,而这是传统的二维CT难以呈现[17]。本研究通过回顾性分析安徽医科大学附属省立医院普外科并行CT三维重建的肝门部胆管癌患者临床资料,评估CT三维重建技术在肝门部胆管癌的术前诊断和可切除性评估的临床价值。
1 资料与方法
1.1 一般资料
选择2015年10月—2016年4月期间收治的15例手术治疗的肝门部胆管癌患者,所有患者在术前行原薄层CT数据基础上的CT三维重建。15例患者中,男9例,女6例;平均年龄(55.54±10.86)岁;术前平均总胆红素为(162.02±131.20)µmol/L,其中黄疸(总胆红素>20.5 µmol/L)14例;患者血清CA19-9值21~1600 kU/L,其中13例患者CA19-9水平高于正常值;肝功能ALT、AST、GGT高于正常者14例。患者需满足:⑴ 术前的肝脏Child-Pugh分级为A级或B级;⑵ 术前与患者家属经过充分沟通,并告知风险。对于重建组需附加:⑴ 术前CT检查数据需满足三维重建要求(CT三期扫面,层厚1.25 mm);⑵ 术前CT及MRCP检查考虑Bismuth-Corlette分型[18]为II、III、IV型的患者。患者排除标准:⑴ 术前明确合并远处转移者,合并心脏、脑血管疾病或肝硬化无法耐受手术者;⑵ 术前评估术后肝脏剩余体积<30%者;⑶ 家属拒绝行手术治疗者。
1.2 重建组CT检查方法以及三维重建
所有患者检查前禁食水4~6 h,扫描前15~30 min饮清水1 000 mL,采用64排GE Discovery 750 HDCT进行上腹部平扫和三期增强扫描(动脉期、门脉期、延迟期),扫描参数:采用高压注射器经肘正中静脉注入非离子型碘对比剂(300 mgI/mL),流率3 mL/s,总量90 mL,注入后30、65、120 s分别扫描获得动脉期、门脉期及延迟期,层厚为1.25 mm,扫描完成后,以医学数字成像和通信(digital imaging and communications in medicine,DICOM)数据格式存储。采集患者的DICOM数据行三维重建。
三维重建方法:将患者的各期的DICOM数据导入由深圳市旭东数字医学影像技术有限公司应用重建软件进行三维重建。重建后得到的三维图像由专门的阅片平台阅读,重建后的动脉、胆管、门静脉、肝静脉、肝脏以及肿瘤(占位)的颜色不同以区分,重建后图像可以以任意角度进行观察肿瘤的周围毗邻关系及肝脏的体积大小,并且根据肝脏各段脉管系统进行肝脏Couinoud八段分区。
1.3 影像学分析可切除性评估
二维影像学分析:重建组所有纳入患者的术前CT检查均由3名及以上影像科主任医师进行阅片并共同出具影像学诊断报告,后由临床医师结合患者的MRCP检查结果进行Bismuth分型,从而对于可切除性进行评估。
三维重建影像学分析:结合患者的三维重建结果,并由胆胰外科2名及以上主任医师进行分析阅片,并分别从占位与胆管、动脉、门静脉、淋巴结等的位置关系,进行Bismuth分型,从而进行手术的可切除性评估,确定最佳的手术方案。
1.4 模拟手术及手术方案确定
根据患者的术前相关生化检查、影像学检查以及三维重建结果,在术前对于患者的手术方案进行评估和确定(模拟手术),对于可能在术中需要肝叶(半肝)切除、肝段切除的患者,在术前由旭东软件平台计算出残肝体积或肝段体积,保证术后残余肝脏的正常生理功能。
根治性手术方案的确定:术中结合探查结果,根据最新的指南,肝门部胆管癌根治性手术应保证[11]:⑴ 解剖性肝切除是肝门部胆管癌的手术切除的标准手术术式,特别是对于Bismuth分型III型等需要联合肝叶切除的患者,且术中肿瘤近端与远端胆管切缘应常规术中冰冻阴性,方可达到R0切除;⑵ 一般认为肿瘤如果侵犯到肝内二级胆管分支时,无法达到R0切除;⑶ 切除肝脏后预留的肝脏功能性体积需能够足够代偿,且可保证胆管和血管的可重建性,能够完成胆肠内引流术;⑷ 手术创伤需保证在患者可控制的范围内。对于术中探查发现可行根治性手术的患者,需按照根治性手术方式进行切除,如出现肿瘤无法切除或患者无法耐受手术时,尽可能选择R1切除或解除患者的黄疸(通过姑息性切除方式或放置U管胆道外引流方式等),并尽量术中活检诊断。
1.5 诊断准确率分析
所有患者在术前均已由胆胰外科主任讨论出肿瘤的毗邻关系以及手术方案,对于术中进行常规高清摄像机的全程录像以及术中照片进行对比,如术中情况与术前三维重建阅读结果相符合(需由2名以上胆胰外科主任医师确定),称为诊断准确,术前的门静脉(左支、右支)、胆管(左右肝管及肝总管、胆总管)、动脉(肝动脉左支、右支)均与术中符合即为整体诊断准确,由此计算出CT三维重建的诊断准确率。
2 结 果
2.1 患者胆管癌分型以及术后情况
15例肝门部胆管癌患者根据Bismuth肝门部胆管癌分型最终结果:II型1例,III型5例(IIIa型2例,IIIb型3例),IV型9例。所有患者均行手术探查,手术探查的方式详见表1。术前均由科室讨论并进行分型,其中完成R0切除患者11例(图1),姑息性手术(剖腹探查术+U管置入术)4例;根治性手术中:肝门部胆管癌切除+肝门部胆管空肠内引流术5例,半肝切除术6例(左半肝切除+尾状叶切除4例,右半肝切除+尾状叶切除2例),其中2例右半肝切除术患者,其中术中的残留肝脏体积均在术前计算根据CT三维重建软件进行计算,计算得出残余肝脏体积>40%。对于切除半肝的患者,残余胆管进行肝门部胆管癌整形后行吻合术,上述胆管空肠内引流术术式均为Roux-en-Y吻合,对于胆管直径较细的,必要时留置胆管支撑管。其中上述11例根治性手术患者中,2例患者术后出现胆瘘,均经延长术后胆肠吻合口引流管时间治愈,余根治性患者未出现出血、胆瘘等其他并发症。4例姑息性手术患者,手术无法根治性切除原因为肿瘤侵犯至肝内二级胆管,无法行根治性手术,遂予以采用U管外引流解除黄疸完成手术,术后未出现致命性并发症,术中未行根治性手术的患者均在术中行病理活检。
所有患者术后均正规随访,截止2016年12月31日随访期间。1例患者因术后8个月出现肺及盆腔转移死亡,其余10例根治性切除患者,3例出现转移并正规化疗中,7例随访期间未出现转移;4例姑息性切除患者中,其中2例术后5个月因全身转移死亡,1例患者在随访11个月出现转移。正规化疗中的患者:1例患者术后2个月尚未出现转移或其他并发症,术后恢复均良好。上述患者随访时间为2~21个月,中位随访时间为14个月。
表1 15例肝门部胆管癌患者手术方式
Table 1 Surgical procedures of the 15 patients with hilar cholangiocarcinoma
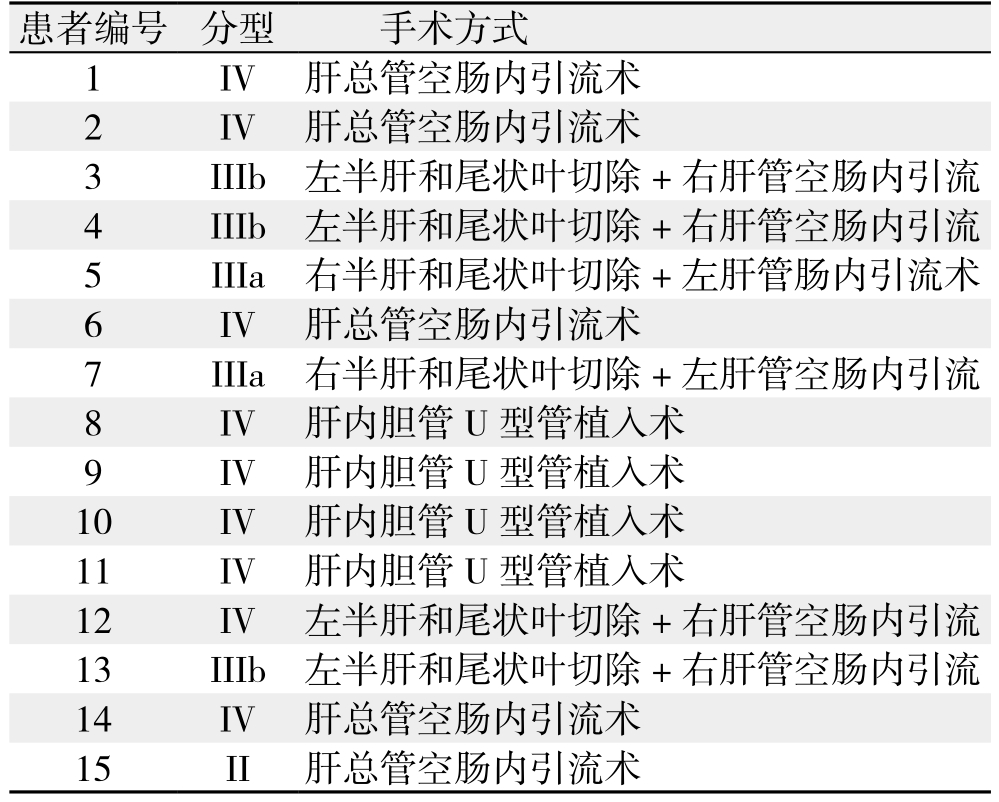
患者编号 分型 手术方式1 IV 肝总管空肠内引流术2 IV 肝总管空肠内引流术3 IIIb 左半肝和尾状叶切除+右肝管空肠内引流4 IIIb 左半肝和尾状叶切除+右肝管空肠内引流5 IIIa 右半肝和尾状叶切除+左肝管肠内引流术6 IV 肝总管空肠内引流术7 IIIa 右半肝和尾状叶切除+左肝管空肠内引流8 IV 肝内胆管U型管植入术9 IV 肝内胆管U型管植入术10 IV 肝内胆管U型管植入术11 IV 肝内胆管U型管植入术12 IV 左半肝和尾状叶切除+右肝管空肠内引流13 IIIb 左半肝和尾状叶切除+右肝管空肠内引流14 IV 肝总管空肠内引流术15 II 肝总管空肠内引流术
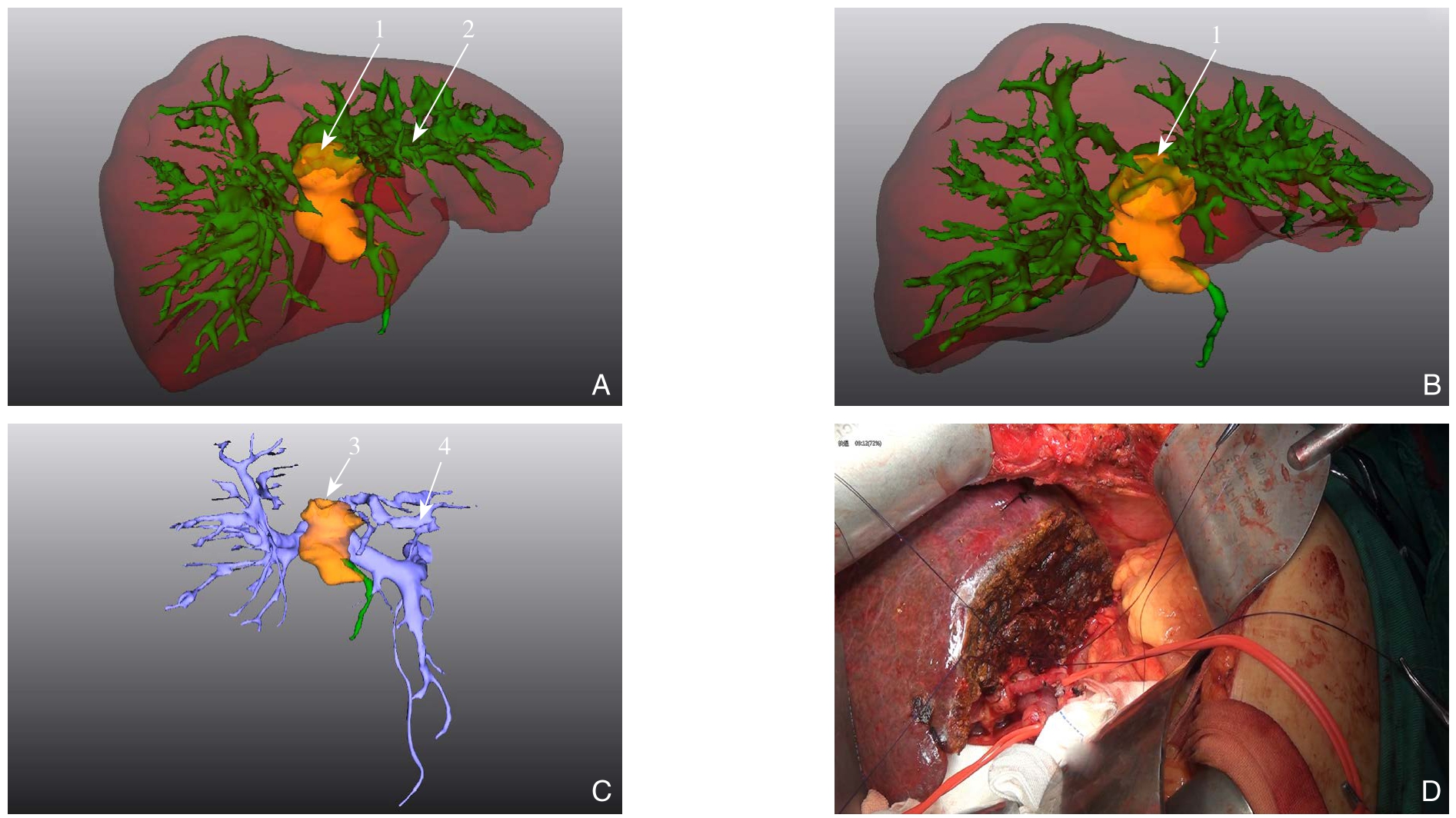
图1 1例肝门部胆管癌患者(Bismuth IIIb型)术前三维重建及术中所见 A-B:术前三维重建肿瘤位于胆总管上段、肝门部及左肝内胆管(1为占位,2为左肝内胆管);C:重建后示门静脉主干及门静脉右支未受侵犯(3为肿块,4为门静脉左支);D:左半肝切除术后肝创面
Figure 1 Preoperative three-dimensional reconstruction and intraoperative review of one case with hilar cholangiocarcinoma (Bismuth type IIIb) A–B: Preoperative three-dimensional reconstruction showing that the tumor involving the upper segment of the common bile duct, hepatic portal region and intrahepatic bile duct (1 showing the occupying lesion, and 2 showing the left intrahepatic bile ducts); C: Reconstruction showing no involvement of the main trunk and the right branch of the portal vein (3 showing the mass,and 4 showing the left branch of the portal vein); D: The cutting surface of the liver after left hemihepatectomy
2.2 术前CT三维重建评估Bismuth分型以及术前模拟手术与实际方式的符合情况
15例患者的术前Bismuth分型与术后Bismuth分型结果详见表2。对于III型肝门部胆管癌患者术前术后分型评估吻合,但对于II型及IV型肝门部胆管癌术前术后分型出现不吻合。术前CT三维重建对于肝门部胆管癌Bismuth分型诊断准确率为93.3%(14/15),术前模拟手术与实际方式符合率为80%(12/15)。
表2 术前CT三维重建评估与术后最终Bismuth分型结果对比(n)
Table 2 Comparison of the preoperative evaluations by threedimensional CT reconstruction and postoperative Bismuth classifications (n)
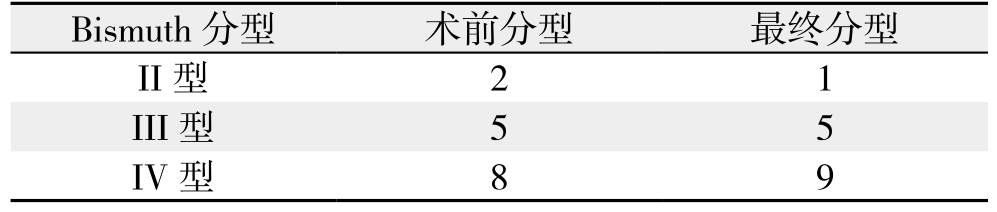
Bismuth分型 术前分型 最终分型II型 2 1 III型 5 5 IV型 8 9
2.3 术前CT三维重建评估肿块比邻关系的符合情况
所有患者均在术前进行三维重建评估并在术中进行对比,并在术中进行手术录像,术后根据术中情况以及术前三维重建评估是否相符,分别评估15例患者的肿块与肝内位置、动脉、门静脉、胆管关系(表3)。总诊断准确率为80.0%(12/15),门静脉主干、肝左静脉、肝中静脉、肝右静脉、右侧胆管诊断准确率为100.0%;门静脉左侧、右侧诊断准确率分别为:86.7%(13/15)、93.3%(14/15),诊断门静脉侵犯与否的准确率为86.7%(准确率为门静脉左右支的最低诊断准确率);胆(肝)总管、左肝内胆管的诊断准确率为均为86.7%(13/15);肝动脉左支、右支的诊断准确率为分别为66.7%(10/15)、53.3%(8/15),肝动脉主干诊断准确率为53.3%(准确率为肝动脉左右支的最低诊断准确率);肿块体积大小诊断准确率为93.3%(14/15)。
表3 术前CT三维重建评估肿块毗邻关系与术中符合情况
Table 3 Coincidence of tumor relations with adjacent structures assessed by preoperative three-dimensional CT reconstruction and intraoperative findings
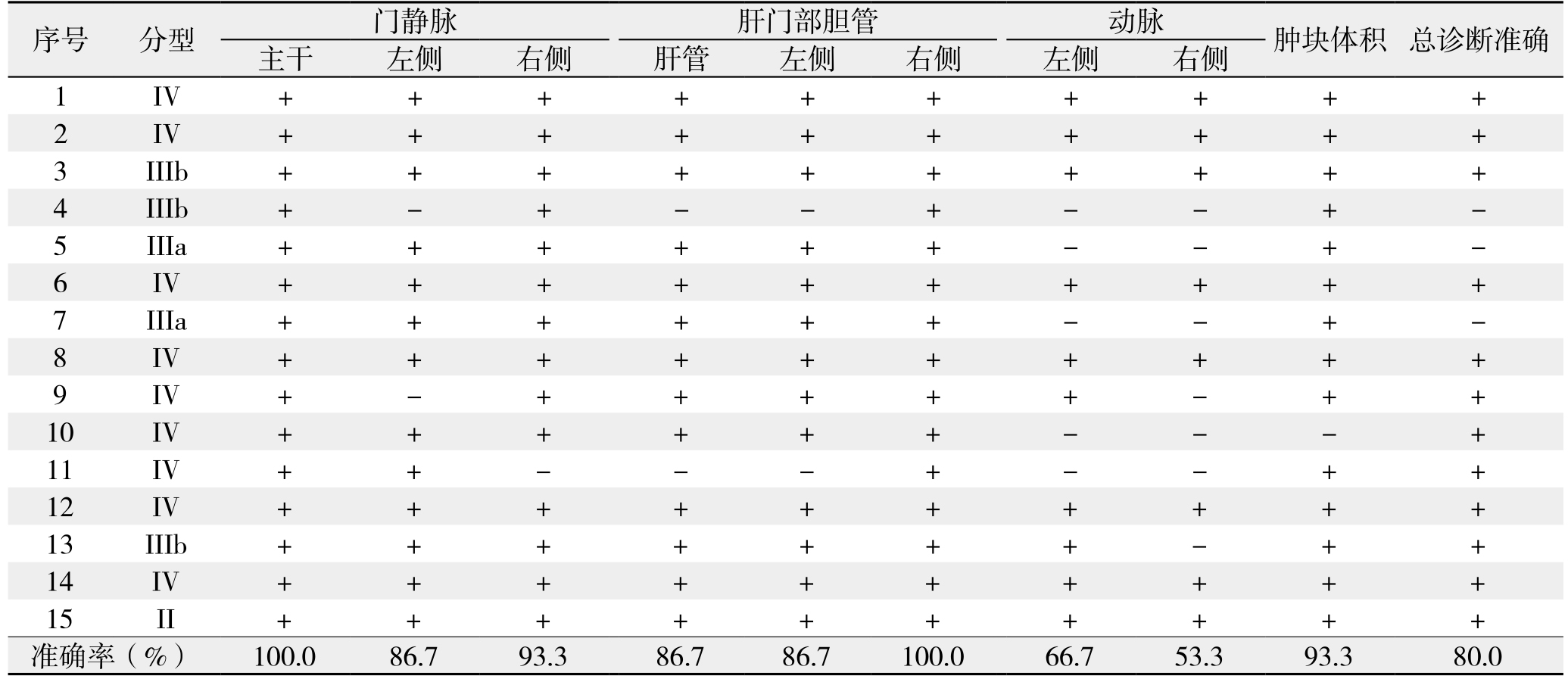
注:+为与术中情况相符;-为与术中情况不相符
Note: + referring to a coincidence; – referring to an uncoincidence
序号 分型 门静脉 肝门部胆管 动脉 肿块体积 总诊断准确主干 左侧 右侧 肝管 左侧 右侧 左侧 右侧1 IV + + + + + + + + + +2 IV + + + + + + + + + +3 IIIb + + + + + + + + + +4 IIIb + - + - - + - - + -5 IIIa + + + + + + - - + -6 IV + + + + + + + + + +7 IIIa + + + + + + - - + -8 IV + + + + + + + + + +9 IV + - + + + + + - + +10 IV + + + + + + - - - +11 IV + + - - - + - - + +12 IV + + + + + + + + + +13 IIIb + + + + + + + - + +14 IV + + + + + + + + + +15 II + + + + + + + + + +准确率(%) 100.0 86.7 93.3 86.7 86.7 100.0 66.7 53.3 93.3 80.0
2.4 术前CT三维重建评估不同分型肝门部胆管癌的诊断准确率
对于不同类型肝门部胆管癌的诊断准确率:II型肝门部胆管癌总诊断准确率及左右肝动脉诊断准确率均为100%;IIIa型患者总诊断准确率及左右肝动脉诊断准确率为0;IIIb型总诊断准确率以及左右肝动脉诊断准确率为分别为:66.7%、66.7%、33.3%;IV型总诊断准确率以及左右肝动脉诊断准确率为分别为100%、66.7%、77.8%(表4)。
表4 术前CT三维重建对不同分型肝门部胆管癌的诊断准确率
Table 4 Accuracy rates of preoperative three-dimensional CT reconstruction for diagnosing different types of hilar cholangiocarcinoma

分型 n 根治性手术例数(n) 总诊断准确率(%) 右肝动脉诊断准确率(%) 左肝动脉诊断准确率(%)II 1 1 100 100 100 IIIa 2 2 0 0 0 IIIb 3 3 66.7(2/3) 33.3(1/3) 66.7(2/3)IV 9 5 100(9/9) 66.7(6/9) 77.8(7/9)
3 讨 论
近年来,随着科学技术的进步,影像学技术的发展和各种治疗方法的不断涌现和发展,肝门部胆管癌的生存率得到了明显的提高,但因肝门部胆管癌的特殊解剖位置和易侵犯特点,目前对于肝门部胆管癌的可切除率较低,根据姜小清等[22]报道1 572例肝门部胆管癌患者,其根治性切除率仅为37.6%,术后5年生存率仅为10.9%,R0切除的患者5年生存率为32.7%。因此根治性切除是肝门部胆管癌患者的唯一有效的治疗手段[23-24]。因此对于肝门部胆管癌的术前精准评估尤为重要,特别是在精准外科理念的推广[25],肝门部胆管癌应用精准外科理念得到了越来越多肝胆外科医师的认可,应用精准外科理念在肝门部胆管癌中可以在术前得知肿瘤与肝门部胆管、门静脉、肝动脉之间的关系及切除范围和残留体积,这对于术中的处理和肿瘤切除尤为重要,在这样的前提下,传统的CT增强以及磁共振检查虽可明确肿瘤大小,但由于系二维图像,对于肿瘤与周围血管和胆道关系无法明确,难以明确肿瘤的毗邻关系,而本研究中CT三维重建在三维状态下进行术前肿瘤的评估可以避免传统二维图像折叠造成的伪影,可以真正的显示肿瘤的毗邻,这样可以在术前对于肿块进行精确评估。
由本组数据可知:三维重建对于肿瘤的位置(与胆管关系)、肝脏体积大小的诊断准确度最高;对于肿瘤与门静脉主干及肝静脉的位置关系诊断准确率相对较高;对于门静脉左右支以及肝总管,左肝内胆管诊断准确率其次,而对于动脉的关系诊断相对较低。II型、IIIb及IV型肝门部胆管癌诊断总诊断准确率较高,诊断相对明确;对于IIIa患者的总诊断率不高(主要动脉未诊断出)。15例患者中,11例为2015年采集数据,另外4例为2016年采集数据,2016年采集数据,术前三维重建与术中基本相同。2015年中,诊断准确率不高,主要为动脉诊断不明确。本研究中术前CT三维重建诊断肝动脉侵犯的准确率为53.3%(8/15),该数据与文献[19]报道的60%~80%诊断相符。本研究得出的门静脉侵犯诊断准确率为86.7%(13/15),这与文献[20-21]报道相似。
本组15例肝门部胆管癌患者数据重建模型诊断肿瘤分型准确率为93.3%,模拟手术与实际手术方式符合率为80%,同时CT三维重建对于门静脉侵犯诊断准确率为86.7%,诊断肝动脉侵犯的准确率为80%。这与相关报道[11]胆道系统的三维重建对肝门部胆管癌Bismuth-Corlette分型相似。这说明了在术前进行CT的三维重建可以更加的精确地对于术中可能情况进行评估。术前的精确诊断大大的提高了术中的可切除率和对于术中的精准评估。因此通过对我院15例的肝门部胆管癌分析研究并总结得出术前CT三维重建的优势在于:⑴ 术前可直观的(可以任意角度)明确肿块与周围组织以及重要血管的关系,特别是肝门部胆管的分型诊断问题(由于MRCP的成像原理在二维系统进行诊断,对二级以上胆管成像显示不清,诊断价值有限),另外对于肝门部胆管癌的术中血管侵犯关系的显示较为准确,这是其他检查所无法达到的效果。⑵ 术前可以精确进行肝脏体积的测量以及进行预手术及手术预切线(相对传统吲哚青绿的残肝体积测量较为方便),这对于如果行切肝手术的患者的术前评估很重要,这样可以有效的避免术中因考虑残余肝体积过少导致无法性根治性手术。⑶ 术前对于肝门部胆管癌的毗邻关系以及淋巴结转移情况以及可以在三维重建平台进行任意角度的观察,可以精准评估肿瘤的浸润范围和可切除性,利于术前评估和模拟手术,减少了盲目的剖腹探查[27],同时一定程度的减少了医患纠纷(病情判别和评估)的可能。
随访发现,在行根治性手术的患者术后整体生存期较未行根治性手术高,这说明根治性手术切除是当前肝门部胆管癌患者治愈和长期生存的首选治疗方式[27],这就说明对于肝门部胆管癌患者术前评估要尽可能的选择根治性的手术方式,达到根治性R0切除,延长患者的生存期。
在应用三维重建的同时,需要注意CT三维重建也存在一定的局限性:⑴ 软件本身存在缺陷,如总体费用较高,目前肝动脉的显示与术中不符等情况;⑵ 平台的要求较高,对于操作者有较高的要求;⑶ 目前该类患者病例数较小,需要更多的病例进行研究。
在临床应用中,为降低手术风险,对于肝门占位的患者,特别是肝门部胆管癌患者和少数复杂肝内胆管结石患者,在术前可通过CT三维重建来对于肝门部胆管癌患者进行术前的手术可切除性评估,这样可以制定合理的个体化手术治疗,可为部分患者创造手术机会,但最终的结果需要根据术中情况而定,且目前该项技术尚处于早期应用阶段,未来仍需大样本、多中心、更加详细的术前术中对比数据进一步的明确CT三维重建技术在肝门部胆管癌的诊断和可切除性的价值。
参考文献
[1] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines)[S]. https://www.nccn.org/professionals/
[2] 倪其泓, 张赟和, 陈炜, 等. Bismuth IV型肝门部胆管癌根治术[J]. 中华消化外科杂志, 2016, 15(4):380–384. doi:10.3760/cma.j.issn.1673–9752.2016.04.014.Ni QH, Zhang YH, Chen W, et al. Radical resection of hilar cholangiocarcinoma in Bismuth type IV[J]. Chinese Journal of Digestive Surgery, 2016, 15(4):380–384. doi:10.3760/cma.j.issn.1673–9752.2016.04.014.
[3] Nagino M, Ebata T, Yokoyama Y, et al. Evolution of surgical treatment for perihilar cholangiocarcinoma: a single-center 34-year review of 574 consecutive resections[J]. Ann Surg, 2013,258(1):129–140. doi: 10.1097/SLA.0b013e3182708b57.
[4] Razumilava N, Gores GJ. Cholangiocarcinoma[J]. Lancet, 2014,383(9935):2168–2179. doi: 10.1016/S0140–6736(13)61903–0.
[5] 殷晓煜, 刘鑫, 陈伟, 等. 肝门部胆管癌手术切除的远期疗效及预后因素分析[J]. 中华消化外科杂志, 2016, 15(4):329–334.doi:10.3760/cma.j.issn.1673–9752.2016.04.005.Yin XY, Liu X, Chen W, et al. Long-term outcomes and prognostic factors of surgical resection of hilar cholangiocarcinoma[J]. Chinese Journal of Digestive Surgery, 2016, 15(4):329–334. doi:10.3760/cma.j.issn.1673–9752.2016.04.005.
[6] 晏益核, 黄玉斌. 肝门部胆管癌的外科治疗现状[J]. 中国普通外科杂志, 2017, 26(2):246–251. doi:10.3978/j.issn.1005–6947.2017.02.019.Yan YH, Huang YB. Current status in surgical management of hilar holangiocarcinoma[J]. Chinese Journal of General Surgery, 2017,26(2):246–251. doi:10.3978/j.issn.1005–6947.2017.02.019.
[7] 苏昭杰, 段朋, 刘昌华, 等. 三维可视化系统在肝门部胆管癌治疗中的应用[J]. 中华消化外科杂志, 2013, 12(3):213–216.doi:10.3760/cma.j.issn.1673–9752.2013.03.013.Su ZJ, Duan P, Liu CH, et al. Application of three-dimensional visualization system in the treatment of hilar cholangiocarcinoma[J].Chinese Journal of Digestive Surgery, 2013, 12(3):213–216.doi:10.3760/cma.j.issn.1673–9752.2013.03.013.
[8] 张辉, 王孟龙. 肝门部胆管癌的可切除性评估[J]. 中华肝胆外科杂志, 2015, 21(11):789–792. doi:10.3760/cma.j.issn.1007–8118.2015.11.023.Zhang H, Wang ML. Research progress on resectability assessment of hilar cholangiocarcinoma[J]. Chinese Journal of Hepatobiliary Surgery, 2015, 21(11):789–792. doi:10.3760/cma.j.issn.1007–8118.2015.11.023.
[9] Xu HX, Chen LD, Xie XY, et al. Enhancement pattern of hilar cholangiocarcinoma: contrast-enhanced ultrasound versus contrastenhanced computed tomography[J]. Eur J Radiol, 2010, 75(2):197–202. doi: 10.1016/j.ejrad.2009.04.060.
[10] Fang CH, Tao HS, Yang J, et al. Impact of three-dimensional reconstruction technique in the operation planning of centrally located hepatocellular carcinoma [J]. J Am Coll Surg, 2015,220(1):28–37. doi: 10.1016/j.jamcollsurg.2014.09.023.
[11] 中国抗癌协会. 肝门部胆管癌规范化诊治专家共识(2015)[J]. 中华肝胆外科杂志, 2015, 21(8):505–511. doi:10.3760/cma.j.issn.1007–8118.2015.08.001.Anti-cancer Association of China. Guideline for the diagnosis and therapy of hilar cholangiocarcinoma (2015)[J]. Chinese Journal of Hepatobiliary Surgery, 2015, 21(8):505–511. doi:10.3760/cma.j.issn.1007–8118.2015.08.001.
[12] 中华医学会数字医学分会, 中国研究型医院学会数字医学临床外科专业委员会. 复杂性肝脏肿瘤三维可视化精准诊治专家共识[J]. 中国实用外科杂志, 2017, 37(1):53–59.Chinese Society of Digital Medicine, Clinical Surgical Committee of Digital Medicine of Chinese Research Hospital Association.Expert consensus on three-dimensional visualization precision diagnosis and treatment of complex liver tumors[J]. Chinese Journal of Practical Surgery, 2017, 37(1):53–59.
[13] Sasaki R, Kondo T, Oda T, et a1. Impact of three-dimensional analysis of multidetector row computed tomography cholangioportography in operative planning for hilar cholangiocarcinoma[J]. Am J Surg, 2011, 202(4):441–448. doi:10.1016/j.amjsurg.2010.06.034.
[14] 方驰华, 陈建新. 数字医学技术在肝胆管结石病诊断和治疗中的应用[J]. 中华消化外科杂志, 2012, 11(2):104–107. doi:10.3760/cma.j.issn.1673–9752.2012.02.004.Fang CH, Chen JX, et al. Application of digital medical technology in the diagnosis and treatment of hepatolithiasis[J]. Chinese Journal of Digestive Surgery, 2012, 11(2):104–107. doi:10.3760/cma.j.issn.1673–9752.2012.02.004.
[15] 周晓俊, 秦磊, 钱海鑫, 等. 虚拟肝脏手术对肝脏手术方案与术中策略的影响[J]. 中华肝胆外科杂志, 2013, 19(2):93–97.doi:10.3760/cma.j.issn.1007–8118.2013.02.003.Zhou XJ, Qin L, Qian HX, et al. The impact of virtual hepatectomy and computer-assisted risk analysis on surgical planning and intraoperative strategy for major hepatic resection[J]. ChineseJournal of Hepatobiliary Surgery, 2013, 19(2):93–97. doi:10.3760/cma.j.issn.1007–8118.2013.02.003.
[16] Uchida M, Ishibashi M, Tomita N, et al. Hilar and suprapancreatic cholangiocarcinoma: value of 3D angiography and multiphase fusion images using MDCT[J]. AJR Am J Roentgenol, 2005,184(5):1572–1577.
[17] 朱云峰, 李建生, 马金良, 等. 三维重建技术在肝门部胆管癌术前评估中的价值[J]. 中国普通外科杂志, 2016, 25(2):175–180.doi:10.3978/j.issn.1005–6947.2016.02.003.Zhu YF, Li JS, Ma JS, et al. Value of three-dimensional reconstruction in preoperative assessment of hilar cholangiocarcinoma[J].Chinese Journal of General Surgery, 2016, 25(2):175–180.doi:10.3978/j.issn.1005–6947.2016.02.003.
[18] Bismuth H, Nakache R, Diamond T. Management strategies in resection for hilar cholangiocarcinoma[J]. Ann Surg, 1992,215(1):31–38.
[19] 余璠, 鲁正. 三维可视化技术在肝门部胆管癌术前评估中的应用[J]. 中国肿瘤临床, 2017, 44(8):390–394. doi:10.3969/j.issn.1000–8179.2017.08.249.Yu F, Lu Z. Application of three-dimensional visualization technology in preoperative assessment of hilar cholangiocarcinoma[J].Chinese Journal of Clinical Oncology, 2017, 44(8):390–394.doi:10.3969/j.issn.1000–8179.2017.08.249.
[20] 曾宁, 方驰华, 范应方, 等. 肝门部胆管癌三维可视化精准诊疗平台构建及临床应用[J]. 中华外科杂志, 2016, 54(9):680–685.doi:10.3760/cma.j.issn.0529–5815.2016.09.007.Zeng N, Fang CF, Fan YF, et al. The construction of threedimensional visualization platform and its application in diagnosis and treatment for hilar cholangiocarcinoma[J]. Chinese Journal of Surgery, 2016, 54(9):680–685. doi:10.3760/cma.j.issn.0529–5815.2016.09.007.
[21] 曾宁, 方驰华, 范应方, 等. 三维可视化系统在肝门部胆管癌外科手术中的应用[J]. 中华肝脏外科手术学电子杂志, 2015,4(4):202–205. doi:10.3877/cma.j.issn.2095–3232.2015.04.003.Zeng N, Fang CF, Fan YF, et al. Application of threedimensional visualization system in surgical operation for hilar cholangiocarcinoma[J]. Chinese Journal of Hepatic Surgery, 2015,4(4):202–205. doi:10.3877/cma.j.issn.2095–3232.2015.04.003.
[22] 姜小清, 易滨, 罗祥基, 等. 肝门部胆管癌10年外科治疗经验[J].中华消化外科杂志, 2010, 9(3):180–182. doi:10.3760/cma.j.issn.1673–9752.2010.03.008.Jiang XQ, Yi B, Luo XJ, et al. Ten-year experience in surgical treatment of hilar cholangiocarcinoma[J]. Chinese Journal of Digestive Surgery, 2010, 9(3):180–182. doi:10.3760/cma.j.issn.1673–9752.2010.03.008.
[23] Regimbeau JM, Fuks D, Le Treut YP, et a1. Surgery for hilar cholangiocarcinoma: a multi-institutional update on practice and outcome by the AFC-HC study group[J]. J Gastrointest Surg, 2011,15(3):480–488. doi: 10.1007/s11605–011–1414–0.
[24] Miyazaki M, Kimura F, Shimizu H, et a1. One hundred seven consecutive surgical resections for hilar cholangiocarcinoma of Bismuth types II, III, IV between 2001 and 2008[J]. J Hepatobiliary Pancreat Sci, 2010, 17(4):470–475. doi: 10.1007/s00534–009–0207–2.
[25] 季顾惟, 朱飞鹏, 李相成. 三维影像学技术在复杂肝胆外科手术中的应用进展[J]. 中华外科杂志, 2017, 55(4):316–320.doi:10.3760/cma.j.issn.0529–5815.2017.04.016.Ji GW, Zhu FP, Li XC. Progress in application of three-dimensional imaging technique in complex hepatobiliary surgery[J]. Chinese Journal of Surgery, 2017, 55(4):316–320. doi:10.3760/cma.j.issn.0529–5815.2017.04.016.
[26] Yu SA, Zhang C, Zhang JM, et al. Preoperative assessment of hilar cholangiocarcinoma: combination of cholangiography and CT angiography[J]. Hepatobiliary Pancreat Dis Int, 2010, 9(2):186–191.
[27] Weiss MJ, Cosgrove D, Herman JM, et al. Multimodal treatment strategies for advanced hilar cholangiocarcinoma[J]. Langenbecks Arch Surg, 2014, 399(6):679–692. doi: 10.1007/s00423–014–1219–1.