肝切除术是创伤较大的手术,肝脏是体内炎症因子灭活的主要场所,术后炎症因子的过度释放可引起全身炎症反应,过度的炎症反应可进一步加重肝切除术后肝损伤,增加肝功能不全发生率及围手术期并发症与病死率[1-2]。静脉使用糖皮质激素可以调控基因表达通路[3],提供免疫调节的负反馈以及抑制溶酶体的过氧化反应来保护细胞膜的完整性[4],激发机体的抗炎反应。糖皮质激素可以减少缺血肝脏的凋亡和组织损伤[5-6]。静脉使用糖皮质激素已经应用于预防围手术期肝切除患者的手术应激反应及缺血再灌注损伤,但是其作用效果仍然存在争议。本研究通过回顾性分析我院肝脏外科126例原发性肝癌患者临床病理资料,以术后有无应用糖皮质激素治疗作为分组因素分为激素治疗组及对照组。比较两组患者相关临床资料,评估糖皮质激素术后短疗程干预治疗对原发性肝癌肝功能恢复的影响及其相关不良反应,以寻求适合肝切除术后的治疗手段。
1 资料与方法
1.1 一般资料
回顾性分析湘雅医院肝脏外科2014年1月—2015年8月因原发性肝癌行肝切除术患者临床病理资料。患者入选标准:⑴ 患者均经术后病理诊断确诊为原发性肝癌;⑵ 均为首次行开腹肝癌切除术,术前评估、手术、术后治疗均由同一医师团队完成。排除标准:⑴ 手术前曾行介入及微创消融等治疗患者;⑵ 18岁以下或70岁以上患者;⑶ 合并自身免疫性疾病、代谢性疾病、活动性消化性溃疡、糖尿病及重度高血压患者以及近期使用过相关糖皮质激素类药物治疗患者。根据术后是否行糖皮质激素治疗分为激素治疗组与对照组,激素治疗组患者63例,其中男52例,女11例;平均年龄(51.6±11.9)岁。对照组患者6 3例,其中男5 0例,女1 3例;平均年龄(50.9±9.6)岁。两组患者术前肝功能分级均为Child A级。所有患者入院后术前常规护肝3~5 d。对HBV DNA定量水平高于检测上限且未行抗病毒治疗患者,入院后即开始规律口服恩替卡韦(0.5 g,1次/d)抗乙肝病毒治疗,入院前已规律抗病毒治疗患者维持原抗病毒治疗方案不变,手术当日及手术后均不停药。
1.2 手术情况
两组患者均由同一医师团队完成手术过程。激素治疗组行大范围(剩余肝体积/标准肝体积40%~60%)肝切除术22例,小范围(剩余肝体积/标准肝体积60%以上)切除术41例,其中行选择性半肝阻断9例,全肝入肝血流阻断30例,未行肝门阻断24例。对照组行大范围肝切除术22例,小范围肝切除术41例,其中行选择性半肝阻断6例,全肝入肝血流阻断32例,未行肝门阻断25例。
1.3 术后处理
对照组:术后常规予以抗病毒、抗感染、护肝、对症支持治疗。激素治疗组:术后当日起给与甲强龙80 mg静滴治疗,连续应用3 d后减量至40 mg继续静滴2 d后停药,余治疗同对照组。术后是否给与糖皮质激素治疗均为随机。两组患者术后补充白蛋白,定期复查白蛋白水平,白蛋白>35 g/L停止补充。术后若有不明原因发热、心动过速、腹痛腹胀等情况,必要时查胸片及胸腹部彩超。有症状的胸腔积液行穿刺引流治疗;腹腔引流管引流量少于10 mL或为清亮腹水,排除胆汁漏等情况后予以拔除。肝功能基本正常后予以办理出院。甲强龙:辉瑞制药比利时公司 注射用甲泼尼龙琥珀酸钠(40 mg/支)。
1.4 观察指标
实验室指标:收集比较两组患者术前及术后1、3、5、7 d血常规、肝功能相关指标结果。临床指标:统计比较两组患者肝功能不全发生率,收集比较两组患者手术并发症及术后住院天数等资料。其中术后并发症包括感染性并发症(切口感染、肺部感染)、切口裂开、胆汁漏、胸腔积液、肝功能不全(或肝功能衰竭)、术后大出血、死亡。术后肺部感染标准:胸片提示新出现的实变、浸润、肺不张影像合并以下3项中至少2项:⑴ 脓痰;⑵ 发热(>38.3℃);⑶ 外周血白细胞升高(>25%基线水平)[7]。术后胸腔积液标准:因呼吸困难、心动过速需穿刺引流的胸腔积液。术后胆汁漏标准:腹腔引流管术后连续7 d流出肉眼可见胆汁[8]。
1.5 统计学处理
统计资料采用SPSS 21.0软件包分析,计量资料根据数据分布类型采用平均值±标准差( ±s)或中位数(四分位数间距)[M(QR)]表示,组间比较采用两独立样本t检验或Mann-Whiney U检验;计数资料采用χ2检验或Fishier确切概率法。P<0.05为差异有统计学意义。
±s)或中位数(四分位数间距)[M(QR)]表示,组间比较采用两独立样本t检验或Mann-Whiney U检验;计数资料采用χ2检验或Fishier确切概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 可比性分析
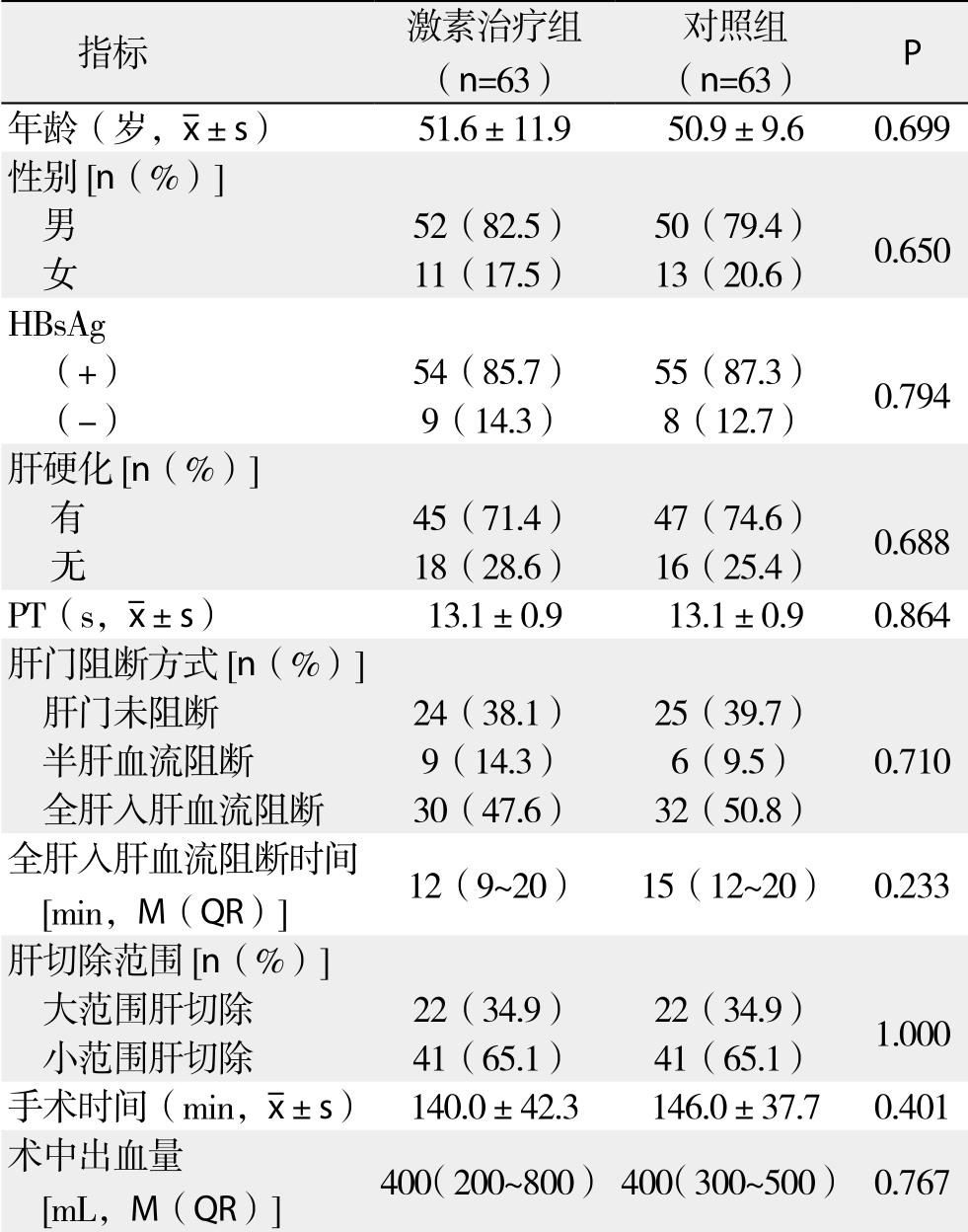
激素治疗组与对照组在性别、年龄、HBsAg、肝硬化、PT、肝门阻断方式、全肝入肝血流阻断时间、肝切除范围、手术时间、术中出血量、术中输血方面均有可比性(均P>0.05)(表1)。
表1 两组患者一般情况及术中相关资料的比较(n=63)
Table 1 Comparison of the general data and intraoperative variables between the two groups (n=63)
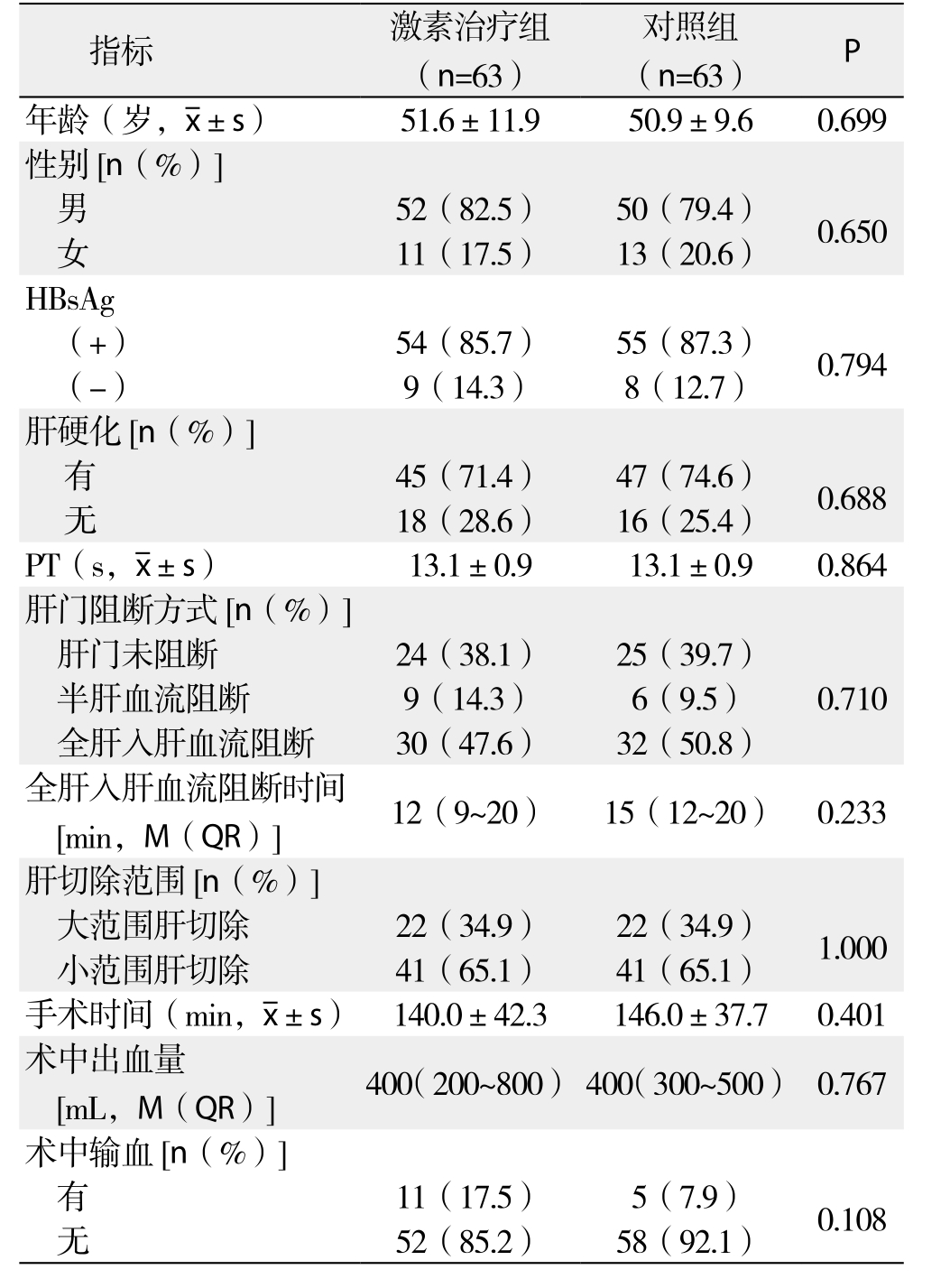
 术中输血[n(%)]有11(17.5) 5(7.9) 0.108无52(85.2) 58(92.1)
术中输血[n(%)]有11(17.5) 5(7.9) 0.108无52(85.2) 58(92.1)
2.2 肝功能相关指标比较
患者术后1天白蛋白(ALB)水平与术前相比明显降低,后逐渐升高,于术后第7天尚未达到术前水平;转氨酶于术后早期达最高水平,后随时间逐渐降低,于术后第7天基本降低至术前水平。术后第1天总胆红素(TBIL)水平较术前明显升高,后逐渐降低,于术后第5天有轻度反弹,后继续下降。
激素治疗组与对照组比较,两组患者术前ALB、TBIL、谷丙转氨酶(ALT)、谷草转氨酶(AST)无统计学差异(均P>0.05)。两组术后各时期ALB水平无明显差异(均P>0.05)。激素治疗组术后第2、3天TBIL水平明显低于对照组[14.1(10.2~17.7)µmol/L vs. 20.2(13~33.2)µmol/L;14.4(10.8~19.4)µmol/L vs.20.1(14.4~32.1)µmol/L](均P<0.001),术后第1、5、7天两组比较无统计学差异(P>0.05)。两组患者术后转氨酶水平比较无统计学差异(P>0.05)(图1)。
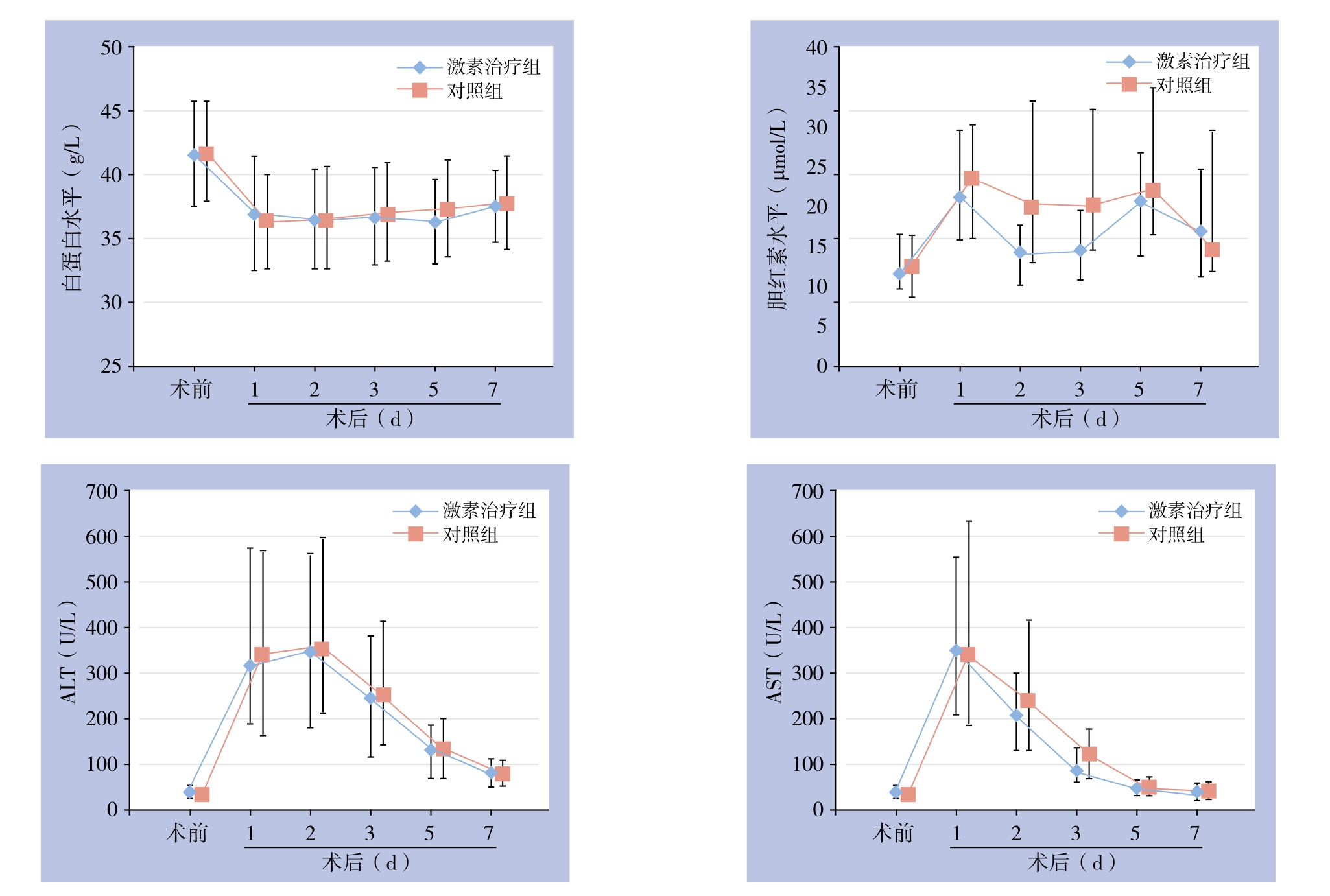
图1 两组患者肝功能指标
Figure 1 Liver function parameters of the two groups of patients
2.3 ALB用量比较
激素治疗组与对照组ALB总用量术后前3 d分别为(70.6±26.2)g与(73.5±22.2)g,术后前5 d分别为(91.2±39.5)g与(103.3±31.8)g,组间差异均无统计学意义(均P>0.05)。
2.4 术后肝功能不全、并发症及术后住院时间比较
激素治疗组术后12例(19.0%)发生肝功能不全,对照组术后22例(34.9%)发生肝功能不全,两组间比较有统计学差异(P=0.045)。其中激素治疗组无发生肝功能衰竭患者,对照组术后4例患者发生肝功能衰竭,2例患者死亡,其余肝功能不全患者均治疗好转后出院。激素治疗组1例患者因术后大出血死亡。激素治疗组共有17例患者(27.0%)术后出现一种或以上并发症,对照组共有28例患者(44.4%)发生并发症,两组总并发症发生率差异有统计学意义(P=0.041),而在术后感染性并发症(肺部感染及切口感染)、胆汁漏及胸腔积液方面两组比较无统计学差异(均P>0.05);所有患者除伤口感染外,均于术后常规时间拆除缝线,无切口裂开病例(表2)。
激素治疗组术后平均住院(12.5±4.5)d,对照组术后住院(11.7±2.6)d,两组患者住院时间差异无统计学意义(P=0.230)。
表2 两组患者术后并发症情况比较[n(%)]
Table 2 Comparison of the incidence of postoperative complications between the two groups [n (%)]
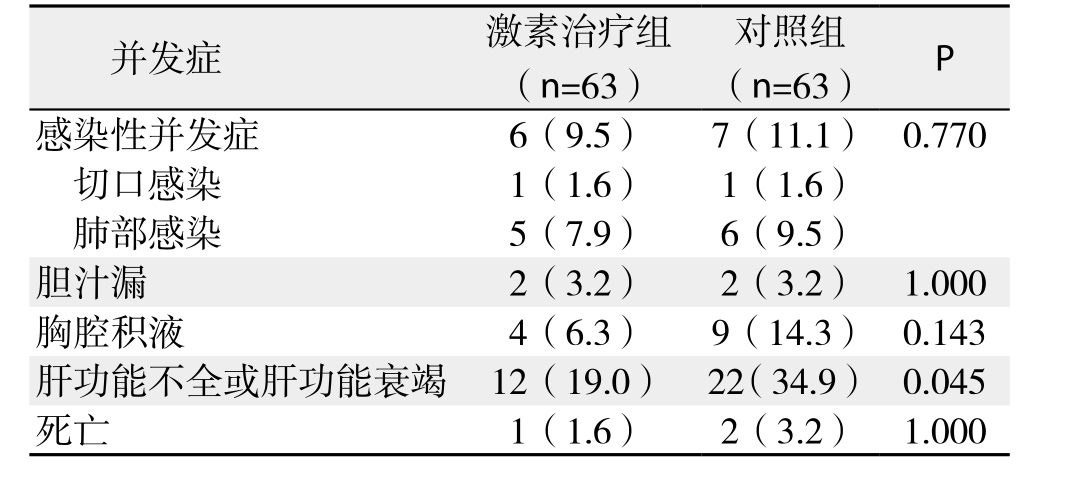
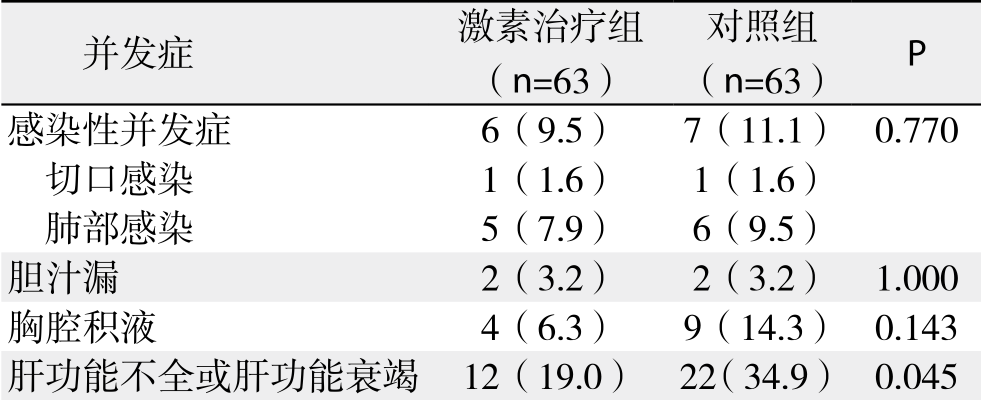 死亡 1(1.6) 2(3.2) 1.000
死亡 1(1.6) 2(3.2) 1.000
3 讨 论
肝切除术是外科领域较为复杂的手术之一,在医学技术迅猛发展的今日,因术中出血而导致患者死亡的情况已较为少见,但随之而来的术后肝功能不全成为影响患者预后的主要因素。肝脏是机体创伤应激时产生炎症介质的主要器官,加之与其它外科手术相比,肝切除术手术复杂、手术时间长、术中出血量大,术中常行血流阻断,术后可产生大量炎症介质,导致机制稳态失调,出现肝脏急性期反应[9-10]。研究[11-13]表明,肝脏急性期反应主要由炎症介质介导,其中IL-6及TNF-α发挥重要作用,而过度的炎症反应可明显增加手术并发症及病死率,增加患者术后肝功能不全及肝功能衰竭的发生率。因此控制围手术期过度炎症反应是增加肝切除术安全性,改善患者预后的重要手段[14]。
甲强龙是人工合成的中效糖皮质激素,其起效迅速,抗炎作用强。与其它激素类药品相比具有以下优点:⑴ 与地塞米松及氢化可的松相比:甲强龙因其特殊分子结构,无需肝脏转化,不增加肝脏负担;组织渗透能力强,能快速达到作用部位,与糖皮质激素受体亲和力在所有糖皮质激素内最高。⑵ 与短效氢化可的松相比,抗炎作用强,水钠潴留副作用轻;⑶ 与长效地塞米松相比,甲强龙对HPA轴的抑制作用较弱,血浆清除率及疗效较稳定[15]。肝切除术后应用甲强龙治疗,既能保证糖皮质激素维持足够的疗效,又能最大程度降低糖皮质激素相关不良反应。
关于肝切除术围手术期应用糖皮质激素治疗的剂量与时机上,国外的研究[16-17]大多选择手术开始前30~60min单剂大剂量静滴甲基强的松龙,最大剂量可达30 mg/kg。日本学者[18]选择在肝门阻断前静滴500 mg氢化可的松,术后连续3 d分别静滴300、200、100 mg后停药。其基于的考虑为肝切除术手术过程,尤其在合并肝门阻断所致的手术创伤是导致术后产生大量炎症介质的主要因素[19]。本研究选择术后激素短疗程逐日减量方案的主要原因如下:⑴ 外科手术后血浆中糖皮质激素水平常于术后第1天达到峰值,后于术后48~72 h逐步下降至术前水平,术后应用糖皮质激素短疗程治疗更加符合正常人体的分泌规律[20];⑵ 术后短疗程应用糖皮质激素同时可兼顾手术后因疼痛、精神应激等因素所致的创伤反应[21];⑶ 大剂量应用糖皮质激素是否会引起机体内环境紊乱,引起激素不良反应尚不得而知。
肝功能指标是肝癌切除术后重点关注及影响患者预后的重要因素,术后高胆红素水平与术后肝功能衰竭、术后并发症及病死率密切相关[18,22-23]。本研究中发现肝癌肝切除术后激素治疗组术后第2、3天TBIL水平明显低于对照组,两组间比较有显著统计学差异(P<0.001),术后短期较小剂量应用甲强龙同样能明显降低患者术后胆红素水平,减少术后肝功能不全发生率。术后白蛋白水平常是反映手术创伤的重要指标[24-25]。本研究中,激素治疗组与对照组术后白蛋白水平较术前均下降明显,两组患者术后各时期比较并无统计学差异(均P>0.05),两组患者在术后前5 d外源性白蛋白用量亦无统计学差异(均P>0.05)。糖皮质激素有抑制蛋白合成及促进蛋白分解的功能,而在激素治疗组中,白蛋白的输注量并未明显增加,究其原因,可能与以下两方面相关:⑴ 本研究中甲强龙应用剂量较小,应用时间较短,对白蛋白的影响较小;⑵ 糖皮质激素通过其抗炎机制抑制IL-6及TNF-α等炎症介质的合成及释放,降低血管通透性,减少蛋白渗漏至第三间隙以及抑制蛋白的分解[26]。肝脏氨基转移酶是反映肝细胞损伤的敏感指标,其活性升高在肝脏疾病中主要见于急慢性肝炎及肝硬化。关于糖皮质激素应用于肝切除术围手术期对转氨酶的影响尚有争议。西方两项研究提示术前大剂量单剂应用糖皮质激素可降低术后转氨酶水平,两项研究中患者肝硬化比例分别为36%及35%[16,27]。来自日本的一项研究[18]发现糖皮质激素治疗组患者与对照组相比,转氨酶水平并无明显差异,该研究中肝硬化患者所占比例为61%。我国肝癌患者大多合并有慢性肝炎及肝硬化背景[28]。本研究中,患者合并肝硬化比例高达72%,研究结果提示两组患者术后转氨酶水平无统计学差异(P>0.05)。导致该差别的可能原因是人种不同或是合并慢性肝病背景患者比例差异,有待于进一步的临床研究以明确。糖皮质激素具有较强的免疫抑制功能,其相关副作用,尤其是感染性并发症是临床上应用糖皮质激素的重要关注点。已有较多研究[16-18,29]表明,肝切除术围手术期短期应用糖皮质激素治疗并未增加患者切口感染、肺部感染等并发症发生率。本研究中肝切除术后感染性并发症发生率在两组间亦无统计学差异(P>0.05)。
综上所述,原发性肝癌切除术后短疗程应用糖皮质激素治疗是一种有效的治疗手段,可改善患者肝功能恢复,并不增加糖皮质相关副作用发生率。
参考文献
[1]Schmidt LE, Larsen FS. Prognostic implications of hyperlactatemia,multiple organ failure, and systemic inflammatory response syndrome in patients with acetaminophen-induced acute liver failure[J]. Crit Care Med, 2006, 34(2):337–343.
[2]Huang J, Xu L, Luo Y, et al. The inflammation-based scores to predict prognosis of patients with hepatocellular carcinoma after hepatectomy[J]. Med Oncol, 2014, 31(4):883. doi: 10.1007/s12032–014–0883–x.
[3]Auphan N, Didonato JA, Rosette C, et al. Immunosuppression by glucocorticoids: inhibition of NF-kappa B activity through induction of I kappa B synthesis[J]. Science, 1995, 270(5234):286–290.
[4]Whitehouse MW. Anti-inflammatory glucocorticoid drugs:re fl ections after 60 years[J]. In fl ammopharmacology, 2011, 19(1):1–19. doi: 10.1007/s10787–010–0056–2.
[5]Saidi RF, Chang J, Verb S, et al. The effect of methylprednisolone on warm ischemia-reperfusion injury in the liver[J]. Am J Surg,2007, 193(3):345–347.
[6]Figueroa I, Santiago-Delpín EA. Steroid protection of the liver during experimental eschemia[J]. Surg Gynecol Obstet, 1975,140(3):368–370.
[7]Evans AL, Gleeson FV. Radiology in pleural disease: state of the art[J]. Respirology, 2004, 9(3):300–312.
[8]Sadamori H, Yagi T, Shinoura S, et al. Risk factors for major morbidity after liver resection for hepatocellular carcinoma[J]. Br J Surg, 2013, 100(1):122–129. doi: 10.1002/bjs.8957.
[9]van Golen RF, Reiniers MJ, Olthof PB, et al. Sterile in fl ammation in hepatic ischemia/reperfusion injury: present concepts and potential therapeutics[J]. J Gastroenterol Hepatol, 2013, 28(3):394–400. doi:10.1111/jgh.12072.
[10]王志明, 陶一明, 黄云, 等. 联合肝脏离断和门静脉切断二步肝切除术在肝炎后肝硬化肝癌中的应用[J]. 中国普通外科杂志,2014, 23(7):867–872. doi:10.7659/j.issn.1005–6947.2014.07.001.Wang ZM, Tao YM, Huang Y, et al. Associating liver partition and portal vein ligation for staged hepatectomy procedure in treatment of hepatocellular carcinoma with post-hepatitic cirrhosis[J]. Chinese Journal of General Surgery, 2014, 23(7):867–872. doi:10.7659/j.issn.1005–6947.2014.07.001.
[11]Tang GH, Yang HY, Zhang JC, et al. Magnesium isoglycyrrhizinate inhibits inflammatory response through STAT3 pathway to protect remnant liver function[J]. World J Gastroenterol, 2015,21(43):12370–12380. doi: 10.3748/wjg.v21.i43.12370.
[12]Pulitanò C, Aldrighetti L, Arru M, et al. Preoperative methylprednisolone administration maintains coagulation homeostasis in patients undergoing liver resection: importance of in fl ammatory cytokine modulation[J]. Shock, 2007, 28(4):401–405.
[13]Hu C, Shen S, Zhang A, et al. The liver protective effect of methylprednisolone on a new experimental acute-on-chronic liver failure model in rats[J]. Dig Liver Dis, 2014, 46(10):928–935. doi:10.1016/j.dld.2014.06.008.
[14]中华医学会外科学分会肝脏外科学组. 肝切除术围手术期管理专家共识[J]. 中国实用外科杂志, 2017, 37(5):525–530. doi:10.19538/j.cjps.issn1005–2208.2017.05.17.Hepatic Surgery Group, Society of Surgery, Chinese Medical Association. Expert consensus on perioperative management of hepatectomy[J]. Chinese Journal of Practical Surgery, 2017,37(5):525–530. doi: 10.19538/j.cjps.issn1005–2208.2017.05.17.
[15]Jabbour SA. Steroids and the surgical patient[J]. Med Clin North Am, 2001, 85(5):1311–1317.
[16]Pulitanò C, Aldrighetti L, Arru M, et al. Prospective randomized study of the bene fi ts of preoperative corticosteroid administration on hepatic ischemia-reperfusion injury and cytokine response in patients undergoing hepatic resection[J]. HPB (Oxford), 2007,9(3):183–189. doi: 10.1080/13651820701216984.
[17]Schmidt SC, Hamann S, Langrehr JM, et al. Preoperative highdose steroid administration attenuates the surgical stress response following liver resection: results of a prospective randomized study[J]. J Hepatobiliary Pancreat Surg, 2007, 14(5):484–492.
[18]Hayashi Y, Takayama T, Yamazaki S, et al. Validation of perioperative steroids administration in liver resection: a randomized controlled trial[J]. Ann Surg, 2011, 253(1):50–55. doi:10.1097/SLA.0b013e318204b6bb.
[19]van den Broek MA, Shiri-Sverdlov R, Schreurs JJ, et al. Liver manipulation during liver surgery in humans is associated with hepatocellular damage and hepatic in fl ammation[J]. Liver Int, 2013,33(4):633–641. doi: 10.1111/liv.12051.
[20]Mohler JL, Michael KA, Freedman AM, et al. The serum and urinary cortisol response to operative trauma[J]. Surg Gynecol Obstet, 1985, 161(5):445–449.
[21]Garabedian MJ, Harris CA, Jeanneteau F. Glucocorticoid receptor action in metabolic and neuronal function[J]. F1000Res, 2017,6:1208. doi: 10.12688/f1000research.11375.1.
[22]Balzan S, Belghiti J, Farges O, et al. The "50–50 criteria" on postoperative day 5: an accurate predictor of liver failure and death after hepatectomy[J]. Ann Surg, 2005, 242(6):824–828.
[23]梅理祥, 李增博, 谢艳会, 等. 肝切除术后第3天ICG-R15对肝细胞肝癌术后肝功能不全的预测价值[J]. 中国普通外科杂志, 2016,25(8):1180–1185. doi:10.3978/j.issn.1005–6947.2016.08.016.Mei LX, Li ZB, Xie YH, et al. Value of ICG-R15 on postoperative day3 in predicting liver dysfunction after hepatectomy for hepatocellular carcinoma[J]. Chinese Journal of General Surgery,2016, 25(8):1180–1185. doi:10.3978/j.issn.1005–6947.2016.08.016.
[24]Hübner M, Mantziari S, Demartines N, et al. Postoperative Albumin Drop Is a Marker for Surgical Stress and a Predictor for Clinical Outcome: A Pilot Study[J]. Gastroenterol Res Pract, 2016,2016:8743187. doi: 10.1155/2016/8743187.
[25]李树民, 徐鹏远, 岑云云, 等. 腹部手术后早期血浆白蛋白及炎症介质变化的研究[J]. 中华普通外科杂志, 2010, 25(12):1002–1004.doi:10.3760/cma.j.issn.1007–631X.2010.12.020.Li SM, Xu PY, Cen YY, et al. Early plasma albumin and inflammatory factors changes in patients undergoing abdominal surgery[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2010, 25(12):1002–1004. doi:10.3760/cma.j.issn.1007–631X.2010.12.020.
[26]Miyata M, Lee JY, Susuki-Miyata S, et al. Glucocorticoids suppress in fl ammation via the upregulation of negative regulator IRAK-M[J].Nat Commun, 2015, 6:6062. doi: 10.1038/ncomms7062.
[27]Aldrighetti L, Pulitano C, Arru M, et al. Impact of preoperative steroids administration on ischemia-reperfusion injury and systemic responses in liver surgery: a prospective randomized study[J]. Liver Transpl, 2006, 12(6):941–949.
[28]肝细胞癌抗病毒治疗专家组. HBV/HCV相关性肝细胞癌抗病毒治疗专家共识[J]. 胃肠病学和肝病学杂志, 2014, 23(5):前插1-前插8. doi:10.3969/j.issn.1006–5709.2014.05.000.Expert Panel of Antiviral Therapy for Hepatocellul. Expert consensus on antiviral therapy to hepatitis B/C virus-related hepatocellular carcinoma[J]. Chinese Journal of Gastroenterology and Hepatology, 2014, 23(5): insert 1–8. doi:10.3969/j.issn.1006–5709.2014.05.000.
[29]Bressan AK, Roberts DJ, Bhatti SU, et al. Preoperative single-dose methylprednisolone versus placebo after major liver resection in adults: protocol for a randomised controlled trial[J]. BMJ Open,2015, 5(10):e008948. doi: 10.1136/bmjopen–2015–008948.
