胰腺癌是全世界内一种恶性度高、病死率高的疾病,近年来其发病率和病死率在国内外均有增加的趋势,2017年美国新发胰腺癌病例数预计达到53 670例,死亡病例预计达43 090例,成为美国与癌症死亡相关第三大主要病因[1],预计到2030年将上升至与癌症死亡相关的第二主要病因[2-4]。由于胰腺癌发病隐匿,缺乏早期诊断症状和灵敏度、特异度高的检测手段,大部分患者就诊时已处于不可切除,只有10%~20%的患者能够有机会得到及时的手术切除[5-6],即便手术切除后年生存率仍然不容乐观。此类胰腺癌患者如若任其自然发展,中位生存时间平均仅约3~4个月,5年总体生存率不到5%[7]。对不宜手术的患者或已没有手术窗口的胰腺癌患者,临床实践常用诸如体外照射放疗、系统静脉化疗、射频消融等非手术治疗手段,但敏感度较差,且常伴随系统的并发症,对于减轻患者疼痛、提高生活质量、控制肿瘤生长等临床效果却不令人满意[8-9],所以寻找有关的代替治疗方案在临床上显得尤为迫切。因胰腺癌位置较深,且临近腹腔内脏器官如肝、胃肠、肾、脊髓等对放疗敏感的,体外放疗很困难或几乎不可能达到可治疗的剂量。据此组织间近距离持续放疗越来越受临床医师所关注,碘125(125I)粒子植入是组织间近距离放疗常用手段。近几十年,越来越多的患者和医生接受不可切除胰腺癌在临床采取放射性125I粒子植入治疗的方法。本文就125I粒子植入治疗胰腺癌患者,从放射性粒子近距离植入概念、适应证与禁忌证、临床应用历史、物理学特性、临床优势与不足、作用机制、植入方法、临床应用效果、辐射防护等方面进行综述。
1 放射性粒子近距离植入治疗的概念
近距离放疗(brachytherapy)是将治疗的粒子源直接或间接方式放置于肿瘤附近(距肿瘤组织5 cm范围内),甚至直接植入到肿瘤病灶组织内,使肿瘤组织遭受粒子持续低放射性的损伤,而毗邻的正常组织仅受轻微损伤或不受损伤实施照射的一类放射治疗方式的总称[10-13]。125I粒子是近距离放疗常用的粒子源。
2 125I粒子植入胰腺癌的适应情况和禁忌情况
适应证:⑴ 不可切除胰腺癌,包括存在远处转移、主要大血管(腹腔干、肠系膜上血管、门静脉等)受侵犯,且不可切除重建[14];⑵ 患者或家属拒绝PD术。禁忌证:⑴ 胰腺癌广泛转移;⑵ 恶病质、血液系统疾病;⑶ 严重糖尿病等基础疾病难以耐受手术[15]。
3 放射性粒子组织间近距离治疗肿瘤的历史
临床上采取近距离放射疗法治疗肿瘤已有100多年历史。1898年,居里夫妇发现放射性核素镭,放射线用于治疗肿瘤就为临床医师所关注。1901年Pierre Curie将密封放射性核素镭粒子管植入到肿瘤组织内,在1905年进行了第1例组织间植入治疗,结果发现放射性核素可使肿瘤变小,这使得内放射治疗技术逐步开展起来[16]。1909年Pasteau完成了世界上第1例镭粒子源置入治疗前列腺癌病例[17]。1931年“近距离治疗”的概念应运而生,首先由Forssell 提出。1934年,Handley[18]第1次使用放射性镭粒子植入临床应用于7例胰腺癌患者,并取得较好疗效。到20世纪70年代早期,Whitmore等[19]首先将125I放射性粒子植入术应用于治疗前列腺,并取得较好的抑制肿瘤疗效。1970年,D'Angio等[20]报道125I粒子植入不可切除胰腺癌中可获得满意疗效,开创行125I粒子植入治疗胰腺癌的先河。上世纪90年代,伴随着计算机治疗计划系统(TPS)完善、影像学等技术发展,为顺应医学技术发展的需求,2002年我国临床引进并应用放射性粒子(主要为125I粒子源)植入技术[21],临床实践应用迅猛,多用于原发实体肿瘤(胰腺癌)等的治疗。
4 125I粒子的物理性质、优势及不足
4.1 125I粒子物理性质
粒子源是一种新型的人工合成的低剂量率的放射源性粒子,125I由Xe124吸收一个中子,93%的能量发生转换发生在其俘获电子的过程中[22],即处于激发状态即125I。目前应用于临床的125I放射性粒子[23-25]由金属钛所包壳,将125I放射源吸附于钛管中,两端用激光焊接成密封源而成。钛管外壁厚度约0.05 mm,内核银丝尺寸3.0 mm×0.5 mm,表层镀有125I,长径为(4.50±0.3)mm,外径为(0.80±0.03)mm;每粒粒子活性在0.40~0.60 mCi,半衰期为5 9.4 3 d,其衰减时释放波长分别为27.4 KeV、为35.5 KeV的X射线、γ射线;组织穿透范围1.7 cm,有效的杀伤半径范围是1~1.5 cm。
4.2 125I粒子的优点
在临床上应用中具备以下优势[26-29]:⑴ 其物理特性决定了所释放的射线能量低,属低剂量率能量辐射;⑵ 125I粒子植入是对各个不同细胞周期的肿瘤细胞的持续照射,从而持续杀伤肿瘤细胞而引起细胞凋亡、死亡,放射生物学效应高;⑶ 肿瘤目标照射剂量与毗邻正常组织剂量高分配比的特点,能使粒子放射剂量大量释放于肿瘤区域内,区域外剂量迅速衰减而减少正常组织的暴露,有利于保护毗邻正常组织;⑷ 肿瘤细胞微环境125I粒子植入肿瘤组织后发生变化,如引起肿瘤细胞免疫表型表达改变,进而抑制肿瘤的转移和复发;⑸ 传统治疗方法因呼吸运动影响放疗吸收剂量不均,治疗有效剂量减少,通过对比,125I粒子放射不受呼吸运动的影响,放疗剂量损失量明显减少;总之,125I粒子植入对靶向肿瘤区域具有高度“适形照射”特点。
4.3 125I粒子治疗的不足
当然,125I粒子临床应用上也有不足之处:⑴ 可发生相关不良反应,如乳糜漏、胃溃疡、放射性肠炎,发生率为4%~7%[30-31],发生率均较低,且予以相应对症处理后均可缓解。⑵ 125I治疗的一个局限是放射衰减,其半衰期接近2个月,也就意味着植入后6~8个月基本就无效了;这个问题某种程度可通过再次粒子植入,但再次粒子植入给患者带来的经济负担和精神负担。
5 125I粒子作用机制
5.1 通过诱导细胞凋亡和G2/M期细胞周期阻滞杀伤胰腺癌细胞
有学者[21]研究:PANC-1、SW1990存活分数随放疗剂量的增加而呈指数型减少;凋亡率在两种细胞系中都比对照组高,且凋亡率随着碘粒子放射剂量呈正性相关,即两类细胞暴露环境中的放射剂量越高,细胞数凋亡所占比例就越高。其凋亡机制:有机体暴露于电离辐射能够增加活性氧的产生,而活性氧是诱导凋亡的决定因素[32]。机体内的活性氧能够有效损伤细胞DNA、蛋白质大分子、细胞内液等细胞主要成分,最终导致细胞凋亡[33]。Ma等[34]对比研究结果显示4 Gy组细胞凋亡率最高,且肿瘤细胞暴露于125I粒子的环境后可以观察到放射剂量依赖的G2/M期细胞周期抑制,且在6 Gy时达到最高值,表明125I粒子的近距离放疗通过诱导细胞凋亡和抑制G2/M期细胞周期以达到有效杀伤胰腺癌细胞生物学效应。先前的研究[35-38]已经证实细胞凋亡和G2/M期细胞周期抑制是抑制肿瘤生长最主要的机制。
5.2 通过抑制DNA合成杀伤胰腺癌细胞
采用3H-TdR渗入试验[21](3H标记脱氧胸腺嘧啶核苷渗入实验,其渗入量与细胞合成DNA的速度呈正比,并反映细胞的增殖水平)显示,两种不同细胞系(PANC-1和SW1990细胞系)的剂量学统计结果随放射剂量增加而减少,且在6 Gy达最低值。即125I粒子低剂量率放射环境中,其可通过抑制DNA合成水平来杀死胰腺癌细胞以达到抑制肿瘤生长。在125I粒子持续放疗环境中,肿瘤细胞受到持续照射,射线使肿瘤细胞的DNA双链断裂,肿瘤细胞增殖受到抑制,持续杀伤不同分裂周期的癌细胞,而且可使更多地处于不敏感的静止期的肿瘤细胞进入到敏感期,使得细胞周期延长,肿瘤细胞再生池被缩小,甚至被消灭。
5.3 诱导肿瘤细胞DNA低甲基化杀伤胰腺癌细胞
有关研究[34]表明:125I粒子低剂量放射剂量达4 Gy可以抑制DNMTRNA和蛋白的表达。4 Gy时DNMTs表达明显减少,明显的肿瘤体积减少只在4 Gy时观察到。事实上,2 Gy低剂量放疗主要引起可逆性DNA损伤,与DNA修复有关。DNMTs活性表达可以反映DNA修复的活性。DNMTs(DNA甲基转移酶)的表达可以维持DNA的甲基化状态[39]。125I粒子照射,尤其在在4 G y剂量时,可引起DNMTs(主要Dnmt1、Dnmt3b)表达降低,导致DNA低甲基化,重新激活抑癌基因和负性调节作用于细胞周期,从而抑制肿瘤生长。
5.4 抑制胰腺癌细胞的神经浸润,减轻疼痛,抑制肿瘤生长
Lu等[40]研究结果显示:125I粒子照射组中胰腺癌细胞、神经细胞增长明显受抑制;共养组(粒子照射时)中神经生长因子(NGF)、表皮生长因子(EGFR)的mRNA表达明显减少,即胰腺癌细胞、神经生长在125I粒子持续照射时均受到抑制。而体内(大鼠原位模型)免疫组化结果中:粒子组小鼠NGF阳性评分明显降低,表明125I放疗可以降低NGF、EGFR的mRNA水平的表达。其纳入研究的所有患者术后2周VAS(视觉模拟疼痛评分)评分均降低,且止痛药用量减少46.7%的用量。NGF是神经营养家族中参与细胞生存、生长的一种信号分子[41],EGFR作为转化因子受体的细胞因子生长信号能促进胰腺神经副神经与PDA细胞的亲和力,NGF、EGFR过表达在胰腺癌患者中是预后不良的标志[42]。因此125I粒子低剂量持续放疗能抑制NGF、EGFR mRNA胰腺癌细胞中表达,从而抑制胰腺癌神经侵犯,减轻疼痛,抑制肿瘤生长。腹部疼痛,是胰腺癌患者的最常见的临床症状表现,目前的研究[43]认为胰腺癌细胞有嗜神经特殊性质,且与疼痛的发生与有紧密关系。相关研究[44]显示胰腺癌细胞神经生长因子是高表达的,从而引起胰腺癌细胞的嗜神经特性并导致疼痛的发生[45]。国内有关报道[27]认为胰腺癌细胞的中NGF含量在125I粒子低剂量率照射后均显著下调,且神经突和胰腺癌细胞的相互联系受到明显抑制。其认为125I粒子照射通过NGF/NGFR途径的抑制神经和癌细胞之间信号的交互作用,进而抑制癌细胞的对神经的浸润,提示125I性粒子照射可有效抑制癌细胞嗜神经功能。
6 125I粒子植入方法
6.1 超声(内镜)引导下的125I粒子植入
超声下测量肿瘤大小,辨认肿瘤位置及周围脉管系统。常规胃镜检查后为使胃、肠腔充分舒展开,可将超声内镜送达十二指肠降部水平,实时超声,明确瘤体与毗邻组织(尤其是血管)关系,操作内镜专用穿刺针进入瘤体,缓慢拔出针芯,注意回抽,如无明显出血时,随即将1颗放射性粒子置入外套管内,然后将针芯套入从而粒子推送到瘤体内,每次退针1 cm左右,再释放第2颗粒子,依次释放粒子植入,每针道植入2~3颗,针道间距1.5 cm左右,均匀种植[46](图1A)。此外还有在术中经超声辨认腹腔神经节(图1B),将125I粒子直接植入神经节内疗效确切[47]。
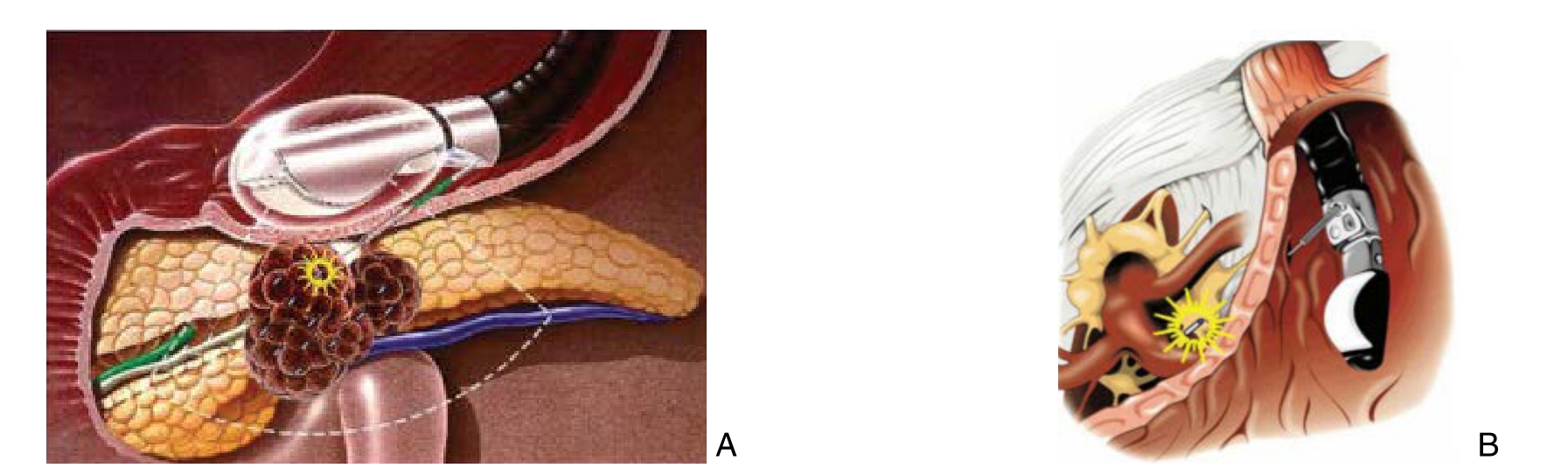
图1 超声(内镜)引导下的125I粒子植入 A:瘤体内125I粒子植入;B:神经节内125I粒子植入
Figure 1 125I seed implantation by ultrasound guidance and endoscopy A: Intratumoral 125I seed implantation; B: Intraganglionic 125I seed implantation
6.2 CT入路125I粒子植入
CT引导下经皮穿刺可通过3种不同路径[48](前侧入路、侧侧入路、后侧入径)将125I粒子植入胰腺癌患者病灶中是一种安全、有效、无严重并发症的植入方式(图2)。植入前肿瘤的大小依据CT成像的TPS计算,CT采集的信息可以重建成三维模型,能够精确的描绘肿瘤的边缘,有助于肿瘤外缘计量计算。根据修改的标准公式计算预期种植的粒子数。为尽可能的达到最优的粒子放射生物学效应,实际操作中种植的粒子数比预计需要的多15%。根据TPS通过CT引导完成粒子的植入。粒子植入在局麻下标准CT室中进行。在CT透视下,T成像间隔5 mm,相邻两穿刺针间穿刺距离相隔约1 cm,避免损伤胃肠、穿透血管、胰腺导管及其他组织器官等器官。缓慢、轻柔、准确调整穿刺针深度、角度及方向,每根穿刺针搭载3~5颗粒子,针每回缩0.5~1 cm释放1颗粒子。
6.3 开腹术中直视下途径125I粒子植入
术中植入法[49]:常规开腹,暴露胰腺,手指探查肿块18 G穿刺针穿刺植入病灶,平行间隔1 cm排列,超过病灶0.5~1 cm,穿刺过程注意避免穿刺到胰腺导管、小血管分支及邻近横结肠,每间隔1 cm操作迈克(Mick)植入枪将125I粒子释放植入胰腺癌病灶。具体操作:针尖从瘤体近端刺入先到达瘤体远端距边缘处0.5 cm释放第1颗粒子植入,然后针尖往近端方向每退1 cm左右操作迈克枪释放1颗粒子植入瘤体,直至接近肿瘤近端边缘处,然后依术前TPS系统治疗计划更换针道后依照前法顺次逐一释放粒子植入,每个针道植入3颗粒子(具体视术中情况决定)。将网膜状脂肪垫放置于粒子植入平面以保护胃肠免受辐。每个穿刺点常常行“8字”缝合,以防止胰瘘。开腹直视下粒子植入具有肿瘤靶区直接、明确。此外,术中使用B超实时引导精确定位下,依照上述方法将子植入。
图2 CT引导下经皮穿刺125I粒子植入路径
Figure 2 Pathways for CT-guided percutaneous puncture 125I seed implantation
6.4 模板立体定位法与其他
有研究[50]报道使用有竖、横坐标标记的多孔模板立体模板,到立体定向治疗肿瘤的效果。此外,还可使用腔镜技术等方式将粒子植入。腔镜粒子植入瘤体技术临床报道较少,为临床应用和研究此项技术带来了新课题。
7 临床疗效
不可切除胰腺癌患者采取125I粒子植入治疗的临床目的主要在于缓解疼痛、改善生活质量、抑制肿瘤生长以及延长患者生存时间等方面。
临床应用125I粒子植入治疗胰腺癌的历史可以追溯至1970年,国外学者[20]永久性组织间125I粒子植入组取得良好疗效:疼痛缓解率为80%、生存期明显延长。另报道[49]将125I粒子植入术组与PD术组比较研究,125I粒子植入手术时间段短、出血少、较高蛋白、肠蠕动和恢复正常进食时间短、并发症发生率低,住院费用少,对不适宜或拒绝行胰十二指肠切除术,或许125I粒子植入退而求其次的方案。Wang等[30]纳入14例行不可切除胰腺癌行125I粒子植入术,术后体外放射疗法(5例)、化疗(5例):87.5%患者疼痛缓解,78.6%的患者肿瘤达到局部控制,中位生存期延长至10个月。Wang等[31]纳入28例不可切除胰腺癌,开腹术中彩超引导下粒子植入,植入术后7例体外照射放疗,10例行化疗:94.1%患者疼痛缓解,其中47%患者疼痛完全缓解,肿瘤反应率78.6%,而局部肿瘤控制率是87.5%,中位生存期明显延长至10.1个月。由此表明125I粒子植入不可切除胰腺癌可使患者从疼痛缓解、肿瘤局部控制、生存时间和改善生活质量等方面受益。有学者[23]将137例125I粒子植入(IP),87例非粒子植入组(NIP),所有的患者术前用75%酒精行腹腔神经丛阻滞,125I粒子植入术后1周采取静脉给予吉西他滨单药化疗(1 000 mg/m2每周,持续3周,28 d一疗程):均表现良好的疼痛减轻,IP组肿瘤反应率明显提高、中位生存期明显延长、整体健康状态评分高于NIP,生活质量改善。Niu等[28]纳入25例不可切除胰腺癌,粒子植入组(13例),对照组(12例患者采取化疗、放疗、分子靶向治疗、免疫治疗,中医药治疗等其他治疗方式):粒子植入组临床收益率分别为92.3%、41.7%(P<0.05)。而学者[51]研究采取彩超引导下直接将125I粒子植入腹腔神经丛毁损神经,其纳入23例病检证实不可切除胰腺癌,均有中、重度疼,所有患者于125I粒子植入术后1周行标准系统化疗:患者疼痛缓解率82.6%,VAS评分明显降低(从6.09分降到4.48分),止痛药平均用量明显减少(从71.74 mg降至55.22 mg);随访过程中,患者的VSA评分、止痛药用量处也相对低的水平。其提出相关作用机制:化疗可以增强控制疼痛和增强腹腔神经阻滞的作用。尽管最佳的化疗药物和方案认识是临床的一大难题,仍然强调化疗在放射治疗的胰腺癌患者重要作用。Peretz等[52]研究中所有患者行粒子植入,其中27例患者后接受静脉5-FU单药化疗,27例患者接受体外放疗(45 Gy):27例接受化疗的患者中位生存期10.3个月,其余没有接受化疗的患者中位生存期6.2个月,两者差异有统计学意义,提示胰腺癌125I粒子植入术后基础上进行系统化疗可患者在延长生存时间上获益。国内研究[29]纳入31例不可切除胰腺癌患者行125I粒子植入治疗,其中10例患者于植入术后1周行静脉5-FU+吉西他滨联合化疗,其结果显示:92%患者疼痛缓解,肿瘤总体反应率61.3%,肿瘤局部控制率90.3%,KPS评分显著增加,整体生活质量改善,相比10例接受粒子+加吉西他滨+5-FU化疗组中位生存期1个1月,而单一行粒子治疗组的患者中位生存期仅7个月(P<0.05),125I粒子植入基础上联合化疗可使患者在延长中位生存期明显获益。
由此可知,对胰腺癌患者,125I粒子植入术联合系统化疗可提高患者临床受益率。Mohiuddin等[53]纳入81例不可切除胰腺行125I粒子植入、体外照射疗法、围手术期系统化疗联合疗法,肿瘤控制率达71%,2、5年生存率达21%、7%,125I粒子植入、体外照射疗法、围手术期系统化疗联合治疗模式不可切除胰腺癌中在肿瘤控制和长期生存上可获得满意的疗效。国内学者[54]Meta分析相比单纯化疗组,125I粒子植入+化疗治疗胰腺癌有效率、临床受益率分别提高了24%、23%,6、12个月生存率分别提高22%、27% 。
以上研究结果显示125I粒子基础辅助化疗可以提高肿瘤局部控制率、减轻疼痛、延长生存期。既往的研究也印证了观点,Cron等[55]提出125I粒子植入术后的第3~4天是最佳的化疗时间,因此时粒子的放射作用提高脉管周围的渗透性。放射性粒子周围2~4 mm(1.5 Gy/d),24 h内氧分压(PO2)明显升高,持续到第3天,PO2升高可以提高这些区域内肿瘤细胞对化疗药物的敏感度,72 h这个区域血液灌注升高,能够增加化疗药物浓度渗透肿瘤,可以有效增强化疗药物对胰腺癌治疗的生物反应。
8 125I粒子辐射防护与安全
未经屏蔽的125I粒子植入术后的患者平均剂量当量率4 m范围内均大于病室内本底,且与测量距离成反比,直至4 m处才相当于病室内本底[56],这印证了屏蔽防护的重要性。有研究[57]报道显示0.25 mmPb橡胶布已经足以屏蔽粒子植入术后患者的大部分辐射,必要时采用0.5 mmPb的铅胶布。防御原则:⑴ 术前防护。125I粒子使用前需要在专用的铅防护用具包装、存储、运输。⑵ 术中防护。充分做好术前准备、计划,尽量由经验医护人员操作,尽可能缩短手术时间,且术中操作人员必须穿戴防辐射铅制品操作。⑶ 术后防护。设立粒子植入患者专用房间(粒子植入患者病房应设于单独楼房区域,且划为控制区;于植入患者植入部位贴铅胶布或穿戴铅背心)。
9 展 望
胰腺癌的治疗是当今临床的一大挑战,胰腺癌治疗是一个复杂而艰难的过程。相关研究证实125I粒子在不可切除胰腺癌临床上的应用可使患者在疼痛缓解、提高生活质量、局部控制肿瘤进展及延长生存期获益。探讨125I粒子植入近距离放疗与系统化疗、射频消融、腹腔神经从毁损、体外照射放疗治等治疗方式联合治疗不可切除胰腺癌的模式,进一步改善胰腺癌患者预后,以提高患者的临床有效率,其结果值得期待。
参考文献
[1]Lindquist CM, Miller FH, Hammond NA, et al. Pancreatic cancer screening[J]. Abdom Radiol (NY), 2017, doi:10.1007/s00261–017–1308–z. [Epub ahead of print]
[2]Ngamruengphong S, Canto MI. Screening for Pancreatic Cancer[J].Surg Clin North Am, 2016, 96(6):1223–1233. doi:10.1016/j.suc.2016.07.016.
[3]Tsai S, Evans DB. Therapeutic Advances in Localized Pancreatic Cancer[J]. JAMA Surg, 2016, 151(9):862–868. doi:10.1001/jamasurg.2016.1113.
[4]Rahib L, Smith BD, Aizenberg R, et al. Projecting cancer incidence and deaths to 2030:the unexpected burden of thyroid, liver,and pancreas cancers in the United States[J]. Cancer Res, 2014,74(11):2913–2921. doi:10.1158/0008–5472.CAN–14–0155.
[5]Park I, Choi SJ, Kim YS, et al. Prognostic Factors for Risk Stratification of Patients Recurrent or Metastatic Pancreatic Adenocarcinoma Who were Treated with Gemcitabine-Based Chemotherapy[J]. Cancer Res Treat, 2016, 48(4):1264–1273.
[6]Balaban EP, Mangu PB, Khorana AA, et al. Locally Advanced,Unresectable Pancreatic Cancer:American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol, 201,34(22):2654–2668. doi:10.1200/JCO.2016.67.5561.
[7]The Lancet Oncology. Pancreatic cancer:cause for optimism?[J].Lancet Oncol, 2016, 17(7):845. doi:10.1016/S1470–2045(16)30234–0.
[8]Joyce F, Burcharth F, Holm HH, et al. Ultrasonically guided percutaneous implantation of iodine-125 seeds in pancreatic carcinoma[J]. Int J Radiat Oncol Biol Phys, 1990, 19(4):1049–1052.
[9]Zou YP, Li WM, Zheng F, et al. Intraoperative radiofrequency ablation combined with 125 iodine seed implantation for unresectable pancreatic cancer[J]. World J Gastroenterol, 2010,16(40):5104–5110.
[10]Antipas V, Dale RG, Coles IP. A theoretical investigation into the role of tumour radiosensitivity, clonogen repopulation, tumour shrinkage and radionuclide RBE in permanent brachytherapy implants of 125I and 103Pd[J]. Phys Med Biol, 2001, 46(10):2557–2569.
[11]Martínez-Monge R, Pagola M, Vivas I. CT-guided permanent brachytherapy for patients with medically inoperable earlystage non-small cell lung cancer(NSCLC)[J]. Lung Cancer, 2008,61(2):209–213. doi:10.1016/j.lungcan.2007.12.016.
[12]Sider L, Mittal BB, Nemced AA Jr, et al. CT-guided placement of iodine-125 seeds for unresectable carcinoma of the lung[J]. J Comput Assist Tomogr, 1988, 12(3):515–517.
[13]Nag S, DeHaan M, Scruggs G, et al. Long-term follow-up of patients of intrahepatic malignancies treated with iodine-125 brachytherapy[J]. Int J Radiat Oncol Biol Phys, 2006, 64(3):736–744.
[14]中华医学会外科学分会胰腺外科学组. 胰腺癌诊治指南(2014)[J]. 临床肝胆病杂志, 2014, (12):1240–1245. doi:10.3969/j.issn.1001–5256.2014.12.003.Division of Pancreatic Surgery, Branch of Surgery, Chinese Medical Association. Guidelines for the management of pancreatic cancer(2014)[J]. Journal of Clinical Hepatology, 2014, (12):1240–1245.doi:10.3969/j.issn.1001–5256.2014.12.003.
[15]王忠敏, 黄钢, 陈克敏, 等. 放射性粒子组织间植入治疗技术指南的建议[J]. 介入放射学杂志, 2009, 18(9):641–644. doi:10.3969/j.issn.1008–794X.2009.09.001.Wang ZM, Huang G, Chen KM, et al. Suggestions on technical guide of implantation of radioactive seeds[J]. Journal of Interventional Radiology, 2009, 18(9):641–644. doi:10.3969/j.issn.1008–794X.2009.09.001.
[16]周亚萍, 金焰, 徐敬, 等. 125I放射性治疗胆管癌的进展[J].中国普通外科杂志, 2016, 25(8):1203–1207. doi:10.3978/j.issn.1005–6947.2016.08.020.Zhou YP, Jin Y, Xu J, et al. Advances in125I seed implantation therapy for cholangiocarcinoma[J]. Chinese Journal of General Surgery, 2016, 25(8):1203–1207. doi:10.3978/j.issn.1005–6947.2016.08.020.
[17]Walz J, Gallina A, Perrotte P, et al. Clinicians are poor raters of lifeexpectancy before radical prostatectomy or de fi nitive radiotherapy for localized prostate cancer[J]. BJU Int, 2007, 100(6):1254–1258.
[18]Handley WS. Pancreatic cancer and its treatment by implanted radium[J]. Ann Surg, 1934, 100(1):215–223.
[19]Whitmore WF Jr, Hilaris B, Grabstald H. Retropubic implantation to iodine 125 in the treatment of prostatic cancer[J]. J Urol, 1972,108(6):918–920.
[20]D'Angio G, Hilaris BS, Arthur K, et al. Iodine 125 implantation for unresectable cancer of the pancreas[J]. Postgrad Med, 1970,47(3):226–230.
[21]Wang ZM, Lu J, Zhang LY, et al. Biological effects of low-doserate irradiation of pancreatic carcinoma cells in vitro using 125I seeds[J]. World J Gastroenterol, 2015, 21(8):2336–2342. doi:10.3748/wjg.v21.i8.2336.
[22]Luo YJ, Liu ZL, Ye PC, et al. Safety and ef fi cacy of intraoperative iodine-125 seed implantation brachytherapy for rectal cancer patients:A retrospective clinical research[J]. J Gastroenterol Hepatol, 2016, 31(6):1076–1084. doi:10.1111/jgh.13261.
[23]Li YF, Liu ZQ, Zhang YS, et al. Implantation of radioactive (125)I seeds improves the prognosis of locally advanced pancreatic cancer patients:A retrospective study[J]. J Huazhong Univ Sci Technolog Med Sci, 2016, 36(2):205–210. doi:10.1007/s11596–016–1567–x.
[24]Du YQ, Li ZS, Jin ZD. Endoscope-assisted brachytherapy for pancreatic cancer:From tumor killing to pain relief and drainage[J].J Interv Gastroenterol, 2011, 1(1):23–27.
[25]苑陆杰, 于华. 125I粒子持续低剂量率照射杀伤恶性肿瘤作用机制研究进展[J]. 齐鲁医学杂志, 2016, 31(2):242–245.doi:10.13362/j.qlyx.201602040.Yuan LJ, Yu H. Research progress of mechanism for killing effect of 125I seed continuous low-dose-rate exposure on malignant tumors[J]. Medical Journal of Qilu, 2016, 31(2):242–245.doi:10.13362/j.qlyx.201602040.
[26]司佩任. ~(125)I籽源短时低剂量率照射干预胰腺癌神经浸润分子机制的研究[D]. 上海:第二军医大学, 2011:1–132. doi:10.7666/d.d151362.Si PR. Molecular Mechanisms of Short-time Low-dose Rate Irradiation of Iodine-125 Seeds on Perineural Invasion in Pancreatic Cancer[D]. Shanghai:Second Military Medical University, 2011:1–132. doi:10.7666/d.d151362.
[27]Odei BC, Boothe D, Lloyd S, et al. A comprehensive analysis of brachytherapy clinical trials over the past 15 years[J]. Brachytherapy, 2016, 15(6):679–686. doi:10.1016/j.brachy.2016.06.014.
[28]Niu H, Zhang X, Wang B, et al. The clinical utility of image-guided iodine-125 seed in patients with unresectable pancreatic cancer[J].Tumour Biol, 2016, 37(2):2219–2223. doi:10.1007/s13277–015–4045–3.
[29]Zhongmin W, Yu L, Fenju L, et al. Clinical ef fi cacy of CT-guided iodine-125 seed implantation therapy in patients with advanced pancreatic cancer[J]. Eur Radiol, 2010, 20(7):1786–1791. doi:10.1007/s00330–009–1703–0.
[30]Wang J, Jiang Y, Li J, et al. Intraoperative ultrasound-guided iodine-125 seed implantation for unresectable pancreatic carcinoma[J]. J Exp Clin Cancer Res, 2009, 28:88. doi:10.1186/1756–9966–28–88.
[31]Wang H, Wang J, Jiang Y, et al. The investigation of 125I seed implantation as a salvage modality for unresectable pancreatic carcinoma[J]. J Exp Clin Cancer Res, 2013, 32:106. doi:10.1186/1756–9966–32–106.
[32]Kim SY, Yang ES, Lee YS, et al. Sensitive to apoptosis gene protein regulates ionizing radiation-induced apoptosis[J]. Biochimie, 2011,93(2):269–276. doi:10.1016/j.biochi.2010.09.020.
[33]Pinthus JH, Bryskin I, Trachtenberg J, et al. Androgen induces adaptation to oxidative stress in prostate cancer:implications for treatment with radiation therapy[J]. Neoplasia, 2007, 9(1):68–80.
[34]Ma JX, Jin ZD, Si PR, et al. Continuous and low-energy 125 I seed irradiation changes DNA methyltransferases expression patterns and inhibits pancreatic cancer tumor growth[J]. J Exp Clin Cancer Res, 2011, 30:35. doi:10.1186/1756–9966–30–35.
[35]王济东, 王俊杰, 赵勇, 等. 放射性125I粒子持续低剂量率照射对胰腺癌细胞PANC-1凋亡及周期的影响[C]//2007第六届全国放射肿瘤学学术年会论文集. 北京:第六届全国放射肿瘤学学术年会委员会, 2007:444.Wang JD, Wang JD, Zhao Y, et al. Effect of 125I continuous lowdose-rate irradiation on apoptosis and cell cycle of pancreatic cancer PANC-1 cells[C]//Proceedings of the sixth academic annual conference of national radiation oncology 2007 Beijing:Committee of the sixth academic annual conference of national radiation oncology, 2007:444.
[36]Ho YS, Duh JS, Jeng JH, et al. Griseofulvin potentiates antitumorigenesis effects of nocodazole through induction of apoptosis and G2/M cell cycle arrest in human colorectal cancer cells[J]. Int J Cancer, 2001, 91(3):393–401.
[37]Bai Y, Qu XY, Yin JQ, et al. Methyl protodioscin induces G2/M cell cycle arrest and apoptosis in A549 human lung cancer cells[J].Pharmacogn Mag, 2014, 10(39):318–324. doi:10.4103/0973–1296.137373.
[38]Yin X, Zhang R, Feng C, et al. Diallyl disulfide induces G2/M arrest and promotes apoptosis through the p53/p21 and MEK-ERK pathways in human esophageal squamous cell carcinoma[J]. Oncol Rep, 2014, 32(4):1748–1756. doi:10.3892/or.2014.3361.
[39]Raiche J, Rodriguez-Juarez R, Pogribny I, et al. Sex- and tissue-specific expression of maintenance and de novo DNA methyltransferases upon low dose X-irradiation in mice[J]. Biochem Biophys Res Commun, 2004, 325(1):39–47.
[40]Lu Z, Dong TH, Si PR, et al. Continuous Low-dose-rate Irradiation of Iodine-125 Seeds Inhibiting Perineural Invasion in Pancreatic Cancer[J]. Chin Med J (Engl), 2016, 129(20):2460–2468. doi:10.4103/0366–6999.191777.
[41]Miknyoczki SJ, Lang D, Huang L, et al. Neurotrophins and Trk receptors in human pancreatic ductal adenocarcinoma:expression patterns and effects on in vitro invasive behavior[J]. Int J Cancer,1999, 81(3):417–427.
[42]Morganti AG, Trodella L, Valentini V, et al. Pain relief with shortterm irradiation in locally advanced carcinoma of the pancreas[J]. J Palliat Care, 2003, 19(4):258–262.
[43]Yamamoto M, Ohashi O, Saitoh Y. Japan Pancreatic Cancer Registry:current status[J]. Pancreas, 1998, 16(3):238–242.
[44]Ito Y, Okada Y, Sato M, et al. Expression of glial cell linederived neurotrophic factor family members and their receptors in pancreatic cancers[J]. Surgery, 2005, 138(4):788–794.
[45]Bapat AA, Hostetter G, Von Hoff DD, et al. Perineural invasion and associated pain in pancreatic cancer[J]. Nature Reviews Cancer,2011, 11(10):695–707. doi:10.1038/nrc3131.
[46]孟浩. 放射性粒子种植治疗胰腺癌的长期疗效:100例患者随访6年的疗效观察[D]. 上海:第二军医大学, 2012:1–42. doi:10.7666/d.y2110672.Meng H. Long-term efficacy of radioative seed implantation for pancreatic cancer:a 6-year follow-up observation in 100 cases[D].Shanghai:Second Military Medical University, 2012:1–42. doi:10.7666/d.y2110672.
[47]Kawakubo K, Isayama H, Sasahira N, et al. Clinical utility of an endoscopic ultrasound-guided rendezvous technique via various approach routes[J]. Surg Endosc, 2013, 27(9):3437–3443. doi:10.1007/s00464–013–2896–5.
[48]Yu YP, Yu Q, Guo JM, et al. Effectiveness and security of CT-guided percutaneous implantation of (125)I seeds in pancreatic carcinoma[J]. Br J Radiol, 2014, 87(1039):20130642. doi:10.1259/bjr.20130642.
[49]Liu K, Ji B, Zhang W, et al. Comparison of iodine-125 seed implantation and pancreaticoduodenectomy in the treatment of pancreatic cancer[J]. Int J Med Sci, 2014, 11(9):893–896. doi:10.7150/ijms.8948.
[50]El Majdoub F, Neudorfer C, Blau T, et al. Stereotactic interstitial brachytherapy for the treatment of oligodendroglial brain tumors[J].Strahlenther Onkol, 2015, 191(12):936–944. doi:10.1007/s00066–015–0887–2.
[51]Wang KX, Jin ZD, Du YQ, et al. EUS-guided celiac ganglion irradiation with iodine-125 seeds for pain control in pancreatic carcinoma:a prospective pilot study[J]. Gastrointest Endosc, 2012,76(5):945–952. doi:10.1016/j.gie.2012.05.032.
[52]Peretz T, Nori D, Hilaris B, et al. Treatment of primary unresectable carcinoma of the pancreas with I-125 implantation[J]. Int J Radiat Oncol Biol Phys, 1989, 17(5):931–935.
[53]Mohiuddin M, Rosato F, Barbot D, et al. Long-term results of combined modality treatment with I-125 implantation for carcinoma of the pancreas[J]. Int J Radiat Oncol Biol Phys, 1992, 23(2):305–311.
[54]宁峥, 李宏宇, 郭晓钟, 等. I-125粒子植入联合化疗和单纯化疗对胰腺癌疗效的荟萃分析[J]. 胃肠病学和肝病学杂志, 2016,25(3):320–325. doi:10.3969/j.issn.1006–5709.2016.03.024.Ning Z, Li HY, Guo XZ, et al. Curative effect of I-125 particles implantation combined with chemotherapy and chemotherapy alone in pancreatic cancer:a Meta-analysis[J]. Chinese Journal of Gastroenterology and Hepatology, 2016, 25(3):320–325.doi:10.3969/j.issn.1006–5709.2016.03.024.
[55]Cron GO, Beghein N, Crokart N, et al. Changes in the tumor microenvironment during low-dose-rate permanent seed implantation iodine-125 brachytherapy[J]. Int J Radiat Oncol Biol Phys, 2005, 63(4):1245–1251.
[56]胡疏, 吴鸣, 杨红杰, 等. 肿瘤放射性粒子植入术后病区工作人员辐射防护的再认识[J]. 同位素, 2016, 29(1):30–35. doi:10.7538/tws.2016.29.01.0030.Hu S, Wu M, Yang HJ, et al. Recognition of Radiological Protection of Ward Staff after Brachytherapy for Malignant Tumor with Radioiodine Seeds[J]. Journal of Isotopes, 2016, 29(1):30–35.doi:10.7538/tws.2016.29.01.0030.
[57]严晓军, 田丰, 徐旭东, 等. 125I粒子植入治疗辐射防护与安全[J].科技经济导刊, 2016, (19):93–94.Yan XJ, Tian F, Xu XD, et al. protection and safety of radiation from 125I seed implantation[J]. Technology and Economic Guide,2016, (19):93–94.
