中国是全球肝癌发病率最高的国家,疾病病死率在癌症中位居第3位[1]。手术仍然是现阶段患者长期生存的主要治疗手段,但是术后复发转移高,此外,约80%的患者初诊时就已处于晚期或发生远处转移而失去手术机会[2-3]。因此,探讨肝癌转移的机制,寻找行之有效的干预手段成为改善肝癌治疗现状的关键。
长链非编码RNA(long non-coding RNA,lncRNA)是长度>200个核苷酸的非编码RNA,可调控转录、转录后和翻译后等水平的基因表达模式,在多种生理学(包括细胞增殖、表观调控、基因组印记和X染色体失活等)和病理学(包括癌症、神经退行性疾病、免疫功能障碍、心血管及代谢性疾病等)过程中发挥重要作用[4]。肺腺癌转移相关转录子1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)属于lncRNA家族成员,最早是在进行非小细胞肺癌研究中发现[5]。越来越多的证据显示MALAT1在多种肿瘤中均发挥重要的调控作用。有证据显示MALAT1在多种肿瘤中均呈高表达,并且有望成为肿瘤诊断指标[6-7]。那么,在肝癌中 MALTA1的表达情况以及其在肝癌中发挥的作用值得我们深入研究。
本研究拟通过q R T-P C R检测肝癌组织中MALAT1的表达情况,并分析其与临床资料各参数之间的关系,同时通过细胞实验检测MALAT1在肝癌细胞中的作用。
1 材料与方法
1.1 实验材料
1.1.1 标本来源 85例肝癌组织及其配对癌旁组织(距肿瘤边缘>5 cm)由2009年1月—2011年12月于中国医科大学附属第四医院和中国医科大学辽阳中心医院确诊为肝细胞癌经手术治疗并经患者签署知情同意书后取得。所有患者术前均未接受化疗及放疗。患者的中位年龄62岁,临床病理参数包括:性别、年龄、肿瘤大小、部位、病理类型、淋巴结转移、TNM分期及门静脉浸润情况。新鲜标本切除后立即应用液氮快速冷冻储存。
1.1.2 主要材料及试剂 肝癌细胞株SMMC-7721购自于中国科学院上海细胞生物研究所细胞库。DMEM培养基,血清购自于逍鹏生物公司(Biological Industries,Israel),Transwell小室购自美国Corning公司;MALAT1质粒购自吉凯公司,转染试剂Lipofectamine® 2000购自Invitrogen公司;引物序列由北京鼎国生物技术有限公司合成。
1.2 实验方法
1.2.1 细胞培养 SMMC-7721细胞置于含10%胎牛血清的DMEM培养液中,在37 ℃,5%CO2培养箱中进行培养,胰酶消化传代。取对数生长期的细胞进行实验。
1.2.2 细胞转染 取处于对数生长期细胞(细胞生长密度约为50%时)用于转染,经LipofectamineTM 2000介导,按照试剂说明书进行转染。转染后孵箱内继续常规培养48 h,收集细胞用于实验检测。
1.2.3 qRT-PCR qRT-PCR检测mRNA的表达。按说明书提取各组细胞中的总RNA。cDNA的合成以18 s作为内参。反转录反应为20 μL反应体系,反应条件为 16 ℃ 30 min,42 ℃ 30 min,85 ℃5 min,4 ℃保存。以18s作为内参,qRT-PCR反应采用20 μL反应体系,反应条件为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。所有反应均设3个复孔。采用相对定量法,测定目的基因、18s的PCR产物的Ct值,代入公式2-△△Ct,实验重复3次。
1.2.4 Transwell小室迁移实验 取对数生长期的细胞,对照组、MALAT组、siMALAT组含无血清的培养基重悬,每个Transwell小室的上室加入5×104细胞,下室加入500 μL含10%胎牛血清的培养液,加入时避免气泡的产生。置于孵箱内继续培养24 h,弃上室中培养液,PBS洗3次,4%多聚甲醛固定20 min。用棉签吸去上室内液体,1%结晶紫染液室温下染色10 min,PBS洗3次,显微镜下每孔随机取5个视野拍照。每组细胞均设3个复孔,实验重复3次。
1.2.5 Transwell小室侵袭实验 将预冷的Matrigel胶与无血清培养基按1:8比例稀释,将胶铺于Transwell小室上下室之间,每孔80 μL均匀包被于Transwell小室底部膜内,置培养箱60 min使之成胶。其余步骤同迁移实验。
1.3 统计学处理
采用SPSS 17.0软件进行统计分析,分别采用秩和检验、Spearson相关分析、进行分析,数据以均数±标准差( ±s)表示,进行方差分析及t检验,P<0.05为差异有统计学意义。
±s)表示,进行方差分析及t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 MALAT1在肝癌组织中的表达
应用qRT-PCR检测肝癌以及对应癌旁组织组织标本中MALAT1的表达,结果表明MALAT1在肝癌组织以及相应癌旁组织中均有表达,在肝癌组织中的表达较癌旁组织明显增高,差异有统计学意义(P<0.01)(图1)。
2.2 MALAT1与肝癌患者临床病理因素之间的关系
为了验证MALAT1在肝癌发生发展过程中的作用,进一步分析MALAT1与肝癌临床病例参数之间的关系,结果显示,肝癌组织中MALAT1的表达与肿瘤大小、肝癌的分化程度、TNM分期、淋巴结转移有关(均P<0.05);肝癌组织中MALAT1的表达与肝癌患者的年龄、性别等临床资料之间均无关(均P>0.05)(表1)。
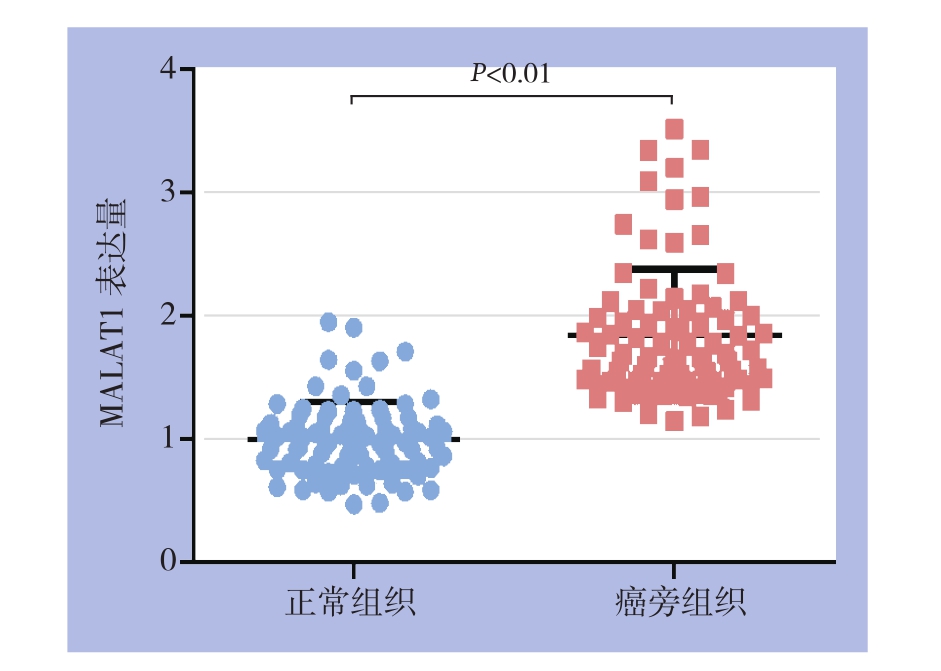
图1 MALAT1在肝癌组织与癌旁组织中表达的比较
Figure 1 Comparison of MALAT1 expressions between HCC and cancer-adjacent tissue
表1 MALAT1表达与肝癌患者临床病理因素的关系[n(%)]
Table 1 Relations of MALAT1 expression with clinicopathologic factors of HCC patients [n (%)]

因素 n 低表达 高表达 P年龄(岁)≥45 38 17(44.7) 21(55.3) >0.05< 45 47 29(61.7) 18(38.3)性别男53 23(44.4) 30(56.6) >0.05女32 23(71.9) 9(28.1)TNM分期I+II 52 37(71.2) 15(28.8) <0.05 III+IV 33 9(27.3) 24(72.7)肿瘤大小(cm)≥5 29 15(51.7) 14(48.3) <0.05< 5 56 31(55.4) 25(44.6)肿瘤分化程度高分化 52 37(71.2) 15(28.8) <0.01低分化 33 9(27.3) 24(72.7)淋巴结转移有28 7(25.0) 21(75.0) <0.05无57 39(68.4) 18(31.6)
2.3 MALAT1对肝癌细胞增殖侵袭的影响
为探讨MALAT1在肝癌细胞中发挥何种作用,在肝癌细胞中分别过表达与敲低MALAT1,并通过CCK-8与Transwell实验观察MALAT1对肝癌细胞增殖侵袭的影响。结果提示,过表达MALAT1后肝癌细胞增殖与侵袭转移细胞数较对照组明显升高;敲低MALAT1的表达后肝癌细胞的增殖与侵袭转移细胞数较对照组明显降低,差异均有统计学意义(均P<0.05)(图2-3)。
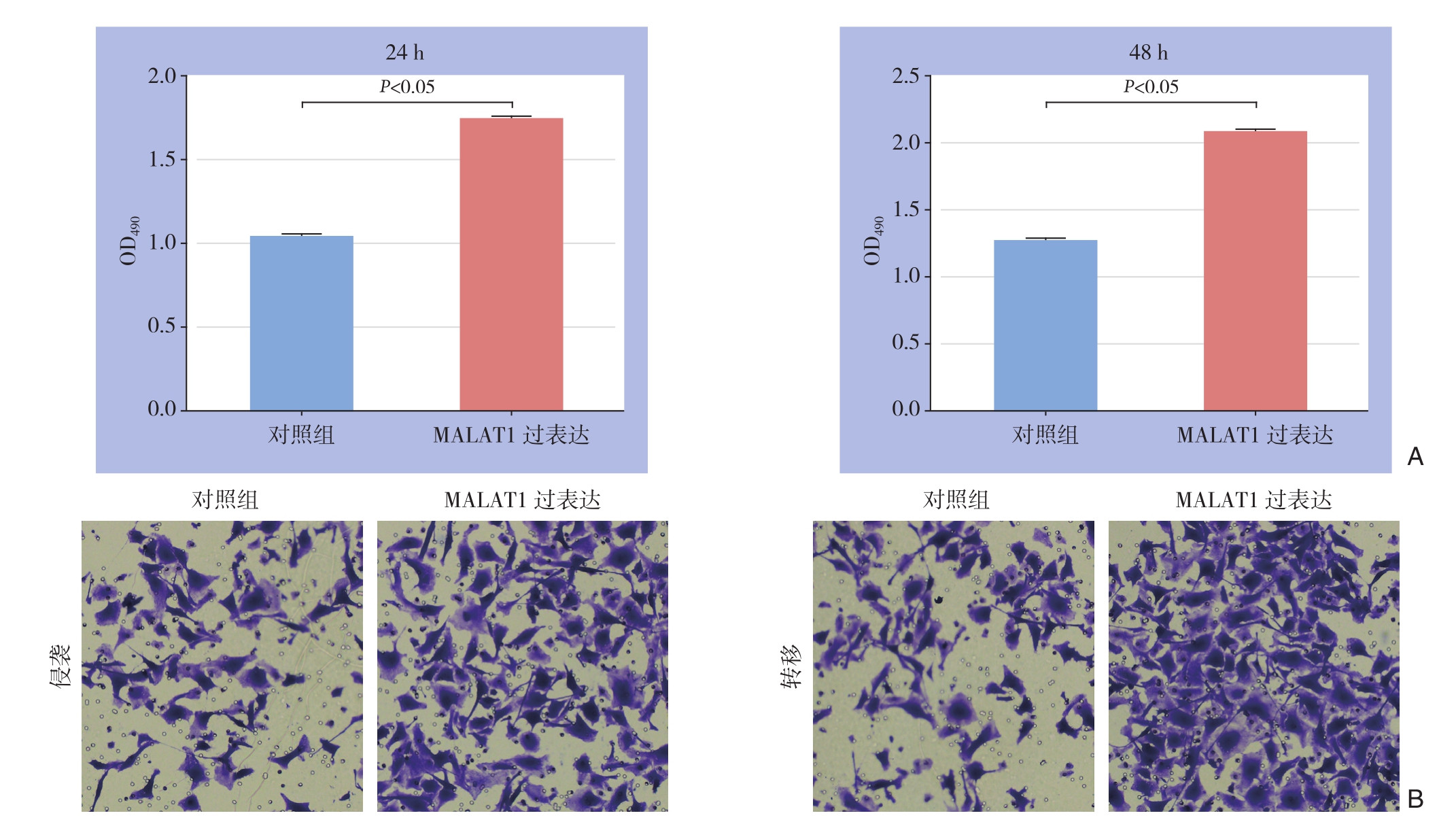
图2 MALAT1过表达对SMMC-7721细胞增殖与侵袭转移的影响
A:MALAT1过表达后24、48 h后细胞增殖活力较对照组明显增加;B:MALAT1过表达后细胞侵袭转移能力较对照组明显增强
Figure 2 Influences of MALAT1 overexpression on proliferation and invasion/metastasis of SMMC-7721 cells
A: Increased proliferation in SMMC-7721 cells 24 and 48 h after MALAT1 overexpression compared with control group; B: Enhanced invasion/metastasis ability in SMMC-7721 cells after MALAT1 overexpression compared with control group

图3 敲低MALAT1表达对SMMC-7721细胞增殖与侵袭转移的影响
A:敲低MALAT1表达后24、48 h后细胞增殖活力较对照组明显降低;B:敲低MALAT1表达后细胞侵袭转移能力较对照组明显减弱
Figure 3 Influences of MALAT1 knock-down on proliferation and invasion/metastasis of SMMC-7721 cells
A: Decreased proliferation in SMMC-7721 cells 24 and 48 h after MALAT1 knock-down compared with control group; B: Reduced invasion/metastasis ability in SMMC-7721 cells after MALAT1 knock-down compared with control group
3 讨 论
肝癌是临床上最常见的肿瘤之一,全世界范围内每年新发肝癌患者常年居高不下,占全世界癌症死亡原因的第3位[1]。在我国,肝癌占癌症死亡原因的第2位,肝癌进展快以及转移复发一直是制约肝癌治疗与预后的主要问题,也是肝癌在世界范围内发生率与病死率常年居高不下的主要原因[8]。在肝癌发生发展过程中,多种基因发挥促癌作用,使得肝癌快速进展。尤其是近年发现的lncRNA,越来越多的证据显示lncRNA在肝癌进展过程中发挥着不可或缺的作用[9-11]。
lncRNA是长度>200个核苷酸的非编码RNA,可以在转录水平以及转录后,翻译水平调控基因表达,进而影响人体多种病理生理过程,尤其是lncRNA 在肿瘤中的作用,日益受到重视[12-15]。MALAT1属于lncRNA家族成员,最早是在非小细胞肺癌的研究中发现的,研究其结构时发现,MALAT1没有足够长度的开放阅读框,这种结构特点决定了MALAT1不具有蛋白编码功能,是真正意义的lncRNA[6,16-18]。近年的研究[19-23]证实MALAT1在多种肿瘤中均发挥重要的调控作用。Wang等[24]在进行胆管癌的研究时发现,MALAT1在胆管癌组织中表达较正常组织升高,并且MALAT1能够促进胆管癌细胞的增殖与侵袭;Liu等[25]研究证实MALAT1能够通过与miRNA之间相互作用,进一步通过HMGB-1实现调控骨肉瘤的进展;Lee等[26]的研究还发现MALAT1能够促进胃腺癌侵袭。这些结果提示 MALAT1 在肿瘤发生发展过程中发挥促癌作用,那么在肝癌中MALAT1发挥怎样的功能?
本研究选取85例肝癌组织标本作为研究对象,距离肿瘤组织>5 cm的癌旁组织作为对照。通过q R T-P C R方法检测肝癌组织以及相应癌旁组织中MALAT1的表达,结果发现 MALAT1在肝癌组织中的表达较癌旁组织中的表达升高(P<0.05)。这一结果提示MALAT1表达与肝癌的发生关系密切,可能参与了肝癌的癌变过程。进一步结合临床病例参数分析发现,MALAT1在低分化,TNM分期,淋巴结转移以及门静脉浸润肝癌患者中表达升高,提示MALAT1的表达与肝癌进展密切相关。进一步通过在细胞中验证MALAT1在肝癌细胞中的作用,结果发现肝癌细胞过表达MALAT1后肝癌细胞增殖活力较对照组显著增加,同时Transwell实验提示过表达MALAT1后肝癌细胞侵袭转移能力较对照组亦显著增强。而在肝癌细胞中敲低MALAT1的表达后,肝癌细胞的增殖活力显著受到抑制,与对照组相比差异显著,同样,敲低MALAT1后肝癌细胞侵袭转移能力较对照组降低(均P<0.05)。这些结果提示MALAT1在肝癌中发挥着促癌作用。
综上,本研究结果证实MALAT1在肝癌中高表达,并且与肝癌的分期密切相关。同时,证实MALAT1能够促进肝癌的侵袭转移、发挥癌基因的作用。但是MALAT1的确切调控机制还需要进一步的细胞以及动物实验来验证。
参考文献
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87-108. doi: 10.3322/caac.21262.
[2] Pang RW, Joh JW, Johnson PJ, et al. Biology of hepatocellular carcinoma[J]. Ann Surg Oncol, 2008, 15(4):962-971. doi: 10.1245/s10434-007-9730-z.
[3] Yang LY, Fang F, Ou DP, et al. Solitary large hepatocellular carcinoma: a speci fi c subtype of hepatocellular carcinoma with good outcome after hepatic resection[J]. Ann Surg, 2009, 249(1):118-123.doi: 10.1097/SLA.0b013e3181904988.
[4] Huarte M. The emerging role of lncRNAs in cancer[J]. Nat Med,2015, 21(11):1253-1261. doi: 10.1038/nm.3981.
[5] 姚凯, 张光军, 黄忠明, 等. 长链非编码RNA MALAT1在肝癌中表达及功能研究[J]. 中国普通外科杂志, 2016, 25(1):90-96.doi:10.3978/j.issn.1005-6947.2016.01.014.Yao K, Zhang GJ, Huang ZM, et al. Long non-coding RNA MALAT1 expression in hepatocellular carcinoma and its action[J].Chinese Journal of General Surgery, 2016, 25(1):90-96. doi:10.3978/j.issn.1005-6947.2016.01.014.
[6] Gutschner T, Hämmerle M, Diederichs S. MALAT1 -- a paradigm for long noncoding RNA function in cancer[J]. J Mol Med (Berl),2013, 91(7):791-801. doi: 10.1007/s00109-013-1028-y.
[7] Wu Y, Lu W, Xu J, et al. Prognostic value of long non-coding RNA MALAT1 in cancer patients[J]. Tumour Biol, 2016, 37(1):897-903.doi: 10.1007/s13277-015-3870-8.
[8] Tian X, Xu G. Clinical value of lncRNA MALAT1 as a prognostic marker in human cancer: systematic review and meta-analysis[J]. BMJ Open, 2015, 5(9):e008653. doi: 10.1136/bmjopen-2015-008653.
[9] Colecchia A, Schiumerini R, Cucchetti A, et al. Prognostic factors for hepatocellular carcinoma recurrence[J]. World J Gastroenterol,2014, 20(20):5935-5950. doi: 10.3748/wjg.v20.i20.5935.
[10] Yu W, Qiao Y, Tang X, et al. Tumor suppressor long non-coding RNA, MT1DP is negatively regulated by YAP and Runx2 to inhibit FoxA1 in liver cancer cells[J]. Cell Signal, 2014, 26(12):2961-2968.doi: 10.1016/j.cellsig.2014.09.011.
[11] 何运, 陈攀, 罗嘉, 等. 长链非编码RNA在肝癌中的研究进展[J].中国普通外科杂志, 2016, 25(7):1069-1075. doi:10.3978/j.issn.1005-6947.2016.07.022.He Y, Chen P, Luo J, et al. Long noncoding RNAs in hepatocellular carcinoma: recent research progress[J]. Chinese Journal of General Surgery, 2016, 25(7):1069-1075. doi:10.3978/j.issn.1005-6947.2016.07.022.
[12] Yang L, Zhang X, Li H, et al. The long noncoding RNA HOTAIR activates autophagy by upregulating ATG3 and ATG7 in hepatocellular carcinoma[J]. Mol Biosyst, 2016, 12(8):2605-2612.doi: 10.1039/c6mb00114a.
[13] Yang G, Lu X, Yuan L. LncRNA: a link between RNA and cancer[J]. Biochim Biophys Acta, 2014, 1839(11):1097-1109. doi:10.1016/j.bbagrm.2014.08.012.
[14] 汤首俊, 朱世凯. 长链非编码RNA在胰腺癌中的研究进展[J]. 中国普通外科杂志, 2016, 25(3):443-447. doi:10.3978/j.issn. 1005-6947.2016.03.024.Tang SJ, Zhu SK. Long non-coding RNAs in pancreatic cancer:recent advances[J]. Chinese Journal of General Surgery, 2016,25(3):443-447. doi:10.3978/j.issn.1005-6947.2016.03.024.
[15] 余斌, 丁佑铭, 廖晓锋. 长链非编码RNA肝癌高表达转录本与原发性肝癌关系的研究进展[J].中国普通外科杂志, 2017,26(7):913-920. doi:10.3978/j.issn.1005-6947.2017.07.016.Yu B, Ding YM, Liao XF. Research progress of relationship between long non-coding RNA highly upregulated in liver cancer and hepatocellular carcinoma[J]. Chinese Journal of General Surgery,2017, 26(7):913-920. doi:10.3978/j.issn.1005-6947.2017.07.016.
[16] 赵月鸣, 邹玉凤, 董莹, 等. 母系印迹表达基因3在结直肠癌组织中表达及其与血管生成的关系[J]. 中国普通外科杂志, 2016,25(10):1450-1454.DOI:10.3978/j.issn.1005-6947.2016.10.014.Zhao YM, Zou YF, Dong Y, et al. Expression of maternally expressed gene 3 in colorectal cancer tissue and its relation with angiogenesis[J]. Chinese Journal of General Surgery, 2016,25(10):1450-1454.DOI:10.3978/j.issn.1005-6947.2016.10.014.
[17] 马骧, 欧阳尧明, 景在平, 等. IncRNA在血管疾病中的作用机制研究进展[J]. 中国普通外科杂志, 2016, 25(12):1792-1795.doi:10.3978/j.issn.1005-6947.2016.12.020.Ma X, Ouyang YM, Jing ZP, et al.Research progress in action mechanisms of lncRNAs in vascular diseases[J]. Chinese Journal of General Surgery, 2016, 25(12):1792-1795. doi:10.3978/j.issn.1005-6947.2016.12.020.
[18] Zhang ZC, Tang C, Dong Y, et al. Targeting LncRNA-MALAT1 suppresses the progression of osteosarcoma by altering the expression and localization of β-catenin[J]. J Cancer, 2018, 9(1):71-80. doi: 10.7150/jca.22113.
[19] Ji Q, Zhang L, Liu X, et al. Long non-coding RNA MALAT1 promotes tumour growth and metastasis in colorectal cancer through binding to SFPQ and releasing oncogene PTBP2 from SFPQ/PTBP2 complex[J]. Br J Cancer, 2014 , 111(4):736-748. doi:10.1038/bjc.2014.383.
[20] Sebastian A, Hum NR, Hudson BD, et al. Cancer-Osteoblast Interaction Reduces Sost Expression in Osteoblasts and Up-Regulates lncRNA MALAT1 in Prostate Cancer[J]. Microarrays(Basel), 2015, 4(4):503-519. doi: 10.3390/microarrays4040503.
[21] Taheri M, Omrani MD, Ghafouri-Fard S. Long non-coding RNA expression in bladder cancer[J]. Biophys Rev, 2017, doi: 10.1007/s12551-017-0379-y. [Epub ahead of print]
[22] YiRen H, YingCong Y, Sunwu Y, et al. Long noncoding RNA MALAT1 regulates autophagy associated chemoresistance via miR-23b-3p sequestration in gastric cancer[J]. Mol Cancer, 2017,16(1):174. doi: 10.1186/s12943-017-0743-3.
[23] Kwok ZH, Tay Y. Long noncoding RNAs: lincs between human health and disease[J]. Biochem Soc Trans, 2017, 45(3):805-812.doi: 10.1042/BST20160376.
[24] Wang C, Mao ZP, Wang L, et al. Long non-coding RNA MALAT1 promotes cholangiocarcinoma cell proliferation and invasion by activating PI3K/Akt pathway[J]. Neoplasma, 64(5):725-731. doi:10.4149/neo_2017_510.
[25] Liu K, Huang J, Ni J, et al. MALAT1 promotes osteosarcoma development by regulation of HMGB1 via miR-142-3p and miR-129-5p[J]. Cell Cycle, 2017, 16(6):578-587. doi: 10.1080/15384101.2017.1288324.
[26] Lee NK, Lee JH, Ivan C, et al. MALAT1 promoted invasiveness of gastric adenocarcinoma[J]. BMC Cancer, 2017, 17(1):46. doi:10.1186/s12885-016-2988-4.