结直肠癌在世界范围内其发病率和病死率均位于恶性肿瘤第三位[1]。全直肠系膜切除(total mesorectal excision,TME)手术是治疗直肠癌最直接有效的手段。直肠癌早期多无明显症状,确诊时多为进展期直肠癌(locally advanced rectal cancer,LARC)。随着治疗理念的日益更新以及精准医疗时代的到来,直肠癌的治疗策略发生了天翻地覆的变化。术前新辅助放化疗(neoadjuvant chemoradiotherapy,NCRT)已成为治疗LARC的标准方案,其优势在于:缩小瘤体,降低分期,提高手术R0切除率及保肛率,降低局部复发率,使部分患者达到临床甚至病理完全缓解(pathological complete response,pCR)[2]。对于LARC, NCRT联合TME手术是目前推荐的金标准治疗模式[3]。然令人遗憾的是,根治性手术难免存在手术创伤大,各种并发症多,远期的排尿及性功能障碍,尤其是伴随永久性造瘘的心理负担[4]。文献[5-6]报道NCRT后约20~30%患者达到临床完全缓解(clinical complete response,cCR),术后约有5%~44%患者达到pCR,且pCR患者在肿瘤局部控制及远期生存明显获益。2002年,Nakagawa等[7]首次提出对于NCRT后达到cCR的患者采取非手术治疗的理念。Habr-Gama等[8]于2004年首次报道了“等待观察”(Wait-and-See,W&S)策略的临床研究;不久,Appelt等[9]提出可通过高剂量的放化疗来提高cCR,并又命名为“Watchful Waiting”策略。随后,Habr-Gama等[10]又报道了采用W&S策略后复发的患者及时手术同样可以有效控制肿瘤的局部复发(local recurrence,LR)。
对于这些cCR的患者是否可以避免创伤性手术而采用W&S策略,成为了近年来结直肠外科医师关注的热点。本研究根据NCRT后达到cCR分为W&S策略组(W&S)和根治性手术组(radical surgery,RS),比较两组在LR,远处转移(distant metastasis,DM或DM+LR),肿瘤相关死亡(cancer-related death,CRD),2、3、5年无疾病进展生存期(disease-free survival,DFS),2、3、5年总体生存期(overall survival,OS)的差异进而验证W&S策略的安全性及可行性。
1 资料与方法
1.1 检索策略
检索Pubmed、Ovid、EMbase、Cochrane Library,时间限截止到2018年2月,检索语种为英文,英文检索词包括:rectal cancer、rectal carcinoma、rectal neoplasms、watch and wait、wait and see、watchful waiting、nonoperative、complete response、clinical complete response、neoadjuvant chemoradiotherapy、preoperative chemoradiotherapy ”。
1.2 文献纳入及排除标准
纳入标准:⑴ 研究对象必须是接受长程NCRT 的直肠癌患者;⑵ 均获得cCR;⑶ 国外公开发表关于W&S策略与根治性TME手术治疗直肠癌的英文文献;⑷ 文献至少提供包含任意4项评价指标的原始数据。排除标准:⑴ 研究对象为未完全获得cCR的直肠癌患者;⑵ 未进行NCRT;⑶ 无法提取足够数据的文献;⑷ 同一作者或同一研究单位重复发表的文献。
1.3 数据提取
由2位研究者独立提取,如有分歧通过讨论解决,必要时和第3位高年资研究者商讨解决。提取信息:⑴ 一般资料为研究者、国家、发表年代、TNM分期、肿瘤位置、样本量、性别比例、放化疗方案、研究类型等。⑵ 观察指标有:LR;DM或DM+LR;CRD;2、3、5年DFS ;2、3、5年OS。
1.4 文献质量评价
本研究纳入的文献均为非随机对照试验(non-randomized controlled trial,NRCT),故采用改良纽卡斯尔渥太华量表(Newcastle-Ottawa Scale,NOS)[11]进行评价,主要包括研究对象的选择、组间可比性和结果或暴露评估3个指标;NOS以☆代表分值,满分为9☆,1~3☆为低质量,4~6☆为中质量,7~9☆为高质量。
1.5 统计学处理
应用Stata/SE12.0统计软件进行Meta分析。采用风险比(risk ratio,RR)及95%可信区间(95%confidence interval,95% CI)表示。各研究间异质性采用χ2检验和I2值进行评价,若纳入研究间无明显异质性(I2≤50%),采用固定效应模型分析;若存在明显异质性(I2>50%),则采用随机效应模型分析。敏感性分析为依次排除单个研究后重新进行Meta分析,估计综合效应大小。同时使用Egger和Begger检验绘制并分析漏斗图的对称性,从而评估有无发表偏移[12]。P<0.05为差异有统计学意义。
2 结 果
2.1 检索结果
根据检索词及上述筛选标准,最终纳入11篇NRCT[8, 13-22]。其中,3篇为回顾性队列研究(retrospective cohort study,RCS),8篇为前瞻性队列研究(prospective cohort study,PCS),文献筛选流程见图1。共纳入847例患者,W&S组378例,RS组469例,纳入文献基本信息及质量评价见表1,纳入文献中两组之间的复发及生存资料见表2。
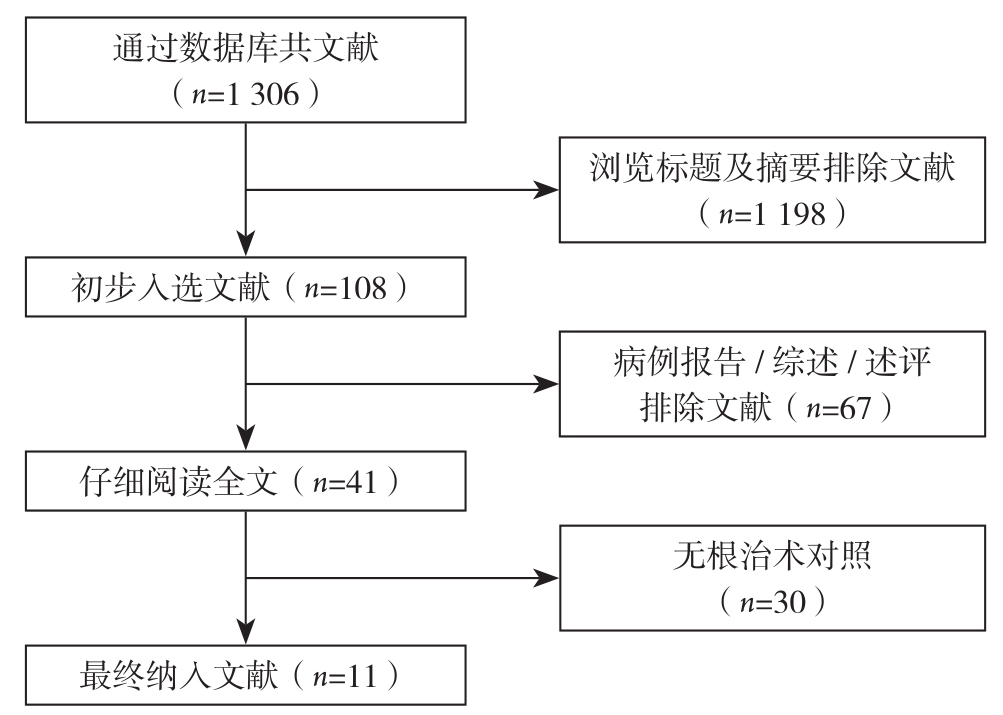
图1 文献筛选流程
Figure 1 Literature screening process
表1 纳入文献的一般资料及质量评分
Table 1 The general data and quality scores of the included studies
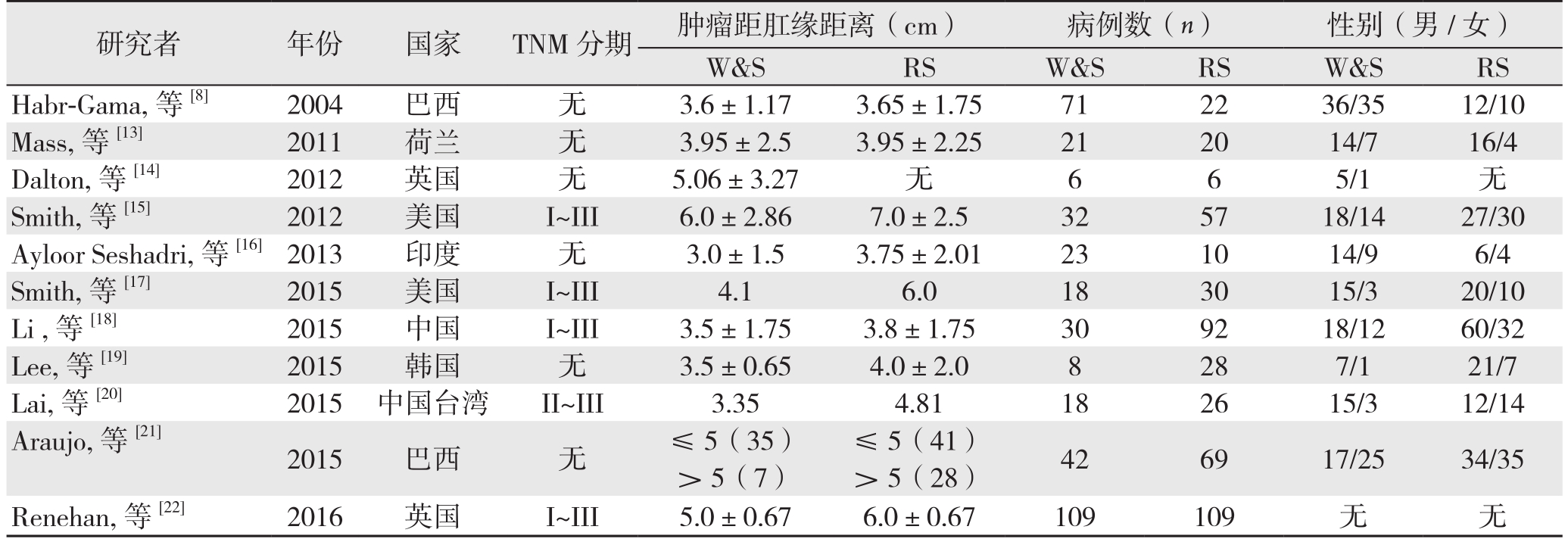
研究者 年份 国家 TNM分期 肿瘤距肛缘距离(cm) 病例数(n) 性别(男/女)W&S RS W&S RS W&S RS Habr-Gama, 等[8] 2004 巴西 无 3.6±1.17 3.65±1.75 71 22 36/35 12/10 Mass, 等[13] 2011 荷兰 无 3.95±2.5 3.95±2.25 21 20 14/7 16/4 Dalton, 等[14] 2012 英国 无 5.06±3.27 无 6 6 5/1 无Smith, 等[15] 2012 美国 I~III 6.0±2.86 7.0±2.5 32 57 18/14 27/30 Ayloor Seshadri, 等 [16]2013 印度 无 3.0±1.5 3.75±2.01 23 10 14/9 6/4 Smith, 等[17] 2015 美国 I~III 4.1 6.0 18 30 15/3 20/10 Li , 等[18] 2015 中国 I~III 3.5±1.75 3.8±1.75 30 92 18/12 60/32 Lee, 等[19] 2015 韩国 无 3.5±0.65 4.0±2.0 8 28 7/1 21/7 Lai, 等[20] 2015 中国台湾 II~III 3.35 4.81 18 26 15/3 12/14 Araujo, 等[21]2015 巴西 无 ≤5(35) ≤5(41) 42 69 17/25 34/35> 5(7) > 5(28)Renehan, 等[22] 2016 英国 I~III 5.0±0.67 6.0±0.67 109 109 无 无
表1 纳入文献的一般资料及质量评分(续)
Table 1 The general data and quality scores of the included studies (continued)
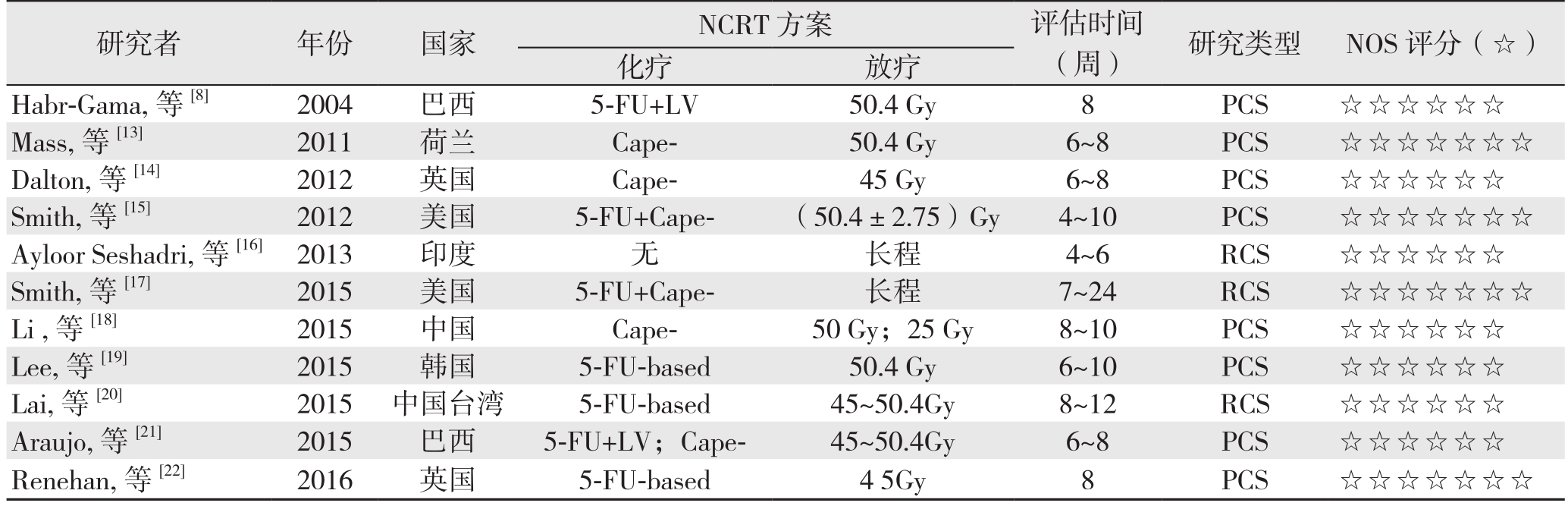
研究者 年份 国家 NCRT方案 评估时间(周)研究类型NOS评分(☆)化疗放疗Habr-Gama, 等[8] 2004 巴西 5-FU+LV 50.4 Gy 8 PCS ☆☆☆☆☆☆Mass, 等[13] 2011 荷兰 Cape- 50.4 Gy 6~8 PCS ☆☆☆☆☆☆☆Dalton, 等[14] 2012 英国 Cape- 45 Gy 6~8 PCS ☆☆☆☆☆☆Smith, 等[15] 2012 美国 5-FU+Cape- (50.4±2.75)Gy 4~10 PCS ☆☆☆☆☆☆☆Ayloor Seshadri, 等 [16] 2013 印度 无 长程 4~6 RCS ☆☆☆☆☆☆Smith, 等[17] 2015 美国 5-FU+Cape- 长程 7~24 RCS ☆☆☆☆☆☆☆Li , 等[18] 2015 中国 Cape- 50 Gy;25 Gy 8~10 PCS ☆☆☆☆☆☆Lee, 等[19] 2015 韩国 5-FU-based 50.4 Gy 6~10 PCS ☆☆☆☆☆☆Lai, 等[20] 2015 中国台湾 5-FU-based 45~50.4Gy 8~12 RCS ☆☆☆☆☆☆Araujo, 等[21] 2015 巴西 5-FU+LV;Cape- 45~50.4Gy 6~8 PCS ☆☆☆☆☆☆Renehan, 等[22] 2016 英国 5-FU-based 4 5Gy 8 PCS ☆☆☆☆☆☆☆
表2 纳入文献中患者的复发与生存资料
Table 2 Data of recurrence and survival of the patients in the included studies
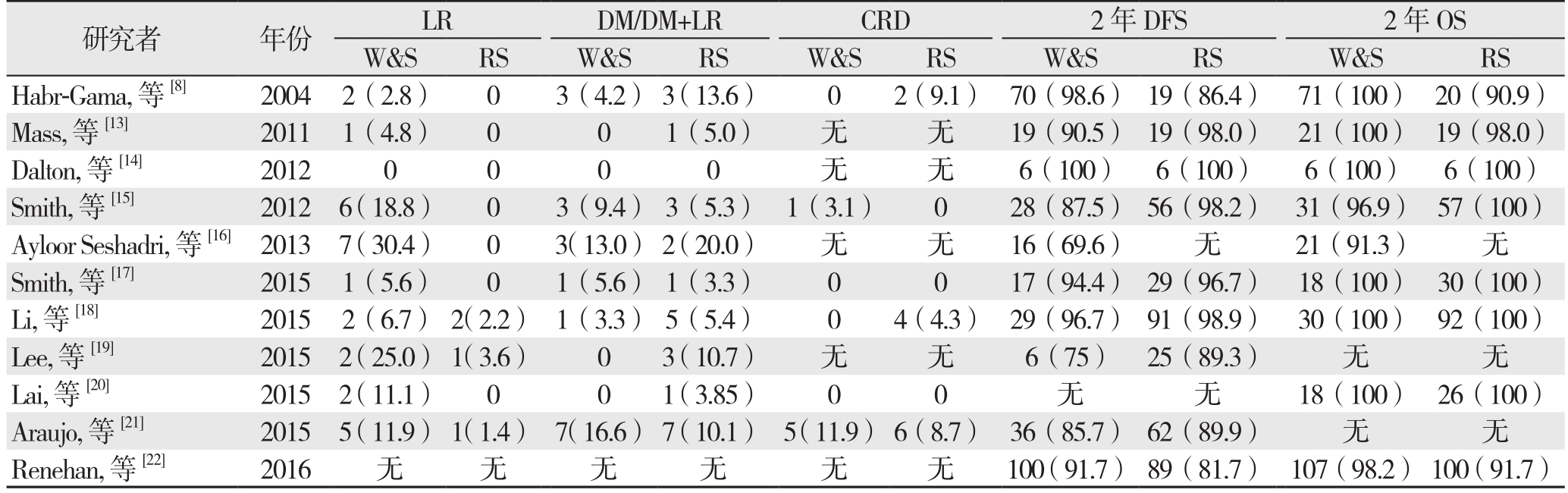
研究者 年份 LR DM/DM+LR CRD 2年DFS 2年OS W&S RS W&S RS W&S RS W&S RS W&S RS Habr-Gama, 等[8] 2004 2(2.8) 0 3(4.2) 3(13.6) 0 2(9.1) 70(98.6) 19(86.4) 71(100) 20(90.9)Mass, 等[13] 2011 1(4.8) 0 0 1(5.0) 无 无 19(90.5) 19(98.0) 21(100) 19(98.0)Dalton, 等[14] 2012 0 0 0 0 无 无 6(100) 6(100) 6(100) 6(100)Smith, 等[15] 2012 6(18.8) 0 3(9.4) 3(5.3) 1(3.1) 0 28(87.5) 56(98.2) 31(96.9) 57(100)Ayloor Seshadri, 等[16]2013 7(30.4) 0 3(13.0) 2(20.0) 无 无 16(69.6) 无 21(91.3) 无Smith, 等[17] 2015 1(5.6) 0 1(5.6) 1(3.3) 0 0 17(94.4) 29(96.7) 18(100) 30(100)Li, 等[18] 2015 2(6.7) 2(2.2) 1(3.3) 5(5.4) 0 4(4.3) 29(96.7) 91(98.9) 30(100) 92(100)Lee, 等[19] 2015 2(25.0) 1(3.6) 0 3(10.7) 无 无 6(75) 25(89.3) 无 无Lai, 等[20] 2015 2(11.1) 0 0 1(3.85) 0 0 无 无 18(100) 26(100)Araujo, 等 [21] 2015 5(11.9) 1(1.4) 7(16.6) 7(10.1) 5(11.9) 6(8.7) 36(85.7) 62(89.9) 无 无Renehan, 等[22] 2016 无 无 无 无 无 无 100(91.7) 89(81.7) 107(98.2) 100(91.7)
表2 纳入文献中患者的复发与生存资料(续)
Table 2 Data of recurrence and survival of the patients in the included studies (continued)
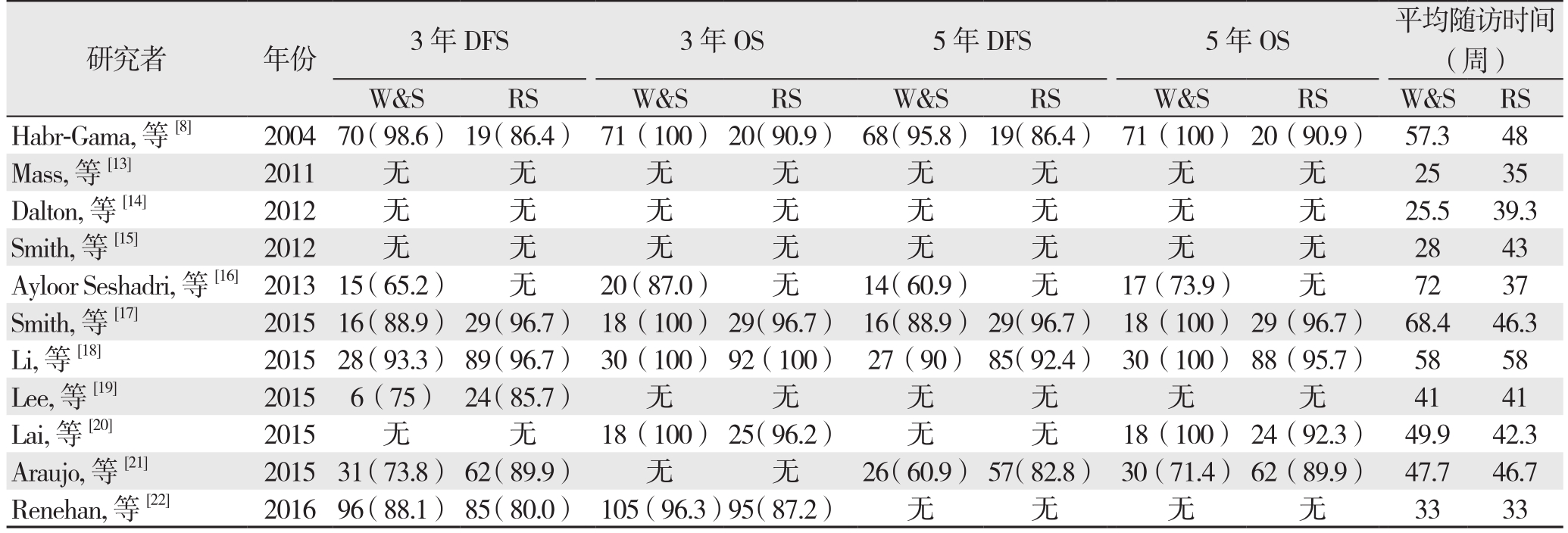
研究者 年份 3年DFS 3年OS 5年DFS 5年OS 平均随访时间(周)W&S RS W&S RS W&S RS W&S RS W&S RS Habr-Gama, 等 [8] 200470(98.6) 19(86.4) 71(100) 20(90.9) 68(95.8) 19(86.4) 71(100) 20(90.9) 57.3 48 Mass, 等[13] 2011 无 无 无 无 无 无 无 无 2535 Dalton, 等[14] 2012 无 无 无 无 无 无 无 无 25.539.3 Smith, 等[15] 2012 无 无 无 无 无 无 无 无 2843 Ayloor Seshadri, 等[16]2013 15(65.2) 无 20(87.0) 无 14(60.9) 无 17(73.9) 无 72 37 Smith, 等 [17] 2015 16(88.9) 29(96.7) 18(100) 29(96.7) 16(88.9) 29(96.7) 18(100) 29(96.7) 68.4 46.3 Li, 等[18] 2015 28(93.3) 89(96.7) 30(100) 92(100) 27(90) 85(92.4) 30(100) 88(95.7) 58 58 Lee, 等[19] 2015 6(75) 24(85.7) 无 无 无 无 无 无 41 41 Lai, 等[20] 2015 无 无 18(100) 25(96.2) 无 无 18(100) 24(92.3) 49.9 42.3 Araujo, 等[21] 2015 31(73.8) 62(89.9) 无 无 26(60.9) 57(82.8) 30(71.4) 62(89.9) 47.7 46.7 Renehan, 等[22] 2016 96(88.1) 85(80.0) 105(96.3)95(87.2) 无 无 无 无 33 33
2.2 Meta分析结果
2.2.1 LR10篇文献[8,13-21]报道了LR,各研究间无明显异质性(P=0.964,I2=0.0%),故采用固定效应模型分析,结果显示,W&S组LR明显高于RS组(RR=6.20,95% CI=2.68~14.30,P=0.000)(图2)。
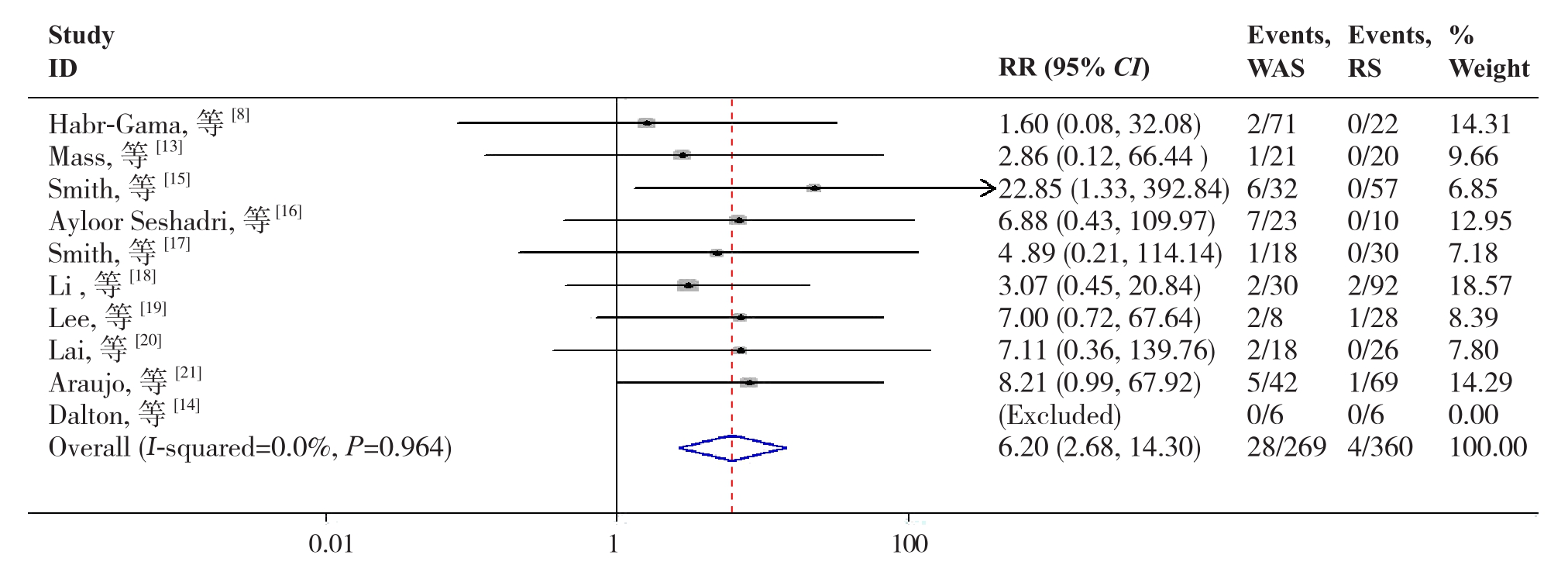
图2 W&S组与RS组LR比较
Figure 2 Comparison of the LR between W&S group and RS group
2.2.2 DM或DM+LR10篇文献[8,13-21]报道了DM或DM+LR,各研究间无明显异质性(P=0.719,I2=0.0%),故采用固定效应模型分析,结果显示两组在DM或DM+LR的差异无统计学意义(RR=0.91,95% CI=0.52~1.58,P=0.730)(图3)。
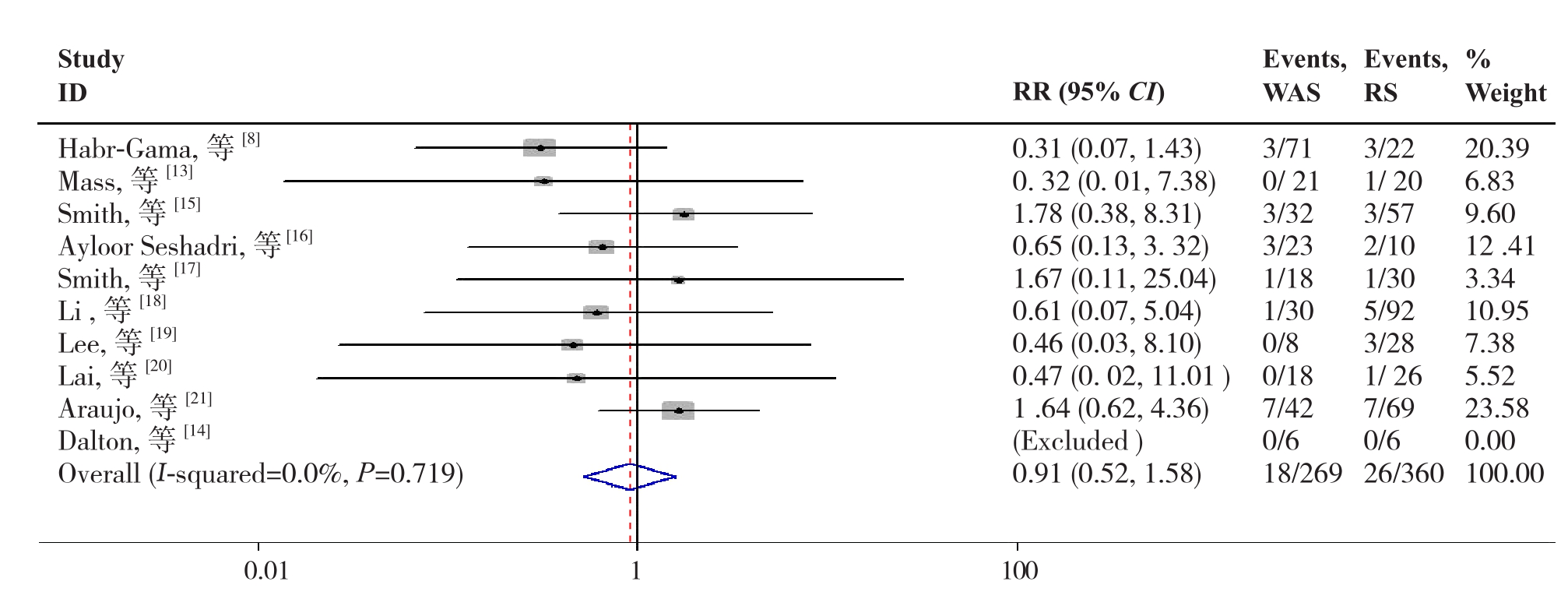
图3 W&S组与RS组DM或DM+LR比较
Figure 3 Comparison of the DM or DM+LR between W&S group and RS group
2.2.3 CRD6篇文献[8,15,17-18,20-21]报道了CRD,各研究间无明显异质性(P=0.154,I2=42.9%),故采用固定效应模型分析,结果显示两组在CRD的差异无统计学意义(RR=0.83,95% CI=0.37~1.87,P=0.658)(图4)。
2.2.4 2年DFS9篇文献[8,13-15,17-19,21-22]报道了2年DFS,各研究间无明显异质性 (P=0.087,I2=43.7%),故采用固定效应模型分析,结果显示两组在2年DFS的差异无统计学意义(RR=1.01,95%CI= 0.96~1.07, P=0.588)。(图5)。
2.2.5 2年OS8篇文献 [8, 13-15, 17-18, 20, 22]报道了2年OS,各研究间无明显异质性(P=0.120,I2=48.5%),故采用固定效应模型分析,结果显示W&S组2年OS高于RS组(RR=1.05,95% CI=1.01~1.10,P=0.029)(图6)。
2.2.6 3年DFS6篇文献[8,17-19,21-22]报道了3年DFS,各研究间存在明显异质性(P=0.028,I2=60.2%),故采用随机效应模型分析,结果显示两组在3年DFS的差异无统计学意义(RR=0.99,95% CI=0.89~1.10,P=0.083)(图7)。
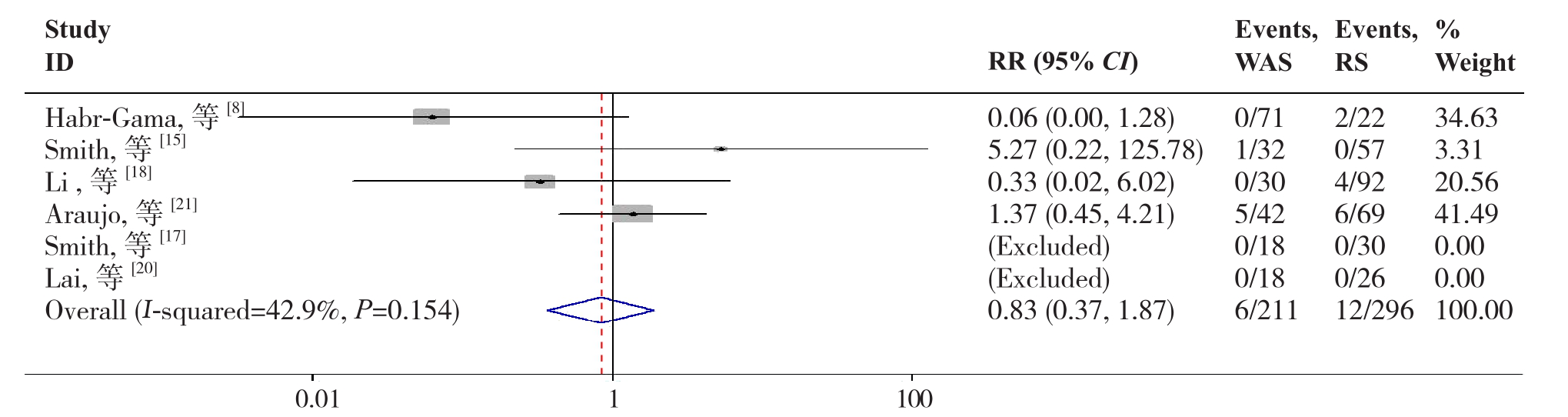
图4 W&S组与RS组CRD比较
Figure 4 Comparison of the CRD between W&S group and RS group
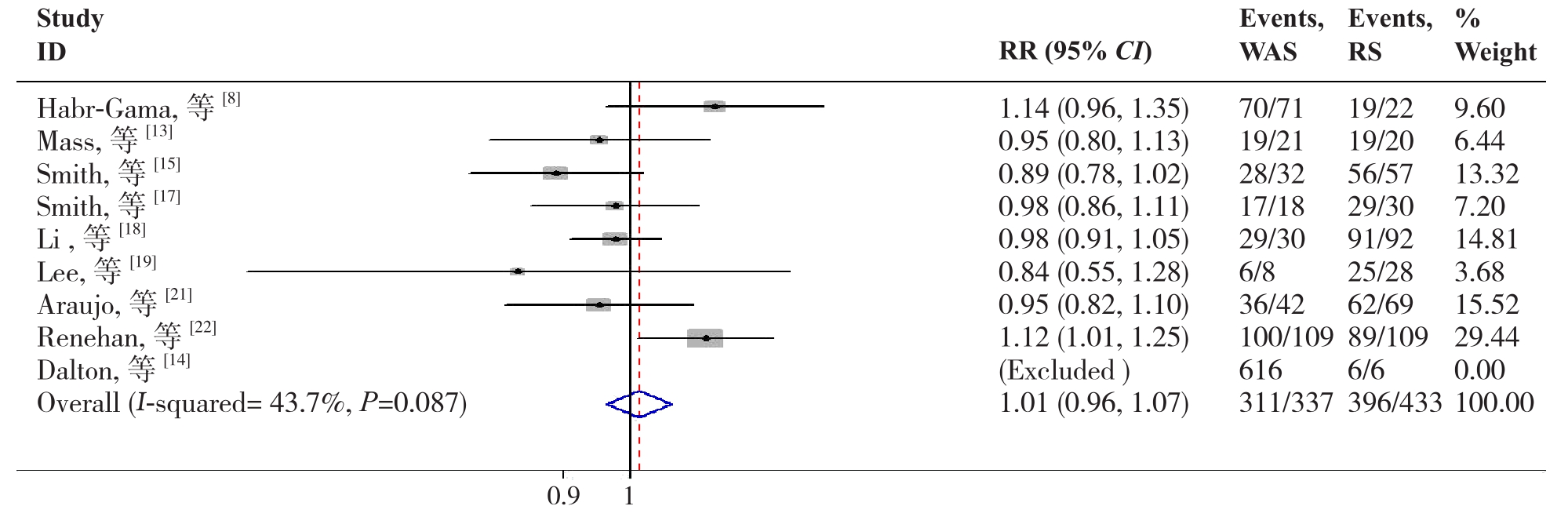
图5 W&S组与RS组2年DFS比较
Figure 5 Comparison of the 2-year DFS between W&S group and RS group
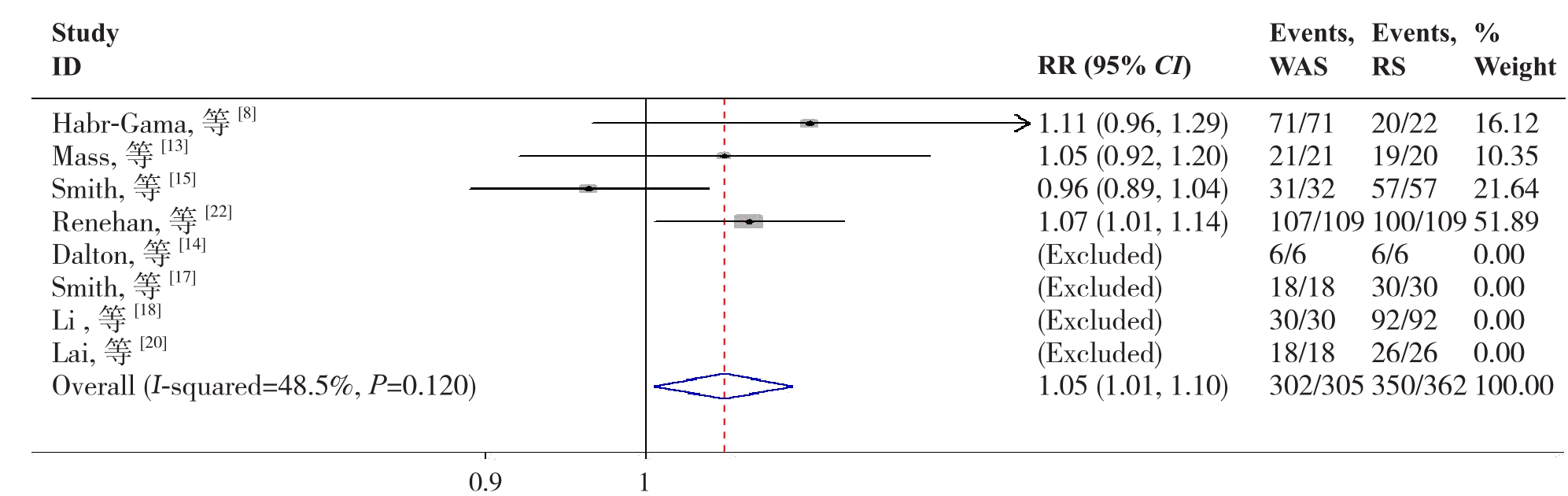
图6 W&S组与RS组2年OS比较
Figure 6 Comparison of the 2-year OS between W&S group and RS group

图7 W&S组与RS组3年DFS比较
Figure 7 Comparison of the 3-year DFS between W&S group and RS group
2.2.7 3年OS5篇文献[8, 17-18, 20, 22]报道了3年OS,各研究间无明显异质性(P=0.524,I2=0.0%),故采用固定效应模型分析,结果显示W&S组3年OS高于RS组(RR=1.09,95% CI=1.03~1.15,P=0.004)(图8)。
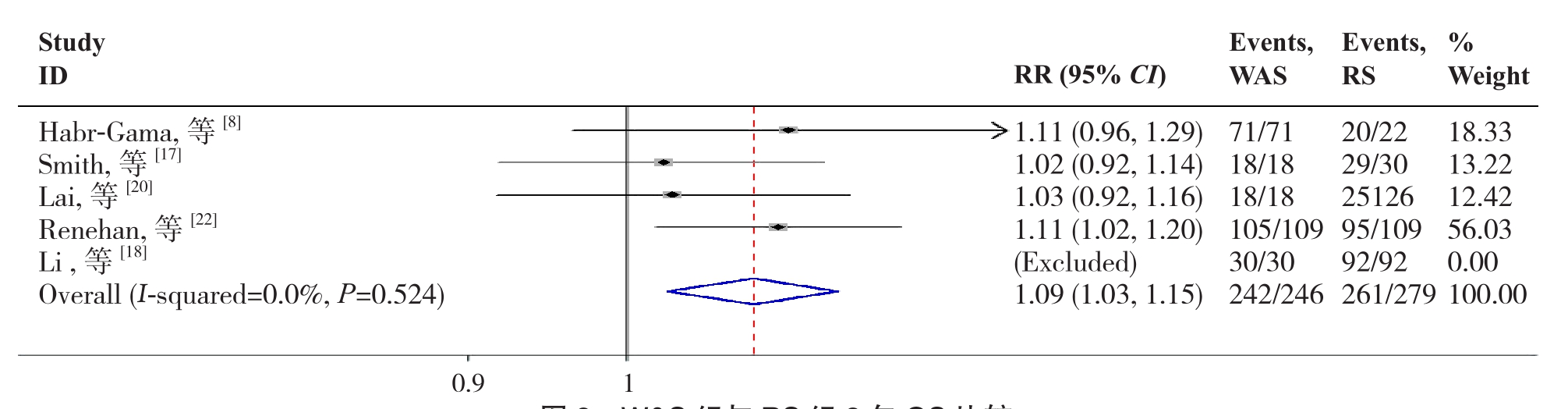
图8 W&S组与RS组3年OS比较
Figure 8 Comparison of the 3-year OS between W&S group and RS group
2.2.8 5年DFS4篇文献[8,17-18,21]报道了5年DFS,各研究间存在明显异质性(P=0.088,I2=54.2%),故采用随机效应模型分析,结果显示两组在5年DFS的差异无统计学意义(RR=0.95,95% CI=0.84~1.08,P=0.435)(图9)。
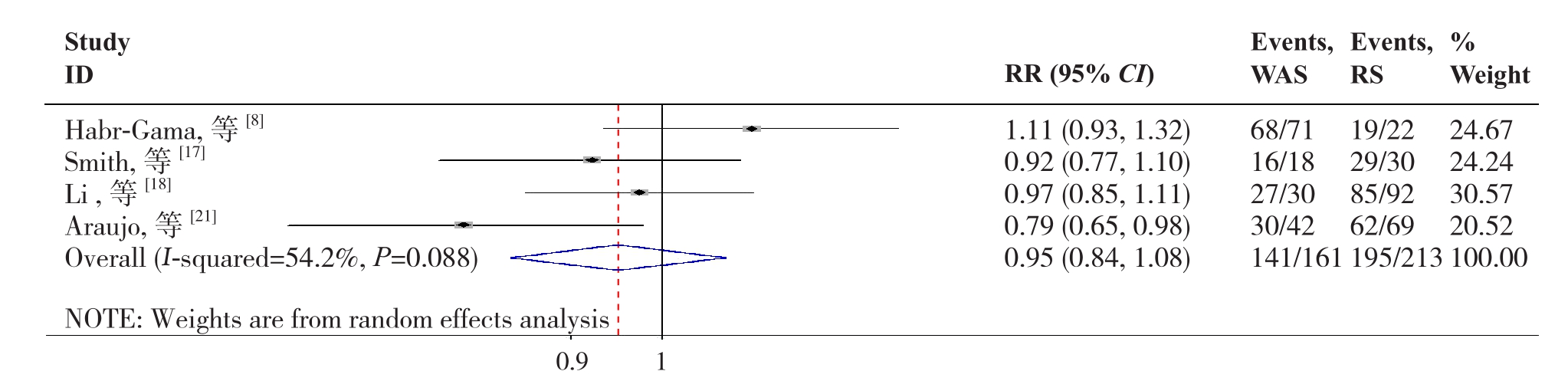
图9 W&S组与RS组5年DFS比较
Figure 9 Comparison of the 5-year DFS between W&S group and RS group
2.2.9 5年OS5篇文献[8, 17-18, 20-21]报道了5年OS,各研究间存在明显异质性(P=0.026,I2=63.9%),故采用随机效应模型分析,结果显示两组在5年OS的差异无统计学意义(RR=1.02,95% CI=0.93~1.12,P=0.674)(图10)。
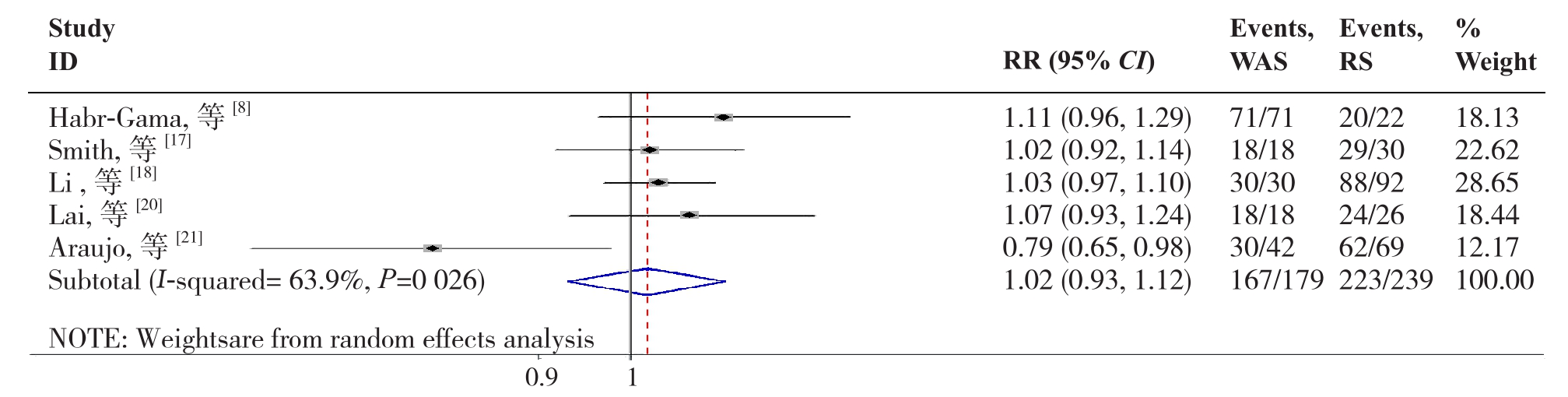
图10 W&S组与RS组5年OS比较
Figure 10 Comparison of the 5-year OS between W&S group and RS group
2.3 异质性及敏感性分析
研究结果显示3年DFS、5年DFS及5年OS出现异质性,究其原因与纳入文献量、标本量较少有关,同时各个试验方法学质量也有差异,故在临床及统计学两方面均可能存在异质性。所有评价指标采用随机效应模型与固定效应模型两者相互替换分析后得出的结论一致,且将每个纳入研究逐一排除后的分析结果也一致,说明该研究稳定性好,分析结果可靠性较高。
2.4 发表偏倚分析
以两组LR做漏斗图绘制分析,所纳入的相关文献全部在95% CI内且分布均匀对称,表明无明显发表偏倚(图11)。
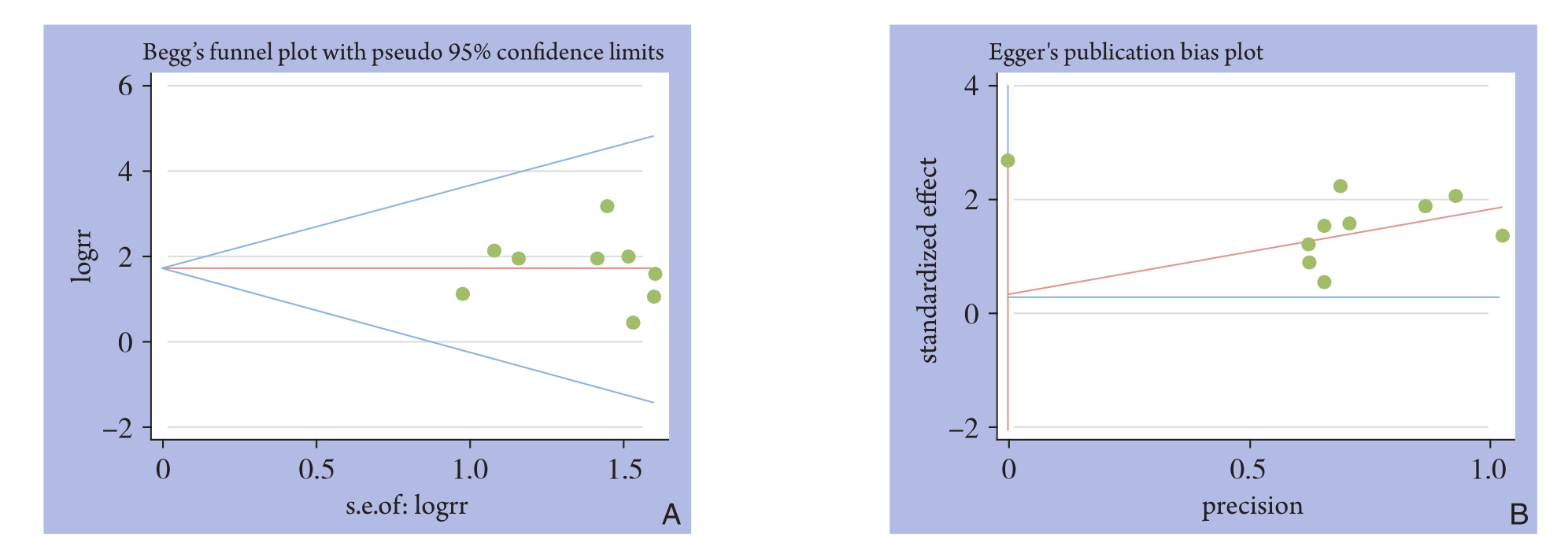
图11 两组LR漏斗图 A:Begger检验;B:Egger检验
Figure 11 Funnel plots for LR of the two groups A: Begg’s test; B: Egger’s test
3 讨 论
外科学诞生之日起,风险、创伤、疼痛和瘢痕就始终伴随着手术,如何最大程度地减轻手术对患者造成的生理和心理上的创伤一直是外科医生思考的问题[2]。2004年,Habr-Gama等[8]率先提出了W&S策略,认为NCRT后经过严格的临床评估确定达到cCR的直肠癌患者可以避免RS,尤其是手术可能导致肛门括约肌功能丧失者,而采取密切观察随访若发现LR,及时采取补救性措施,这无疑避免了手术伴随的风险及并发症,同时给部分不接受肛门切除的患者带来了希望的曙光。
通常认为NCRT后无肿瘤残余的临床、肠镜及影像学证据则认为达到cCR[17],而pCR通常被定义为NCRT后手术切除标本中未发现任何残余肿瘤细胞或者阳性淋巴结(ypT0N0M0)[23]。目前对cCR定义缺乏统一认识,初步总结为:⑴ 直肠指检未扪及肿瘤;⑵ 肠镜检查未发现肿块、结节,溃疡或仅见瘢痕或红斑,且活检为阴性;⑶ CT、MRI、直肠超声(EUS)等影像学检查未发现肿瘤残余以及可疑肿大淋巴结。文献报道,NCRT后血清CEA<5 ng/dL是直肠癌预后良好的因素,与肿瘤完全消退有关,因此,血清CEA<5 ng/dL是定义cCR的重要组成部分[24]。直肠指检是一项重要的临床手段,但是可能因直肠局部的炎症和纤维化常被误认为是癌症残留,单独应用直肠指诊以判定 cCR 的准确性仅为 21%[25]。此外,肠镜虽便于直视下观察肿瘤及对可疑病灶取活检,但是肠镜活检并不能判断NCRT后淋巴结情况。NCRT可能会引起直肠局部纤维化,而为了评估淋巴结情况,影像学检查就显得尤为重要,其中EUS、MRI,CT对肠周浸润的敏感性分别为90%,82%和79%;对淋巴结阳性检出敏感性分别为67%,66%和55%,特异性分别为78%,76%和74%,对邻近器官侵犯敏感性分别为:70%,74%和72%[26]。肠镜送病检结合PET-CT/CT,评估cCR的准确度可达91%[27]。而肠镜结合功能MRI(DWI)可精确评估肿瘤对NCRT的反应程度,对预测cCR 的准确度可达98%[28]。因此,评估cCR必须由外科、内窥镜和放射科医师综合评估。Habr-Gama等[29]表示:行NCRT后最短间隔6~8周或更长间隔行cCR评估,并对cCR者推荐采取W&S策略,每2~6个月规律体检和复查影像。若10周后有可疑残余病灶则行局部切除(local excision,LE),切除后病理若为ypT0期,则继续观察等待并严密规律随访。所有采取W&S策略的患者随访1年仍无疾病进展或复发证据,则定义为持续cCR。而其余未获得cCR的患者,则行补救性手术。
有研究[30]报道了488例患者接受NCRT,术前有19%患者诊断为cCR,而术后仅约10%患者最终诊断为pCR。此外,pCR患者仍然有5%~9%存在累及淋巴结风险[6]。因此,就选择W&S策略的cCR患者而言,肿瘤复发或转移风险可能更高,故制定严格、周密的随访体系显得尤为重要。通常建议由1~2名专业的外科医生于治疗后第1年内每1~3个月重复进行1次包括体格检查、直肠指检、血清CEA测定,肠镜(必要时送病检),每6个月进行1次影像学检查,包括全腹部及盆腔CT、MRI等,第2年内每3~6个月随访1次;第3~5年每6个月随访1次,以后每年随访1次。
本Meta分析结果显示:W&S组局部复发率明显高于RS组。毫无疑问,达cCR患者采取W&S策略后LR是不可避免的。其LR率从5%~60%不等,其中约34%发生在NCRT后1年内[22]。W&S出现LR后的补救策略主要包括LE、RS、短程放疗等。研究[8,13]表明:采取WAS策略后LR的最常见部位为直肠腔内复发,而NCRT并不破坏直肠癌患者系膜的完整性,及时发现LR并采取补救性手术,90%以上复发患者仍可达到R0切除,同时可以有效控制局部复发(94%),并增加保肛率(78%)[2]。既往一篇纳入71例LR患者(18例行LE,44例行RS)的研究[31]表明:cCR采取W&S策略后LR患者,其LE组与RS组长期生存无显著差异(logrank=2.99,P=0.0838);而LE却避免了RS的术后并发症及永久性结肠造瘘,且生活质量高于RS组。故对于部分LR患者,LE不失为一种首选的补救性措施。因此,对cCR采取W&S策略LR患者进行全面、谨慎评估,为临床决策提供依据,并选择适合的补救措施,从而避免漏治或过度的RS。
关于DM,两组之间无统计学差异。表明DM的发生与两组治疗方式无明显相关,即DM与是否行RS无关。有观点[31]认为:无论原发肿瘤是否切除,都有可能发生DM,这可能是肿瘤的特定生物学行为所致,即肿瘤在形成、发生发展的过程中癌细胞可能通过突破血管、淋巴管及脱落等,从而在合适的时机合适的部位发生转移。
与RS组相比,W&S组有相似的CRD,2、3、5年DFS和5年OS,且2、3年OS更高。两组间DFS无统计学差异,而短期OS有统计学差异,分析其原因:⑴ 主要由非肿瘤相关因素如术后并发症导致RS组短期OS降低;⑵ DFS和OS两者间比较具有一定差异性,如2年DFS纳入了9篇研究,其中有8篇数据可进行对比分析,而2年OS纳入了8篇,但其中仅有4篇数据可进行分析,故两者间纳入文献量不同、样本量不同,且各研究间各自的组间条件不相等,因此导致DFS和OS结果存在一定差距。当然,该结论需谨慎看待。但是也潜在表明对于cCR患者采取W&S策略安全可行,未来前景可观。然而本研究也有一些局限性,比如纳入文献数量不算多,采取W&S策略组样本量偏少,且缺乏RCTs;其次,纳入文献中的直肠肿瘤距肛缘位置、NCRT具体方案等因素存在一定差异,导致了两组比较的不平等性。
笔者对这一新兴策略有几点理解:⑴ 其主要优势并非改善肿瘤长期预后,而是在于避免手术及其严重并发症以及永久性造瘘。⑵ 其适应人群应当更具针对性:在并发症方面,高龄患者接受W&S策略的获益可能较低龄人群更显著,尤其是对于年纪>80岁患者来说可以从这项策略中明显获益[32];而在避免永久性造瘘方面,年轻患者的需求可能更能满足,有文献[22]对3年无永久性造瘘生存期进行报道:W&S组vs.RS组为74% vs.47%(log-rank,P<0.0001)。⑶ 其目前难点在于如何更加精准评估cCR,以及采取该策略的患者是否配合及接受严密随访。
综上所述,非手术W&S策略极大地颠覆了传统的直肠癌治疗理念,而直肠癌患者行NCRT后达cCR选择W&S策略是安全可行的,它的出现或许是一种新的直肠癌管理策略,并将促使结直肠外科进入下一个崭新的个体化精准“无创”时代。然不可忽略的是,必须严格、谨慎地评估其是否达到cCR,以及必须制定严密、规范的随访体系。同时,亟待未来大样本、多中心、前瞻性临床随机对照研究对采取W&S策略患者的远期结局加以验证。
[1]Siegel RL, Miller KD, Jemal A.Cancer Statistics, 2017[J].CA Cancer J Clin, 2017, 67(1):7–30.doi: 10.3322/caac.21387.
[2]张旋, 程先硕, 余昆, 等."等待观察":直肠癌新辅助放化疗后完全缓解治疗的新策略[J].中国普通外科杂志, 2017, 26(4):514–518.doi:10.3978/j.issn.1005–6947.2017.04.018.Zhang X, Cheng XS, Yu K, et al."Wait-and-see": a new treatment strategy for rectal cancer with complete response after neoadjuvant chemoradiotherapy[J].Chinese Journal of General Surgery, 2017,26(4):514–518.doi:10.3978/j.issn.1005–6947.2017.04.018.
[3]Fujita S, Akasu T, Mizusawa J, et al.Postoperative morbidity and mortality after mesorectal excision with and without lateral lymph node dissection for clinical stage or stage III lower rectal cancer(JCOG0212): results from a multicenter, randomized controlled,non-inferiority trial[J].Lancet Oncol, 2012, 13(6):616–621.doi:10.1016/S1470–2045(12)70158–4.
[4]Harrison JD, Solomon MJ, Young JM, et al.Patient and physician preferences for surgical and adjuvant treatment options for rectal cancer[J].Arch Surg, 2008, 143(4):389–394.doi: 10.1001/archsurg.143.4.389.
[5]Glynne-Jones R, Hughes R.Complete response after Chemoradiotherapy in Rectal cancer (Watch-and-Wait): Have we Cracked the Code?[J].Clin Oncol(R Coll Radio), 2016, 28(2):152–160.doi: 10.1016/j.clon.2015.10.011.
[6]Mass M, Nelemans PJ, Valentini V, et al.Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data[J].Lancet Oncol, 2010, 11(9):835–844.doi: 10.1016/S1470–2045(10)70172–8.
[7]Nakagawa WT, Rossi BM, de O Ferreira F, et al.Chemoradiation instead of surgery to treat mid and low rectal tumors: is it safe?[J].Ann Surg Oncol, 2002, 9(6):568–573.
[8]Habr-Gama A, Perez RO, Nadalin W, et al.Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results[J].Ann Surg, 2004,240(4):711–717.
[9]Appelt AL, Pløen J, Harling H, et al.High-dose chemoradiotherapy and watchful waiting for distal rectal cancer: a prospective observational study[J].Lancet Oncol, 2015, 16(8):919–927.doi:10.1016/S1470–2045(15)00120–5.
[10]Habr-Gama A, Gama-Rodrigues J, São Julião GP, et al.Loacl recurrence after complete clinical response and watch and wait in rectal cancer after neoadjuvant chemoradiation: impact of salvage therapy on local disease control[J].Int J Radiat Oncol Biol Phys,2014, 88(4):822–828.doi: 10.1016/j.ijrobp.2013.12.012.
[11]Stang A.Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in metaanalyses[J].Eur J Epidemiol, 2010, 25(9):603–605.doi: 10.1007/s10654–010–9491-z.
[12]Egger M, Davey Smith G, Schneider M, et al.Bias in meta-analysis detected by a simple, graphical test[J].BMJ, 1997, 315(7109):629–634.
[13]Maas M, Beets-Tan RG, Lambregts DM, et al.Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer[J].J Clin Oncol, 2011, 29(35):4633–4640.doi: 10.1200/JCO.2011.37.7176.
[14]Dalton RS, Velineni R, Osborne ME, et al.A single-centre experience of chemoradiotherapy for rectal cancer: is there potential for nonoperative management?[J].Colorectal Dis, 2012, 14(5):567–571.doi: 10.1111/j.1463–1318.2011.02752.x.
[15]Smith JD, Ruby JA, Goodman KA, et al.Nonoperative management of rectal cancer with complete clinical response after neoadjuvant therapy[J].Ann Surg, 2012, 256(6):965–972.doi: 10.1097/SLA.0b013e3182759f1c.
[16]Ayloor Seshadri R, Kondaveeti SS, Jayanand SB, et al.Complete clinical response to neoadjuvant chemoradiation in rectal cancers:can surgery be avoided?[J].Hepatogastroenterology, 2013,60(123):410–414.doi: 10.5754/hge12354.
[17]Smith RK, Fry RD, Mahmoud NN, et al.Surveillance after neoadjuvant therapy in advanced rectal cancer with complete clinical response can have comparable outcomes to total mesorectal excision[J].Int J Colorectal Dis, 2015, 30(6):769–774.doi: 10.1007/s00384–015–2165–2.
[18]Li J, Liu H, Yin J, et al.Wait-and-see or radical surgery for rectal cancer patients with a clinical complete response after neoadjuvant chemoradiotherapy: a cohort study[J].Oncotarget, 2015,6(39):4235–4261.doi: 10.18632/oncotarget.6093.
[19]Lee SY, Kim CH, Kim YJ, et al.Oncologic Outcomes according to Treatment Strategy in Radiologic Complete Responders after Neoadjuvant Chemoradioation for Rectal Cancer[J].Oncology,2015, 89(6):311–318.doi: 10.1159/000439279.
[20]Lai CL, Lai MJ, Wu CC, et al.Rectal cancer with complete clinical response after neoadjuvant chemoradiotherapy, surgery, or "watch and wait"[J].Int J Colorectal Dis, 2016, 31(2):413–419.doi:10.1007/s00384–015–2460-y.
[21]Araujo RO, Valadão M,Borges D, et al.Nonoperative management of rectal cancer after chemoradiation opposed to resection after complete clinical response.A comparative study[J].Eur J Surg Oncol, 2015, 41(11):1456–1463.doi: 10.1016/j.ejso.2015.08.156.
[22]Renehan AG, Malcomson L, Emsley R, et al.Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer (theOnCoRe project): a propensity-score matched cohort analysis[J].Lancet Oncol, 2016, 17(2):174–183.doi: 10.1016/S1470–2045(15)00467–2.
[23]Dinaux AM, Amri R, Bordeianou LG, et al.The Impact of Pathologic Complete Response in Patients with Neoadjuvantly Treated Locally Advanced Rectal Cancer-a Large Single-Center Experience[J].J Gastrointest Surg, 2017, 21(7):1153–1158.doi:10.1007/s11605–017–3408-z.
[24]Habr-Gama A, Perez RO, Wynn G, et al.Complete clinical reponse after neoadjuvant chemoradiation therapy for distal rectal cancer: characterization of clinical and endoscopic findings for standardization[J].Dis Colon Rectum, 2010, 53(12):1692–1698.doi: 10.1007/DCR.0b013e3181f42b89.
[25]Guillem JG, Chessin DB, Shia J, et al.Clinical examination following preoperative chemoradiation for rectal cancer is not a reliable surrogate end point[J].J Clin Oncol, 2005, 23(15):3475–3479.doi: 10.1200/JCO.2005.06.114.
[26]Bipat S, Glas AS, Slors FJ, et al.Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT,and MR imaging--a meta-analysis[J].Radiology, 2004, 232(3):773–783.doi: 10.1148/radiol.2323031368.
[27]Perez RO, Habr-Gama A, Gama-Rodrigues J, et al.Accuracy of positron emission tomography/computed tomography and clinical assessment in the detection of complete rectal tumor regression after neoadjuvant chemoradiation: long-term results of a prospective trial(National Clinical Trial 00254683)[J].Cancer, 2012, 118(14):3501–3511.doi: 10.1002/cncr.26644.
[28]Maas M, Lambregts DM, Nelemans PJ, et al.Assessment of Clinical Complete Response After Chemoradiation for Rectal Cancer with Digital Rectal Examination, Endoscopy, and MRI:Selection for Organ-Saving Treatment[J].Ann Surg Oncol, 2015,22(12):3873–3880.doi: 10.1245/s10434–015–4687–9.
[29]Habr-Gama A, Sabbaga J, Gama-Rodrigues J, et al.Watch and wait approach following extended neoadjuvant chemoradiation for distal rectal cancer: are we getting closer to anal cancer management?[J].Dis Colon Rectum, 2013, 56(10):1109–1117.doi: 10.1097/DCR.0b013e3182a25c4e.
[30]Hiotis SP, Weber SM, Cohen AM, et al.Aseessing the predictive value of clinical complete response to neoadjuvant therapy for rectal cancer: an analysis of 488 patients[J].J Am Coll Surg, 2002,194(2):131–136.
[31]金旭.直肠癌新辅助治疗后临床完全缓解患者“wait and see”策略的Meta分析及局部复发治疗策略的选择[D].昆明: 昆明医科大学, 2016:1–44.Jin X.Wait-and-see to Clinic complete response patients curative effect of rectal cancer after neoadjuvant chemoradiotherapy of Meta analysis and the choice of treatment strategy after local recurrence[D].Kunming: Kunming Medical University, 2016:1–44.
[32]Smith FM, Rao C, Oliva Perez R, et al.Avoiding radical surgery improves early survival in elderly patients with rectal cancer,demonstrating complete clinical response after neoadjuvant therapy:results of a decision-analytic model[J].Dis Colon Rectum, 2015,58(2):159–171.doi: 10.1097/DCR.0000000000000281.
