三阴性乳腺癌(three negative breast cancer,TNBC)是乳腺癌分子分型中的一种特殊亚型,因其特殊的生物学特性,导致三阴性乳腺癌具有进展快、预后差等特点。因为缺乏内分泌治疗和靶向治疗的特异性位点,所以除了化疗临床上尚无有效的综合治疗手段。蛋白质是生命功能的执行者,正常机体蛋白质的产生与降解维持着动态平衡。其产生受基因调控,其降解主要通过两种途径,即溶酶体途径和泛素-蛋白酶体系统途径(ubiquitin proteasome system,UPS),后者因为特异性的泛素蛋白连接酶E3(UBE3),导致其降解蛋白质具有高度选择性[1-2],正因为如此,有越来越多的药物针对UPS系统作为治疗靶标[2-4]。UBE3A为UBE3酶之一,前期实验[5-9]发现,UBE3在乳腺癌组织中比癌旁组织中高表达,说明UBE3A在乳腺癌发生发展中具有促进作用。本实验通过对shRNA下调UBE3A观察三阴性乳腺癌细胞系MDA-MB-MB231的生物学行为,旨在进一步研究三阴性乳腺癌发生、发展的机制,并期待为临床治疗和研究提供新靶点和新方向。
1 材料与方法
1.1 细胞与分组
人三阴性乳腺癌细胞株MDA-MB-231,购于中国科学院细胞总库。将细胞分为干扰组(转染含UBE3A shRNA片段的慢病毒,包括3种干扰序列,选择干扰效率最高的干扰序列行后续实验)、空白对照组(无任何处理)、阴性对照组(转染含阴性对照shRNA序列的慢病毒)。
1.2 主要实验仪器
流式细胞仪购于美国BD公司;倒置显微镜、荧光显微镜等购于德国Leica;酶标仪、SDSPAGE电泳仪、转膜仪、成像仪、PCR仪购于美国Bio-Rad公司;CO2细胞培养箱购于德国Heraeus。
1.3 实验主要试剂
RPMI-1640培养基、胎牛血清购于美国HyClone公司;UBE3A siRNAs片段、Negative siRNA片段、GV-115中国上海吉凯基因化学技术有限公司,脂质体Lipo-2000、Trans IT购于美国Invitrogen;逆转录试剂盒、PCR游引购于物美国Thermo;Western blot相关试剂购于中国碧云天公司;兔抗人UBE3A单克隆抗体(货号:ab126765)、兔抗人β-actin(货号:ab8227)多克隆抗体购于美国Abcam;Transwell小室购于美国Millipore;Matrigel购于美国BD。
1.4 实验方法
1.4.1 构建及鉴定慢病毒质粒载体 通过Genebank查询人UBE3A基因(NM-130839)序列,针对人UBE3A基因按RNA干扰序列设计原则,设计的3个RNA干扰序列与阴性对照序列见表1。使用AgeI,EcoRI内切酶在酶切反应体系中于相应酶切位点进行酶切反应,利用T4DNA连接酶进行连接反应。在制备新鲜大肠杆菌感受态细胞内进行转化,提取大肠杆菌质粒并将PCR扩增,将PCR阳性克隆进行测序,测序序列正确的重组质粒才可以进行扩增及后续实验。
表1 设计的shRNA序列
Table1 The designed shRNA seqeunces


1.4.2 包装含目的片段的慢病毒 于5%的CO2孵箱培养用于包装慢病毒的239T、MDA-MB-231细胞。当细胞密度达60%~70%时将细胞培养基更换为无血清的1640培养基;并分别加入预先混匀的 LV-UBE3A-shRNA 载体 20 μg,pHelper 2.0载体 10 μg、pHelper 1.0载体 15 μg和 Lipo2000转染溶液进行细胞转染。收集转染48 h后的培养293T细胞的上清液,于4 ℃、4000 r/min离心10 min,收集含目的片段的慢病毒,并采用荧光法测病毒滴度测定以确保后续实验的准确性。
1.4.3 感染目的细胞 取处于对数生长期且生长状态良好的MDA-MB-231细胞、制成细胞悬液;调整细胞浓度,培养24 h;待细胞融合度达到约20%~30%时,加入适宜量含目的片段的慢病毒,培养12 h后更换培养基;于荧光显微镜下观察感染72 h后细胞GFP的表达情况,与普通光学显微镜下比较,荧光率>90%者,可用于后续实验。
1.4.4 筛选最佳干扰片段 使用TRIzol试剂提取各组细胞总RNA。同时逆转录为cDNA,检测各组细胞UBE3A基因相对表达水平,利用2-△△Ct法计算UBE3A相对表达水平,筛选干扰效率最高的干扰片段。
1.4.5 Western blot检测蛋白表达 各组细胞转染72 h后,提取各组细胞总蛋白并进行蛋白定量,计算含20 μg蛋白的溶液的体积为上样量,按常规进行SDS-PAGE电泳、转膜、洗膜、封闭,加入一抗4 ℃过夜,再次洗膜后孵育二抗1 h,BeyoECL Plus试剂盒显色及成像,以β-actin为内对照,使用凝胶图像软件Image Lab数据分析。
1.4.6 CCK8法检测UBE3A细胞增殖 分别于转染 24、48、72 h后每孔加入 CCK8试剂 10 μL,于培养箱中孵育1 h,使用酶标仪选择450 nm波长测定吸光度值,根据吸光度值分析细胞增值情况;每次取5个复孔,重复3次。
1.4.7 Transwell小室侵袭实验检测细胞侵袭能力 取生长良好处于对数期的细胞,消化后调整细胞密度至2×104/mL;取细胞悬液200 µL加入Transwell上室,下室加入500 µL含10%的FBS培养基,常规培养24 h,后用1%的结晶紫染色微孔膜下室的细胞10 min,PBS轻轻冲洗干净后稍微晾干,于倒置显微镜观察。每组10个高倍视野观察通过Transwell小室的MDA-MB-231细胞数量,以反映肿瘤细胞的体外侵袭能力的大小。
1.4.8 流式细胞术检测细胞周期情况 取生长良好的各组细胞,制成单个细胞悬液;离心收集细胞,加入3 mL预冷(-20 ℃)70%乙醇到细胞沉淀中,重悬细胞,于4 ℃固定过夜;再次离心收集细胞,用PBS洗细胞2次后离心收集细胞,加入500 μL PBS 含 50 μg/mL PI、100 μg/mL RNase A、0.2%Triton X-100,于4 ℃避光孵育30 min;调整细胞密度,设置参数,上机检测。
1.5 统计学处理
计量资料采用均数±标准差( ±s)表示,采用SPSS 24.0软件进行统计学分析,组间采用t检验,以P<0.05为差异有统计学意义;使用Graphpad 7对结果进行绘图。
±s)表示,采用SPSS 24.0软件进行统计学分析,组间采用t检验,以P<0.05为差异有统计学意义;使用Graphpad 7对结果进行绘图。
2 结 果
2.1 shRNA载体阳性克隆测序结果
将设计合成的UBE3A靶点序列在基因组数据库进行对比,未发现该序列与其它编码同源,且重组质粒经过测序分析验证,与预期序列相符。
2.2 慢病毒转染效率
根据同一视野下白光和荧光细胞数目如图1,干扰组转染率均在95%以上,可进行后续基因功能实验。
2.3 最有效干扰片段的筛选
慢病毒转染细胞48 h后,提取各组细胞总RNA,应用qRT-PCR检测UBE3A及内参基因GAPDH的mRNA,获得各组细胞的扩增曲线及各组细胞UBE3A及GAPDH的Ct值,利用溶解曲线判断PCR产物的特异性。以GAPDH进行标化,使用2-△△Ct法分析各基因的Ct值,2-△△Ct值即为基因的相对表达量。以空白对照组为参考比较,其中阴性对照组差异无统计学意义(t=1.861,P=0.136);3个干扰组差异均有统计学意义(干扰序列1:t=18.907,P=0.000046;干扰序列2:t=0.196,P=0.00000517;干扰序列3:t=71.925,P=0.00000293),其中,干扰序列3的干扰效率较高,达89.5%,故采用干扰序列3序列进行后续实验(图2)。
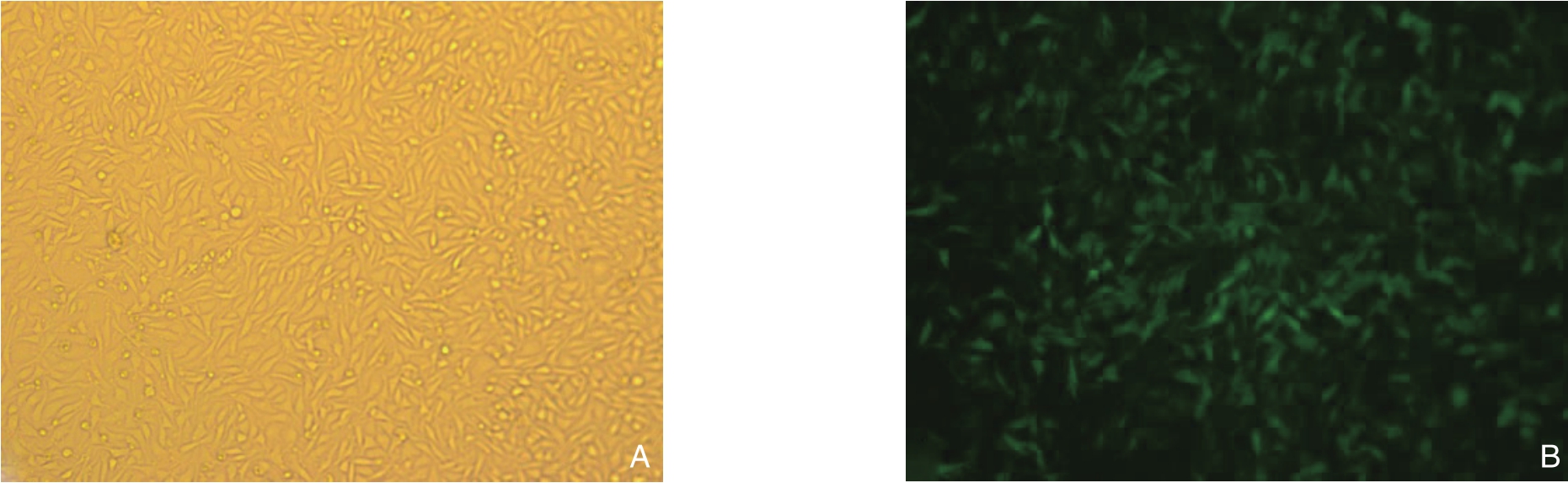
图1 慢病毒转染48 h后的MDA-MB-231细胞(同一视野,×50) A:普通光学显微镜下;B:荧光显微镜下
Figure1 MDA-MB-231 cells 48 h after lentiviral transfection (the same field of view, ×50) A: Under light microscope; B: Under fluorescence microscope
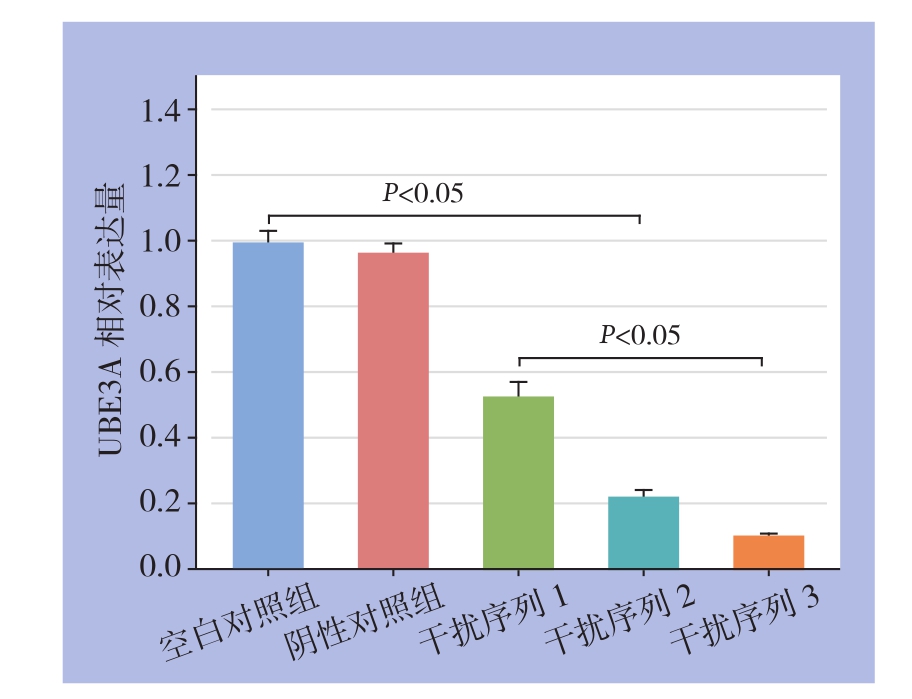
图2 各组MDA-MB-231细胞UBE3A mRNA相对表达量
Figure2 The relative mRNA expression levels in each group of cells
2.4 干扰后UBE3A蛋白的相对表达水平
病毒感染细胞72 h后,提取各组细胞总蛋白检,检测UBE3A蛋白的相对表达水平,结果见图3,以Image J进行灰度分析和标化。阴性对照组与空白对照组差异无统计学意义(均P>0.05),干扰组与空白对照组比较,差异有统计学意义(t=14.488,P=0.010),其相对表达量为54.7%,抑制率为45.3%,可进行后续实验。
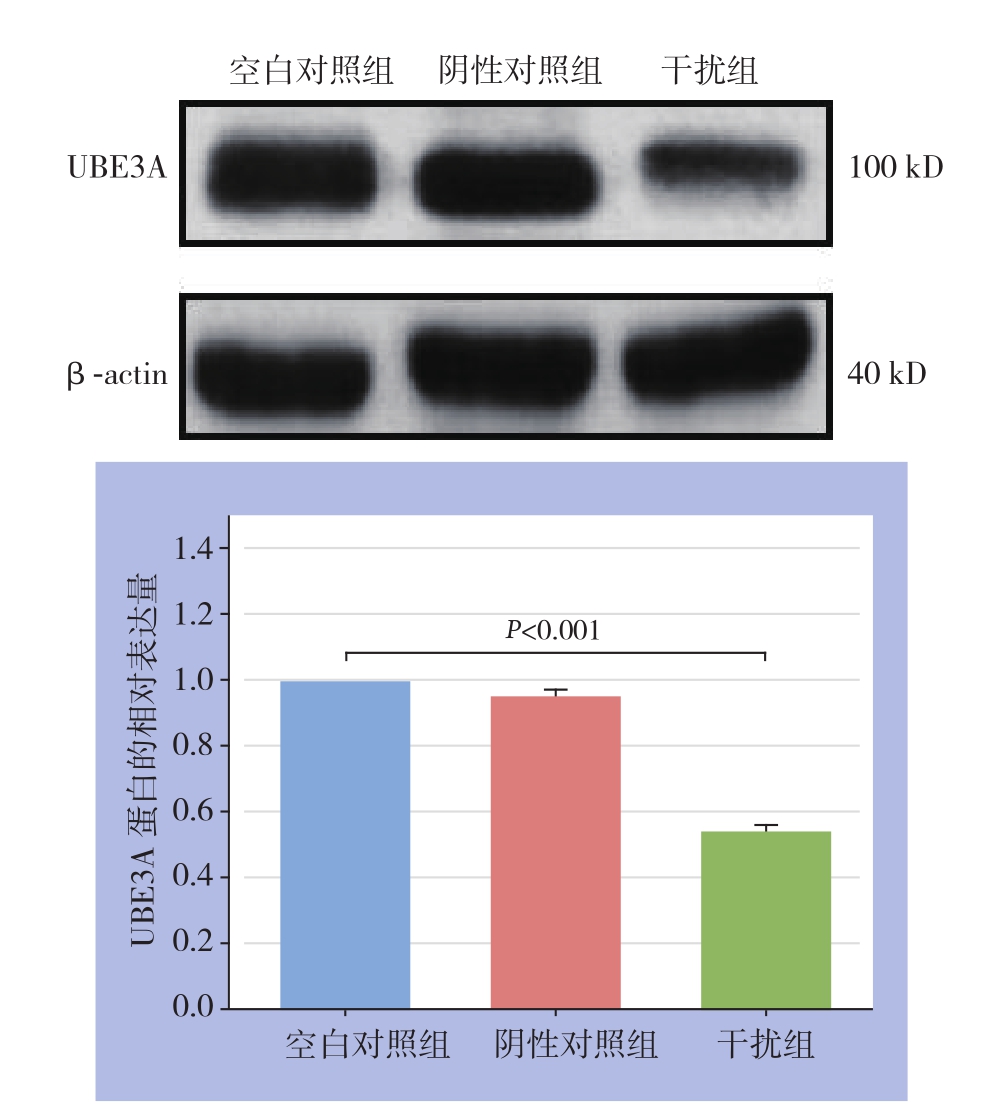
图3 Western blot检测UBE3A蛋白的相对表达水平
Figure3 The relative mRNA expression levels determined by Western blot
2.5 Transwell检测MDA-MB-231细胞的侵袭能力
Transwell实验结果显示,阴性对照组与空白对照组的侵袭细胞数差异无统计学意义(P>0.05),干扰组与空白对照组相比,侵袭细胞数明显减少,差异有统计学意义(t=10.450,P=0.000)(图4)。
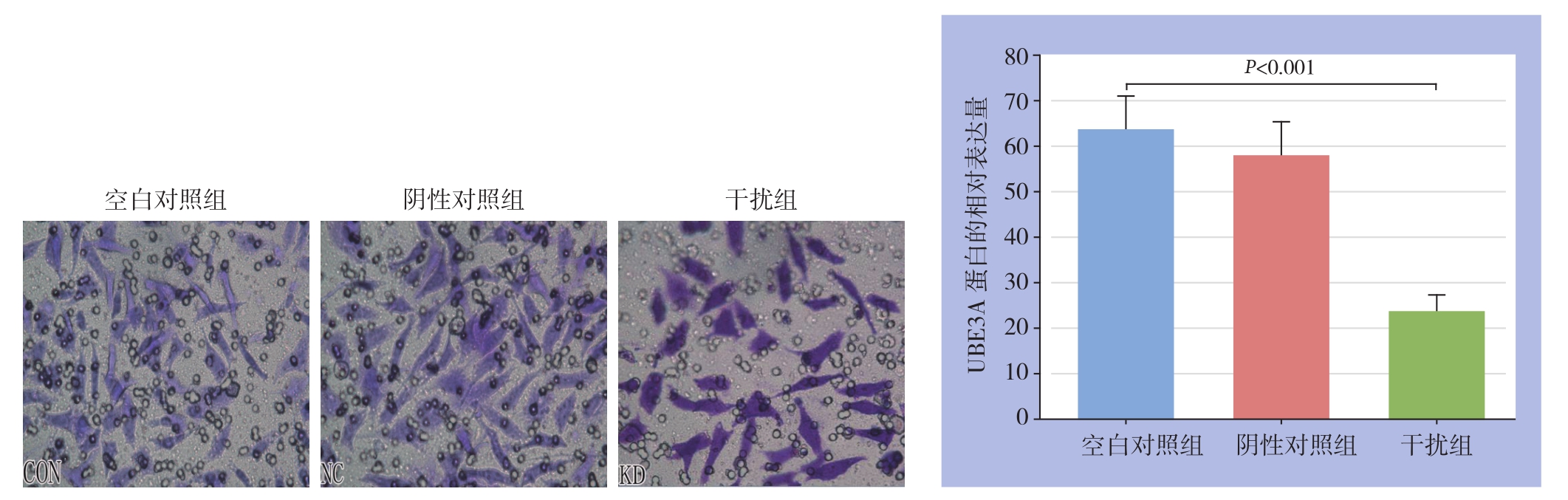
图4 Transwell检测各组细胞侵袭能力
Figure4 Cell invasion abilities detected by Transwell assay
2.6 细胞增殖能力的变化
转染24、48、72 h后,测各组450 nm处OD值,阴性对照组与空白对照组相比,各时间点差异均无统计学意义(均P>0.05);干扰组与空白对照组比较,差异均有统计学意义(t24 h=2.314,P=0.039;t48 h=3.498,P=0.008;t72 h=7.657,P=0.000)(图5)。
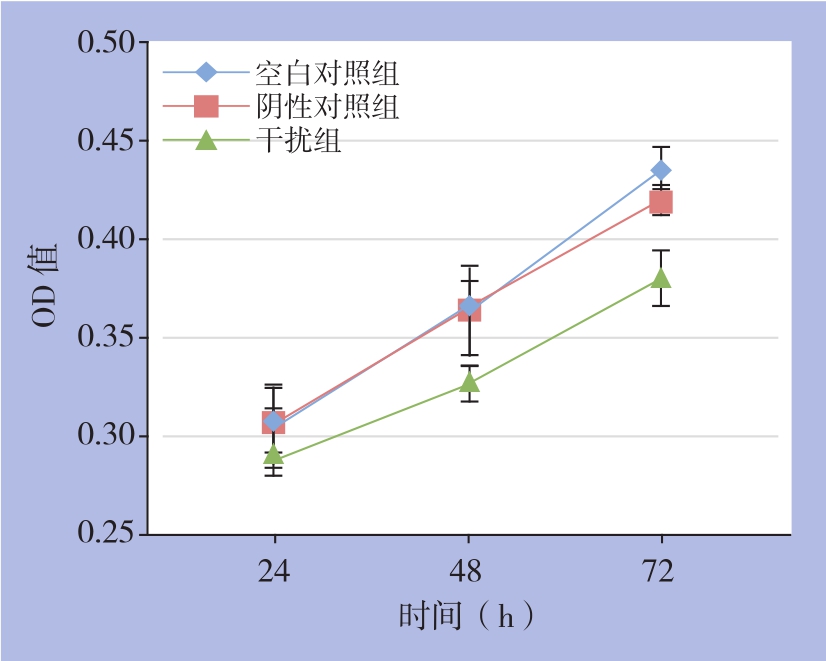
图5 各组细胞各时间点OD值
Figure5 OD values of each group of cells at different time points
2.7 细胞周期的变化
转染48 h后进行流式细胞术检测各组细胞周期,3组细胞在各个周期差异均有统计学意义(G0/G1期:F=243.712,P=0.000;G2/M期:F=29.804,P=0.001;S期:F=252.522,P=0.000)。其中阴性对照组与空白对照组在细胞周期各时期差异无统计学意义(均P>0.05);干扰组与空白对照组比较,各时期差异均有统计学意义(均P<0.05),干扰UBE3A后,MDAMB-231细胞大多数处于S期(图6)。
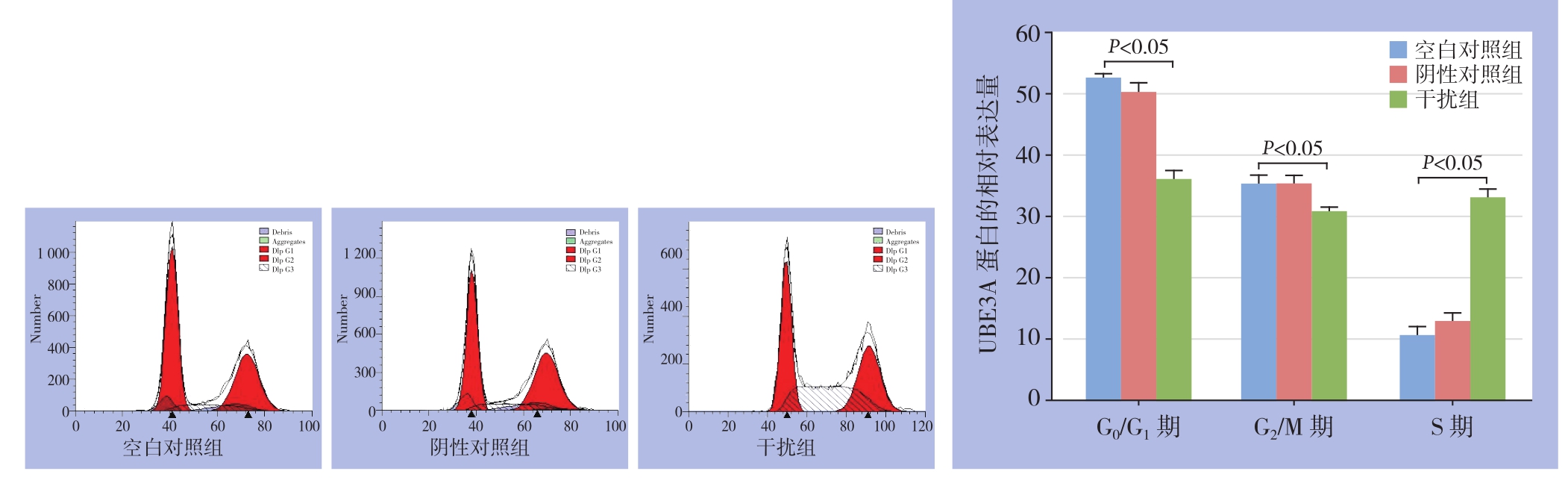
图6 流式细胞术检测各组细胞周期
Figure6 Cell cycles of each group of cells examined by flow cytometry
3 讨 论
蛋白质是生命功能的执行者,正常机体蛋白质的产生与降解维持着动态平衡。其产生受基因调控,其降解主要通过两种途径,即溶酶体途径和UPS,后者具有高度选择性[2],正因为如此,有越来越多的药物针对UPS系统作为治疗靶标[3-4,10],比如bortezomib和carfilzomib靶向药物。UPS由泛素(UB)、泛素活化酶E1、泛素结合酶E2、泛素蛋白连接酶E3、泛素延长酶E4、去泛素化酶DUB(DUB)和26S的蛋白酶体组成。到目前为止,发现少数几种E1酶,约30种的E2酶,约600种E3酶[1]。在UPS中由于E3酶独特的结构和功能域,决定了其介导的靶蛋白降解反应的高度选择性与特异性。UBE3A又称E6-AP(E6 associated protein,E6-AP),属于含有HECT结构的E3泛素蛋白连接酶家族成员。UBE3A基因可编码5种mRNA,最终编码3种同分异构体的蛋白亚型[11]。每一种亚型的具体功能现在还不完全清楚。目前的研究[12-13]表明,UBE3A蛋白定位在细胞核中,作为甾醇类激素受体的共激活因子调节下游基因的转录参与天使综合征(Angelic Syndrome,AS),研究[5,14-19]证实,细胞内大量的基因编码的蛋白质如P53、c-myc、P27等可通过UBE3A介导的泛素-蛋白酶体系统降解,从而促进肿瘤的发生发展。
本次选取乳腺癌细胞株MDA-MB-231来源于三阴性乳腺癌患者,恶性程度较高,具有较强的侵袭能力。本实验首先以UBE3A基因为靶标,按照RNAi原则设计出3条siRNA和1条阴性对照,按照小干扰片段设计合成shRNA表达载体,同时使用慢病毒介导转染至MDA-MB-231细胞,以此来增加转染效率。
细胞的增殖是活细胞在行使各种生理功能时重要的生物学特征之一,是生物体新陈代谢的表现,是生物体遗传、分裂繁殖、生长、发育的基础[20]。细胞的增殖周期即指细胞从一次分裂结束开始生长,到下一次分裂结束所经历的整个过程,可分为间期和分裂期。间期又可分为G0期(休眠期)、G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)。因此如果阻断某些蛋白的合成如组蛋白、微管蛋白等,细胞将停止间期而不能进入有丝分裂,从而影响细胞周期[20]。
本实验通过慢病毒介导转染,成功下调乳腺癌细胞MDA-MB-231 UBE3A基因及蛋白的表达。下调UBE3A后乳腺癌细胞的增殖能力较空白组及阴性对照组受到抑制,这也应证了前期Zhou等[7]和侯令密等[8-9]的研究结果,且下调UBE3A表达后的乳腺癌细胞与对照组相比较,多的处于S期,即DNA合成期。换言之,下调UBE3A的细胞无法正常进入分裂期,从而显示出较低的增值能力。同时在Transwell小室侵袭实验中显示,下调UBE3A表达后,细胞的侵袭能力降低。这可能是因为UBE3A作为UPS中关键酶之一降解细胞周期相关的的蛋白,参与了基因的调控,抑制了DNA的合成,从而使下调UBE3A后的乳腺癌细胞较多的处于S期,显示出较低的增值能力[21-22];还可能是因为下调UBE3A后乳腺癌细胞内某些信号通路发生改变[23-24],或者某些抑癌基因未受到UBE3A介导的蛋白降解[5,21,25],致使乳腺癌细胞侵袭能力减弱。
总之,下调UBE3A表达后,三阴性乳腺癌细胞MDA-MB-231细胞的增殖能力、细胞周期以及细胞的侵袭能力等生物学行为发生变化,提示UBE3A在三阴性乳腺癌细胞中扮演着重要角色,其可能是三阴性乳腺癌治疗的一个潜在靶标。当然其具体参与机制还有待进一步的研究。
下调UBE3A表达后,三阴性乳腺癌细胞MDAMB-231的增殖能力降低、侵袭能力降低以及细胞周期发生变化,提示UBE3A在三阴性乳腺癌细胞中扮演着重要角色,其可能是乳腺癌治疗的一个潜在靶标。
[1] Shi D, Grossman SR. Ubiquitin becomes ubiquitous in cancer:emerging roles of ubiquitin ligases and deubiquitinases in tumorigenesis and as therapeutic targets[J]. Cancer Biol Ther, 2010,10(8):737–747.
[2] Meiners S, Evankovich J, Mallampalli RK. The ubiquitin proteasome system as a potential therapeutic target for systemic sclerosis[J]. Transl Res, 2018, 198:17–28. doi: 10.1016/j.trsl.2018.03.003.
[3] Soave CL, Guerin T, Liu J, et al. Targeting the ubiquitin-proteasome system for cancer treatment: discovering novel inhibitors from nature and drug repurposing[J]. Cancer Metastasis Rev, 2017,36(4):717–736. doi: 10.1007/s10555–017–9705-x.
[4] Hyer ML, Milhollen MA, Ciavarri J, et al. A small-molecule inhibitor of the ubiquitin activating enzyme for cancer treatment[J].Nat Med, 2018, 24(2):186–193. doi: 10.1038/nm.4474.
[5] Deng S, Zhou H, Xiong R, et al. Over-expression of genes and proteins of ubiquitin specific peptidases (USPs) and proteasome subunits (PSs) in breast cancer tissue observed by the methods of RFDD-PCR and proteomics[J]. Breast Cancer Research and Treatment, 2007, 104(1):21–30. doi: 10.1007/s10549–006–9393–7.
[6] Deng S, Wang J, Hou L, et al. Annexin A1, A2, A4 and A5 play important roles in breast cancer, pancreatic cancer and laryngeal carcinoma, alone and/or synergistically [J]. Oncology Letters, 2012,5(1):107–112. doi: 10.3892/ol.2012.959.
[7] Zhou X, Deng S, Liu H, et al. Knockdown of ubiquitin protein ligase E3A affects proliferation and invasion, and induces apoptosis of breast cancer cells through regulation of annexin A2[J].Molecular Medicine Reports, 2015, 12(1):1107–1113. doi: 10.3892/mmr.2015.3549.
[8] 侯令密, 谢少利, 陈茂山, 等. E6-AP基因在乳腺癌MDAMB-231细胞中调节膜联蛋白A2的表达[J]. 中华乳腺病杂志:电子版, 2016, 10(6):326–332. doi:10.3877/cma.j.issn.1674–0807.2016.06.002.Hou LM, Xie SL, Chen MS, et al. E6-AP gene regulates Annexin A2 expression in breast cancer MDA-MB-231 cells[J]. Chinese Journal of Breast Disease: Electronic Version, 2016, 10(6):326–332.doi:10.3877/cma.j.issn.1674–0807.2016.06.002.
[9] 侯令密, 谢少利, 陈茂山, 等. E6相关蛋白调节膜联蛋白A2的表达对三阴性乳腺癌裸鼠移植瘤的影响[J]. 中华妇幼临床医学杂志: 电子版, 2016, 12(3):274–279. doi:10.3877/cma.j.issn.1673–5250.2016.03.005.Hou LM, Xie SL, Chen MS, et al. Influence of annexin A2 expression regulated by E6-associated protein on trip-negative breast cancer in nude mouse with transplantation tumor[J].Chinese Journal of Obstetrics & Gynecology and Pediatrics:Electronic Edition, 2016, 12(3):274–279. doi:10.3877/cma.j.issn.1673–5250.2016.03.005.
[10] Weathington NM, Mallampalli RK. Emerging therapies targeting the ubiquitin proteasome system in cancer[J]. J Clin Invest, 2014,124(1):6–12. doi: 10.1172/JCI71602.
[11] Singhmar P, Kumar A. Angelman syndrome protein UBE3A interacts with primary microcephaly protein ASPM, localizes to centrosomes and regulates chromosome segregation[J]. PLoS One,2011, 6(5):e20397. doi: 10.1371/journal.pone.0020397.
[12] Greer PL, Hanayama R, Bloodgood BL, et al. The Angelman Syndrome protein Ube3A regulates synapse development by ubiquitinating arc[J]. Cell, 2010, 140(5):704–716. doi: 10.1016/j.cell.2010.01.026.
[13] Krishnan V, Stoppel DC, Nong Y, et al. Autism gene Ube3a and seizures impair sociability by repressing VTA Cbln1[J]. Nature,2017, 543(7646):507–512. doi: 10.1038/nature21678.
[14] Ben Khalifa Y, Teissier S, Tan MK, et al. The human papillomavirus E6 oncogene represses a cell adhesion pathway and disrupts focal adhesion through degradation of TAp63β upon transformation[J].PLoS Pathog, 2011, 7(9):e1002256. doi: 10.1371/journal.ppat.1002256.
[15] Srinivasan S, Nawaz Z. E3 ubiquitin protein ligase, E6-associated protein (E6-AP) regulates PI3K-Akt signaling and prostate cell growth [J]. Biochim Biophys Acta, 2011, 1809(2):119–127. doi:10.1016/j.bbagrm.2010.08.011.
[16] Teissier S, Ben Khalifa Y, Mori M, et al. A new E6/P63 pathway,together with a strong E7/E2F mitotic pathway, modulates the transcriptome in cervical cancer cells[J]. J Virol, 2007,81(17):9368–9376. doi: 10.1128/JVI.00427–07.
[17] Nasu J, Murakami K, Miyagawa S, et al. E6AP ubiquitin ligase mediates ubiquitin-dependent degradation of peroxiredoxin 1[J]. J Cell Biochem, 2010, 111(3):676–685. doi: 10.1002/jcb.22752.
[18] Munakata T, Liang Y, Kim S, et al. Hepatitis C virus induces E6AP-dependent degradation of the retinoblastoma protein[J].PLoS Pathogens, 2007, 3(9):1335–1347. doi: 10.1371/journal.ppat.0030139.
[19] Kohli S, Bhardwaj A, Kumari R, et al. SIRT6 Is a Target of Regulation by UBE3A That Contributes to Liver Tumorigenesis in an ANXA2-Dependent Manner[J]. Cancer Res, 2018, 78(3):645–658. doi: 10.1158/0008–5472.CAN-17–1692.
[20] Santarosa M, Del Col L, Viel A, et al. BRCA1 modulates the expression of hnRNPA2B1 and KHSRP[J]. Cell Cycle, 2010,9(23):4666–4673. doi: 10.4161/cc.9.23.14022.
[21] Li Y, Huang J, Zeng B, et al. PSMD2 regulates breast cancer cell proliferation and cell cycle progression by modulating p21 and p27 proteasomal degradation[J]. Cancer Lett, 2018, 430:109–122. doi:10.1016/j.canlet.2018.05.018.
[22] Raghu D, Paul PJ, Gulati T, et al. E6AP promotes prostate cancer by reducing p27 expression[J]. Oncotarget, 2017, 8(26):42939–42948.doi: 10.18632/oncotarget.17224.
[23] Martínez-Noël G, Luck K, Kühnle S, et al. Network Analysis of UBE3A/E6AP-Associated Proteins Provides Connections to Several Distinct Cellular Processes[J]. J Mol Biol, 2018, 430(7):1024–1050.doi: 10.1016/j.jmb.2018.01.021.
[24] Wu JS, Zhang PM, Sun LJ, et al. Liguisticum wallichii inhibits renal carcinoma progression by downregulating UBE3A and through suppression of NF‐κB signaling[J]. Genet Mol Res, 2016,15(4). doi: 10.4238/gmr15049023.
[25] Sailer C, Offensperger F, Julier A, et al. Structural dynamics of the E6AP/UBE3A-E6-p53 enzyme-substrate complex[J]. Nat Commun,2018, 9(1):4441. doi: 10.1038/s41467–018–06953–0.
