胰腺癌常指胰腺导管腺癌,占胰腺恶性肿瘤的95%以上,其世界各地发病率呈上升趋势,病死率预计将在2030年位居西方国家所有恶性肿瘤的第二位[1-2]。美国胰腺癌新发病例数从2009年的42 470例上升到2017年的53 670例,相应的年发病率从约10/l0万上升到约12.6/10万[3-4];日本国家癌症中心预计2017年日本胰腺癌新发病例数为39 800,致死病例数为34 100[5];韩国胰腺癌年发病率及病死率分别为11.7/10万和10.1/10万[6];中国男性胰腺癌年发病率从2000年的约6/10万上升到2011年的约7/10万,相应的病死率从约7/10万上升到约8/10万[7]。由于缺乏有效的辅助治疗措施,手术切除仍是目前胰腺癌唯一可能达到治愈的治疗手段[8]。近几十年来,胰腺癌的外科治疗取得了长足的进步,胰腺癌围手术期病死率和术后并发症发生率均有显著下降,但是,胰腺癌由于特殊的解剖部位以及它的肿瘤生物学行为:一方面,胰腺癌的浸润性生长使其容易侵犯周围的器官和血管;另一方面,胰腺癌的亲神经性和胰周极为丰富的淋巴管决定了其较早的神经侵犯和淋巴结转移,因此其总体手术切除率和远期生存率的提高并不明显[9]。在过去100多年胰腺癌外科发展的历程中,为了提高切除率,改善远期疗效,许多学者对胰腺肿瘤进行了各种手术探索。目前人们已充分认识到,虽然胰腺癌R0手术切除至关重要,但他的生物学行为是决定预后最重要的因素。近年来,随着人类大规模基因组测序技术的飞速发展,对胰腺癌进行了全基因组测序,在此基础上提出了胰腺癌的分子病理分型,为深入研究胰腺癌的临床生物学行为,进而改善其治疗现状带来了曙光。胰腺癌新辅助治疗的研究虽已悄然超越手术成为当下该领域的热点,但目前其在胰腺癌治疗中的作用仍不十分明确。本文对胰腺癌外科治疗的历史和现状进行简要的回顾分析。
1 Whippe手术发展的3个阶段
1.1 Whipple手术原形的出现
1880—1935年是Whipple手术原型出现的阶段。许多杰出的外科医生为之作出了重要贡献。1882年,德国外科医生Friedrich Trendelenburg(图1)为1例患胰尾部梭形细胞肉瘤的44岁女性患者施行了胰腺远端切除术(distal pancreatonectomy),切除胰尾部肿瘤,缝合结扎胰腺近端,术中因损伤脾脏而行脾脏切除。患者术后出现切口感染并继发恶病质,2周后死于肺部感染所致的急性呼吸衰竭[10],这是世界首例胰腺手术。

图1 德国著名外科医生Friedrich Trendelenburg(1844—1924)
Figure 1 Famous German surgeon Friedrich Trendelenburg(1844–1924)
1884年,伟大的世界外科学先驱和奠基人,德国Billroth教授从手术的角度成功实施了世界第1例全胰切除术,但他的手术方式鲜有后继者。1898年,Alessandro Codivilla对胰头癌行胰头和十二指肠整块切除,胃幽门及胰腺断端缝合,胆总管末端结扎,胃空肠吻合及胆囊空肠吻合(图2)。患者术后存活了24个月。该手术被认为是第一次对胰头部病变行了真正意义上胰十二指肠切除术[11]。
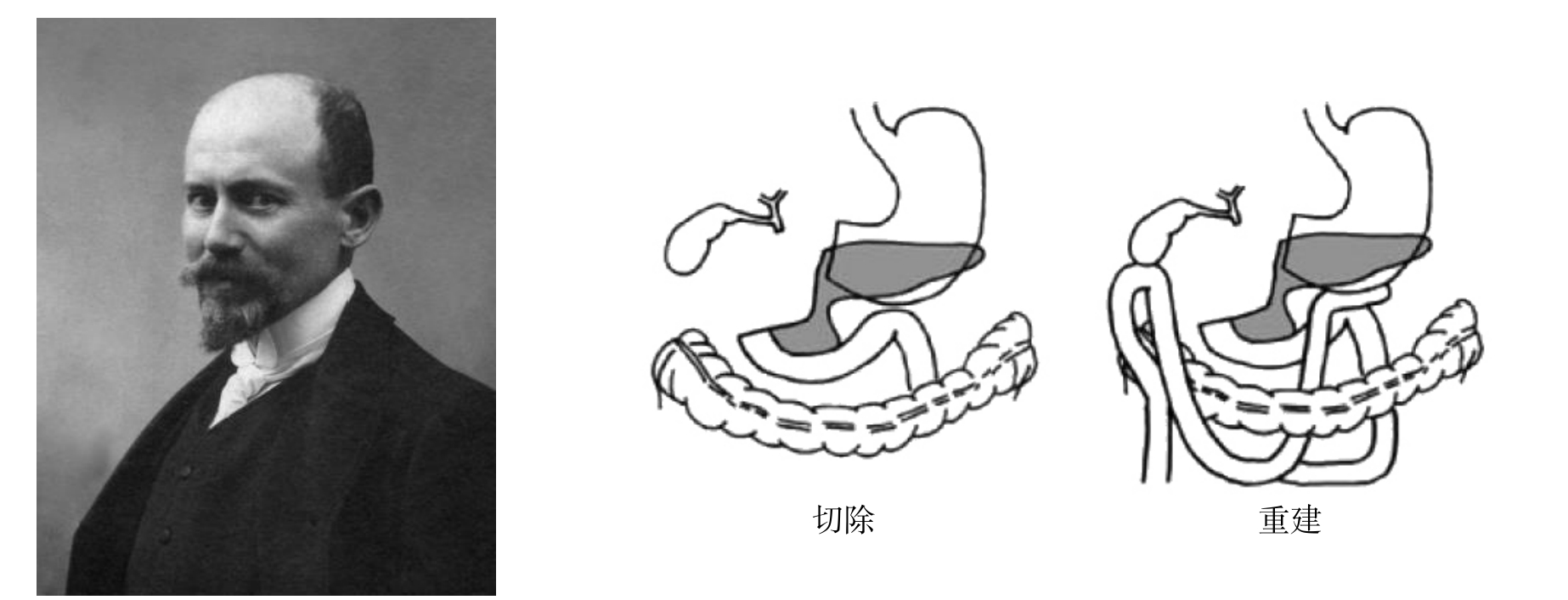
图2 意大利外科医生Alessandro Codivilla(1861—1912)及其实施的胰十二指肠切除术
Figure 2 Italian surgeon Alessandro Codivilla (1861–1912) and his pancreaticoduodenectomy
1909年德国外科医生Walther Kausch对1例壶腹部癌成功实施首例部分胰十二指肠切除术,手术分为二期,一期行胆囊空肠吻合,2个月后行二期切除术,胃空肠吻合术,用十二指肠的第三段和胰腺残端吻合(图3)。患者术后9个月死于胆管炎。
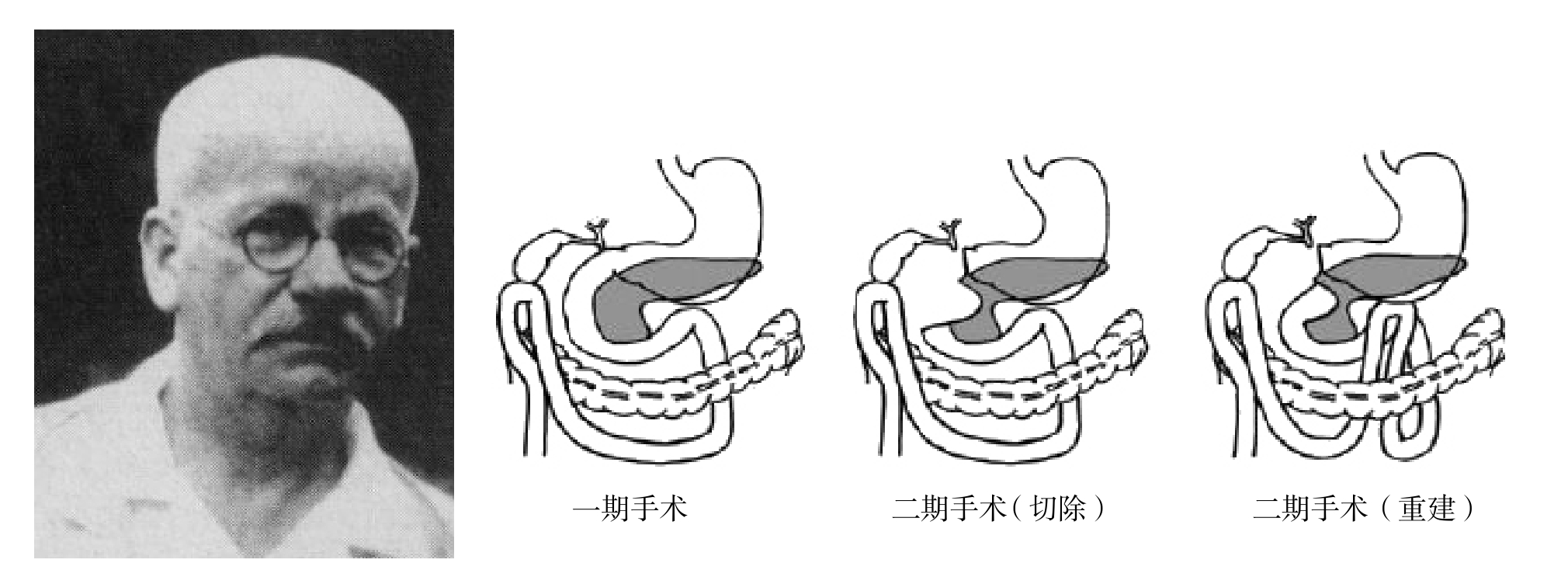
图3 德国外科医生Walther Kausch(1867—1928)及其实施的胰十二指肠切除术
Figure 3 German surgeon Walther Kausch (1867–1928) and his pancreaticoduodenectomy
1912年德国外科医生Georg Hirschel对1例壶腹部癌成功实施了世界首例一步法部分胰十二指肠手术。该手术方法虽与Kausch的相似,但其在恢复胰十二指肠连续性上进行了改良,术中探查发现化脓性胆管炎(图4)。患者术后存活1年[10]。
1910年美国约翰·霍普金斯医院外科医生Finney[12]报道了胰体良性肿瘤切除术,切除胰体后行胰头和胰尾吻合,术中保留的胰腺约一个核桃大小,同时用碘仿纱条行烟卷引流,患者术后并发胰瘘,持续约3个月,之后逐渐康复出院。该病例报告后,胰腺手术的可行性开始引起美国外科医生的重视。并在一定程度上为今天广泛使用的Whipple手术的出现提供了临床证据支持。之后的20年间虽有关于胰腺手术的文献报道,但有关胰头和壶腹部肿瘤的正确手术方式依然没有出现。一方面,当时的外科医生对胰腺生理作用缺乏应有的认识,又对术后吻合口瘘的危害估计不足,导致所尝试的术式疗效甚微;另一方面,多数外科医生不论手术方式如何均试图通过一步法切除肿瘤,忽略了患者通常伴有严重的肝功能损害而不能耐受手术的问题。直到1935年,在前人手术探索的基础上,Whipple等[13]对壶腹癌一期行胆囊胃吻合,胆总管远端结扎切断及胃空肠吻合(图5),改善患者肝功能。30 d后行二期手术,切除胰头大部和十二指肠,缝合闭锁十二指肠断端及胰腺断端,患者术后28个月死于肝转移。这种手术方式意味着胰头癌切除术时代的到来。被认为是后来标准胰十二指肠切除术的原形。为了纪念Whipple,胰十二指肠切除术又称为Whipple手术,并逐渐成为治疗胰头癌的标准术式。
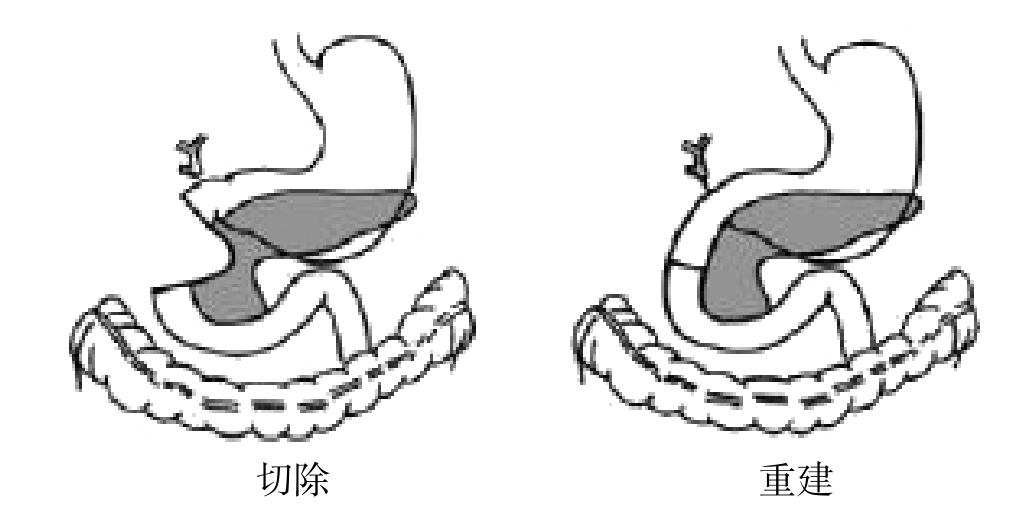
图4 Georg Hirschel医生实施的首例一步法胰十二指肠切除术
Figure 4 The first one-step pancreaticoduodenectomy by Georg Hirschel
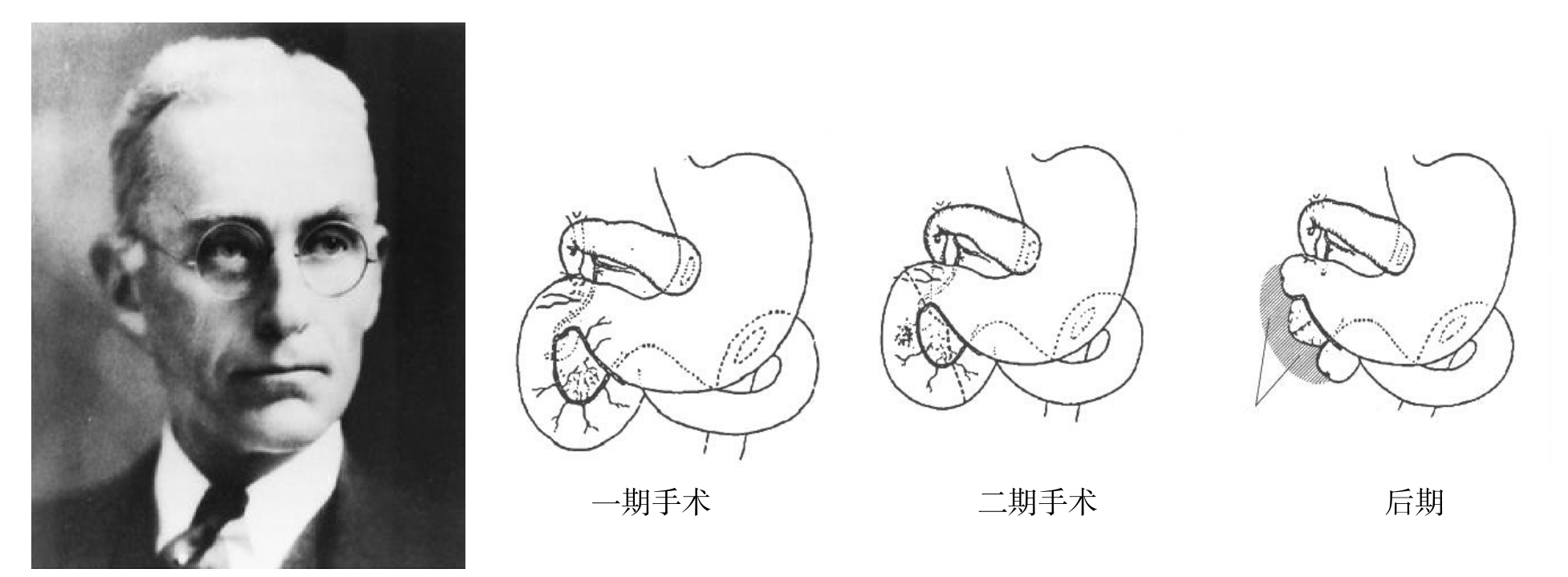
图5 美国著名外科学家Allen Oldfather Whipple(1881—1963)与其最初的Whipple术式
Figure 5 Outstanding American surgeon Allen Oldfather Whipple (1881–1963) and his first Whipple’s procedure
1.2 Whipple手术的初步完善
1935—1960年是Whipple手术初步完善阶段。1935年Whipple对其手术方式进行报告之后,许多杰出的外科医生对该术式的完善和发展作出了贡献,其中主要的贡献者有Mann等[14],Warren等 [15], Priestley等[16],Hunt[17], Zinninger[18]。1938年,Whipple改良术式:一期行胆总管结扎,胆囊空肠Roux-en-Y吻合;二期行胰头和十二指肠切除,胃后壁与空肠吻合,空肠断端及胰腺断端缝合闭锁[19](图6A)。1940年,Whipple[20]提出一步法胰十二指肠切除术:先切除远端胃、十二指肠、胰头、远端胆总管,再行胃空肠吻合和胆总管空肠吻合,最后缝合闭锁空肠断端及胰腺断端(图6B)。患者术后存活9年。1942年Whipple[21]再次改良术式:切除远端胃、十二指肠、胰头、远端胆总管后,胆总管与空肠残端行端端吻合,胃残端与空肠壁行端侧吻合,胰腺残端与空肠壁行端侧吻合(图6C)。1944年Child[22]改良Whipple的术式:将空肠断端上提和胰腺断端吻合,在其下方行胆总管空肠端侧吻合及胃空肠端侧吻合(图6D),即现在的Child法。由于Child法重建消化道较为合理,逐渐为国内外众学者接受并广泛应用于临床。1946年,Whipple[21]行胰管空肠吻合时,向胰管内插入1枚短橡皮管,在空肠上开以5 mm小孔并将橡皮管插入空肠内,然后用丝线缝合胰断端与空肠,即现在的Whipple法。1953年4月,中国现代外科学先驱余文光等[23]在杭州广济医院(后为浙医大二院)进行了我国首例胰头癌Whipple手术(图6D)。文题为“胰腺头部癌:一期胰十二指肠切除术病例报告”1954年发表于《中华外科杂志》。
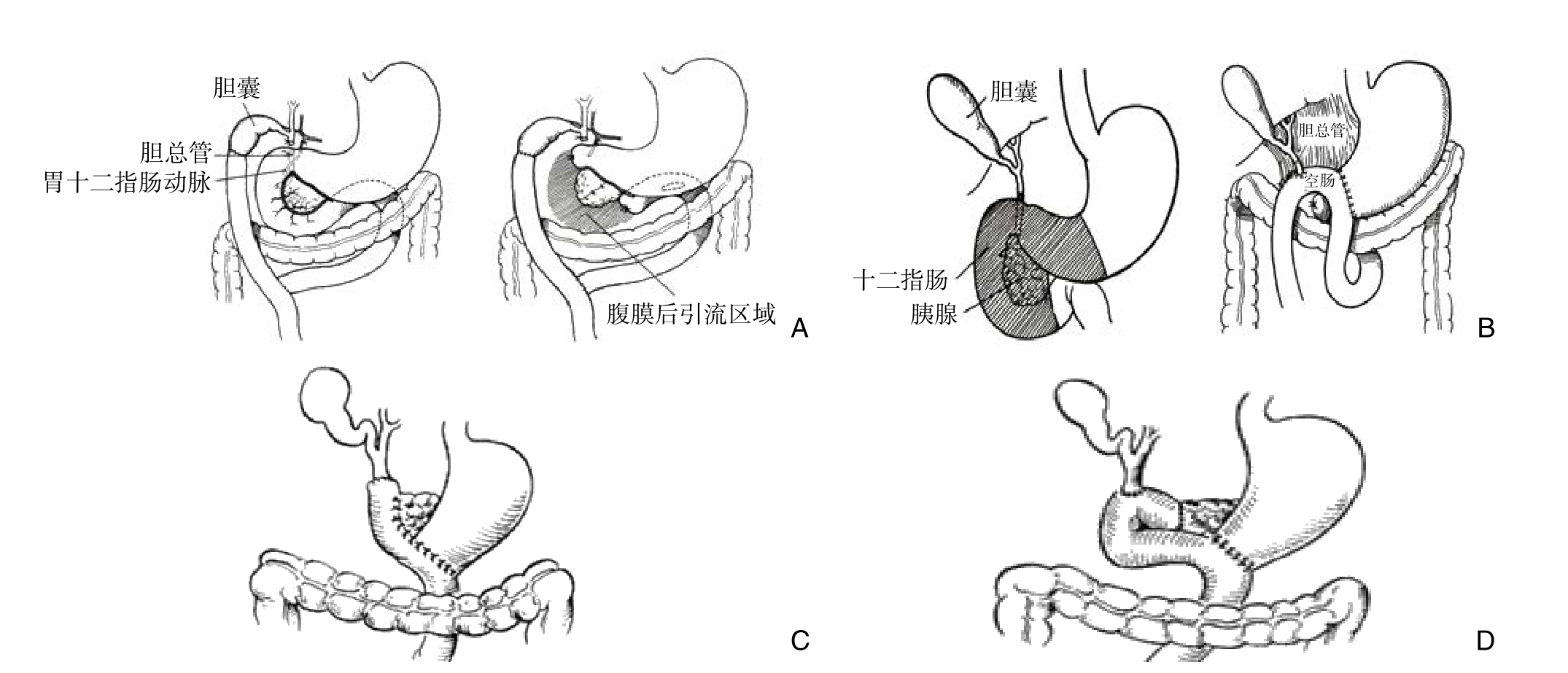
图6 Whipple手术的改良 A:术式1;B:术式2;C:术式3;D:术式4
Figure 6 Improvement of Whipple’s procedure A: Procedure 1; B: Procedure 2; C: Procedure 3; D: Procedure 4
1.3 Whipple手术的标准化
从1970年至今是Whipple手术逐步标准化阶段。1935年Whipple手术出现后几十年的临床实践表明,该术式仅能使少部分胰腺及壶腹周围良性疾病获益[24],而对胰腺癌的疗效甚微。这主要是因为当时Whipple手术切除范围较小,术中切除肿瘤后仅对胰周淋巴结进行处理,忽略了胰腺癌早期淋巴结转移和神经侵犯的问题。因此,为了提高胰腺癌手术疗效,部分学者开始尝试扩大手术切除范围的扩大切除术,提出了区域性胰腺切除术和“经后腹膜途径”的胰腺扩大切除术。区域性胰腺切除术由美国学者Fortner[25]于1973年提出,其根据是否联合血管切除将术式分为3型:0型为不联合血管切除;I型为联合肠系膜上静脉或门静脉切除;II型为联合腹腔干、肝动脉或肠系膜上动脉切除。“经后腹膜途径”的胰腺扩大切除术由日本学者永川宅和于1977年提出,其术式特点是:广范围的腹膜后廓清,防止胰腺后方的癌残留;腹主动脉周围的淋巴结廓清;完全廓清胰头神经丛,肠系膜上动脉和腹腔动脉神经丛;合并门静脉切除。受上述扩大切除术理念影响,各国学者相继开展了多种扩大切除术,包括扩大淋巴结清扫术、胰头神经丛及腹腔神经丛切除术、联合门静脉及肠系膜上动静脉切除术等。由于不同国家和地区对“扩大”概念的理解有别,因此对扩大切除的青睐程度不同,日本尤为热衷,欧美等国则持保守态度。为了规范胰腺手术切除范围,日本胰脏病研究会于1980年制订了全国统一的胰腺癌处理规约,把胰周淋巴结分为18组, 根据肿瘤不同部位,将18组淋巴结分为第1、2、3站,手术时要求在第1、2站淋巴结廓清的基础上,适当廓清第3站淋巴结[26]。与之前Whipple手术只清扫第1站淋巴结相比,上世纪80~90年代日本的胰腺癌手术均完成了第2站淋巴结的清扫,故又称为D2切除术。早期日本学者的研究结果多支持扩大淋巴结切除术对患者的长期生存有益。1988年,Ischikawa等[27]对1971—1983年间59例胰头癌患者的临床资料进行了回顾性分析,其中37例行标准清扫术,22例行扩大清扫术(D3切除术),结果显示,两组的3年生存率分别为13%和38%,研究结果支持扩大淋巴结清扫有益于患者生存率的提高。1989年Manabe等[28]的研究同样表明,与标准清扫组相比,扩大淋巴结切除能显著延长胰腺癌患者的生存时间。1996年Ischikawa[29]再次报告了62例胰头癌患者的临床研究资料,结果表明,扩大手术组1、3、5年的生存率分别为56%、35%、26%,标准手术组分别为39%、10%、8%;两者比较差异有统计学意义。鉴于日本学者的研究结果,越来越多的学者开始研究扩大淋巴结清扫的胰腺手术,但日本学者的临床研究结果未能在其他国家和地区得到重复。1989年美国国家癌症研究院通过分析20例行区域性胰腺切除术的胰腺癌患者的临床资料发现,与标准胰十二指肠切除术相比,扩大切除术具有更高的术后并发症率(55.0%)和病死率(20.0%)[30]。1998年,Pedrazzoli等[31]复制了Ishikawa等[27]的手术设计,对81例胰头癌患者的临床资料进行随机对照研究,其中41例行扩大淋巴结清扫术,清扫至第3站淋巴结,40例行标准胰十二指肠切除术,研究结果发现,两组的并发症发生率、病死率和长期生存率差异均无统计学意义。由于当时不同国家和地区进行的扩大切除术的名称及选择的切除范围不全相同,导致其研究结果大相径庭,因此急需对世界范围内的胰腺手术进行规范。为了解决胰腺手术名称与切除范围混乱的问题,以便各研究间疗效比较有一个统一的标准,1998年5月30日在意大利威托尼举办的胰腺癌治疗共识研讨会上,由来自欧洲不同国家29名外科医生和病理医生组成的国际胰腺专家组认为,胰腺癌手术治疗的规范化不但有利于随机对照研究的开展,而且还能提高不同研究间比较结果的可信度[32]。本次共识按日本胰腺协会(Japanese pancreas society,JPS)1993年第4版淋巴结分组(图7)设计手术:胰头癌手术方式分为标准胰十二指肠切除术(standard pancreatoduodenectomy,S P D)、根治性胰十二指肠切除术(radical pancreatoduodenectomy,RPD)和扩大根治性胰十二指肠切除术(extended radical pancreatoduodenectomy,ERPD)3种。胰体尾癌手术方式分为标准左侧胰腺切除术(standard left pancreatectomy,SLP)和根治性左侧胰腺切除术(radical left pancreatectomy,RLP)2种。胰头癌3种术式共有的方法包括:胆囊切除,胆总管切断,横断胰腺,切断屈氏韧带,行保留幽门或传统Whipple手术;3种术式中淋巴结清扫范围见表1。胰体尾癌两种术式均在门静脉/肠系膜上静脉右侧横断胰腺,切除胰体尾和脾脏;两种术式中淋巴结清扫范围见表2。这次会议可以看作是胰腺癌手术标准化的开始。
此次会议后,虽各国并不完全参照此标准执行,但其在胰腺癌手术规范化形成过程中具有重要意义。1998年Mukaiya 等分析了日本1991—1994年间460例胰腺癌患者的临床资料,其中标准清扫167例,扩大清扫293例,R0、R1、R2切除组的3年总体生存率分别为29%、14%、6%,与国际上标准手术的临床效果近似。2000 年,Henne等[33]报告了72例胰头癌患者的临床资料,其中46例行扩大淋巴结清扫术,26例行标准手术;结果显示,扩大淋巴结清扫术未能显著延长患者的生存时间。基于上述研究,越来越多的日本学者认识到胰腺癌手术规范化的必要性和重要性,并认为其有助于R0切除率的提高[34]。JPS也于2003版的胰腺癌TNM分期系统中对胰周淋巴结分站进行了修改,将第9组(腹腔动脉干)、第15组(结肠中动脉)及第16组(腹主动脉旁)淋巴结由原来的第2站重新界定为第3站。相应的,之前认为的D2切除被界定为D3切除,并认可第3站淋巴结转移可视为远处转移,行手术切除意义不大。并推荐在临床实践中对胰腺癌行规范化手术切除。最近JPS第7版(2016)胰腺癌TNM分期系统中明确将第3站淋巴结归为M1期,如术前或术中病理检查结果证实有第3站淋巴结转移,则不建议行切除手术。规范化的胰十二指肠切除术从提出到现在已有约20年的时间,其中不乏多次修改和完善,目前,国际胰腺研究小组胰腺癌诊疗指南[35],JPS第七版胰腺癌诊疗指南[36]和2014版中国胰腺癌诊疗指南[37]中标准胰腺手术淋巴结清扫范围见表3,中国胰腺癌诊疗指南淋巴结分组见图8。
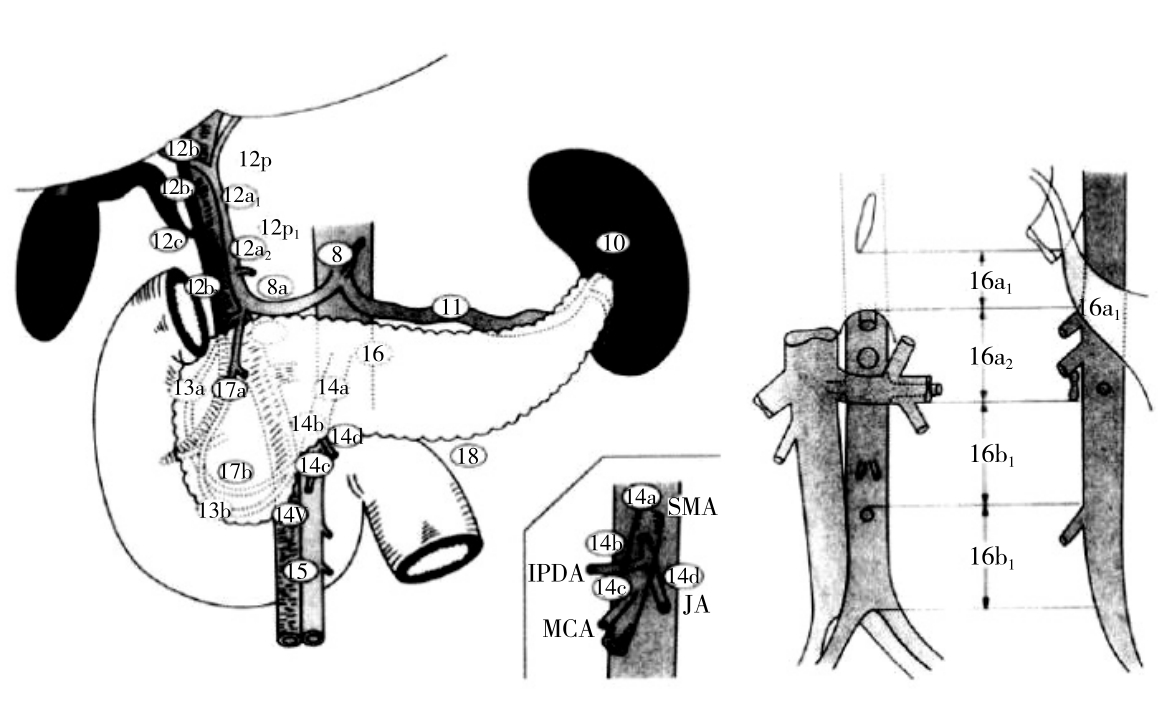
图7 JPS胰周淋巴结分组(第四版,1993)
Figure 7 JPS classification of peripancreatic lymph node stations (the 4th edition, 1993)
1~6:胃周; 7:胃左动脉周围;8:肝固有动脉周围(8a:前上方;8p:后方);9:腹腔干周围;10:脾门;11:动脉周围;12:肝十二指肠韧带中(12h, 肝门;12a1:肝动脉上半部分;12a2:肝动脉下半部分;12b1:胆管上端;12b2:胆管下端;12p1:门静脉后上;12p2:门静脉后下;12c:胆囊管);13:胰十二指肠后(13a:壶腹部以上;13b:壶腹部以下);14:肠系膜上动脉周围(14a:肠系膜上动脉根部;14b:胰十二指肠下动脉根部;14c:结肠中动脉根部;14d:空肠动脉的第一条分支处);15:结肠中动脉;16:主动脉旁(16a1:膈肌的主动脉裂孔周围;16a2:从腹腔干上缘到左肾静脉下缘;16b1:从左肾静脉下缘到肠系膜下动脉上缘;16b2:肠系膜下动脉上缘至髂总动脉分叉处);17:胰十二指肠前(17a:壶腹部以上;17b:壶腹部以下);18:胰体尾下缘
表1 胰头癌3种术式的淋巴结清扫范围
Table 1 Scopes of lymph node dissection of three types of procedures for pancreatic head cancer
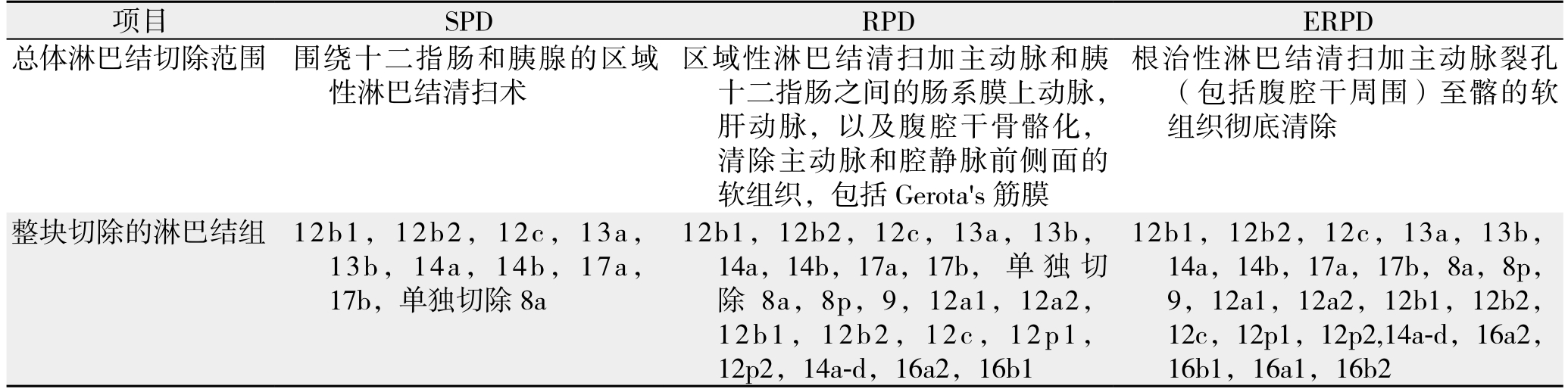
项目 SPD RPD ERPD总体淋巴结切除范围 围绕十二指肠和胰腺的区域性淋巴结清扫术区域性淋巴结清扫加主动脉和胰十二指肠之间的肠系膜上动脉,肝动脉,以及腹腔干骨骼化,清除主动脉和腔静脉前侧面的软组织,包括Gerota's筋膜根治性淋巴结清扫加主动脉裂孔(包括腹腔干周围)至髂的软组织彻底清除整块切除的淋巴结组 12b1,12b2,12c,13a,13b,14a,14b,17a,17b,单独切除8a 12b1,12b2,12c,13a,13b,14a,14b,17a,17b, 单 独 切除 8a,8p,9,12a1,12a2,12b1,12b2,12c,12p1,12p2,14a-d,16a2,16b1 12b1,12b2,12c,13a,13b,14a,14b,17a,17b,8a,8p,9,12a1,12a2,12b1,12b2,12c,12p1,12p2,14a-d,16a2,16b1,16a1,16b2
表2 胰体尾癌2种术式的淋巴结清扫范围
Table 2 Scopes of lymph node dissection of two types of procedures for pancreatic tail cancer

?
中国胰腺癌手术规范化最早由钟守先和赵玉沛在2003年第2届中国外科周胰腺外科会议上提出倡议(统一胰头癌根治术名称,规范切除范围),随后在2004年中华医学会10届全国胰腺外科学术研讨会上开始征求意见稿[38]。这标志着中国外科医生开始探索适合中国的规范化胰腺癌切除手术。
表3 不同指南标准胰腺手术中淋巴结清扫范围
Table 3 Scopes of lymph node dissection of pancreatic surgery according to different guidelines

指南 胰十二指肠切除 胰体尾切除国际胰腺研究小组 5,6,8a,12b1,12b2,12c,13a,13b,14a,14b,17a,17b 10,11p,11d,18日本胰腺协会 1,2,3,4,5,6,7,8a,8p,9,10,11p,11d,12a,12b,12p,13a,13b,14p,14d,15,16a2,16b1,17a,17b,18 5,6,7,8a,8p,9,10,11p,11d,12a,12b,12p,13a,13b,14p,14d,15,16a2,16b1,17a,17b,18中华医学会 5,6,8a,12bl,12b2,12c,13a-b,14a-b,17a-b 10,11,18

图8 中国胰腺癌诊治指南胰周淋巴结分组(2014)
Figure 8 Classification of peripancreatic lymph node stations of Chinese guidelines for diagnosis and treatment of pancreatic cancer(2014)
5:幽门上淋巴结;6:幽门下淋巴结;7:胃左动脉旁淋巴结;8a:肝总动脉上前淋巴结;8p:肝总动脉后方淋巴结;9:腹腔动脉干周围淋巴结;10:脾门淋巴结;11p:脾动脉近侧旁淋巴结;11d:脾动脉远侧旁淋巴结;12a:肝动脉旁淋巴结;12p:门静脉旁淋巴结;12b:胆总管旁淋巴结;12c:胆囊管周围淋巴结;13a:胰头背侧上缘淋巴结;13b:胰头背侧下缘淋巴结;14a-b:肠系膜上动脉右侧淋巴结;14d-c:肠系膜上动脉左后侧淋巴结;15:结肠中动脉旁淋巴结;16:腹主动脉周围淋巴结;17a:胰头腹侧上缘淋巴结;17b:胰头腹侧下缘淋巴结;18:胰腺下缘淋巴结
2 扩大的Whipple手术
2.1 扩大淋巴结清扫术
基于过去40多年的研究结果,目前,关于胰十二指肠切除术中是否行扩大淋巴结清扫的问题已争议不多。事实上,1973年Fortner提出区域性胰腺切除术的概念后,以日本外科医生为主的部分学者便开始探索扩大淋巴结清扫的胰十二指肠切除术。他们在其他肿瘤切除术(如胃癌D3切除术)的基础上提出胰腺手术中“根治性淋巴结切除术”的概念[39]。
胰腺癌早期即有淋巴结转移和周围神经侵犯,而传统胰十二指肠切除术通常只处理胰周淋巴结,造成胰腺癌手术疗效低,扩大的淋巴结清扫术在理论上是合理的[40]。Nagai等[41]研究了8例早期胰腺癌的尸体标本发现4例T1期中2例已有淋巴结转移,4例T2期均已有淋巴结转移。Gebhardt等[42-43]的研究表明胰腺癌在肿瘤尚小,从大体观上仍局限于原发部位时,可能已经有了广泛的显微镜下淋巴结转移。早期日本学者的研究对扩大淋巴清扫多持肯定态度。Ishikawa[29]总结了1981—1993年开展的62例胰头癌患者的资料,其中扩大手术组1、3、5年的生存率分别为56%、35%、26%,标准手术组分别为39%、10%、8%;两者比较差异有统计学意义。鉴于日本学者报告的扩大淋巴结清扫在胰腺癌治疗中疗效较佳,越来越多的学者开始探索扩大淋巴结清扫的胰腺手术,但与日本学者报告的临床效果大相径庭。一方面日本学者的研究多来自单一机构,非多中心研究,另一方面,研究均为回顾性研究,非随机对照研究,可能存在组间可比性的问题。随后许多学者对该问题进行了前瞻性随机对照研究,但结果仍然不支持扩大淋巴结清扫对患者长期生存有益。Reddy等[44]对日本、意大利、美国霍普金斯医院和梅奥医学中心4项前瞻性随机对照研究的结果进行Meta分析,标准清扫组与扩大清扫组相比,术后病死率无明显差异,扩大淋巴结清扫不能显著延长患者的生存期,而且扩大清扫组术后并发症率明显多于标准清扫组。因此认为, 胰腺癌扩大淋巴结清扫术有可能提高早期胰腺癌患者的生存率,但对进展期患者做过度的淋巴结廓清仍有争议。韩国学者Jang等[45]报道了前瞻性随机对照试验,2006—2009年间的169例患者被随机分成标准切除组和扩大切除组,标准切除组中,切除的淋巴结包括:13、17、12b、12c。扩大切除组切除淋巴结包括:5、6、8、9,所有12、13、14a-d、16a2、16b1、17,同时切除腹腔干和肠系膜上动脉右半周神经丛;术后比较两组的临床资料发现,标准切除组和扩大切除组患者的R0切除率相似(85.5% vs. 90.7%),5年生存率无统计学差异(18.4% vs. 14.4%,P>0.05)。5年无瘤生存时间相似(14.8% vs.14.0%,P>0.05),总体复发率无统计学差异(74.7% vs. 69.9%,P>0.05)。因此不建议扩大淋巴结清扫术在胰腺癌手术中常规使用。随着扩大淋巴结清扫在胰腺癌中作用的研究不断深入,人们对其有了基本统一的认识,欧洲ESMO及日本胰腺协会认为,目前尚未发现支持扩大淋巴结清扫对胰腺癌有益的证据,并推荐NCCN指南建议行标准范围的淋巴结清扫[46]。2015年后的NCCN指南推荐:除临床研究外,建议对胰腺癌手术行标准的淋巴结清扫。腹主动脉旁、腹腔干周围及肠系膜上动脉左侧淋巴结的转移可视为远处转移(M1),不建议再行切除手术。在最新的国际胰腺研究小组(ISGPS)胰腺手术的共识中,标准清扫的范围包括:No.5(幽门上)、6(幽门下)、8a(肝总动脉)、12bl(肝十二指肠韧带内胆总管旁)、12b2(肝十二指肠韧带内胆总管旁)、12c(肝十二指肠韧带内胆囊管旁)、13a(胰头后上)、13b(胰头后下)、14a(肠系膜上动脉上)、14b(肠系膜上动脉右侧)、17a(胰头前上)和17b(胰头前下)。扩大清扫的范围是在上述基础上增加了No.14d-c(肠系膜上动脉左侧)、9(腹腔干)、11(脾动脉)或者7(胃左动脉旁)[47]。该共识可供今后扩大淋巴结清扫术研究参考。尽管如此,临床实践中仍不乏通过扩大清扫以试图改善预后的尝试。这些研究是否有新的发现我们拭目以待。
2.2 血管切除
2.2.1 静脉切除 由于解剖位置毗邻,胰头癌易侵犯门静脉系统,血管受累曾一度被列为胰腺癌手术的禁忌证,成为既往胰腺癌切除率低的主要原因之一,但随着自体和人工合成血管移植物的应用及手术技术的提高,胰十二指肠切除联合门静脉系统切除和重建的研究逐渐增多。胰十二指肠切除联合肠系膜上静脉或门静脉切除和重建的文献[48-49]报告最早分别出现在1951年和1963年,这是在血管切除仍是手术禁忌的时代背景下进行的一次大胆尝试。1973年Fortner[25]在区域性胰腺切除术中指出,联合血管切除不但能极大提高胰腺癌的切除率,而且其近期效果也优于传统Whipple手术。2008年Yekebas等[50]比较了1994—2005年胰腺癌联合静脉切除术和标准的肿瘤学切除共计585例患者的住院时间、并发症发生率、病死率、生活质量和总体生存率,发现两种手术方式的疗效无显著性差别。随后Heidelberg大学Müller等[51]也对2001—2007年110 例接受胰十二指肠联合静脉切除重建术胰头癌患者进行了回顾性分析,发现患者围手术期病死率3.6%,并发症率41.8%,1 、2、3年生存率分别为 55.2%、23.1%、14.4%,认为联合肠系膜上-门静脉切除重建术的安全性,并发症发生率和病死率是可以接受的。最近,Selvaggi等[52]进行了单中心前瞻性对照试验,比较了胰十二指肠联合静脉切除和胆肠和/或胃肠道旁路手术共计60例患者的术后生存时间,结果显示:胰十二指肠联合静脉切除的患者术后存活时间能延长1年,该手术方式安全可靠,术后并发症率可以接受,患者预后较好。目前,对于大型胰腺中心有经验的手术医生,处理胰腺癌时联合静脉切除可以被认为是标准的手术方式,已经被广泛接受并作为胰腺癌治疗指南的一部分。
2.2.2 动脉切除 世界上最早的胰腺联合动脉切除术是Appleby[53]于1953年实施的胰体尾联合腹腔干切除术。与静脉切除相比,动脉切除的使用范围明显较小,虽然目前只在交界性可切除的胰腺癌中推荐使用,但人们对其临床价值仍存争议。Christians等[54]对10例胰腺癌联合动脉切除(腹腔干,肝总动脉和/或胃左动脉)的病例进行了分析,结果显示:联合动脉切除的R0切除率可达85%,62%的患者术后中位生存时间达21个月,因此认为,在具有较好生物学特性的胰腺癌患者中实施胰十二指肠联合动脉切除的并发症率和病死率是可以接受的,该部分患者能从中延长术后生存时间。但更多的单中心报告[55-57]认为,动脉切除后患者的中位生存时间为12~20个月,病死率为30%~100%。这些研究的一个共同不足之处是样本量相对较少和切除的动脉不全相同,可能影响结果的一致性。
最近,约翰·霍普金斯大学的Natalia教授分析了35例胰十二指肠联合动脉切除的病例,其中3例行脾动脉切除,18例行肝动脉切除,8例行腹腔干切除,3例行中结肠动脉切除,2例行肠系膜上动脉切除,1例行左肾动脉切除。结果提示,两组患者在手术时间、术中出血量、住院时间、并发症发生率上均无显著性差异;但联合动脉切除的患者具有较低的术后复发率(20.0% vs.47.0%)和较短的中位生存时间[(22±18)个月vs.(49±7)个月],因此认为,动脉切除能降低术后肿瘤复发率,不增加并发症率,但显著缩短其中位生存期[58]。另一项针对肠系膜上动脉切除的研究来自曼彻斯特大学Santhalingam课题组,研究人员通过分析2000—2016年70例胰十二指肠联合肠系膜上动脉切除的病例,发现其围手术期病死率为39.0%~91.0%,中位生存时间仅为11个月,因此认为,没有证据证明联合肠系膜上动脉的胰十二指肠切除术是可取的[59]。虽然目前对胰十二指肠联合动脉切除的认识不一,但一般认为,联合动脉切除在技术上是安全的,一般的小动脉必须切除,胰腺癌侵及肠系膜上动脉或肝总动脉是动脉切除的禁忌证,因为这种情况常提示肿瘤已向周围广泛浸润,即使行联合动脉切除,其腹膜后切缘阳性率极高,而且并发症发生率也非常高。目前国内外多数学者不主张做联合动脉切除,但在选择性个体中,可以考虑使用以增加患者获得根治性切除的机会,改善预后。
2.3 联合脏器切除
目前,对于发生远处转移的晚期胰腺癌患者,已有的诊疗指南多建议行放化疗而不行手术切除。然而,随着近年来手术技术安全性的增加,手术相关病死率已降至5%以下[60]。有关晚期胰腺癌患者行胰腺癌联合多脏器切除的研究也逐渐得到外科医生的青睐。胰腺癌转移灶切除的第1次文献报道出现在1982年Morrow等[61]有关癌转移灶切除系列性报告中的胰腺癌转移灶切除术。随后人们对于该领域的研究逐渐增多,Takamori等[62]1994年报告了首例胰腺癌(头、颈)联合肝转移灶切除的病例,Ko等和Shimada等[63-64]也分别于2001年和2004年发表了胰腺癌联合肝转移灶切除的病例报告。由于治疗方法和肿瘤组织学形态不同,这些研究并没有得出清晰的结论,但值得注意的是,这些研究的作者都建议,除了胰腺癌广泛转移外,应切除肝转移灶和受侵犯的腹腔脏器以增加患者长期生存的机会。Michalski等[65]系统分析了1982—2007年的21项研究中103例胰腺癌联合肝转移灶切除的病例,其得出的结论是在选择性患者(如肝功能正常的非弥散性肝转移灶,且不伴腹膜和其他部位转移灶)中行胰腺癌联合肝转移灶切除是可行的,因为其有较低的并发症发生率和病死率。与这项研究结果相似的是,Tachezy等[66]进行了回顾性多中心分析,比较了1994—2014年胰腺癌联合肝转移灶切除和行姑息性治疗共计138例患者的住院时间,并发症发生率、病死率和总体生存率,结果显示:在选择性患者中,胰腺癌联合肝转移灶切除能显著使患者生存获益,但该结论仍需前瞻性随机对照研究评估该联合切除的适应证和疗效证实。Crippa等[67]进行了另一项回归性分析,127例胰腺癌伴孤立性肝转移患者接受化疗后对部分患者行胰腺癌联合肝转移灶切除,结果表明:接受手术的患者的中位生存时间明显延长,预后改善。因此认为,胰腺癌联合孤立性肝转移灶切除可以在特定的患者中进行。Kruger等[68]关于胰腺癌肺转移的回顾性研究也有类似发现,其在进行了40例胰腺癌合并肺转移的研究分析后认为,与多发性或双侧肺转移相比,胰腺癌孤立性或单侧肺转移患者的预后较好,这可能与胰腺癌特定的分子类型有关。在最近的一项针对德国大型胰腺中心外科医生的调查中,44.2%的被调查者认为,在有可能实现R0切除时,即使在现有的临床指南不推荐的情况下也会进行胰腺癌联合癌转移灶的切除[69]。这在一定程度上说明了外科医生对胰腺癌联合多脏器切除的重视程度。 目前,人们对合并脏器转移的特定晚期胰腺癌患者实施胰腺癌联合癌转移灶的切除有了新的认识,对其疗效充满期待,但要达成共识需要前瞻性随机对照研究进一步证实。
3 胰腺癌分子病理分型
自1999年美国国立癌症研究所提出肿瘤分子分型的概念后,胰腺癌分子分型的研究在过去近20年间获得了较大的发展。随着研究技术的提高和样本量的增加,胰腺癌分子分型的研究得到了不断的补充和完善。2016年,长期从事胰腺癌分子分型研究的澳大利亚昆士兰大学分子生物研究所医学基因组学研究中心的研究人员报告了胰腺癌不同的分子亚型,把胰腺癌分子类型分为鳞癌(24%),胰腺原始肿瘤型(30%),内外分泌肿瘤的异常分化型(17%)和免疫原性亚型(29%)[70]。
该研究提示胰腺癌可能是四种独立疾病,拥有不同的生存率、治疗方法和遗传学特征[70]。胰腺癌的分子病理分型标志着人们对胰腺癌这种高度异质性肿瘤的认识深入,为未来新的治疗模式或方法奠定了新的分子病理基础,也为改善胰腺癌的治疗现状带来曙光。
4 新辅助治疗在胰腺癌治疗中的应用
新辅助的概念是相对于术后辅助治疗提出的,是指手术治疗前对恶性肿瘤给予化疗、放疗、或者同步放化疗,旨在提高手术的R0切除率,降低肿瘤复发率和延长生存期。1980年Pilepich 等[71]对17例可能切除或不可切除的胰腺癌患者先行术前放疗,评估疗效后,对11例行剖腹探查术发现,只有6例能行根治性手术切除。6例根治性手术患者中的2例5年后依然存活。这可被认为是最早的胰腺癌新辅助治疗。随后,Kopelson等[72]对5例胰腺癌患者术前行放疗后4例行手术切除,2例5年后依然存活。虽然之后有关胰腺癌术前治疗的研究逐渐增多,但均处于感性认识水平。直到1992年,Evans等[73]发现术前辅助治疗后行手术切除组患者的预后优于先行手术切除再行辅助治疗组,并率先提出胰腺癌术前辅助治疗的理念。
2017年最新版的NCCN指南中,根据术前多学科评估的肿瘤可切除状态将胰腺癌分为:可切除胰腺癌、可能切除胰腺癌、局部进展不可切除胰腺癌、转移性胰腺癌四类[74],而新辅助治疗的研究多集中于前三类胰腺癌中。
4.1 可切除胰腺癌
对可切除胰腺癌是否行新辅助治疗目前存在较大争议。Mokdad等[75]最近进行了一项倾向性匹配分析研究,比较了新辅助治疗+手术切除组2 005例胰头癌患者和直接手术组6 015例胰头癌患者的资料,发现直接手术组患者具有较高的病理分期(pT3-T4:86% vs. 73%)、阳性淋巴数(73% vs. 48%)和阳性切缘率(24% vs. 17%)。与直接手术+术后辅助性治疗组相比,新辅助治疗+手术切除组患者具有较长术后生存时间(26个月vs. 21个月)。认为,对于可切除性胰头癌患者,新辅助治疗+手术切除能使患者的生存时间显著延长,数据支持对可切除性胰腺癌行新辅助治疗后行手术切除。但也有反对者认为胰腺癌新辅助治疗的临床价值和意义不大,Gillen等[76]进行了一项Meta分析,比较了1996—2006年间的111项研究中的4 394例患者的临床资料,发现对于可切除性胰腺癌,新辅助治疗+手术切除组和直接手术组的手术切除率和总体生存率相似。可切除胰腺癌与不可切除胰腺癌行新辅助治疗后手术切除的并发症发生率(26.7% vs. 39.1%),病死率(3.9% vs. 7.1%)和2年生存率(49.2% vs. 50.1%)相比均无统计学差异。因此认为,没有证据支持新辅助治疗能使可切除性胰腺癌患者获益。近期的两项研究[77-78]也表明新辅助治疗不能提高手术切除率,同时对患者预后并无实际临床意义。因此,2016年在圣加仑举办的第三届胃肠道肿瘤会议上对可切除胰腺癌是否行新辅助治疗的问题达成共识,即没有证据支持新辅助治疗,应行直接手术切除[79]。虽然近年来已有国际知名医疗中心如麻省总医院等认可新辅助治疗在可切除胰腺癌中的作用,并在其临床诊治过程中进行尝试 但2017年第2版的胰腺癌NCCN指南对临床实验外该组患者仍不常规推荐新辅助治疗;除非具有高危因素(CA19-9显著升高、原发肿瘤较大、局部淋巴结转移、体质量过度减轻和极端疼痛)可以考虑行新辅助治疗,但需要在病理活检证实为胰腺癌的前提下进行[74]。
4.2 可能切除和不可切除胰腺癌
对于交界可切除的胰腺癌患者,最新的NCCN指南认为新辅助治疗优于即刻手术(证据级别2B)。由于不同研究使用的放化疗方案不全相同,现有研究的新辅助方案证据级别不高,因此不推荐特定的新辅助治疗方案。各诊疗机构新辅助治疗可以通过中心内部进行协调。而对于不可切除胰腺癌或远处转移的患者,新辅助治疗提供了改善预后的可能[74]。
Van等[80]报告的临床研究结果表明,新辅助治疗可明确提高可能切除和不可切除胰腺癌的总体生存率。Epelboym等[81]通过分析143例可能切除和不可切除胰腺癌患者新辅助治疗的临床资料,结果发现,新辅助治疗组R0切除率较高,中位生存时间明显延长(27.3个月vs. 19.7个月)。与该研究结果一致的是,日本学者Sano等[82]通过对2010—2014年间20例可能切除和不可切除胰腺癌患者的临床资料进行分析后认为,与姑息性放化疗组相比,新辅助治疗联合手术切除组的中位生存期明显延长(11.3个月vs. 25.2 个月)。
目前各中心使用新辅助放化疗方案主要是基于辅助治疗的经验,差异较大,常见的化疗方案包括FOLFIRINOX,吉西他滨单药、吉西他滨为主的联合用药等。目前尚无足够的数据支持某种特定的新辅助治疗方案在不同研究间有较大差异,有待进一步高级别的循证研究,以提出最佳方案。
目前为止,胰腺癌的多学科联合诊治模式(MDT)已成全世界的共识,手术切除依然是患者获得根治的唯一方法,各种手术方式还在不断的尝试,淋巴结扩大清扫术目前争议不多,达到R0切除基础之上的门静脉-肠系膜上静脉联合切除得到广泛认可,有选择的联合动脉切除或联合多脏器的胰十二指肠切除值得进一步探索。胰腺癌分子病理分型能使人们更深入的了解胰腺癌的生物学行为,将为改善胰腺癌治疗现状带来根本的变化。现今的新辅助治疗成为当下热点。在胰腺癌发生的分子机制研究逐渐深入的同时,探索手术的方式、时机、切除的范围以及新辅助治疗的临床价值,将为胰腺癌的治疗带来新的曙光。
参考文献
[1]Rahib L, Smith BD, Aizenberg R, et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver,and pancreas cancers in the United States[J]. Cancer Res, 2014,74(11):2913–2921. doi: 10.1158/0008–5472.CAN-14–0155.
[2]Kuroczycki-Saniutycz S, Grzeszczuk A, Zwierz ZW, et al.Prevention of pancreatic cancer[J]. Contemp Oncol (Pozn), 2017,21(1):30–34. doi: 10.5114/wo.2016.63043.
[3]Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1):7–30. doi: 10.3322/caac.21387.
[4]Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59(4):225–249. doi: 10.3322/caac.20006.
[5]Kikuyama M, Kamisawa T, Kuruma S, et al. Early Diagnosis to Improve the Poor Prognosis of Pancreatic Cancer[J]. Cancers(Basel), 2018, 10(2). pii: E48. doi: 10.3390/cancers10020048.
[6]Jung KW, Won YJ, Kong HJ, et al. Cancer statistics in Korea:incidence, mortality, survival and prevalence in 2010[J]. Cancer Res Treat, 2013, 45(1):1–14. doi: 10.4143/crt.2013.45.1.1.
[7]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China,2015[J]. CA Cancer J Clin, 2016, 66(2):115–132. doi: 10.3322/caac.21338.
[8]Hidalgo M. Pancreatic cancer[J]. N Engl J Med, 2010,362(17):1605–1617. doi: 10.1056/NEJMra0901557.
[9]Pereira FL, Vasques FT, Moricz Ad, et al. Correlation analysis between post-pancreatoduodenectomy pancreatic fistula and pancreatic histology[J]. Rev Col Bras Cir, 2012, 39(1):41–47.
[10]Schnelldorfer T, Adams DB, Warshaw AL, et al. Forgotten pioneers of pancreatic surgery: beyond the favorite few[J]. Ann Surg, 2008,247(1):191–202.
[11]Schnelldorfer T, Sarr MG. Alessandro Codivilla and the first pancreatoduodenectomy[J]. Arch Surg, 2009, 144(12):1179–1184.doi: 10.1001/archsurg.2009.219.
[12]Finney JM. VII. Resection of the Pancreas: Report of a Case[J].Ann Surg, 1910, 51(6):818–829.
[13]Whipple AO, Parsons WB, Mullins CR. Treatment of carcinoma of the ampulla of vater[J]. Ann Surg, 1935, 102(4):763–779.
[14]Mann FC, Kawamura K. Duodenectomy: an experimental study[J].Ann Surg, 1922, 75(2):208–220.
[15]Warren KW, Cattell RB, Blackburn JP, et al. A long-term appraisal of pancreaticoduodenal resection for peri-ampullary carcinoma[J].Ann Surg, 1962, 155:653–662.
[16]Priestley JT, Comfort MW, Radcliffe J. Total Pancreatectomy for Hyperinsulinism Due to an Islet-Cell Adenoma: Survival and Cure at Sixteen MOnths after Operation Presentation of Metabolic Studies[J]. Ann Surg, 1944, 119(2):211–221.
[17]Hunt VC. Surgical management of carcinoma of the ampulla of vater and of the periampullary portion of the duodenum[J]. Ann Surg, 1941, 114(4):570–602.
[18]Zinninger MM. Some experiences with anastomosis of the common bile duct to the duodenum, and repair of strictures of the common bile duct[J]. Surgery, 1948, 23(3):337–350.
[19]Whipple AO. Surgical treatment of carcinoma of the ampullary region and head of the pancreas[J]. Am J Surg, 1938, 40(1):260–263.
[20]Whipple AO. Pancreaticoduodenectomy for Islet Carcinoma: A Five-Year Follow-Up[J]. Ann Surg, 1945, 121(6):847–852.
[21]Whipple AO. Observations on radical surgery for lesions of the pancreas[J]. Surg Gynecol Obstet, 1946, 82:623–631.
[22]Child CG. Pancreaticojejunostomy and Other Problems Associated With the Surgical Management of Carcinoma Involving the Head of the Pancreas: Report of Five Additional Cases of Radical Pancreaticoduodenectomy[J]. Ann Surg, 1944, 119(6):845–855.
[23]余文光, 黄德赡, 陈惠尔. 胰腺头部癌: 一期胰十二指肠切除术病例报告[J]. 中华外科杂志, 1954, 2(2):125–127.Yu WG, Huang DS, Chen HE. Carcinoma of head of pancreas: a reoprt of one-staged pancreaticoduodenectomy[J]. Chinese Journal of Surgery, 1954, 2(2):125–127.
[24]Bowden L, Mcneer G, Pack GT. Carcinoma of the head of the pancreas; five year survival in four patients[J]. Am J Surg, 1965,109:578–582.
[25]Fortner JG. Regional resection and pancreatic carcinoma[J].Surgery, 1973, 73(5):799–800.
[26]日本胰脏病研究会. 胰腺癌治疗规约[M]. 东京: 金原出版株式会社, 1980.Japnese Society of Pancreas. Treatment standardization for pancreatic cancer[M]. Tokyo: Kinvara Publisher Limited, 1980.
[27]Ishikawa O, Ohhigashi H, Sasaki Y, et al. Practical usefulness of lymphatic and connective tissue clearance for the carcinoma of the pancreas head[J]. Ann Surg, 1988, 208(2):215–220.
[28]Manabe T, Ohshio G, Baba N, et al. Radical pancreatectomy for ductal cell carcinoma of the head of the pancreas[J]. Cancer, 1989,64(5):1132–1137.
[29]Ishikawa O. Surgical technique, curability and postoperative quality of life in an extended pancreatectomy for adenocarcinoma of the pancreas[J]. Hepatogastroenterology, 1996, 43(8):320–325.
[30]Sindelar WF. Clinical experience with regional pancreatectomy for adenocarcinoma of the pancreas[J]. Arch Surg, 1989, 124(1):127–132.
[31]Pedrazzoli S, DiCarlo V, Dionigi R, et al. Standard versus extended lymphadenectomy associated with pancreatoduodenectomy in the surgical treatment of adenocarcinoma of the head of the pancreas:a multicenter, prospective, randomized study. Lymphadenectomy Study Group[J]. Ann Surg, 1998, 228(4):508–517.
[32]Pedrazzoli S, Beger HG, Obertop H, et al. A surgical and pathological based classification of resective treatment of pancreatic cancer. Summary of an international workshop on surgical procedures in pancreatic cancer[J]. Dig Surg, 1999, 16(4):337–345.
[33]Henne-Bruns D, Vogel I, Lüttges J, et al. Surgery for ductal adenocarcinoma of the pancreatic head: staging, complications, and survival after regional versus extended lymphadenectomy[J]. World J Surg, 2000, 24(5):595–601.
[34]Fujii Y, Ueda M, Yoshida K, et al. Standard surgery as part of the multidisciplinary treatment for pancreatic cancer[J]. Nihon Geka Gakkai Zasshi, 2006, 107(4):177–181.
[35]Hartwig W, Vollmer CM, Fingerhut A, et al. Extended pancreatectomy in pancreatic ductal adenocarcinoma: definition and consensus of the International Study Group for Pancreatic Surgery (ISGPS)[J]. Surgery, 2014, 156(1):1–14. doi: 10.1016/j.surg.2014.02.009.
[36]Yamaguchi K, Okusaka T, Shimizu K, et al. Clinical Practice Guidelines for Pancreatic Cancer 2016 From the Japan Pancreas Society: A Synopsis[J]. Pancreas, 2017, 46(5):595–604. doi:10.1097/MPA.0000000000000816.
[37]中国临床肿瘤学会胰腺癌专家委员会. 胰腺癌综合诊治中国专家共识(2014年版)[J]. 临床肿瘤学杂志, 2014, 19(4):358–370.Expert Committee of Pancreatic Cancer of Chinese Society of Clinical Oncology. Chinese consensus on pancreatic cancer diagnosis and treatment (2014 version)[J]. Chinese Clinical Oncology, 2014, 19(4):358–370.
[38]赵玉沛. 胰腺癌诊治规范(征求意见稿)[C]//中华医学会第10届全国胰腺外科学术研讨会论文汇编. 威海: 第10届全国胰腺外科学术研讨会委员会, 2004:3–6.Zhao YP. Standard procedure of diagnosis and treatment for pancreatic cancer (exposure draft)[C]//Proceedings of the 10th Chinese academic conference of pancreatic surgery of Chinese Medical Association. Weihai: Seminar the 10th Chinese academic conference of pancreatic surgery, 2004:3–6.
[39]Kawarada Y. New classification of pancreatic carcinoma--Japan Pancreas Society[J]. Nihon Shokakibyo Gakkai Zasshi, 2003,100(8):974–980.
[40]Kang MJ, Jang JY, Kim SW. Surgical resection of pancreatic head cancer: What is the optimal extent of surgery?[J]. Cancer Lett,2016, 382(2):259–265. doi: 10.1016/j.canlet.2016.01.042.
[41]Nagai H, Kuroda A, Morioka Y. Lymphatic and local spread of T1 and T2 pancreatic cancer. A study of autopsy material[J]. Ann Surg,1986, 204(1):65–71.
[42]Gebhardt C, Meyer W, Reichel M, et al. Prognostic factors in the operative treatment of ductal pancreatic carcinoma[J]. Langenbecks Arch Surg, 2000, 385(1):14–20.
[43]Mao C, Domenico DR, Kim K et al. Observations on the developmental patterns and the consequences of pancreatic exocrine adenocarcinoma. Findings of 154 autopsies[J]. Arch Surg, 1995,130(2):125–134.
[44]Reddy SK, Tyler DS, Pappas TN, et al. Extended resection for pancreatic adenocarcinoma[J]. Oncologist, 2007, 12(6):654–663.
[45]Jang JY, Kang JS, Han Y, et al. Long-term outcomes and recurrence patterns of standard versus extended pancreatectomy for pancreatic head cancer: a multicenter prospective randomized controlled study[J]. J Hepatobiliary Pancreat Sci, 2017, 24(7):426–433. doi:10.1002/jhbp.465.
[46]Seufferlein T, Bachet JB, Van Cutsem E, et al. Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012, 23(Suppl 7):vii33–40.
[47]Tol JA, Gouma DJ, Bassi C, et al. Definition of a standard lymphadenectomy in surgery for pancreatic ductal adenocarcinoma:a consensus statement by the International Study Group on Pancreatic Surgery (ISGPS)[J]. Surgery, 2014, 156(3):591–600. doi:10.1016/j.surg.2014.06.016.
[48]Moore GE, Sako Y, Thomas LB. Radical pancreatoduodenectomy with resection and reanastomosis of the superior mesenteric vein[J].Surgery, 1951, 30(3):550–553.
[49]Asada S, Itaya H, Nakamura K, et al. Radical pancreatoduodenectomy and portal vein resection. report of two successful cases with transplantation of portal vein[J]. Arch Surg, 1963, 87:609–613.
[50]Yekebas EF, Bogoevski D, Cataldegirmen G, et al. En bloc vascular resection for locally advanced pancreatic malignancies infiltrating major blood vessels: perioperative outcome and long-term survival in 136 patients[J]. Ann Surg, 2008, 247(2):300–309. doi: 10.1097/SLA.0b013e31815aab22.
[51]Müller SA, Hartel M, Mehrabi A, et al. Vascular resection in pancreatic cancer surgery: survival determinants[J]. J Gastrointest Surg, 2009, 13(4):784–792. doi: 10.1007/s11605–008–0791–5.
[52]Selvaggi F, Mascetta G, Daskalaki D, et al. Outcome of superior mesenteric-portal vein resection during pancreatectomy for borderline ductal adenocarcinoma: results of a prospective comparative study[J]. Langenbecks Arch Surg, 2014, 399(5):659–665. doi: 10.1007/s00423–014–1194–6.
[53]Appleby LH. The coeliac axis in the expansion of the operation for gastric carcinoma[J]. Cancer, 1953, 6(4):704–707.
[54]Christians KK, Pilgrim CH, Tsai S, et al. Arterial resection at the time of pancreatectomy for cancer[J]. Surgery, 2014, 155(5):919–926. doi: 10.1016/j.surg.2014.01.003.
[55]Stitzenberg KB, Watson JC, Roberts A, et al. Survival after pancreatectomy with major arterial resection and reconstruction[J].Ann Surg Oncol, 2008, 15(5):1399–1406. doi: 10.1245/s10434–008–9844-y.
[56]Bockhorn M, Burdelski C, Bogoevski D, et al. Arterial en bloc resection for pancreatic carcinoma[J]. Br J Surg, 2011, 98(1):86–92.doi: 10.1002/bjs.7270.
[57]Amano H, Miura F, Toyota N, et al. Is pancreatectomy with arterial reconstruction a safe and useful procedure for locally advanced pancreatic cancer?[J]. J Hepatobiliary Pancreat Surg, 2009,16(6):850–857. doi: 10.1007/s00534–009–0190–7.
[58]Glebova NO, Hicks CW, Tosoian JJ, et al. Outcomes of arterial resection during pancreatectomy for tumor[J]. J Vasc Surg, 2016,63(3):722–729. doi: 10.1016/j.jvs.2015.09.042.
[59]Jegatheeswaran S, Baltatzis M, Jamdar S, et al. Superior mesenteric artery (SMA) resection during pancreatectomy for malignant disease of the pancreas: a systematic review[J]. HPB (Oxford),2017, 19(6):483–490. doi: 10.1016/j.hpb.2017.02.437.
[60]Bockhorn M, Uzunoglu FG, Adham M, et al. Borderline resectable pancreatic cancer: a consensus statement by the International Study Group of Pancreatic Surgery (ISGPS) [J]. Surgery, 2014,155(6):977–988. doi: 10.1016/j.surg.2014.02.001.
[61]Morrow CE, Grage TB, Sutherland DE, et al. Hepatic resection for secondary neoplasms[J]. Surgery, 1982, 92(4):610–614.
[62]Takamori H, Hiraoka T, Kanemitsu K et al. Treatment strategies for hepatic metastases from pancreatic cancer in patients previously treated with radical resection combined with intraoperative radiation therapy[J]. HPB Surg, 1994, 8(2):107–110.
[63]Ko K, Fujioka S, Kato K, et al. Resection of liver metastasis after a pancreatoduodenectomy for pancreatic cancer: a case report[J].Hepatogastroenterology, 2001, 48(38):375–377.
[64]Shimada K, Kosuge T, Yamamoto J, et al. Successful outcome after resection of pancreatic cancer with a solitary hepatic metastasis[J].Hepatogastroenterology, 2004, 51(56):603–605.
[65]Michalski CW, Erkan M, Hüser N, et al. Resection of primary pancreatic cancer and liver metastasis: a systematic review[J]. Dig Surg, 2008, 25(6):473–480. doi: 10.1159/000184739.
[66]Tachezy M, Gebauer F, Janot M, et al. Synchronous resections of hepatic oligometastatic pancreatic cancer: Disputing a principle in a time of safe pancreatic operations in a retrospective multicenter analysis[J]. Surgery, 2016, 160(1):136–144. doi: 10.1016/j.surg.2016.02.019.
[67]Crippa S, Bittoni A, Sebastiani E, et al. Is there a role for surgical resection in patients with pancreatic cancer with liver metastases responding to chemotherapy? [J]. Eur J Surg Oncol, 2016,42(10):1533–1539. doi: 10.1016/j.ejso.2016.06.398.
[68]Kruger S, Haas M, Burger PJ, et al. Isolated pulmonary metastases define a favorable subgroup in metastatic pancreatic cancer[J]. Pancreatology, 2016, 16(4):593–598. doi: 10.1016/j.pan.2016.03.016.
[69]Dhayat SA, Mirgorod P, Lenschow C, et al. Challenges in pancreatic adenocarcinoma surgery - National survey and current practice guidelines[J]. PLoS One, 2017, 12(3):e0173374. doi:10.1371/journal.pone.0173374.
[70]Bailey P, Chang DK, Nones K, et al. Genomic analyses identify molecular subtypes of pancreatic cancer[J]. Nature, 2016,531(7592):47–52. doi: 10.1038/nature16965.
[71]Pilepich MV, Miller HH. Preoperative irradiation in carcinoma of the pancreas[J]. Cancer, 1980, 46(9):1945–1949.
[72]Kopelson G. Curative surgery for adenocarcinoma of the pancreas/ampulla of Vater: the role of adjuvant pre or postoperative radiation therapy[J]. Int J Radiat Oncol Biol Phys, 1983, 9(6):911–915.
[73]Evans DB, Rich TA, Byrd DR, et al. Preoperative chemoradiation and pancreaticoduodenectomy for adenocarcinoma of the pancreas[J]. Arch Surg, 1992, 127(11):1335–1339.
[74]Tempero MA, Malafa MP, Al-Hawary M, et al. Pancreatic Adenocarcinoma, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2017,15(8):1028–1061. doi: 10.6004/jnccn.2017.0131.
[75]Mokdad AA, Minter RM, Zhu H, et al. Neoadjuvant Therapy Followed by Resection Versus Upfront Resection for Resectable Pancreatic Cancer: A Propensity Score Matched Analysis[J]. J Clin Oncol, 2017, 35(5):515–522. doi: 10.1200/JCO.2016.68.5081.
[76]Gillen S, Schuster T, Meyer Zum Büschenfelde C, et al.Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages[J].PLoS Med, 2010, 7(4):e1000267. doi: 10.1371/journal.pmed.1000267.
[77]Casadei R, Di Marco M, Ricci C, et al. Neoadjuvant Chemoradiotherapy and Surgery Versus Surgery Alone in Resectable Pancreatic Cancer: A Single-Center Prospective,Randomized, Controlled Trial Which Failed to Achieve Accrual Targets[J]. J Gastrointest Surg, 2015, 19(10):1802–1812. doi:10.1007/s11605–015–2890–4.
[78]Golcher H, Brunner TB, Witzigmann H, et al. Neoadjuvant chemoradiation therapy with gemcitabine/cisplatin and surgery versus immediate surgery in resectable pancreatic cancer: results of the first prospective randomized phase II trial[J]. Strahlenther Onkol, 2015, 191(1):7–16. doi: 10.1007/s00066–014–0737–7.
[79]Lutz MP, Zalcberg JR, Ducreux M, et al. 3rd St. Gallen EORTC Gastrointestinal Cancer Conference: Consensus recommendations on controversial issues in the primary treatment of pancreatic cancer[J]. Eur J Cancer, 2017, 79:41–49. doi: 10.1016/j.ejca.2017.03.022.
[80]Van Buren G 2nd, Ramanathan RK, Krasinskas AM, et al. Phase II study of induction fixed-dose rate gemcitabine and bevacizumab followed by 30 Gy radiotherapy as preoperative treatment for potentially resectable pancreatic adenocarcinoma[J]. Ann Surg Oncol, 2013, 20(12):3787–3793. doi: 10.1245/s10434–013–3161–9.
[81]Epelboym I, DiNorcia J, Winner M, et al. Neoadjuvant therapy and vascular resection during pancreaticoduodenectomy: shifting the survival curve for patients with locally advanced pancreatic cancer[J]. World J Surg, 2014, 38(5):1184–1195. doi: 10.1007/s00268–013–2384–z.
[82]Sano T, Takano K, Chiba N, et al. The Efficacy of Neoadjuvant Chemoradiation Therapy for Borderline Resectable Pancreatic Cancer[J]. Gan To Kagaku Ryoho, 2015, 42(12):1488-1490.
