乳腺癌是女性最常见的恶性肿瘤之一。国际抗癌协会统计资料表明,欧美国家乳腺癌已经成为威胁女性生命健康的头号杀手。虽然目前我国乳腺癌发病率与西方相比相对较低,但近年来以每年3%的速度递增,增速较快[1]。2015年我国乳腺癌新发人数预计将达女性新发肿瘤的15%,为268 600人,居女性恶性肿瘤首位,而病死数达69 500人[2]。新辅助化疗(neoadjuvant chemotherapy,NAC)作为乳腺癌的治疗策略现已广泛应用于临床,是局部晚期乳腺癌或炎性乳腺癌的规范疗法:第一,可使肿瘤降期以利于手术,变不可手术为可手术乳腺癌;第二,对于肿瘤较大且有保乳意愿的患者可提高保乳率;第三,是评估肿瘤细胞对药物敏感性的有效手段[3-4]。但约3%的患者在NAC过程中可能出现病情进展,甚至丧失手术机会[5]。文献[6-9]证实,接受NAC的乳腺癌患者,若能达到病理学完全缓解(pathological complete response,pCR),则预示较好的远期效果。传统的影像学技术、肿瘤形态等并不能准确预测NAC疗效。因此,临床上需要一个敏感性和特异性高的指标来评估和预测NAC疗效。
Ki-67是可通过病理学免疫组化方法进行测定的肿瘤指标,是除G0期外,可在细胞增殖的各个阶段进行表达的核蛋白,代表肿瘤细胞的增殖速度。研究[10-13]表明,Ki-67表达水平可能与乳腺癌NAC疗效及预后存在一定的相关性。pCR是NAC的主要病理观测指标,pCR的定义有两种:⑴ 一般是指乳腺原发灶中找不到恶性肿瘤的组织学证据,或仅存在原位癌成分;⑵ 严格意义上是指乳腺原发灶和转移的区域淋巴结均达到pCR[14]。本研究中pCR的定义采用第一种标准,病理标本由哈尔滨医科大学附属第二医院病理科2名病理科医师独立盲目阅片完成,通过分析行NAC患者的临床病理资料,探讨Ki-67水平和PR表达情况对NAC疗效(pCR)的预测价值。
1 资料与方法
1.1 研究对象
选择2011年11月—2015年11月哈尔滨医科大学附属第二医院乳腺外科收治的行NAC且临床病理资料较为完整的乳腺癌患者261例。纳入标准:化疗前经粗针穿刺取得病理和免疫组化结果,病理类型均为浸润性癌;根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第7版TNM分期标准[15],临床分期为II~III期可进行NAC的患者;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分为0~2分。排除标准:经系统检查发现有远处转移;NAC前曾进行其他抗肿瘤治疗;NAC前有器官移植病史或其他影响重要器官功能障碍的重大疾病史。所有患者的临床一般资料包括肿瘤的临床大小、淋巴结状态,治疗方案,受体状态均记录相对完整。入组患者基本情况:平均年龄(49.2±9.4)岁;病理类型:浸润性导管癌251例,浸润性小叶癌10例;手术方式:乳腺癌改良根治术241例,保留乳房的乳腺癌切除术20例。
1.2 治疗方案
术前NAC方案:TEC(多西他赛75 mg/m2+表柔比星60 mg/m2,d1+环磷酰胺500 mg/m2,第1天),TE(多西他赛75mg/m2+表柔比星75 mg/m2,第1天)和TCH方案[多西他赛75 mg/m2+卡铂血药浓度设为曲线下面积(AUC)6,第1天,曲妥珠单抗首剂8 mg/kg,第1天,随后6 mg/kg 21 d],所有化疗方案每21天为1个疗程。 患者术前均接受了≥4个疗程的NAC。术前未完成全部NAC疗程的患者,术后继续完成剩余化疗疗程,后续治疗方案包括放疗、靶向治疗、内分泌治疗等均按照美国国家综合癌症网络(NCCN Clinical Practice Guidelines in Oncology v.2)指南进行[16]。
1.3 乳腺癌分子标记物
采 用免疫组化SP法测定雌激素受体(ER)、孕激素受体(PR)、Ki-67表达及表皮生长因子受体2(Her-2)状态。所有检测标本均用中性甲醛固定,石蜡包埋,4 µm连续切片,实验步骤按常规免疫组化步骤进行,ER、PR和Ki-67的阳性表达均定为在细胞核,有弥漫性或者深浅各异的棕黄色颗粒记为阳性,Her-2主要定为在细胞膜,在细胞膜内发现棕黄色颗粒则记为阳性,上述指标单克隆抗体及免疫组化试剂盒均购自上海基因科技有限公司,所有标本切片染色后结果判定由两位病理科医生通过双盲法进行,在400倍高倍镜下每张切片随机选取5个代表性区域,每个高倍镜视野计数镜下所有肿瘤细胞,计数阳性肿瘤细胞占所有肿瘤细胞的百分比。ER、PR阳性定义:≥1%的肿瘤细胞核着色,经免疫组织化学检测Her-2为(++)的患者应进一步做荧光原位杂交(fluorescence in situ hybridization,FISH)、显色原位杂交(chromogenic in situ hybridization,CISH)或重复免疫组化检测明确是否有基因扩增。
1.4 统计学处理
采用SPSS 20.0(IBM,Bethesda,MD,USA)软件进行统计学分析,对部分临床信息不明确的情况,在统计分析中按缺失值进行处理。不同临床病理因素之间pCR的比较采用χ2检验;采用多因素Logistic回归分析方法分析各因素对pCR表达的影响,找出影响pCR表达的独立预测因 子;此外,采用ROC曲线下面积(AUC)评估Ki-67对NAC疗效的预测价值,并通过Youden指数对最佳截断值的敏感性和特异性进行了评估,分析计算Ki-67最佳截断值为50%。P<0.05为差异有统计学意义。
2 结 果
2.1 Ki-67预测pCR的ROC曲线
K i-6 7表达与 p C R呈正相关,在所有患者中,以Ki-67为指标的ROC曲线下面积(AUC)为0.7092(图1A),在ER阳性乳腺癌患者中,以Ki-67为指标的AUC为0.7312(图1B),提示在ER阳性患者中,Ki-67的潜在诊断价值可能更高。采用AUC评估Ki-67对NAC疗效的预测价值,并通过Youden指数对最佳截断值的敏感性和特异性进行了评估。分析计算得出本研究Ki-67预测pCR的最佳截断值为50%,随之将患者分为Ki-67高水平组(Ki-67>50%)和Ki-67低水平组(Ki-67≤50%)。
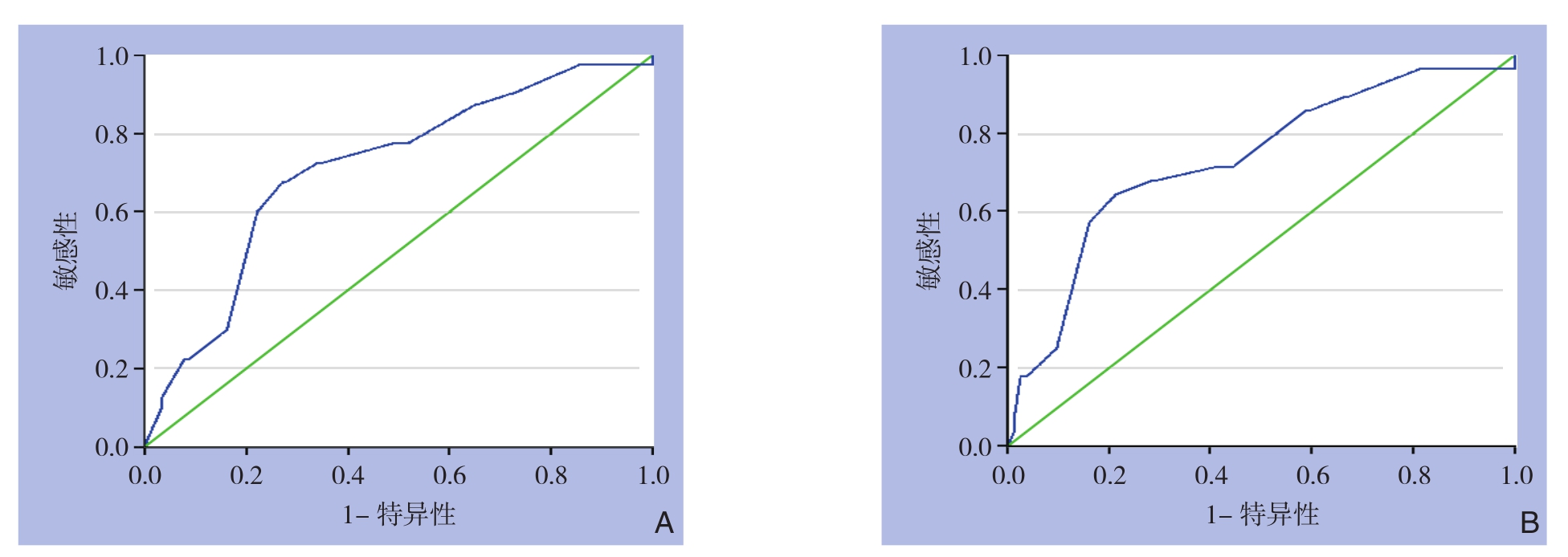
图1 Ki-67预测pCR的ROC曲线 A:全组患者;B:ER阳性患者
Figure 1 ROC curves of Ki-67 for predicting pCR A: Whole group of patients; B: ER positive patients
2.2 NAC疗效与临床病理因素关系
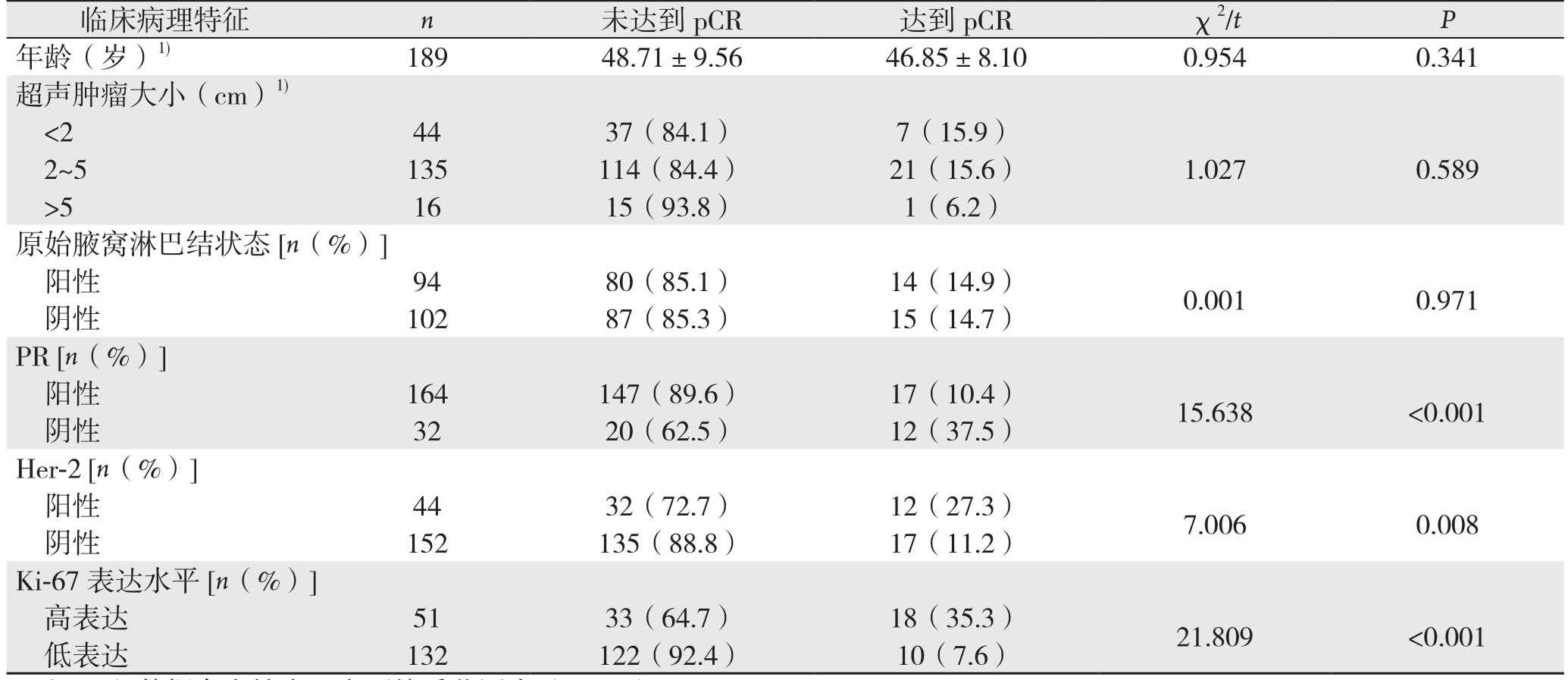
本研究共261例患者入组,41例(15.7%)获得了pCR(表1)。单因素分析中,pCR与PR、Her-2状态、分子分型和Ki-67水平明显有关(均P<0.05);pCR与年龄、肿瘤大小、原始腋窝淋巴结状态、ER无关(均P>0.05)(表1),其中:PR阳性患者pCR率(14.9%)明显低于PR阴性者(18.5%);Her-2阳性患者pCR率(23.0%)明显高于Her-2阴性者(12.8%),Her-2阳性患者中,未进行曲妥珠单抗治疗组pCR率(20.97%)低于进行曲妥珠单抗治疗组(33.3%);HR阳性患者(ER和PR均阳性)pCR率(11.0%) 明显低于三阴性乳腺癌(TNBC)患者(21.9%);Ki-67高水平患者pCR率(32.9%)明显高于Ki-67低水平者(8.1%)。在多因素变量Logistic回归分析中,仅Ki-67进入了多因素模型,结果有统计学意义(P<0.05)。因此,Ki-67表达水平是pCR的独立预测因子,Ki-67高水平患者的pCR率是Ki-67低水平的5.476倍(OR=5.476,95% CI=2.637~11.372)(表2)。
表1 NAC疗效与乳腺癌患者临床病理因素关系的单变量分析
Table 1 Univariate analysis of relations of NAC efficacy with clinicopathologic factors of breast cancer patients

注:1)数据存在缺失,在可接受范围内(<10%)Note: 1) With missing data in an acceptable scope (<10%)

表2 乳腺癌患者pCR影响因素的多变量Logistic回归分析
Table 2 Multivariate Logistic regression analysis of Influential factors for pCR in breast cancer patients
因素 Wald χ2OR 95% CI P Ki-67(高表达vs.低表达) 20.793 5.476 2.637~11.372<0.0001
本研究共196例ER阳性患者入组,其中29例(14.8%)获得了pCR(表3)。分析结果显示,在ER阳性患者亚组中,Ki-67高水平,PR阳性和Her-2阳性是pCR的独立预测因子。其中:PR阳性患者的pCR率(10.4%)明显低于PR阴性者(37.5%) ;Ki-67高水平患者pCR率(35.3%)明显高于Ki-67低水平者(7.6%);Her-2阳性患者的pCR率(27.3%)明显高于Her-2阴性者(11.2%)。在多因素Logistic回归分析中显示:PR阳性者的pCR率是PR阴性者的0.303倍(OR=0.303,95% CI=0.113~0.810);Her-2阳性者的pCR率是Her-2阴性者的2.607倍(OR=2.607,95% CI=1.023~6.642);Ki-67高水平者pCR率是Ki-67低水平者的4.282倍(OR=4.282,95% CI=1.694~10.825)(表4)。
表3 NAC疗效与ER阳性乳腺癌患者临床病理因素关系的单变量分析
Table 3 Univariate analysis of relations of NAC efficacy with clinicopathologic factors of ER positive breast cancer patients
注:1)数据存在缺失,在可接受范围内(<10%)
Note: 1) With missing data in an acceptable scope (<10%)
临床病理特征 n 未达到pCR 达到pCR χ2/t P年龄(岁)1) 189 48.71±9.56 46.85±8.10 0.954 0.341超声肿瘤大小(cm)1)<2 44 37(84.1) 7(15.9)2~5 135 114(84.4) 21(15.6) 1.027 0.589>5 16 15(93.8) 1(6.2)原始腋窝淋巴结状态[n(%)]阳性 94 80(85.1) 14(14.9) 0.001 0.971阴性 102 87(85.3) 15(14.7)PR [n(%)]阳性 164 147(89.6) 17(10.4) 15.638 <0.001阴性 32 20(62.5) 12(37.5)Her-2 [n(%)]阳性 44 32(72.7) 12(27.3) 7.006 0.008阴性 152 135(88.8) 17(11.2)Ki-67表达水平[n(%)]高表达 51 33(64.7) 18(35.3) 21.809 <0.001低表达 132 122(92.4) 10(7.6)
表4 ER阳性乳腺癌患者pCR影响因素的多变量Logistic回归分析
Table 4 Multivariate Logistic regression analysis of Influential factors for pCR in ER positive breast cancer patients

因素 Wald χ2 OR 95% CI P PR(阳性 vs.阴性) 5.659 0.303 0.113~0.810 0.017 Her-2(阳性 vs.阴性) 4.030 2.607 1.023~6.642 0.045 Ki-67(高表达vs.低表达) 9.446 4.282 1.694~10.825 0.002
3 讨 论
乳腺癌是女性最常见的恶性肿瘤,极大威胁着女性的身心健康。乳腺癌是一种异质性疾病,个体化治疗在乳腺癌的临床治疗中具有越来越重要的意义。乳腺癌的综合治疗包括手术、放疗、化疗、内分泌治疗、靶向治疗等,NAC为临床综合治疗多种恶性疾病的重要部分,通过NAC,可以有效提高肿瘤手术完全切除率,延长生存周期。NAC的疗效预测指标对指导乳腺癌的个体化治疗和预测预后具有特殊重要的意义。
Ki-67是目前最常用的反应细胞增殖状况的标记,与肿瘤的发生、浸润种植和转移过程相关,在乳腺癌中,肿瘤细胞Ki-67的表达被认为与细胞核分级,淋巴结转移,有丝分裂率等密切相关,Ki-67阳性表达率越高,反映肿瘤细胞增殖活性强,恶性程度高,患者预后差,NAC疗效评价系统主要为MP系统、残余肿瘤负荷等指标,但这些评价系统应用于NAC后手术切除病理,而Ki-67在术前穿刺病理中即可方便获得,探究NAC前穿刺病理Ki-67水平来预测NAC效果,对临床有较大指导意义。既往文献[17-21]报道,Ki-67是NAC疗效的独立预测因子,Ki-67高表达患者对化疗更敏感,Ki-67高水平可能预示着预后较差。许多研究已经对Ki-67是否可以作为乳腺癌的预后指标来进行分析[22]。Fasching等[23]得出Ki-67截断值定义为>13%时,Ki-67水平是PCR的独立预测因素,Ki-67高水平被认为是总生存(overall survival,OS)和远处无病生存(distant disease free survival,DDFS)的独立危险因素,但遗憾的是,本研究不包括随访资料,因此未进行生存分析。
关于乳腺癌NAC的经典试验(NSABP B-18研究、NSABP B-27研究、EORTC 10994/BIG 1-00研究、NOAH研究)显示NAC与术后化疗的乳腺癌患者的DFS和OS差异无统计学意义,但NAC能显著提高乳腺癌患者的保乳手术率,而且亚组分析显示:NAC获得pCR的乳腺癌患者较未获得pCR的患者DFS、OS得到显著改善,提示肿瘤对NAC的反应可以作为预测患者预后的指标,然而NAC的临床疗效受到诸多因素的影响,不同患者对化疗的敏感性及预后存在较大差异。在大样本随机对照试验中的pCR率从5%到29%不等,如NSABP B-18研究,NAC方案为AC(多柔比星60 mg/m2+环磷酰胺500 mg/m2,第1天),pCR率为13%,NSABP B-2 7研究,N A C方案为A C序贯T(多柔比星60 mg/m2+环磷酰胺500 mg/m2+序贯多西他赛100 mg/m2,第1天),pCR率为26%[24-25]。但NSABP B-18和NSABP B-27研究并没有涉及乳腺癌患者的激素受体及Her-2表达情况的分析。本研究的pCR率为15.7%,与之前的研究结果类似。EORTC 10994/BIG 1-00研究说明不同分子亚型对NAC的疗效反应不同,激素受体阳性患者进行NAC很难获得pCR,而Her-2阳性和TNBC患者可获得更佳的pCR[25],在本研究中,三阴性乳腺癌(TNBC)患者的pCR率(21.9%)与先前研究所公布的pCR率(22%~58%)结果相近[26-27]。NOAH研究表明加用曲妥珠单抗的NAC能显著提高Her-2阳性乳腺癌患者的pCR率[28]。本研究中,Her-2阳性亚组pCR率(20.97%未进行曲妥珠单抗治疗组 vs. 33.3%进行曲妥珠单抗治疗组)与NOAH研究(19% vs. 38%)[28]和其他研究[29-30]结果类似。
本研究对Ki-67的最佳截断值进行了评估。先前研究中常以Ki-67截断值为14%或20%将激素受体阳性患者被分为Luminal A和Luminal B组,但该截断值不能作为预测肿瘤对NAC反应的最佳值。本研究依据我科室NAC患者临床病理资料及NAC疗效,通过计算ROC的AUC得出Ki-67水平的最佳截断值为50%。在以前的研究中,HR阳性,TNBC和Her-2阳性亚型组的最佳截断值范围分别为36%~40%,30%~40%和17%~20%[23]。然而,在本研究中存在许多影响pCR率的相关因素。首先,Her-2阳性患者接受靶向治疗更易获得pCR,但由于经济原因,很少有患者选择含靶向治疗的NAC方案。因此,在这些患者中很难获得关于Ki-67最佳截断值的准确数据。其次,通常TNBC患者pCR率较高,但本研究中TNBC患者入组较少,因此在一些特定患者中,Ki-67的最佳截断值可能偏离参考值。
本研究得出,Ki-67是pCR的独立预测因子,Ki-67高表达患者与pCR率高;在ER阳性亚组中,PR阳性患者与pCR率低,Ki-67水平和PR状态可作为预测NAC的疗效的分子指标,对于个体化NAC有一定临床指导价值,但是本研究也有一些不足之处:研究类型属于回顾性研究且入组患者人数较少,今后需开展前瞻性、随机和多中心研究进一步明确Ki-67表达水平和PR表达情况对NAC疗效及预后的预测价值。
参考文献
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71–96.doi: 10.3322/CA.2007.0010.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115–132.doi: 10.3322/caac.21338.
[3]Bonnefoi H,Piccart M,Bogaerts J,et al.TP53 status for prediction of sensitivity to taxane versus non-taxane neoadjuvant chemotherapy in breast cancer (EORTC 10994/BIG 1–00): a randomised phase 3 trial[J].Lancet Oncol,2011,12(6):527–539.doi: 10.1016/S1470–2045(11)70094–8.
[4]Prat A,Cheang MC,Martín M,et al.Prognostic significance of progesterone receptor-positive tumor cells within immunohistochemically defined luminal A breast cancer[J].J Clin Oncol,2013,31(2):203–209.doi: 10.1200/JCO.2012.43.4134.
[5]Caudle AS,Gonzalez-Angulo AM,Hunt KK,et al.Predictors of tumor progression during neoadjuvant chemotherapy in breast cancer[J].J Clin Oncol,2010,28(11):1821–1828.doi: 10.1200/JCO.2009.25.3286.
[6]Kuerer HM,Newman LA,Smith TL,et al.Clinical course of breast cancer patients with complete pathologic primary tumor and axillary lymph node response to doxorubicin-based neoadjuvant chemotherapy[J].J Clin Oncol,1999,17(2):460–469.doi: 10.1200/JCO.1999.17.2.460.
[7]Liedtke C,Mazouni C,Hess KR,et al.Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer[J].J Clin Oncol,2008,26(8):1275–1281.doi:10.1200/JCO.2007.14.4147.
[8]Guarneri V,Broglio K,Kau SW,et al.Prognostic value of pathologic complete response after primary chemotherapy in relation to hormone receptor status and other factors[J].J Clin Oncol,2006,24(7):1037–1044.doi: 10.1200/JCO.2005.02.6914.
[9]Cortazar P,Zhang L,Untch M,et al.Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis[J].Lancet,2014,384(9938):164–172.doi: 10.1016/S0140–6736(13)62422–8.
[10]Viale G,Regan MM,Mastropasqua MG,et al.Predictive value of tumor Ki-67 expression in two randomized trials of adjuvant chemoendocrine therapy for node-negative breast cancer[J].J Natl Cancer Inst,2008,100(3):207–212.doi: 10.1093/jnci/djm289.
[11]Hugh J,Hanson J,Cheang MC,et al.Breast cancer subtypes and response to docetaxel in node-positive breast cancer: use of an immunohistochemical definition in the BCIRG 001 trial[J].J Clin Oncol,2009,27(8):1168–1176.doi: 10.1200/JCO.2008.18.1024.
[12]Penault-Llorca F,André F,Sagan C,et al.Ki67 expression and docetaxel efficacy in patients with estrogen receptor-positive breast cancer[J].J Clin Oncol,2009,27(17):2809–2815.doi: 10.1200/JCO.2008.18.2808.
[13]Bartlett JM,Munro A,Cameron DA,et al.Type 1 receptor tyrosine kinase profiles identify patients with enhanced benefit from anthracyclines in the BR9601 adjuvant breast cancer chemotherapy trial[J].J Clin Oncol,2008,26(31):5027–5035.doi: 10.1200/JCO.2007.14.6597.
[14]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2017年版)[J].中国癌症杂志,2017,27(9):695–759.Committee of Breast Cancer Society of Chinese Anti-Cancer Association.Guidelines and standardization for diagnosis and treatment of breast cancer of Chinese Anti-Cancer Association (2017 edition)[J].China Oncology,2017,27(9):695–759.
[15]Edge SB,Compton CC.The American Joint Committee on cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6):1471–1474.doi: 10.1245/s10434–010–0985–4.
[16]Levy MH,Back A,Benedetti C,et al.NCCN clinical practice guidelines in oncology: palliative care[J].J Natl Compr Canc Netw,2009,7(4):436–473.
[17]Stuart-Harris R,Caldas C,Pinder SE,et al.Proliferation markers and survival in early breast cancer: a systematic review and meta-analysis of 85 studies in 32,825 patients[J].Breast,2008,17(4):323–334.doi: 10.1016/j.breast.2008.02.002.
[18]Penault-Llorca F,Abrial C,Raoelfils I,et al.Changes and predictive and prognostic value of the mitotic index,Ki-67,cyclin D1,and cyclo-oxygenase-2 in 710 operable breast cancer patients treated with neoadjuvant chemotherapy[J].Oncologist,2008,13(12):1235–1245.doi: 10.1634/theoncologist.2008–0073.
[19]Petit T,Wilt M,Velten M,et al.Comparative value of tumour grade,hormonal receptors,Ki-67,HER-2 and topoisomerase II alpha status as predictive markers in breast cancer patients treated with neoadjuvant anthracycline-based chemotherapy[J].Eur J Cancer,2004,40(2):205–211.
[20]Pohl G,Rudas M,Taucher S,et al.Expression of cell cycle regulatory proteins in breast carcinomas before and after preoperative chemotherapy[J].Breast Cancer Res Treat,2003,78(1):97–103.
[21]von Minckwitz G,Sinn HP,Raab G,et al.Clinical response after two cycles compared to HER2,Ki-67,p53,and bcl-2 in independently predicting a pathological complete response after preoperative chemotherapy in patients with operable carcinoma of the breast[J].Breast Cancer Res,2008,10(2):R30.doi: 10.1186/bcr1989.
[22]Yerushalmi R,Woods R,Ravdin PM,et al.Ki67 in breast cancer:prognostic and predictive potential[J].Lancet Oncol,2010,11(2):174–183.doi: 10.1016/S1470–2045(09)70262–1.
[23]Fasching PA,Heusinger K,Haeberle L,et al.Ki67,chemotherapy response,and prognosis in breast cancer patients receiving neoadjuvant treatment[J].BMC Cancer,2011,11:486.doi:10.1186/1471–2407–11–486.
[24]Mamounas EP,Anderson SJ,Dignam JJ,et al.Predictors of locoregional recurrence after neoadjuvant chemotherapy: results from combined analysis of National Surgical Adjuvant Breast and Bowel Project B-18 and B-27[J].J Clin Oncol,2012,30(32):3960–3966.doi: 10.1200/JCO.2011.40.8369.
[25]von Minckwitz G,Blohmer JU,Costa SD,et al.Response-guided neoadjuvant chemotherapy for breast cancer[J].J Clin Oncol,2013,31(29):3623–3630.doi: 10.1200/JCO.2012.45.0940.
[26]Bonnefoi H,Litière S,Piccart M,et al.Pathological complete response after neoadjuvant chemotherapy is an independent predictive factor irrespective of simplified breast cancer intrinsic subtypes: a landmark and two-step approach analyses from the EORTC 10994/BIG 1–00 phase III trial[J].Ann Oncol,2014,25(6):1128–1136.doi: 10.1093/annonc/mdu118.
[27]von Minckwitz G KM,Kümmel S,Fasching P,et al.Integrated meta-analysis on 6402 patients with early breast cancer receiving neoadjuvant anthracycline-taxane ± trastuzumab containing chemotherapy[Abstract 792008].SABCS Abstract 792008,2008.
[28]Gianni L,Eiermann W,Semiglazov V,et al.Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone,in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort[J].Lancet,2010,375(9712):377–384.doi: 10.1016/S0140–6736(09)61964–4.
[29]Untch M,Rezai M,Loibl S,et al.Neoadjuvant treatment with trastuzumab in HER2-positive breast cancer: results from the GeparQuattro study[J].J Clin Oncol,2010,28(12):2024–2031.doi:10.1200/JCO.2009.23.8451.
[30]Untch M,Stoeckl D,Konecny G,et al.A multicenter phase ii study of preoperative epirubicin,cyclophosphamide (ec) followed by paclitaxel (p) plus trastuzumab (t) in her2 positive primary breast cancer[abstract 1064].Breast Cancer Res Treat,2005,94:60–61.
