随着分子生物学技术的发展,乳腺癌分子学检测已被临床广泛应用。根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)表达情况以及乳腺癌肿瘤细胞增殖指数(Ki-67)的不同,临床将乳腺癌分为Luminal A型、Luminal B型、Her-2型和三阴性乳腺癌(triple negative breast cancer,TNBC)4个亚型[1]。其中,TNBC是一类特殊生物学行为的乳腺癌,约占乳腺癌的15%~20%[2]。综述文献发现,TNBC多发生于绝经前的年轻女性、黑色人种发病率高于白人、病理组织学分级高、侵袭性强、易早期复发和转移、临床预后较差[3-6],对ER及PR为受体的内分泌治疗无效[7],Her-2为靶点的靶向药物治疗不敏感[8]。因此,除手术、放疗之外,化疗在TNBC的治疗中显得尤为重要。无论是TNBC还是非TNBC的化疗,紫杉醇是重要的化疗药物之一[9],但临床经常出现紫杉醇耐药的现象[10]。肿瘤耐药既是一种常见现象,又是一个复杂而尚未解决的难题,虽然有各种理论和推测解释化疗药物耐药的机制,但目前仍无根本性进展。据报道[11],肿瘤细胞的自噬(autophagy)与化疗耐药有关。目前,自噬与肿瘤发生及其耐药研究越来越受到学者们的重视,已成为肿瘤耐药机制研究的热点之一[12]。自噬相关基因8(autophagy-related gene 8,Atg8)在哺乳动物被称为微管相关蛋白1轻链3(microtubuleassociated protein1 light chain3,MAP1-LC3,简称LC3)[13],对自噬泡的形成必不可少,是LC3是自噬的重要标记物。有文献[14-15]报道肺癌A549细胞、人胶质瘤U87细胞、卵巢癌顺铂耐药细胞SK-OV/DDP和乳腺癌MCF-7细胞的紫杉醇耐药与自噬相关基因相关,但机制不清楚。为探讨LC3在TNBC中与紫杉醇敏感性的关系,本研究以人TNBC细胞MDA-MB-231为研究对象,研究不同浓度紫杉醇与LC3表达的关系,以及对肿瘤细胞凋亡的影响,为今后进一步寻找紫杉醇耐药靶点提供理论基础。
1 材料与方法
1.1 细胞及主要试剂
人TNBC细胞MDA-MB-231系由中南大学肿瘤研究所馈赠,LC3阳性细胞MCF-7为本实验建株,紫杉醇购自浙江海正制药公司,荧光标记Anti-LC3 A/B兔单克隆抗体、荧光标记山羊抗兔IgG-HRP购自南京赛泓瑞公司,Bax兔单克隆抗体、山羊抗鼠IgG-HRP、β-actin、山羊抗兔IgG-HRP购自SANTA公司,caspase-3兔单克隆抗体购自Abcam公司,LC3 A/B兔单克隆抗体购自CST公司。
1.2 方法
1.2.1 细胞培养 MDA-MB-231细胞培养于含10%胎牛血清、1 mL/100 mL青链霉素的二抗混合液的高糖DMEM培养液,青链霉素混合液双抗用于预防细胞培养的细菌污染。产品经过滤除菌处理,可以直接添加到细胞培养液内。青霉素的含量为10 kU/mL,链霉素的含量为10 mg/mL。在细胞培养液中推荐的青霉素的工作浓度为100 U/mL,链霉素的工作浓度为 0.1 mg/mL。37 ℃,5% CO2饱和湿度培养箱中培养,每2~3天更换培养液,观察细胞的生长状态并进行细胞传代备用。
1.2.2 CCK-8法检细胞增殖抑制 取对数生长期MDA-MB-231细胞,接种于96孔板内,每孔约100 μL。分为实验组(MDA-MB-231细胞 +紫杉醇)和对照组(仅有MDA-MB-231细胞),根据紫杉醇浓度不同又将实验组分为0.5、1、2、5、10、20 μg/mL 6个亚组。每组设置 3个平行孔,置 37 ℃培养 48 h,每孔加入约 10 μL CCK-8 溶液,孵育1 h。将96孔板置于摇床充分混匀1 min,酶标仪检测450 nm波长下每孔的OD值,代入以下公式计算细胞生长抑制率:肿瘤细胞增值抑制率(%)=(实验组OD值-对照组OD值)/对照组OD值×100%。绘制生长曲线,计算出紫杉醇对MDAMB-231细胞增殖的25%抑制浓度(IC25),用于后续实验。
1.2.3 免疫荧光法检测LC3表达 为观察紫杉醇对MDA-MB-231细胞LC3表达的影响,设置实验组(MDA-MB-231+IC25浓度紫杉醇)和对照组(MDA-MB-231+高糖DMEM稀释成工作浓度)。用胰蛋白酶-EDTA 溶液将实验组和对照组细胞消化,离心,收集下层细胞沉淀。将收集的细胞用完全培养液重悬、计数、调整好细胞密度。将调整好密度的细胞悬液分别加入每个玻片培养小室,每个约1 mL,孵育24 h后在各组细胞中按设计方案加入紫杉醇,再次孵育72 h后,弃去培养液,PBS洗涤2min。3%多聚甲酸4℃下固定30min。PBS洗涤。加入一抗及荧光素标记的相关二抗,室温避光1 h,PBS 洗涤。每小室加入To-Pro3(1:1 000),室温下避光 5 min,PBS洗涤。甘油封片,荧光显微镜观察并拍照。Motic Fluo 1.0软件测定各组积分光密度值(integrated optical density,IOD)值。
1.2.4 Western blot检测LC3表达 一抗LC3工作浓度为1:800,内参β-actin为1:1 000,二抗为HRP标记的羊抗鼠抗体。按1.2.3方法设置实验组与对照组。取对数生长期细胞制备细胞悬液,调整细胞密度约1×107个/mL;0.25%胰蛋白酶消化,离心后收集到1.5 mL EP管中;加入细胞裂解液,超声破碎仪进一步破碎,12 000 r/min转速离心10~20 min,取上清液转移至另一离心管中,震荡混匀。按 0、1、2、4、6、8、10 μL含量将其加到96孔板标准品孔中,每孔均用灭菌双蒸水补足到10 μL,每个样本设置3个平行孔;每孔加入 BCA工作液200 μL孵育30 min;多功能酶标仪测量OD562 nm波长时的吸光度,制作标准曲线,计算各组蛋白浓度。以4:1的比例将剩余蛋白加入SDS上样缓冲液,在100 ℃高温放置5 min变性,SDS-PAGE 凝胶电泳,电转移至PVDF膜。将转好的膜放入含有5%脱脂奶粉的TBST缓冲液封闭。先后加入一抗、二抗孵育,室温下TBST缓冲液洗膜3次,每次5~10 min;取ECL化学发光试剂显影。通过化学发光凝胶成像分析系统进行扫描图像上的信号条带,并用Image J图像分析软件对条带灰度进行数字量化,计算光密度值(optical density,OD)。上述实验重复3次。
1.2.5 凋亡相关蛋白与细胞凋亡检测 将待检细胞分为实验组(MDA-MB-231+IC25浓度紫杉醇)、阳性对照组(LC3阳性MCF-7+IC25浓度紫杉醇)和阴性对照组(仅有MDA-MB-231)。参照1.2.4方法应用Western blot检测各组细胞凋亡相关因子Bax、capase-3蛋白的表达。流式细胞术检测细胞早期凋亡率和总凋亡率。IC25浓度为紫杉醇工作浓度,Bax为1:300、capase-3为1:5 000,内参β-actin为 1:1 000。
1.3 统计学处理
用SPSS 21.0统计软件进行分析,计量资料以均数±标准差( ±s)表示,计量资料两组比较采用t检验,组间比较采用方差分析,检验水准为α=0.05,P<0.05为差异具有统计学意义。免疫荧光法图像采用Motic Fluo 1.0软件处理测定各组IOD值、Western blot图像灰度值采用Image J软件分析、所有图片通过GraphPad Prism 5软件完成。
±s)表示,计量资料两组比较采用t检验,组间比较采用方差分析,检验水准为α=0.05,P<0.05为差异具有统计学意义。免疫荧光法图像采用Motic Fluo 1.0软件处理测定各组IOD值、Western blot图像灰度值采用Image J软件分析、所有图片通过GraphPad Prism 5软件完成。
2 结 果
2.1 紫杉醇对MDA-MB-231细胞增殖的影响
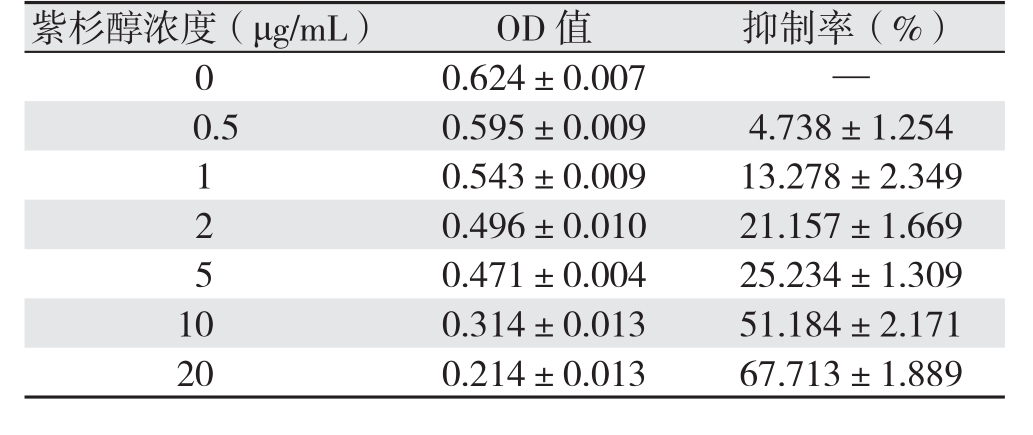
用不同浓度紫杉醇(0.5~20 μg/mL)处理MDA-MB-231细胞48 h后,CCK-8法检测细胞活性,绘制生长抑制曲线(表1)(图1),结果显示,随着紫杉醇浓度增高,MDA-MB-231细胞的增殖抑制率逐渐增加,呈浓度依赖性(P<0.05),经计算,紫杉醇IC25为3.11 μg/mL,选择IC25作为后续实验浓度。
表1 不同浓度紫杉醇作用后的OD值与细胞生长抑制率( ±s)
±s)
Table 1 OD values and cell growth inhibition rates after treatment of different concentrations of paclitaxel( ±s)
±s)
 20 0.214±0.013 67.713±1.889
20 0.214±0.013 67.713±1.889
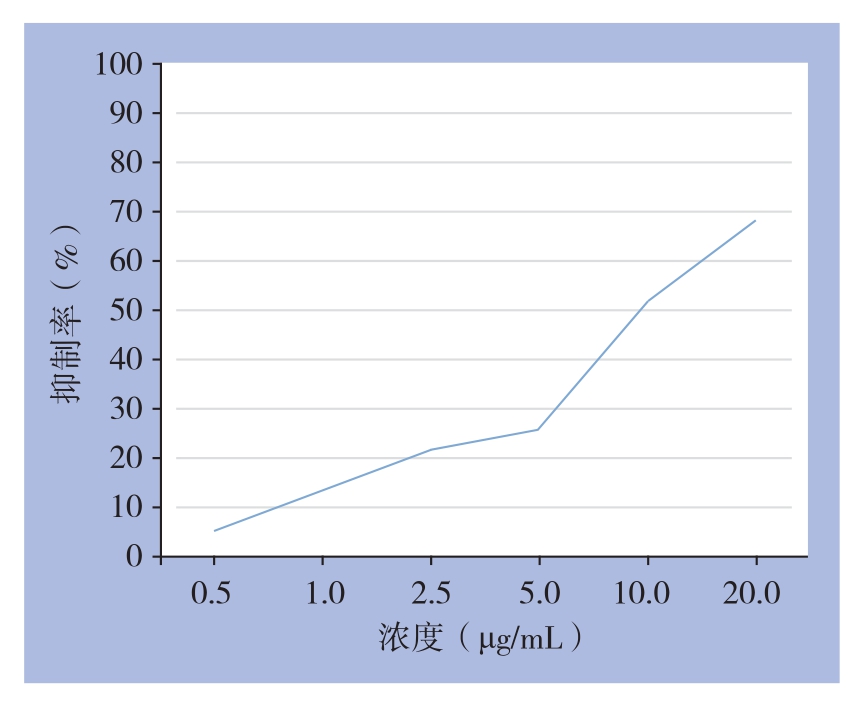
图1 不同浓度紫杉醇下MDA-MB-231细胞生长曲线
Figure 1 Survival curve of MDA-MB-231 cells under diあ erent concentrations of paclitaxel
2.2 紫杉醇对MDA-MB-231细胞LC3表达的影响
应用免疫荧光化学法和Western blot分别从定性与定量两方面检测紫杉醇对MDA-MB-231细胞LC3表达的影响,在荧光显微镜下观察(图2),与对照组比较,实验组细胞中代表LC3的红色荧光亮度增多增强,主要分布于细胞核周围的细胞质中。统计分析结果显示,实验组IOD值较对照组明显增高(P=0.0 018)。
LC3分为LC3A和LC3B两种亚型,自噬时主要以LC3B形式存在。Western blot结果显示,对照组LC3B/LC3A相对含量为0.9 657±0.0 685,实验组为1.6 394±0.0 282,与对照组比较,实验组LC3B/LC3A比例明显提高(P=0.0 009)(图3)。
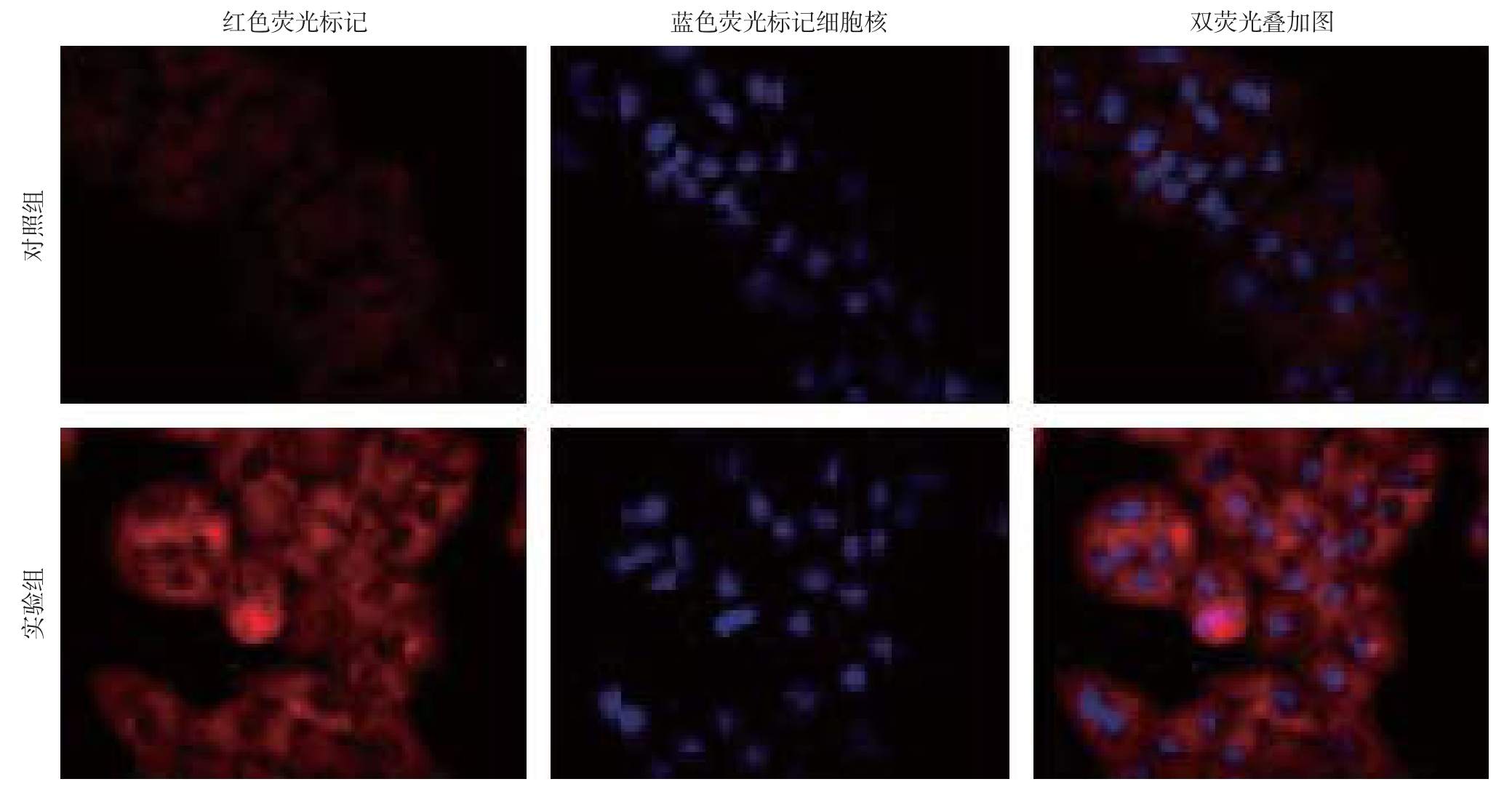
图2 免疫荧光法检测LC3表达
Figure 2 Immumofl uorescence staining for LC3 expression
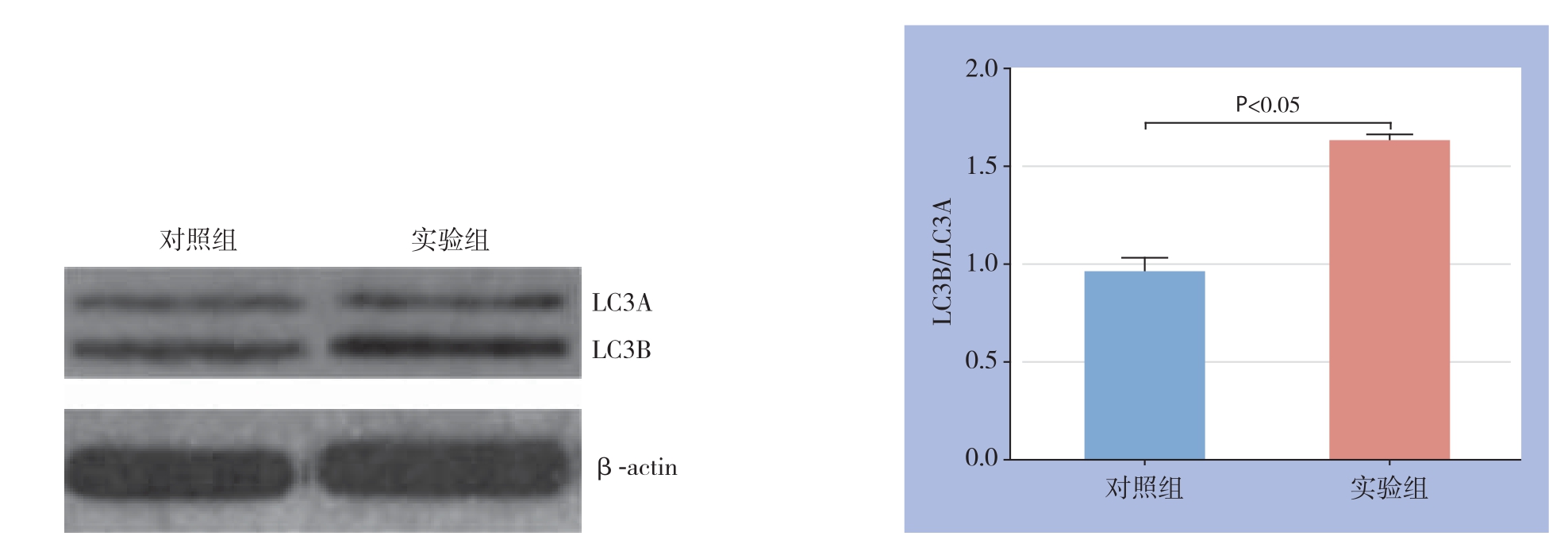
图3 Western blot检测LC3蛋白表达
Figure 3 Western blot analysis for LC3 protein expression
2.3 凋亡相关蛋白及细胞凋亡情况检测
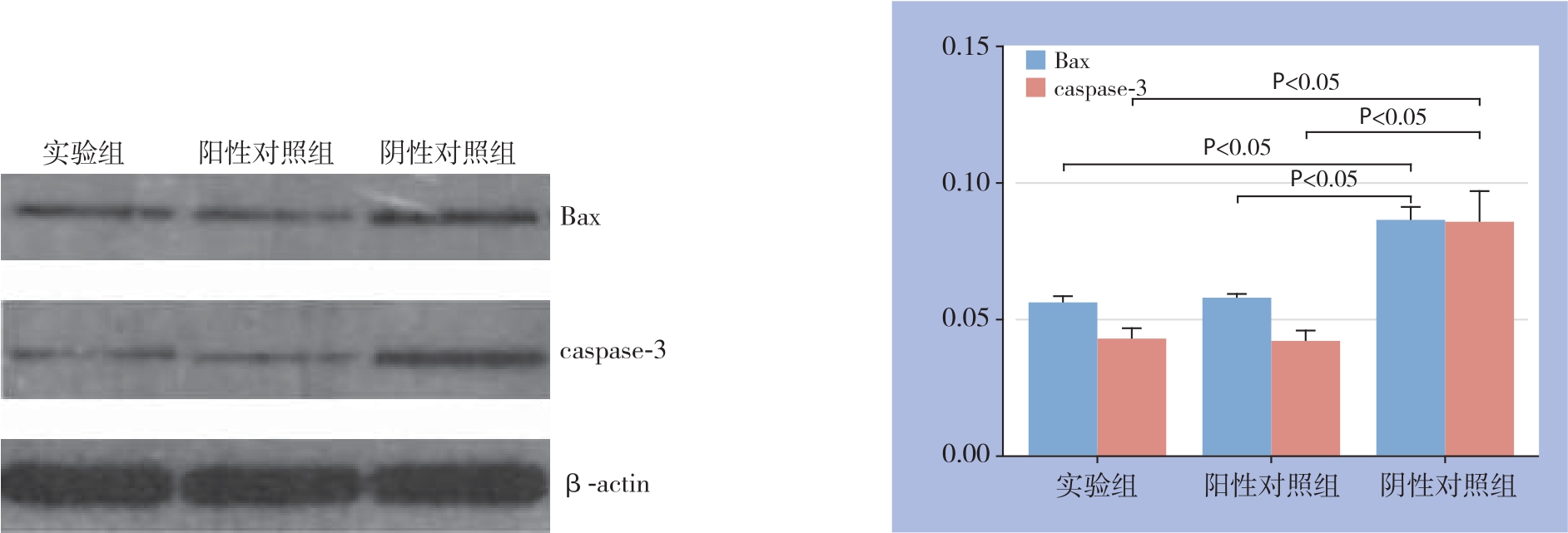
图4 Western blot检测Bax、caspase-3蛋白表达
Figure 4 Western blot analysis for Bax and caspase-3 protein expressions
Western blot结果显示,实验组和阳性对照组Bax蛋白表达较阴性对照组明显降低(P=0.0 005、0.0 004),而实验组与阳性对照组之间无统计学差异(P=0.2 847);实验组与阳性对照组caspase-3蛋白的表达也较阴性对照组低(P=0.0 034、0.0 032),而实验组与阳性对照组之间无统计学差异(P=0.9 599)(图4)。
流式细胞术检测结果显示,实验组细胞总凋亡率为(10.21±0.03)%、阳性对照组为(11.99±0.15)%、阴性对照组为(25.06±0.03)% ,实验组和阳性对照组的细胞总凋亡率均低于阴性对照组(P=0.0 056、0.0 067);实验组细胞早期调亡率为(6.53±0.06)%、阳性对照组为(6.28±0.06)%、阴性对照组为(12.74±0.07)%,实验组和阳性对照组的早期调亡率均低于阴性对照组(P=0.0 035、0.0 039)。实验组与阳性对照组细胞总凋亡率、早期凋亡率均无统计学差异(P=0.6 744、0.4 506)(图5)。
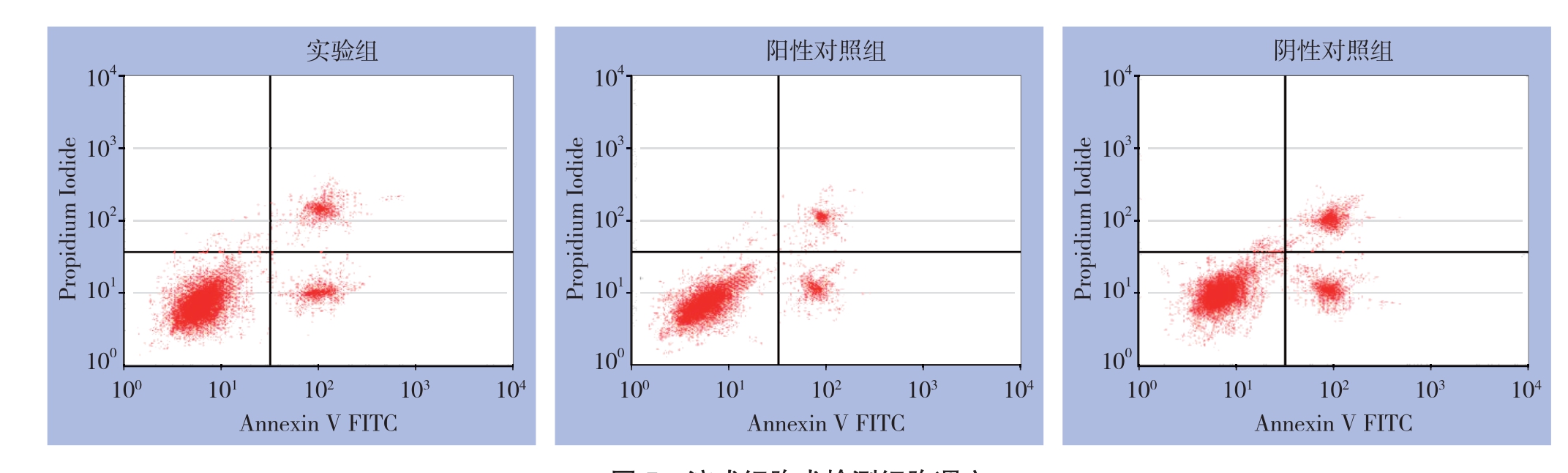
图5 流式细胞术检测细胞凋亡
Figure 5 Apoptosis analysis by fl ow cytometry
3 讨 论
乳腺癌已成为女性第一位的恶性肿瘤,严重威胁妇女的生命健康。其中TNBC约占所有乳腺癌的15%~20%,具有发病年龄较小、分化差、侵袭性强、容易复发和转移、临床预后较差的特点。因缺乏ER、PR和Her-2表达,对以ER、PR为靶点的内分泌治疗和以Her-2为靶点的靶向药物治疗不敏感,成为临床预后较差的乳腺肿瘤。TNBC除手术、放疗外,化疗是其主要治疗手段之一。多个大型临床研究和诊疗指南均推荐含紫杉类和(或)蒽环类的化疗方案作为TNBC化疗的首选方案[16-18]。本研究应用CCK-8检测人MDA-MB-231细胞对紫杉醇的抗肿瘤作用,结果显示随着紫杉醇浓度的提高,MDA-MB-231细胞的增值抑制率逐渐增加,呈浓度依赖性,提示紫杉醇在体外细胞中能抑制MDA-MB-231细胞的增殖而发挥抗肿瘤作用。当紫杉醇浓度为3.11 μg/mL,肿瘤细胞增殖抑制率达到25%(IC25),与笔者前期实验相符[19]。文献[11]报道和笔者的前期研究均证实,紫杉醇在用药一段时间后出现药物敏感性下降,产生耐药性[20-22],在一定程度上限制了紫杉醇在临床中的应用。
肿瘤耐药是一个复杂的过程,虽然有多种学说解译肿瘤细胞耐药产生的机制,但均未能完全解决问题。在已报道的众多耐药机制研究中,包括了肿瘤细胞的自噬。自噬是细胞维持自身稳定性的生理过程,是溶酶体降解途径,通过细胞的自噬作用而降解或清除不需要的代谢产物或(和)损伤的细胞器,或重新利用降解后的生物大分子和能量,以维持细胞的稳定状态[23]。根据自噬底物运送至溶酶体腔方式的不同,自噬可分为大自噬(marcroautophagy)、小自噬(microautophagy)、分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)3种。自噬过程由自噬相关基因(autophagy associated gene,Atg)介导,多种上下游调控信号途径传导,主要有依赖mTOR(mammalian target of rapamycin,mTOR)和非依赖mTOR途径,如Class III PI3K、P53、RAS-MAPK等[24]。Atg最初是在酵母菌中被发现,迄今为止已鉴定出30余种直接参与自噬形成以及调控的相关基因。LC3分为LC3I(或LC3A)和LC3II(或LC3B)2种形式,Atg7在Atg4的参与下活化形成LC3A,并在Atg3的协同下与磷脂酰乙醇胺结合,形成LC3B。LC3B具有融合特性,定位于自噬体膜上,可促进自噬泡的延伸[14],因此LC3是自噬的重要标记物[25]。
近年来研究发现自噬参与多种生理病理过程,如组织发育、分化、抗衰老、免疫调节、清除微生物,以及肿瘤的发生与发展等[26-27]。正常情况下细胞的自噬作用主要是维持细胞的稳定状态,但在某些情况下,如饥饿、低氧、药物等因素可以改变细胞自噬水平,使其提高或降低自噬能力。自噬与肿瘤的发展及耐药密切相关,化疗、放疗和内分泌治疗均可诱导肿瘤细胞发生自噬[28]。文献[14-15]报道显示,在肺癌A549细胞、人胶质瘤U87细胞、卵巢癌顺铂耐药细胞SK-OV/DDP、乳腺癌MCF-7细胞的研究中,均发现紫杉醇能诱导肿瘤细胞发生自噬。本实验中应用免疫荧光法及Western blot检测均证实,紫杉醇作用于MDA-MB-231细胞后,与对照组相比,自噬相关蛋白LC3 B/A的分布增多,含量增高,证实紫杉醇可诱导MDA-MB-231发生自噬。
为进一步证实紫杉醇诱导MDA-MB-231细胞上调LC3(LC3B/LC3A)的情况下,紫杉醇对MDA-MB-231细胞凋亡的影响,本实验进一步检测了不同情况下的MDA-MB-231细胞的凋亡相关因子caspase-3及Bax蛋白水平表达和肿瘤细胞凋亡率。与未发生LC3蛋白表达变化的细胞组相比,实验组与LC3阳性细胞组的相关凋亡蛋白Bax和caspase-3降低,流式细胞术检测早期凋亡率和总凋亡率下降,提示LC3的存在降低了紫杉醇对MDA-MB-231细胞的敏感性。文献[29-30]报道,自噬相关蛋白LC3是一种微管结合蛋白,在自噬过程中LC3被转化形成溶于细胞质的LC3 A并被Atg5募集向自噬体膜,最后被转化形成LC3B,定位于自噬体膜上募集脂质分子,保证自噬体膜的进一步扩展并封闭。紫杉醇作用靶点是微管,诱导自噬相关蛋白LC3表达变化可能与此有关。
结合本研究和文献报道资料,笔者认为紫杉醇作为化疗药物,一方面对MDA-MB-231细胞有抑制作用,同时又能诱导MDA-MB-231细胞引起自噬相关蛋白LC3表达变化,并在此基础上可降低紫杉醇对MDA-MB-231细胞的促调亡效应。提示LC3可能通过调节肿瘤细胞的自噬而影响紫杉醇的耐药性,可能作为未来研究TNBC紫杉醇耐药,提高药物敏感性的新靶点。
参考文献
[1] 高国璇, 辛灵, 刘倩,等. St Gallen国际乳腺癌会议专家共识10年历程回顾[J]. 中国实用外科杂志, 2014, 34(1):70–72.Gao GX, Xin L, Liu Q, et al. Review for the St Gallen international expert consensus from 2003 to 2013[J]. Chinese Journal of Practical Surgery, 2014, 34(1):70–72.
[2] Abramson VG, Lehmann BD, Ballinger TJ, et al. Subtyping of triple-negative breast cancer: implications for therapy[J]. Cancer,2015, 121(1):8–16. doi: 10.1002/cncr.28914.
[3] Carey LA, Perou CM, Livasy CA, et al. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study[J].JAMA, 2006, 295(21):2492–2502. doi: 10.1001/jama.295.21.2492
[4] Anders CK, Carey LA. Biology, metastatic patterns, and treatment of patients with triple-negative breast cancer[J]. Clin Breast Cancer,2009, 9(Suppl 2):S73–81. doi: 10.3816/CBC.2009.s.008.
[5] Rody A, Karn T, Solbach C, et al. The erbB2+ cluster of the intrinsic gene set predicts tumor response of breast cancer patients receiving neoadjuvant chemotherapy with docetaxel, doxorubicin and cyclophosphamide within the GEPARTRIO trial[J]. Breast,2007, 16(3):235–240. doi: 10.1016/j.breast.2007.02.006.
[6] Foulkes WD, Smith IE, Reis-Filho JS. Triple-negative breast cancer[J]. N Engl J Med, 2010, 363(20):1938–1948. doi: 10.1056/NEJMra1001389.
[7] Kumar P, Aggarwal R. An overview of triple-negative breast cancer[J]. Arch Gynecol Obstet, 2016, 293(2):247–269. doi:10.1007/s00404–015–3859-y.
[8] Sharma P. Biology and Management of Patients With Triple-Negative Breast Cancer[J]. Oncologist, 2016, 21(9):1050–1062.doi: 10.1634/theoncologist.2016–0067.
[9] Mustacchi G, De Laurentiis M. The role of taxanes in triplenegative breast cancer: literature review[J]. Drug Des Devel Ther,2015, 9:4303–4318. doi: 10.2147/DDDT.S86105.
[10] Murray S, Briasoulis E, Linardou H, et al. Taxane resistance in breast cancer: mechanisms, predictive biomarkers and circumvention strategies[J]. Cancer Treat Rev, 2012, 38(7):890–903. doi: 10.1016/j.ctrv.2012.02.011.
[11] Kumar P, Zhang DM, Degenhardt K, et al. Autophagy and transporter-based multi-drug resistance[J]. Cells, 2012, 1(3):558–575. doi: 10.3390/cells1030558.
[12] Panzarini E, Dini L. Nanomaterial-induced autophagy: a new reversal MDR tool in cancer therapy?[J]. Mol Pharm, 2014,11(8):2527–2538. doi: 10.1021/mp500066v.
[13] Noda NN, Inagaki F. Mechanisms of Autophagy[J]. Annu Rev Biophys, 2015, 44:101–122. doi: 10.1146/annurevbiophys–060414–034248.
[14] Zhang Q, Si S, Schoen S, et al. Suppression of autophagy enhances preferential toxicity of paclitaxel to folliculin-defi cient renal cancer cells[J]. J Exp Clin Cancer Res, 2013, 32:99. doi: 10.1186/1756–9966–32–99.
[15] Xi G, Hu X, Wu B, et al. Autophagy inhibition promotes paclitaxelinduced apoptosis in cancer cells[J]. Cancer Lett, 2011, 307(2):141–148. doi: 10.1016/j.canlet.2011.03.026.
[16] Hudis CA, Gianni L. Triple-negative breast cancer: an unmet medical need[J]. Oncologist, 2011, 16(Suppl 1):1–11. doi: 10.1634/theoncologist.2011-S1–01.
[17] Ghersi D, Willson ML, Chan MM, et al. Taxane-containing regimens for metastatic breast cancer[J]. Cochrane Database Syst Rev, 2015, (6):CD003366. doi: 10.1002/14651858.CD003366.
[18] Rapoport BL, Nayler S, Demetriou GS,et al. Triple-negative breast cancer pathologic diagnosis and current chemotherapy treatment options[J]. Oncol Hematol Rev, 2014, 10(1):25–32. doi: http://doi.org/10.17925/OHR.2014.10.1.25.
[19] 刘利, 杨农, 邱霞, 等. 叶酸及亚甲基四氢叶酸还原酶基因多态性与乳腺癌细胞多药耐药的相关性分析[J]. 现代肿瘤学, 2015,23(3):306–310.Liu L, Yang N, Qiu X, et al. Correlation of folate and methylenetetrahydrofolate reductase gene polymorphism and multidrug resistant breast cancer cells[J]. Journal of Modern Oncology, 2015, 23(3):306–310.
[20] 吴至佛, 汪灵, 黄俊辉. 三阴性乳腺癌的生物标记物研究进展[J].中国普通外科杂志, 2017, 26(11):1472–1477. doi:10.3978/j.issn.1005–6947.2017.11.016.Wu ZF, Wang L, Huang JH. Research progress on biomarkers of triple-negative breast cancer[J]. Chinese Journal of General Surgery, 2017, 26(11):1472–1477. doi:10.3978/j.issn.1005–6947.2017.11.016.
[21] 黄俊辉, 张铁, 黄玉婷, 等. MIF对耐ADM人乳腺癌细胞MCF-7/ADM体内外耐药逆转作用[J]. 中南大学学报: 医学版, 2010,35(6):576–583.Huang JH, Zhang T, Huang YT, et al. Reversal effect of mifepristone on adriamycin resistance in human breast cancer cell line MCF-7/ADM in vitro and in vivo[J]. Journal of Central South University: Medical Sciences, 2010, 35(6):576–583.
[22] 邱霞, 杨国荣, 刘利, 等. Wnt5a基因在乳腺癌细胞株MCF-7中的表达及其与E-钙黏蛋白、波形蛋白基因的关系[J]. 肿瘤研究与临床, 2016, 28(10):649–653. doi:10.3760/cma.j.issn.1006–9801.2016.10.001.Qiu X, Yang GR, Liu L, et al. Expression of Wnt5a gene in breast cancer cell line MCF-7 and its relationship with E-cadherin or vimentin[J]. Cancer Research and Clinic, 2016, 28(10):649–653.doi:10.3760/cma.j.issn.1006–9801.2016.10.001.
[23] Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4):728–741. doi: 10.1016/j.cell.2011.10.026.
[24] Eskelinen EL, Saftig P. Autophagy: a lysosomal degradation pathway with a central role in health and disease[J]. Biochim Biophys Acta, 2009, 1793(4):664–673. doi: 10.1016/j.bbamcr.2008.07.014.
[25] Suzuki K, Kubota Y, Sekito T, et al. Hierarchy of Atg proteins in pre-autophagosomal structure organization[J]. Genes Cells, 2007,12(2):209–218. doi: 10.1111/j.1365–2443.2007.01050.x.
[26] Jiang P, Mizushima N. Autophagy and human diseases[J]. Cell Res,2014, 24(1):69–79. doi: 10.1038/cr.2013.161.
[27] White E. Deconvoluting the context-dependent role for autophagy in cancer[J]. Nat Rev Cancer, 2012, 12(6):401–410. doi: 10.1038/nrc3262.
[28] Janku F, McConkey DJ, Hong DS, et al. Autophagy as a target for anticancer therapy[J]. Nat Rev Clin Oncol, 2011, 8(9):528–539. doi:10.1038/nrclinonc.2011.71.
[29] Lee YK, Lee JA. Role of the mammalian ATG8/LC3 family in autophagy: differential and compensatory roles in the spatiotemporal regulation of autophagy[J]. BMB Rep, 2016, 49(8):424–430.
[30] Alonso S, Pethe K, Russell DG, et al. Lysosomal killing of Mycobacterium mediated by ubiquitin-derived peptides is enhanced by autophagy[J]. Proc Natl Acad Sci U S A, 2007, 104(14):6031–6036. doi: 10.1073/pnas.0700036104.