肝细胞癌是全球第六大恶性肿瘤,同时也是病死率排在第3位的癌症[1–2]。近年来,虽然我国肝癌的发病率与病死率较之前有下降趋势,但由于人口基数大,每年仍有大量增加的肝癌病例。随着肝癌筛查手段的不断提高,小肝癌检出比例明显升高[3]。Du等[4]研究显示,微血管浸润(microvascular invasion,MVI)是影响小肝癌患者总生存的独立危险因素。MVI作为肿瘤侵袭性的指标,对肝癌术后的良好诊断效果受到了广泛的重视。一些学者[5–6]认为MVI是肝癌发生肝内或全身转移的第一步;若能在术前对小肝癌患者MVI存在与否进行诊断,将对治疗方案的制定起到积极的辅助作用。目前MVI的确定主要依赖于术后肿瘤的病理学检查[7],虽然影像学检查在一定程度上能对MVI进行术前诊断,但由于准确度、敏感度以及成本的制约,并未得到有效的推广。因此,发现一种方便、简单的,术前可对小肝癌患者是否并发MVI进行预测的有效标记物具有重要意义。
自炎症被认为是一个重要的致癌因子后[8],越来越多的研究证实,机体炎性反应和免疫状态的改变与肿瘤的发生、发展有着密切的关系。外周血中性粒细胞和淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)被认为对肝癌患者的无复发生存和总生存有着良好的预测作用[9],由此我们可以假设术前NLR也可用来预测小肝癌患者是否存在MVI。由于我国相关研究较少,因此本研究通过回顾性分析,旨在探讨术前外周血NLR水平对于小肝癌患者并发MVI的预测价值。现将结果报告如下。
1 资料与方法
1.1 研究对象
通过调取电子病历及相关住院记录,收集2012年6月—2017年6月郑州大学第一附属医院所收治并确诊的临床资料完善并接受外科治疗的小肝癌并发MVI患者50例,并采用随机数字表法选择同期确诊的资料完善的90例接受外科治疗的小肝癌未并发MVI作为对照组。病例纳入标准:⑴ 肿瘤单发,直径大小不超过5 cm,且肝功能储备正常;⑵ 肝功能Child分级为A级或B级;⑶ 所有患者均于全麻下行肝癌切除术且为同一治疗团队的手术患者;⑷ 病理诊断为原发性肝癌;⑸ MVI的诊断标准是指在显微镜下于内皮细胞衬覆的脉管腔内见到癌细胞巢团,以门静脉分支为主(含包膜内血管)[10]。排除标准:合并有其他部位恶性肿瘤的患者;有临床证据表明伴发感染或炎症状态的患者。小肝癌并发MVI患者与小肝癌未并发MVI患者的典型病理图片见图1。
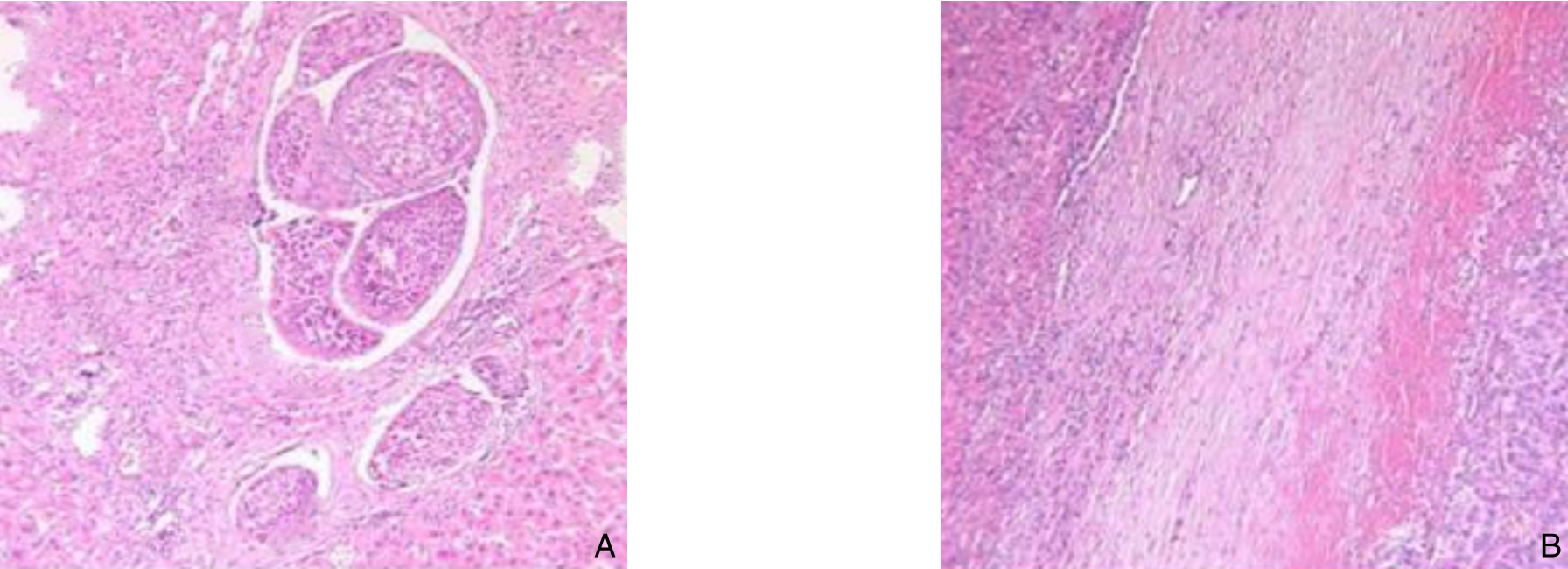
图1 患者病理切片(HE ×100) A:小肝癌并发MVI;B:小肝癌未并发MVI
Figure 1 Pathological sections of the patients (HE ×100) A: Small HCC with MVI; B: Small HCC without MVI
1.2 方法
选取本院电子病历系统中最接近手术日期的血常规、血生化等检测指标作为术前临床指标;根据术后病理报告记录病理指标。血NLR由血中性粒细胞绝对值除以血淋巴细胞绝对值计算而来。绘制NLR的受试者工作特征(receiver operating characteristic,ROC)曲线,确定NLR的临界值,临界值定义为敏感度与特异度之和最大的NLR值。
1.3 统计学处理
原始数据经过整理,采用SPSS 21.0软件进行数据分析。计量资料采用均数±标准差(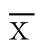 ±s)表示,两组间数据比较采用独立样本t检验;两组间计数资料用率表示,采用χ2检验。将单因素分析结果显示差异有统计学意义的变量进行非条件Logistic回归模型分析,筛选出相应的独立危险因素。P<0.05为差异有统计学意义。
±s)表示,两组间数据比较采用独立样本t检验;两组间计数资料用率表示,采用χ2检验。将单因素分析结果显示差异有统计学意义的变量进行非条件Logistic回归模型分析,筛选出相应的独立危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 NLR临界值的确定
ROC曲线分析显示,NLR的ROC曲线下面积为0.613(95% CI=0.511~0.715,P=0.027)。当Youden指数取最大值时,NLR的临界值为3.27,对应的敏感度为0.480,特异度为0.767(图2)。
2.2 单因素分析
对计量资料进行分组,转化为计数资料,然后用χ2检验进行单因素分析。结果显示:两组患者在年龄、性别、肝硬化病史、慢性病毒性肝炎病史、Child-Pugh分级、白细胞数目、中性粒细胞数目、淋巴细胞数目、血小板数目、凝血酶原时间、国际标准化比值、丙氨酸转氨酶、天冬氨酸转氨酶、总胆红素及白蛋白上差异均无统计学意义(均P>0.05)。MVI组患者的甲胎蛋白(AFP)、NLR和肿瘤最大直径数值均明显高于非MVI组患者,它们都是小肝癌患者并发MVI的危险因素(均P<0.05)(表1)。
2.3 多因素分析
以是否发生术后并发症作为因变量,以单因素分析显示有统计学意义的3种因素作为自变量,进行非条件Logistic回归模型分析。结果显示AFP、NLR和肿瘤最大直径均为小肝癌患者并发MVI的独立危险因素(均P<0.05)(表2)。
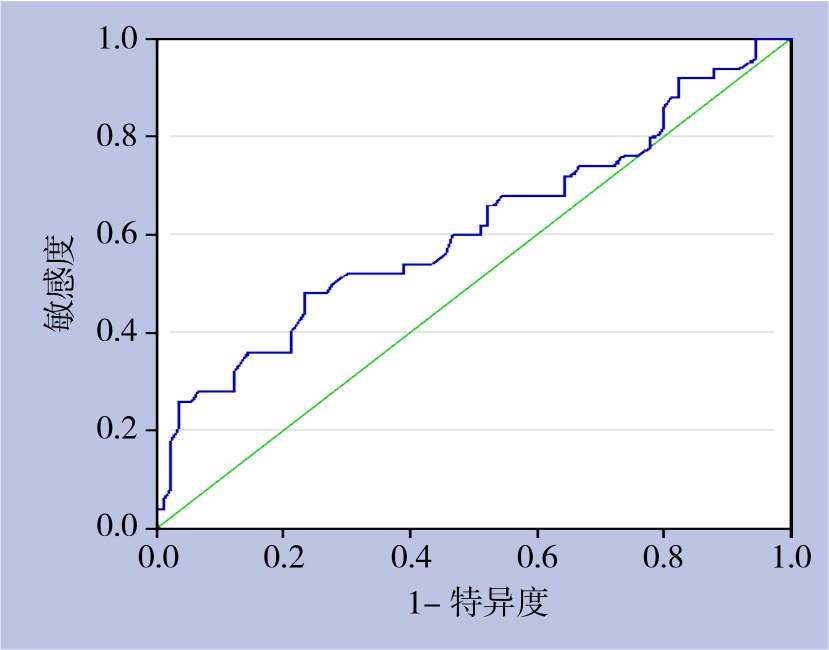
图2 NLR与小肝癌并发MVI关系的ROC曲线
Figure 2 The ROC curve of NLR for diagnosis of small HCC with complicated MVI
表1 小肝癌并发MVI的单因素分析[n(%)]
Table 1 Univariate analysis of factors for small HCC with complicated MVI [n (%)]
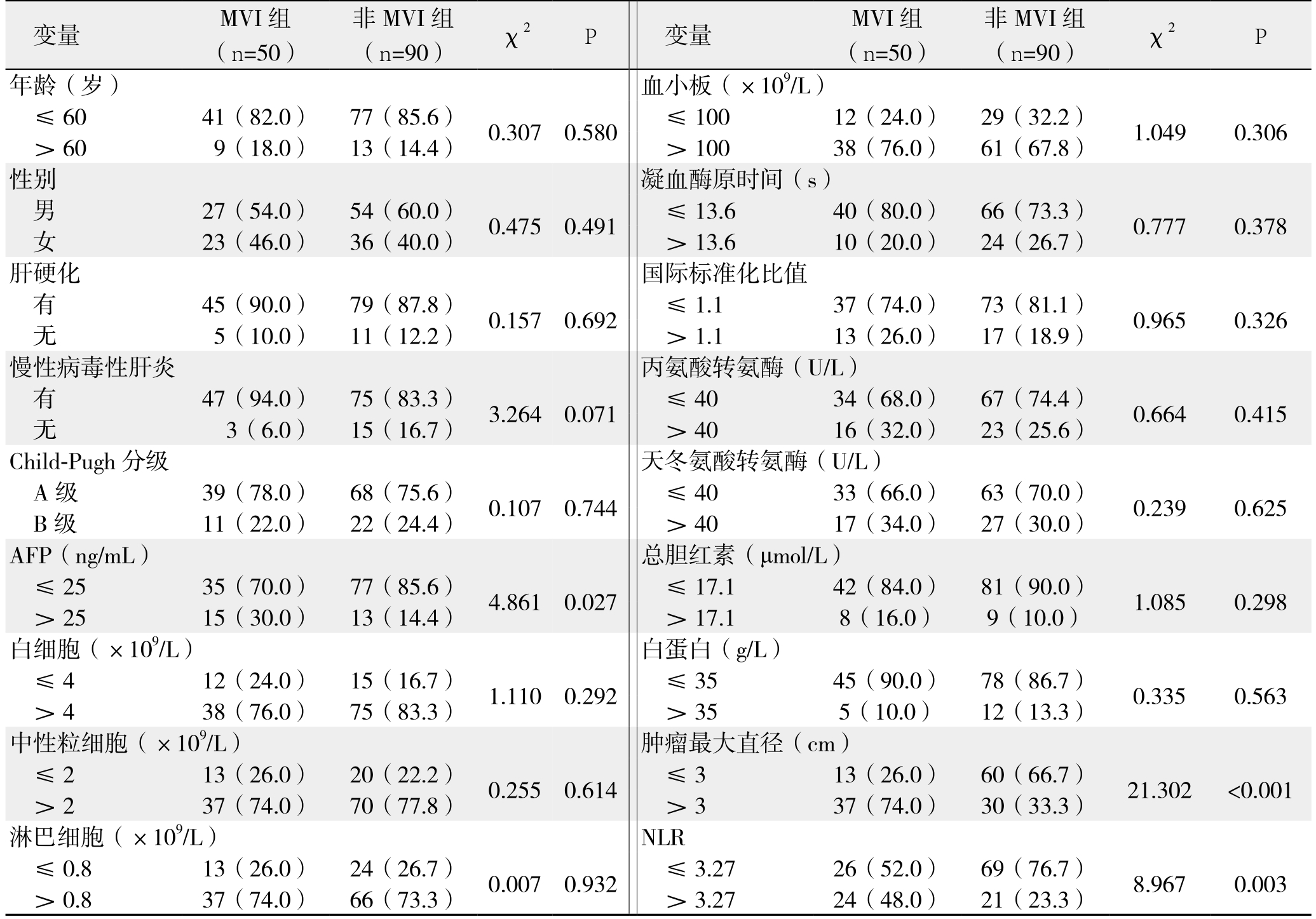
变量 MVI组(n=50)非MVI组(n=90) χ2 P 变量 MVI组(n=50)非MVI组(n=90) χ2 P年龄(岁) 血小板(×109/L)≤60 41(82.0) 77(85.6) 0.307 0.580 ≤100 12(24.0) 29(32.2) 1.049 0.306>60 9(18.0) 13(14.4) >100 38(76.0) 61(67.8)性别 凝血酶原时间(s)男27(54.0) 54(60.0) 0.475 0.491 ≤13.6 40(80.0) 66(73.3) 0.777 0.378女23(46.0) 36(40.0) >13.6 10(20.0) 24(26.7)肝硬化 国际标准化比值有45(90.0) 79(87.8) 0.157 0.692 ≤1.1 37(74.0) 73(81.1) 0.965 0.326无5(10.0) 11(12.2) >1.1 13(26.0) 17(18.9)慢性病毒性肝炎 丙氨酸转氨酶(U/L)有47(94.0) 75(83.3) 3.264 0.071 ≤40 34(68.0) 67(74.4) 0.664 0.415无3(6.0) 15(16.7) >40 16(32.0) 23(25.6)Child-Pugh分级 天冬氨酸转氨酶(U/L)A级 39(78.0) 68(75.6) 0.107 0.744 ≤40 33(66.0) 63(70.0) 0.239 0.625 B级 11(22.0) 22(24.4) >40 17(34.0) 27(30.0)AFP(ng/mL) 总胆红素(μmol/L)≤25 35(70.0) 77(85.6) 4.861 0.027 ≤17.1 42(84.0) 81(90.0) 1.085 0.298>25 15(30.0) 13(14.4) >17.1 8(16.0) 9(10.0)白细胞(×109/L) 白蛋白(g/L)≤4 12(24.0) 15(16.7) 1.110 0.292 ≤35 45(90.0) 78(86.7) 0.335 0.563>4 38(76.0) 75(83.3) >35 5(10.0) 12(13.3)中性粒细胞(×109/L) 肿瘤最大直径(cm)≤2 13(26.0) 20(22.2) 0.255 0.614 ≤3 13(26.0) 60(66.7) 21.302 <0.001>2 37(74.0) 70(77.8) >3 37(74.0) 30(33.3)淋巴细胞(×109/L) NLR≤0.8 13(26.0) 24(26.7) 0.007 0.932 ≤3.27 26(52.0) 69(76.7) 8.967 0.003>0.8 37(74.0) 66(73.3) >3.27 24(48.0) 21(23.3)
2.4 NLR与小肝癌并发MVI相关临床因素的关系
根据NLR大小将患者分为NLR≤3.27组和NLR>3.27组,比较两组各项临床指标。结果显示:NLR≤3.27组在AFP、中性粒细胞、淋巴细胞、血小板、白蛋白及肿瘤最大直径方面优于NLR>3.27组,差异有统计学意义(均P<0.05)(表3)。
表2 小肝癌并发MVI的非条件Logistic回归分析
Table 2 Unconditional Logistic regression analysis of factors for small HCC with complicated MVI
?
表3 NLR与小肝癌患者临床指标的关系( ±s)
±s)
Table 3 Relations of NLR with other clinical variables in patients with small HCC (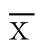 ±s)
±s)
变量 NLR≤3.27组(n=95) NLR>3.27组(n=45) t P AFP(ng/mL) 19.74±6.31 29.63±7.80 8.013 <0.001中性粒细胞(×109/L) 4.33±1.17 4.80±1.30 2.141 0.034淋巴细胞(×109/L) 1.35±0.52 1.56±0.64 2.068 0.041血小板(×109/L) 218.60±106.25 259.92±117.12 2.079 0.040白蛋白(g/L) 31.21±4.62 29.09±4.13 2.621 0.010肿瘤最大直径(cm) 3.17±0.95 3.52±0.77 2.157 0.033
3 讨 论
研究[11]表明,小肝癌具有特殊的生物学行为和病理学特点,小肝癌常侵犯血管而在肝内发生转移,进而形成复发,肝内的微小转移灶与MVI有着密不可分的关系。MVI是小肝癌恶性程度增加、侵袭性增强的一个标志[12],是肝内微小转移灶和肿瘤复发灶的最直接的预测信息。随着近年来对肿瘤分子机制相关研究的日益深入,越来越多的证据表明,炎症反应在各个阶段均对肿瘤的发生与发展有着促进作用,增强肿瘤细胞的增殖能力与抗凋亡能力,诱发DNA发生损伤突变,促进血管的生成,增加肿瘤细胞的侵袭能力和转移能力[13]。外周血中NLR可以作为机体炎症反应的标志,反映机体的炎性反应水平。研究发现,炎症反应是影响癌症预后的重要因素[14–15],在结直肠癌、胰腺癌、肺癌、乳腺癌和卵巢癌等多种癌症中,NLR升高者预后较差[16]。
鉴于癌症预后与MVI发生的密切联系,我们提出临床有可能利用NLR预测小肝癌患者MVI的发生。本研究提示NLR与MVI关系密切,通过ROC曲线,兼顾敏感性和特异性,取3.27作为NLR的最佳截点值,结果显示:NLR与小肝癌并发MVI关系的ROC曲线下面积为0.613(95% CI=0.511~0.715,P=0.027),说明采用NLR预测术后并发症的发生有一定的准确性。本研究NLR高危组并发MVI发生率为53.3%明显高于低危组的27.4%(χ2=8.967,P=0.003)。经单因素及多因素分析显示NLR>3.27是发生术后并发症的独立危险因素(P<0.05)。以上结果表明NLR是否大于3.27可以作为预测小肝癌患者MVI发生的良好指标。NLR在一定程度上反映了促肿瘤的炎症反应与抗肿瘤的免疫反应之间的平衡状态[17]。若NLR较高,说明中性粒细胞相对较高或淋巴细胞相对较少,更倾向于促进肿瘤的生长、进展和转移,更有利于形成MVI的微环境。小肝癌患者存在NLR升高的具体生物学机制尚不清楚,推测可能与以下因素相关:肿瘤发生恶性变化前,机体已经存在组织炎症反应[18];中性粒细胞通过分泌多种细胞因子促进肿瘤的发生与发展[19],而且还能够抑制细胞毒性淋巴细胞对肿瘤细胞的杀伤,造成肿瘤细胞的免疫逃逸;淋巴细胞则可以通过激活机体的免疫系统进而对肿瘤产生杀伤作用。当小肝癌患者术前外周血NLR升高时,意味着此平衡已经遭到破环,机体防御能力降低、肿瘤进展,MVI发生的可能性增高,同时也提示患者预后不良。
小肝癌患者并发MVI还和AFP水平及肿瘤最大直径有关。AFP是一种常见的肿瘤血清标志物[20],当肝癌患者出现肝损伤时,肝细胞合成分泌的AFP进入血液循环,导致其浓度升高[21]。AFP能促进肿瘤血管形成,它的升高提示肿瘤的高侵袭性[22]。多因素分析显示,当小肝癌患者AFP水平>25 ng/mL时,合并MVI的风险增加了5.119倍(OR=5.119,P=0.007)。Moriya等[21]研究也显示,AFP水平与肝癌患者的病情程度呈显著正相关,这与本研究结论基本相符。有研究[23]表明,直径≤3 cm的肝癌病理学特点常表现为高分化,MVI及卫星灶较少,肿瘤边界清晰;而直径>3 cm的肿瘤则表现出显著的生物学及病理学特征变化。Logistic回归分析显示,肿瘤最大直径是小肝癌患者并发MVI独立危险因素(P<0.001),OR值为15.071。这提示对于小肝癌患者而言,直径>3cm并发MVI的风险是≤3 cm的15.071倍,证实了肿瘤最大直径在小肝癌患者MVI发生中的重要作用,可见肿瘤大小与MVI关系密切。
本研究结果也显示:NLR≤3.27组的血小板水平低于NLR>3.27组(P=0.040);而其白蛋白指标高于NLR>3.27组(P=0.010)。血小板可刺激肿瘤细胞生长,同时肿瘤细胞产生的炎性介质也可以刺激血小板的增高[24]。肿瘤细胞和血小板之间相互作用,形成血小板-肿瘤细胞栓子复合体,这为肿瘤血管浸润转移等提供了有利的条件。低白蛋白血症可能与白蛋白是一种负性急性时相蛋白有关,它在炎症状态下呈下降趋势[25];也可能是由于潜在的肝脏疾病导致肝脏合成功能受损[26]。
本研究为回顾性研究,论证NLR>3.27与小肝癌患者发生MVI因果关系的能力有限,而且还存在着样本量较少、病例背景存在差别、病例来源较为局限等不足。因此,尚需后期多样本、多中心的研究来进一步验证。
综上所述,NLR>3.27是小肝癌患者发生MVI的危险因素,是预测小肝癌患者MVI发生的良好指标。外科医生可以利用NLR对患者进行危险分级,判断患者是否为MVI的高危人群。这将有助于小肝癌最佳治疗方案的制定,指导肝癌及肝移植等手术方式的选择,从而降低小肝癌术后复发率,改善小肝癌患者术后的总体疗效。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5):E359-E386.doi:10.1002/ijc.29210.
[2] 程康文, 詹勇强, 王成友, 等. 肝癌干细胞标志物研究的进展[J].中国普通外科杂志, 2015, 24(1):110–115. doi:10.3978/j.issn.1005–6947.2015.01.021.Cheng KW, Zhan YQ, Wang CY, et al. Advances in research of liver cancer stem cell markers[J]. Chinese Journal of General Surgery,2015, 24(1):110–115. doi:10.3978/j.issn.1005–6947.2015.01.021..
[3] 荣维淇, 余微波, 吴凡, 等. 切缘和肿瘤数目对小肝癌患者预后的影响[J]. 中华肿瘤杂志, 2015, 37(12):928–931. doi:10.3760/cma.j.issn.0253–3766.2015.12.010.Rong WQ, Yu WB, Wu F, et al. Effect of resection margin and tumor number on survival of patients with small liver cancer[J].Chinese Journal of Oncology, 2015, 37(12):928–931. doi:10.3760/cma.j.issn.0253–3766.2015.12.010.
[4] Du M, Chen L, Zhao J, et al. Microvascular invasion (MVI) is a poorer prognostic predictor for small hepatocellular carcinoma[J].BMC Cancer, 2014, 14:38. doi:10.1186/1471–2407–14–38.
[5] 涂海斌, 郭佳. 影像学诊断肝癌微血管浸润的研究进展[J].中华肝胆外科杂志, 2017, 23(7):488–490. doi:10.3760/cma.j.issn.1007–8118.2017.07.016.Tu HB, Guo J. Radiological updates in diagnosing microvascular invasion of hepatocellular carcinoma[J]. Chinese Journal of Hepatobiliary Surgery, 2017, 23(7):488–490. doi:10.3760/cma.j.issn.1007–8118.2017.07.016.
[6] 贺莎莎, 范晓棠, 祝达, 等. 乙型肝炎相关性肝细胞性肝癌患者术后生存的危险指数模型的建立[J]. 中国普通外科杂志, 2015,24(7):952–957. doi:10.3978/j.issn.1005–6947.2015.07.007.He SS, Fan XT, Zhu D, et al. Establishment of predictive index model for postoperative survival in patients with hepatitis B-related hepatocellular carcinoma[J]. Chinese Journal of General Surgery,2015, 24(7):952–957. doi:10.3978/j.issn.1005–6947.2015.07.007.
[7] 陈洁, 黎乐群. 术前预测肝细胞癌并微血管侵犯的研究进展[J]. 中国普通外科杂志, 2017, 26(7):921–925. doi:10.3978/j.issn. 1005–6947.2017.07.017.Chen J, Li LQ. Research progress of preoperative predicting microvascular invasion of hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2017, 26(7):921–925. doi:10.3978/j.issn.1005–6947.2017.07.017.
[8] Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008 454(7203):436–444. doi:10.1038/nature07205.
[9] Yang HJ, Guo Z, Yang YT, et al. Blood neutrophil-lymphocyte ratio predicts survival after hepatectomy for hepatocellular carcinoma:A propensity score-based analysis[J]. World J Gastroenterol, 2016,22(21):5088–5095. doi:10.3748/wjg.v22.i21.5088.
[10] 中华人民共和国国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017年版)[J]. 中国实用外科杂志, 2017, 37(7):705–720. doi:10.19538/j.cjps.issn1005–2208.2017.07.01.National Health and Family Planning Commission of China.Standardization of diagnosis and treatment for hepatocellular carcinoma (2017 edition)[J]. Chinese Journal of Practical Surgery, 2017, 37(7):705–720. doi: 10.19538/j.cjps.issn1005–2208.2017.07.01.
[11] Duffy JP, Hiatt JR, Busuttil RW. Surgical resection of hepatocellular carcinoma[J]. Cancer J, 2008, 14(2):100–110. doi:10.1097/PPO.0b013e31816a5c1f.
[12] Sumie S, Kuromatsu R, Okuda K, et al. Microvascular invasion in patients with hepatocellular carcinoma and its predictable clinicopathological factors[J]. Ann Surg Oncol, 2008, 15(5):1375–1382. doi:10.1245/s10434–008–9846–9.
[13] Clatot F, Gouérant S, Mareschal S, et al. The gene expression profile of inflammatory, hypoxic and metabolic genes predicts the metastatic spread of human head and neck squamous cell carcinoma[J]. Oral Oncol, 2014, 50(3):200–207. doi:10.1016/j.oraloncology.2013.12.009.
[14] Lu H, Ouyang W, Huang C. Inflammation, a key event in cancer development[J]. Mol Cancer Res, 2006, 4(4):221–233.
[15] McMillan DC. Systemic inflammation, nutritional status and survival in patients with cancer[J]. Curr Opin Clin Nutr Metab Care,2009, 12(3):223–226. doi:10.1097/MCO.0b013e32832a7902.
[16] Tao L, Zhang L, Peng Y, et al. Preoperative neutrophil-tolymphocyte ratio and tumor-related factors to predict lymph node metastasis in patients with pancreatic ductal adenocarcinoma(PDAC)[J]. Oncotarget, 2016, 7(45):74314–74324. doi:10.18632/oncotarget.11031.
[17] 张远标, 卢毅, 吴伟顶, 等. 术前中性粒细胞/淋巴细胞比值在甲胎蛋白阴性肝细胞肝癌术后复发中的预测价值[J]. 中华普通外科杂志, 2016, 31(5):387–390. doi:10.3760/cma.j.issn.1007–631X.2016.05.008.Zhang YB, Lu Y, Wu WD, et al. Preoperative neutrophil-tolymphocyte ratio is an independent prognostic predictor for AFP negative hepatocellular carcinoma after hepatectomy[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2016, 31(5):387–390. doi:10.3760/cma.j.issn.1007–631X.2016.05.008.
[18] Zhou L, Rui JA, Wang SB, et al. Prognostic factors of solitary large hepatocellular carcinoma: the importance of differentiation grade[J]. Eur J Surg Oncol, 2011, 37(6):521–525. doi:10.1016/j.ejso.2011.03.137.
[19] Keizman D, Ish-Shalom M, Huang P, et al. The association of pre-treatment neutrophil to lymphocyte ratio with response rate,progression free survival and overall survival of patients treated with sunitinib for metastatic renal cell carcinoma[J]. Eur J Cancer,2012, 48(2):202–208. doi:10.1016/j.ejca.2011.09.001.
[20] Yu Y, Song J, Zhang R, et al. Preoperative neutrophil-to-lymphocyte ratio and tumor-related factors to predict microvascular invasion in patients with hepatocellular carcinoma[J]. Oncotarget, 2017,8(45):79722–79730. doi:10.18632/oncotarget.19178.
[21] Moriya S, Morimoto M, Numata K, et al. Fucosylated fraction of alpha-fetoprotein as a serological marker of early hepatocellular carcinoma[J]. Anticancer Res, 2013, 33(3):997–1002.
[22] Zhao H, Hua Y, Lu Z, et al. Prognostic value and preoperative predictors of microvascular invasion in solitary hepatocellular carcinoma ≤ 5 cm without macrovascular invasion[J]. Oncotarget,2017, 8(37):61203–61214. doi:10.18632/oncotarget.18049.
[23] 冯龙海, 丛文铭. 高度异型增生结节与高分化小肝细胞癌的病理诊断[J]. 中华肝脏病杂志, 2015, 23(11):870–873. doi:10.3760/cma.j.issn.1007–3418.2015.11.015.Feng LH, Cong WM. Pathology-based differential diagnosis of high-grade dysplastic nodule from well-differentiated small hepatocellular carcinoma[J]. Chinese Journal of Hepatology, 2015,23(11):870–873. doi:10.3760/cma.j.issn.1007–3418.2015.11.015.
[24] 苏子剑, 翟军伟, 潘群雄, 等. 术前血小板/淋巴细胞比值与肝癌预后的关系[J]. 中国普通外科杂志, 2016, 25(1):12–18. doi:10.3978/j.issn.1005–6947.2016.01.003.Su ZJ, Qu JW, Pan QX, et al. Relationship between platelet-tolymphocyte ratio and prognosis in patients with hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2016, 25(1):12–18. doi:10.3978/j.issn.1005–6947.2016.01.003.
[25] Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation[J]. N Engl J Med, 1999, 340(6):448–454.[26] Zheng J, Seier K, Gonen M, et al. Utility of Serum Inflammatory Markers for Predicting Microvascular Invasion and Survival for Patients with Hepatocellular Carcinoma[J]. Ann Surg Oncol, 2017,24(12):3706–3714. doi:10.1245/s10434–017–6060–7.