临床调查显示,胆管癌中80%患者为肝门部胆管癌,严重影响人们身心健康[1-2]。由于肝门部胆管癌会累及患者肝门区血管、淋巴结、神经等,造成其手术难度相对较大。目前,外科手术是肝门部胆管癌唯一有望治疗的方法,术后5年生存率在18%~42%不等[3]。姑息治疗主要包括姑息性手术和介入方法,其中介入治疗如经皮经肝胆道穿刺引流(PTBD)介入,其远期疗效并不十分理想[4-5]。随着医疗外科技术的不断发展,腹腔镜胆管癌根治术在肝门部胆管癌中应用,明显提高了治疗效果和手术成功率[6-7]。因此,本文研究探讨不同外科手术治疗胆管癌患者效果及对患者应激反应和生活质量的影响,旨在为临床外科手术治疗提供一定参考。
1 资料与方法
1.1 临床资料
选择2014年5月—2016年5月我院收治92例肝门部胆管癌患者,按照手术方法不同分为观察组46例与对照组46例。观察组46例中,男28例,女18例;年龄43~78岁,平均年龄(62.37±5.41)岁;按照Bloom分级:I型10例,II型19例,III型17例。对照组46例患者中,男29例,女17例;年龄41~79岁,平均年龄(61.83±4.25)岁;按照Bloom分级:I型9例,II型20例,III型17例。两组一般资料无统计学差异(P>0.05),具有可比性。该研究通过医院伦理委员会批准,且签署了知情同意书。
1.2 纳入标准及排除标准
纳入标准:⑴ 经临床表现、影像学检查或术后病理学检查证实为肝门部胆管癌;⑵ 患者可耐受手术过程疼痛。
排除标准:⑴ 患者存在手术禁忌和姑息性手术禁忌者;⑵ 合并心、肺、肾等功能严重异常者;⑶ 精神疾病者。
1.3 方法
对照组:采用PTBD介入治疗。具体方法如下:取患者仰卧位,在X线监视下,选择管径相对较粗、走向较平直的胆管为目标胆管,按照目标胆管位置确定进针角度和进针管。采用18~21 G塑料套管针在无菌条件下穿刺进入皮肤,快速经肝进入胆道,回抽见胆汁后,将塑料导管外鞘推入胆道,沿着套管针外鞘将金属导丝插入胆管达梗阻远端,是其能够通过梗阻段达十二指肠内,再沿导丝将预选好的金属支架套管送至梗阻段远端1 cm释放支架,再进行造影见胆道通畅,留置胆道外引流以避免出现支架闭塞,于3 d后经外引流管行泛影葡胺造影,外引流管于支架扩张状态良好下拔除。
观察组:采用腹腔镜胆管癌根治术治疗,具体方法如下:全身麻醉,取患者仰卧位,常规消毒铺巾,按照患者病变部位选择体位,病变位置充分暴露。于患者病灶对应表面切开皮肤1.0 cm左右,穿刺气腹针,将镜头Trocar、操作臂Trocar及辅助Trocar在监视下放置。术中置入超声套头后,按照顺序排查肝脏。按照探查结果实施腹腔镜引导下的肝门部胆管癌切除手术,术毕确定无出血停气腹,拔出Trocar,缝合切口,包扎固定。
1.4 观察指标
⑴ 观察两组近期疗效情况,依据WHO制定的实体瘤疗效判定标准,分为完全缓解、部分缓解、稳定、进展,其中以患者可见肿瘤消失且持续1个月以上为完全缓解;以患者肿瘤2个最大的相互垂直的直径的乘积缩小50%以上,且持续1个月以上为部分缓解;以患者肿瘤2个最大的相互垂直的直径的乘积缩小不足50%,或增大不超过25%,且持续1个月以上为稳定;以患者肿瘤2个最大的相互垂直的直径乘积增大超过25%为进展。以完全缓解率与部分缓解率之和为有效率; ⑵ 观察两组术后并发症;⑶ 观察两组术前和术后24 h应激反应指标变化,包括皮质醇(Cor)、白介素-6(IL-6)和去甲肾上腺素(NE),分别于术前和术后24 h采集患者外周静脉血3 mL,分离血浆标本,放置于-20 ℃下保持待测;⑷ 观察两组术后3个月生活质量改善情况,采用功能状态评分标准(KPS评分)评价,包括生活质量提高、稳定、下降;⑸ 观察两组随访1年和2年生存率。
1.5 统计学处理
数据采用SPSS 22.0统计学软件处理。运用χ2检验方法检验计数资料,运用t检验方法检验计量资料。P<0.05表示具有统计学差异。
2 结 果
2.1 两组近期疗效比较
观察组总有效率为78.26%,对照组为58.70%,组间差异有统计学意义(P<0.05)(表1)。
表1 两组近期疗效比较
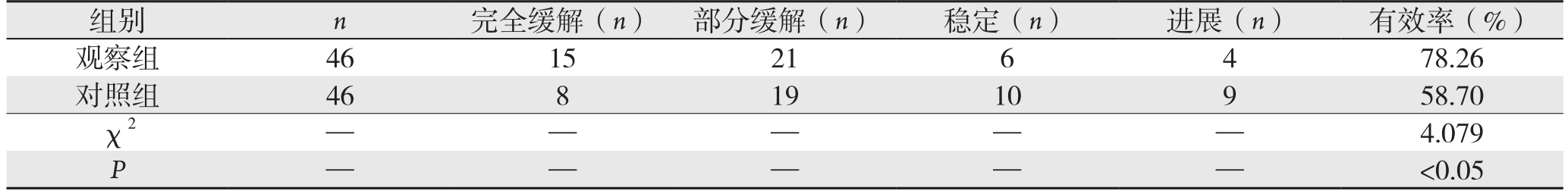
组别 n 完全缓解(n) 部分缓解(n) 稳定(n) 进展(n) 有效率(%)观察组 46 15 21 6 4 78.26对照组 46 8 19 10 9 58.70 χ2— — — — —4.079 P——<0.05
2.2 两组术后并发症比较
观察组术后并发症发生率10.87%,低于对照组的26.09%,组间差异有统计学意义(P<0.05)(表2)。
表2 两组术后并发症比较
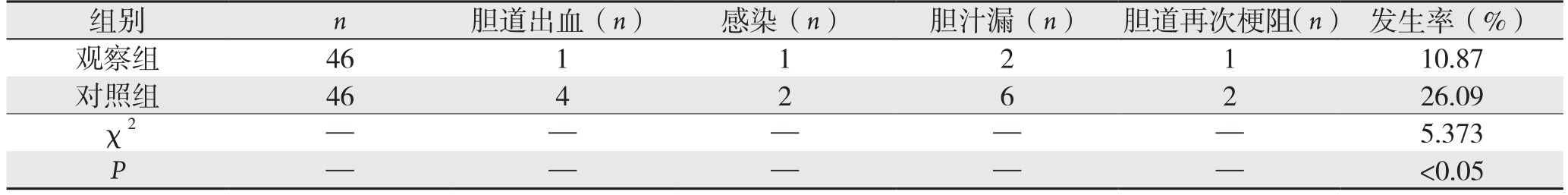
组别 n 胆道出血(n) 感染(n) 胆汁漏(n) 胆道再次梗阻(n) 发生率(%)观察组 46 1 1 2 1 10.87对照组 46 4 2 6 2 26.09 χ2— — — — —5.373 P——<0.05
2.3 两组术前和术后24 h应激反应指标比较
两组术前血浆Cor、IL-6和NE含量比较无统计学差异(P>0.05);术后24 h血浆Cor、IL-6和NE含量均较术前升高(P<0.05);观察组术后24 h血浆Cor、IL-6和NE含量低于对照组(P<0.05)(表3)。
表3 两组术前和术后24 h应激反应指标变化比较( ±s)
±s)
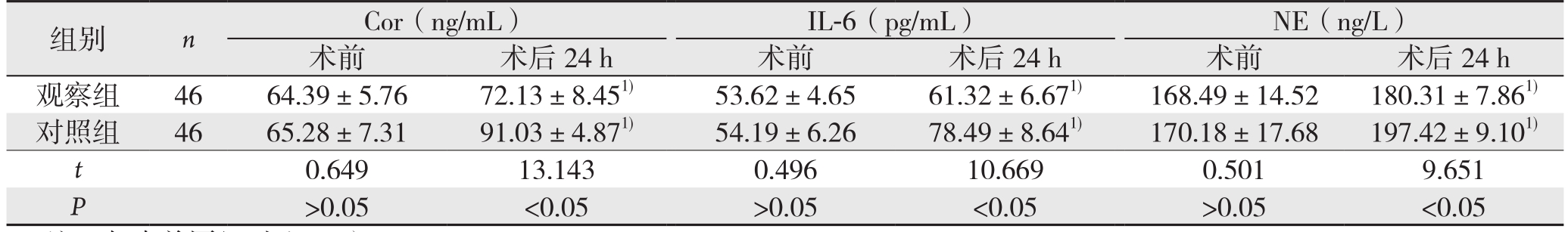
注:与术前同组对比,1)P<0.05
组别 n Cor(ng/mL) IL-6(pg/mL) NE(ng/L)术前 术后24 h 术前 术后24 h 术前 术后24 h观察组 46 64.39±5.76 72.13±8.451) 53.62±4.65 61.32±6.671) 168.49±14.52 180.31±7.861)对照组 46 65.28±7.31 91.03±4.871) 54.19±6.26 78.49±8.641) 170.18±17.68 197.42±9.101)t 0.649 13.143 0.496 10.669 0.501 9.651 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 两组术后3个月生活质量变化比较
观察组术后3个月生活质量提高多于对照组,且有统计学差异(P<0.05)(表4)。
表4 两组术后3个月生活质量变化比较
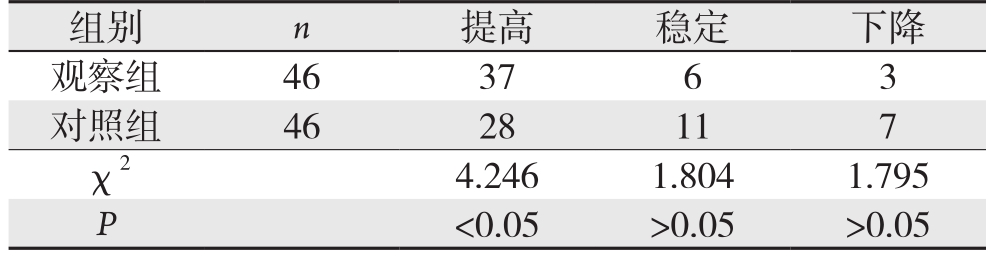
组别 n 提高 稳定 下降观察组 46 37 6 3对照组 46 28 11 7 χ2 4.246 1.804 1.795 P<0.05 >0.05 >0.05
2.5 两组生存率比较
两组1年生存率组间比较无统计学差异(P>0.05);观察组2年生存率高于对照组(P<0.05)(表5)(图1)。
表5 两组1年和2年生存率比较(%)
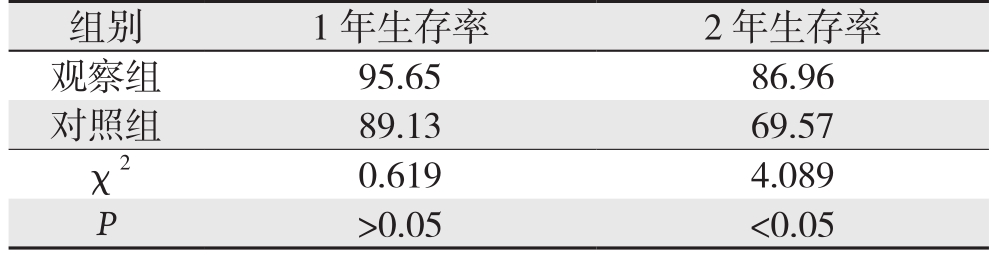
组别 1年生存率 2年生存率观察组 95.65 86.96对照组 89.13 69.57 χ2 0.619 4.089 P>0.05 <0.05
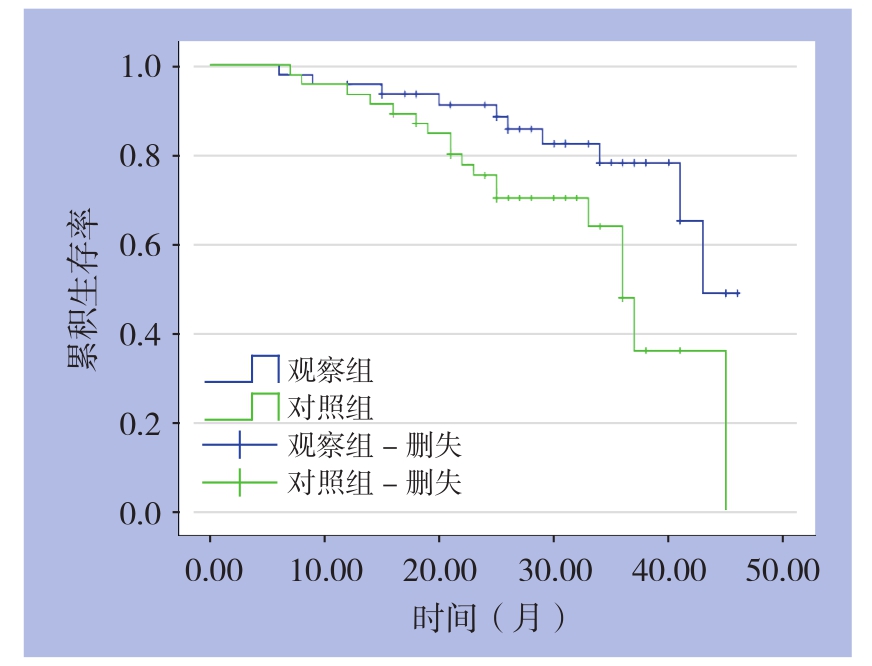
图1 两组患者生存曲线
3 讨 论
肝门部胆管癌主要是指原发于胆囊管开口以上的肝总管至左、右肝管部位的黏膜上皮癌,容易侵犯肝门区神经、淋巴结和血管,由于其病情较为隐匿,发现较难且病情发展迅速[8-15]。随着近年来影像学技术的不断提高,使得肝门部胆管癌诊断率明显升高[16]。
在肝门部胆管癌的姑息治疗中,介入治疗具有可重复、有效引流胆汁的特点,PTBD介入治疗在肝门部胆管癌综合治疗中的重要性越来越受到重视[17-18]。但PTBD介入治疗远期效果并不十分理想。近年来随着腹腔镜手术的不断发展,已经逐渐应用于临床,并且很大程度上降低了手术中的风险和难度[19-20]。此外,腹腔镜根治术具有术后并发症少、创伤小等特点[21]。朱鸿超等[22]研究显示,Bismuth I型肝门胆管癌患者应用腹腔镜手术治疗术中出血量少于开腹手术、术后平均住院时间短于开腹手术,而术后并发症少于开腹手术但无明显差异,因此腹腔镜是安全、可行的手术方式。杜羽升等[23]研究报道,肝门部胆管癌6例患者均于腹腔镜下顺利完场手术,无中转开腹手术,手术时间(231.3±94.5)min,术后首次排气时间(2.7±0.3)d,术中出血量(123.3±46.8)mL,术后住院时间(11.9±1.7)d,术后发生1例短暂性胆汁漏和1例并发胸腔积液,其中短暂性胆汁漏经保守治疗1周后自愈,并发胸腔积液经B超引导下穿刺引流后治愈。本研究结果表明,观察组近期总有效率高于对照组,提示腹腔镜胆管癌根治术近期疗效更为明显;观察组术后3个月生活质量提高多于对照组,提示腹腔镜胆管癌根治术可明显提高患者生活质量;观察组随访2年生存率高于对照组,提示腹腔镜胆管癌根治术可延长患者生存时间。本研究结果显示,观察组术后并发症发生率低于对照组,其胆汁漏和胆道出血是术后常见并发症。笔者认为胆汁漏发生后若引流通畅,患者无明显腹部症状,可不暂进行处理,注意电解质平衡,则能够自愈;若患者出现明显腹部症状,则需急诊行腹腔镜下探查术,以及洗净腹腔内渗出液,留置通畅引流即可。胆道出血是最常见的一种并发症,认为其原因可能是由于肝门部血管失去了周围结缔组织保护,继发感染或局部积液侵蚀血管后导致术后出血。术中应尽量避免伤及大血管,术后确保引流通畅。
应激反应主要是指机体受内外环境因素如创伤、手术等,及心理和社会因素刺激时发生的一种全身非特异性适应反应,当出现应激反应时,机体内发生一系列神经内分泌反应[24-25]。常见的应激反应指标Cor、NE、IL-6等。由于手术和介入治疗均为创伤性操作,会引起患者不同程度应激反应。本研究表明,观察组术后24 h血浆Cor、IL-6和NE含量低于对照组,提示腹腔镜胆管癌根治术对应激反应较小。
综上所述,腹腔镜胆管癌根治术治疗肝门部胆管癌效果显著,且可改善患者生活质量,提高患者生存率。
[1]Siripingsakun S, Vidhyarkorn S, Charuswattanakul S, et al.Ultrasound surveillance for cholangiocarcinoma in an endemic area: A prove of survival benefits[J]. J Gastroenterol Hepatol, 2018,33(7):1383–1388. doi: 10.1111/jgh.14074.
[2]黄强, 杨骥, 林先盛, 等. CT三维重建在肝门部胆管癌的诊疗中的应用价值[J]. 中国普通外科杂志, 2017, 26(8):960–967.doi:10.3978/j.issn.1005–6947.2017.08.002.Huang Q, Yang J, Lin XS, et al. Application value of threedimensional reconstruction of CT scan images in diagnosis and treatment of hilar cholangiocarcinoma[J]. Chinese Journal of General Surgery, 2017, 26(8):960–967. doi:10.3978/j.issn.1005–6947.2017.08.002.
[3]Dong LQ, Shi Y, Ma LJ, et al. Spatial and temporal clonal evolution of intrahepatic cholangiocarcinoma[J]. J Hepatol, 2018, 69(1):89–98. doi: 10.1016/j.jhep.2018.02.029.
[4]黄兢姚, 杨维竹, 江娜, 等. 经皮胆道支架联合支架内外125I粒子植入治疗肝门部胆管癌研究[J]. 临床放射学杂志, 2016,35(3):448–452.Huang JY, Yang WZ, Jiang N, et al. Research on Treatment of Hilar Cholangiocarcinoma through 125I Seed Implantation Via Percutaneous Biliary Stent Combined with Internal and External Stents[J]. Journal of Clinical Radiology, 2016, 35(3):448–452.
[5]李颖, 高明发. 经皮经肝胆道引流与胆道金属支架置入治疗肝门部胆管癌的疗效分析[J]. 实用癌症杂志, 2017, 32(3):448–450.doi:10.3969/j.issn.1001–5930.2017.03.029.Li Y, Gao MF. Efficacy of Percutaneous Biliary Drainage and Biliary Metallic Stent for Hilar Cholangiocarcinoma[J]. The Practical Journal of Cancer, 2017, 32(3):448–450. doi:10.3969/j.issn.1001–5930.2017.03.029.
[6]Le Roy B, Gelli M, Pittau G, et al. Neoadjuvant chemotherapy for initially unresectable intrahepatic cholangiocarcinoma[J]. Br J Surg,2018, 105(7):839–847. doi: 10.1002/bjs.10641.
[7]Joo I, Lee JM, Yoon JH. Imaging Diagnosis of Intrahepatic and Perihilar Cholangiocarcinoma: Recent Advances and Challenges [J].Radiology, 2018, 288(1):7–13. doi: 10.1148/radiol.2018171187.
[8]张伟, 韩新巍, 吴刚, 等. 肝门部胆管癌的临床症状及与临床分型的关系[J]. 临床肝胆病杂志, 2011, 27(4):405–407.Zhang W, Han XW, Wu G, et al. Analysis of the clinical symptom and its relationship with the clinical classification of hilar cholangiocarcinoma[J]. Journal of Clinical Hepatology, 2011,27(4):405–407.
[9]蔡烈, 傅钢, 陈志武, 等. 经皮肝穿刺胆道引流治疗晚期肝门部胆管癌22例的临床意义[J]. 临床和实验医学杂志, 2008, 7(9):98–99.doi:10.3969/j.issn.1671–4695.2008.09.071.Cai L, Fu G, Chen ZW, et al. Clinical significance of PTCD In treatment of advanced hepatic portal cholangiocarcinoma:a report of 22 cases[J]. Journal of Clinical and Experimental Medicine,2008, 7(9):98–99. doi:10.3969/j.issn.1671–4695.2008.09.071.
[10]牛宏, 李明阳. 不同胆道引流方式治疗肝门部胆管癌所致黄疸的疗效观察[J]. 中华胃肠内镜电子杂志, 2017, 4(3):103–108.doi:10.3877/cma.j.issn.2095–7157.2017.03.002.Niu H, Li MY. Clinical efficacy of different drainage methods in the treatment of jaundice caused by hilar cholangiocarcinoma[J].Chinese Journal of Gastrointestinal Endoscopy:Electronic Edition, 2017, 4(3):103–108. doi:10.3877/cma.j.issn.2095–7157.2017.03.002.
[11]Lee J, Kang SH, Noh OK, et al. Adjuvant concurrent chemoradiation therapy in patients with microscopic residual tumor after curative resection for extrahepatic cholangiocarcinoma[J]. Clin Transl Oncol, 2018, 20(8):1011–1017. doi: 10.1007/s12094–017–1815-y.
[12]Yang J, Wang J, Zhou H, et al. Efficacy and safety of endoscopic radiofrequency ablation for unresectable extrahepatic cholangiocarcinoma: a randomized trial[J]. Endoscopy, 2018,50(8):751–760. doi: 10.1055/s-0043–124870.
[13]Wiggers JK, Groot Koerkamp B, van Klaveren D, et al. Preoperative Risk Score to Predict Occult Metastatic or Locally Advanced Disease in Patients with Resectable Perihilar Cholangiocarcinoma on Imaging[J]. J Am Coll Surg, 2018, 227(2):238–246. doi:10.1016/j.jamcollsurg.2018.03.041.
[14]朱安东, 刘奇, 陈德兴. 腹腔镜下肝门部胆管癌根治术中淋巴结廓清方法的探讨[J]. 中国微创外科杂志, 2010, 10(10):922–924.doi:10.3969/j.issn.1009–6604.2010.10.024.Zhu AD, Liu Q, Chen DX. Laparoscopic Radical Resection of Hilar Cholangiocarcinoma and Lymph Node Dissection[J]. Chinese Journal of Minimally Invasive Surgery, 2010, 10(10):922–924.doi:10.3969/j.issn.1009–6604.2010.10.024.
[15]晏益核, 黄玉斌, 蔡小勇. 肝门部胆管癌的外科治疗现状[J]. 中国普通外科杂志, 2017, 26(2):246–251. doi:10.3978/j.issn.1005–6947.2017.02.019.Yan YH, Huang YB, Cai XY. Current status in surgical management of hilar holangiocarcinoma[J]. Chinese Journal of General Surgery,2017, 26(2):246–251. doi:10.3978/j.issn.1005–6947.2017.02.019.
[16]Xiao K, Ouyang Z, Tang HH. Inhibiting the proliferation and metastasis of hilar cholangiocarcinoma cells by blocking the expression of vascular endothelial growth factor with small interfering RNA[J]. Oncol Lett, 2018, 16(2):1841–1848. doi:10.3892/ol.2018.8840.
[17]隋鑫磊, 汤恢焕, 肖广发, 等. 肝门部胆管癌姑息治疗的效果及预后分析:附218例报告[J]. 中国普通外科杂志, 2017, 26(8):953–959. doi:10.3978/j.issn.1005–6947.2017.08.001.Sui XL, Tang HW, Xiao GF, et al. Clinical effects and outcomes of palliative therapy to hilar cholangiocarcinoma: a report of 218 cases[J]. Chinese Journal of General Surgery, 2017, 26(8):953–959.doi:10.3978/j.issn.1005–6947.2017.08.001.
[18]方兆山, 向飞, 刘星星, 等. 经皮肝穿胆道射频消融联合金属支架植入治疗晚期肝门部胆管癌的临床价值[J]. 国际医药卫生导报, 2016, 22(14):2022–2026. doi:10.3760/cma.j.issn.1007–1245.2016.14.002.Fang ZS, Xiang F, Liu XX, et al. Percutaneous intraductal radiofrequency ablation combined with metal stent implantation for the treatment of advanced hilar cholangiocarcinoma[J]. International Medicine and Health Guidance News, 2016, 22 (14):2022–2026.doi:10.3760/cma.j.issn.1007–1245.2016.14.002.
[19]项灿宏, 童翾. 肝门部胆管癌外科治疗的进展与争议[J]. 中国普通外科杂志, 2018, 27(2):137–142. doi:10.3978/j.issn.1005–6947.2018.02.001.Xiang CH, Tong X. Surgical treatment of hilar cholangiocarcinoma:progress and controversy[J]. Chinese Journal of General Surgery,2018. 27(2):137–142. doi:10.3978/j.issn.1005–6947.2018.02.001
[20]Lv B, Ma L, Tang W, et al. FXR Acts as a Metastasis Suppressor in Intrahepatic Cholangiocarcinoma by Inhibiting IL-6-Induced Epithelial-Mesenchymal Transition[J]. Cell Physiol Biochem, 2018,48(1):158–172. doi: 10.1159/000491715.
[21]朱安东, 刘奇, 陈德兴. 腹腔镜辅助下肝门部胆管癌根治术38例[J]. 中国微创外科杂志, 2012, 12(9):783–786. doi:10.3969/j.issn.1009–6604.2012.09.005.Zhu AD, Liu Q, Chen DX. Laparoscopic-assited Radical Resection of Hilar Cholangiocarcinoma : Report of 38 Cases[J]. Chinese Journal of Minimally Invasive Surgery, 2012, 12(9):783–786.doi:10.3969/j.issn.1009–6604.2012.09.005.
[22]朱鸿超, 周龙飞, 刘天德, 等. 腹腔镜与开腹Bismuth-Ⅰ型肝门胆管癌根治术的疗效分析[J]. 中国内镜杂志, 2018, 24(2):10–15.doi:10.3969/j.issn.1007–1989.2018.02.003.Zhu HC, Zhou LF, Liu TD, et al. Analysis of laparoscopic and open radical resection for hilar cholangiocarcinoma of type Bismuth-I[J]. China Journal of Endoscopy, 2018, 24(2):10–15. doi:10.3969/j.issn.1007–1989.2018.02.003.
[23]杜羽升, 赵文星, 王骥, 等. 完全腹腔镜手术治疗肝门部胆管癌(附6例报道)[J]. 中国普通基础与临床杂志, 2017,24(12):1487–1491.Du YS, Zhao WX, Wang J, et al. Total laparoscopic radical resection in treatment of hilar cholangiocarcinoma (report of 6 cases)[J].Chinese Journal of Bases and Clinics in General Surgery, 2017,24(12):1487–1491.
[24]刘军辉, 张学军, 赵永灵. 腹腔镜结肠癌手术对患者免疫功能和应激反应影响分析[J]. 中华普外科手术学杂志:电子版, 2016,10(2):123–126. doi:10.3877/cma.j.issn.1674–3946.2016.02.014.Liu JH, Zhang XJ, Zhao YL. Effect of Laparoscopic surgery on the immune system and stress response in patients with colon cancer[J].Chinese Journal of Operative Procedures of General Surgery:Electronic Version, 2016, 10(2):123–126. doi:10.3877/cma.j.issn.1674–3946.2016.02.014.
[25]程勇, 刘磊, 王向阳, 等. 腹腔镜全结肠系膜切除术对结肠癌患者机体应激反应及腹腔脱落细胞的影响[J]. 中华实验外科杂志, 2016, 33(2):377–379. doi:10.3760/cma.j.issn.1001–9030.2016.02.030.Cheng Y, Liu L, Wang XY, et al. Effect of laparoscopic complete mesocolic excision surgery on stress reaction and exfoliated cells on colon cancer patients[J]. Chinese Journal of Experimental Surgery, 2016, 33(2):377–379. doi:10.3760/cma.j.issn.1001–9030.2016.02.030.