胃癌是导致全球癌症相关死亡的第二大主因,在东亚的发病率居首位。全球每年大约有990 000例患者被确诊为胃癌,其中有738 000例死于胃癌[1-2]。即使通过最有效的D2根治性胃切除手术治疗和放化疗,术后复发率和病死率仍很高。围术期多种因素能影响胃癌患者的生存和预后[3-5]。由于胃癌患者因为营养不良、慢性失血等所致贫血,常常需要进行围术期输血。输血的出现和血库系统的建立为改善患者预后有一定的意义,但同时也带来了一定的风险。许多回顾性研究[6-7]发现,围术期输血降低了乳腺癌、肠癌等疾病患者的5年生存率;然而,也有研究发现,围术期输血并不是影响胃癌患者复发和死亡的因素[8-9]。因此,本研究通过回顾性研究分析评估围术期输血对胃癌根治术患者术后总生存期的影响,为临床输血治疗提供依据。
1 资料与方法
1.1 一般资料
回顾性地选取2010年1月—2016年1月湘雅三医院手术室择期行D2胃癌根治术的患者。纳入标准为:年龄>18岁;ASA分级为I/II/III;术前胃镜和病理诊断为胃上皮性肿瘤;术前无肝、肺、腹腔等转移等。排除指标为:再次手术,重度贫血,术前化放疗,免疫性疾病如糖尿病、记录不完整、术中姑息性切除手术者、围术期死亡者,非上皮性如肉瘤、间质瘤、淋巴瘤和内分泌肿瘤等。
1.2 研究方法
收集患者性别、年龄、尿量、手术时间、失血量等、肿瘤大小、病理分型、组织学分级、TNM分级、淋巴结切除数量、术后情况包括住院日、肺部感染心梗等并发症等信息。TNM分期标准采用国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)最新标准[10]。术后进行电话、短信随访和再次就诊记录查询,生存时间从出院日开始至患者死亡的时间,以月份表示。每隔1~3个月随访直至死亡。总生存期是从手术日开始至任何原因所致的死亡日。
围术期定义为住院期间手术日前后7 d,即从入院术前准备开始至手术及相关治疗结束的这段时间[11]。麻醉医生和外科医生权衡后决定是否输血,一般为血红蛋白低于80 g/L即考虑输血[12]。本研究输注的血制品限定为浓缩红细胞,血红蛋白约为20 g/mL。根据围术期是否输血,将患者分为输血组和未输血组。
1.3 统计学处理
用Prism 7统计软件进行数据统计分析,各组间发生率的比较采用χ2检验或Fisher确切概率法,计量资料用均值±标准差( ±s)表示,采用t检验。单因素生存分析采用Kaplan-Meier法比较组间生存曲线。采用多因素回归分析判断影响预后的独立因素。单因素和多因素分析使用Cox比例风险模型。P<0.05为差异有统计学意义。
±s)表示,采用t检验。单因素生存分析采用Kaplan-Meier法比较组间生存曲线。采用多因素回归分析判断影响预后的独立因素。单因素和多因素分析使用Cox比例风险模型。P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床资料比较
194例接受胃癌根治术患者中,输血组116例,未输血组78例,输血率占59.8%。输血组平均输血量为689 mL。两组患者年龄、术前贫血人数、术中入量、尿量、手术时间、TNM分级、组织学分级、术后住院时间以及心梗、肺部感染等并发症方面均无统计学差异(均P>0.05)(表1)。两组中位随访时间为32.2个月,Kaplan-Meier检验结果显示,输血组较未输血组5年生存率明显降低(65.3% vs. 73.6%,χ2=7.235,P=0.042)(图1)。
表1 单因素分析
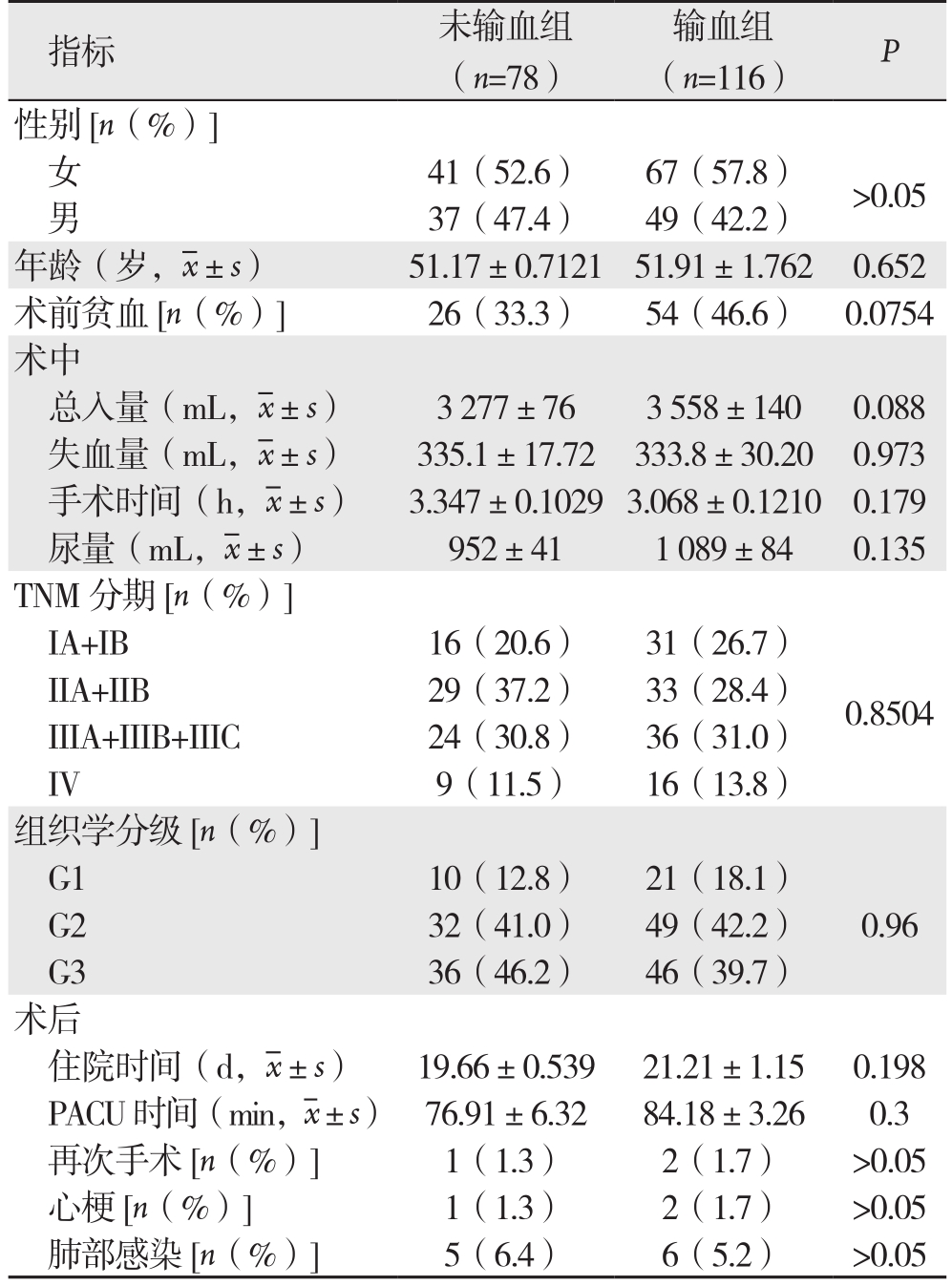
指标 未输血组(n=78)输血组(n=116) P性别[n(%)]女41(52.6) 67(57.8) >0.05男37(47.4) 49(42.2)年龄(岁, ±s) 51.17±0.7121 51.91±1.762 0.652术前贫血[n(%)]26(33.3) 54(46.6) 0.0754术中总入量(mL,
±s) 51.17±0.7121 51.91±1.762 0.652术前贫血[n(%)]26(33.3) 54(46.6) 0.0754术中总入量(mL, ±s) 3 277±76 3 558±140 0.088失血量(mL,
±s) 3 277±76 3 558±140 0.088失血量(mL, ±s) 335.1±17.72 333.8±30.20 0.973手术时间(h,
±s) 335.1±17.72 333.8±30.20 0.973手术时间(h, ±s) 3.347±0.1029 3.068±0.1210 0.179尿量(mL,
±s) 3.347±0.1029 3.068±0.1210 0.179尿量(mL, ±s) 952±41 1 089±84 0.135 TNM分期[n(%)]IA+IB 16(20.6) 31(26.7)IIA+IIB 29(37.2) 33(28.4) 0.8504 IIIA+IIIB+IIIC 24(30.8) 36(31.0)IV 9(11.5) 16(13.8)组织学分级[n(%)]G1 10(12.8) 21(18.1)G2 32(41.0) 49(42.2) 0.96 G3 36(46.2) 46(39.7)术后住院时间(d,
±s) 952±41 1 089±84 0.135 TNM分期[n(%)]IA+IB 16(20.6) 31(26.7)IIA+IIB 29(37.2) 33(28.4) 0.8504 IIIA+IIIB+IIIC 24(30.8) 36(31.0)IV 9(11.5) 16(13.8)组织学分级[n(%)]G1 10(12.8) 21(18.1)G2 32(41.0) 49(42.2) 0.96 G3 36(46.2) 46(39.7)术后住院时间(d, ±s) 19.66±0.539 21.21±1.15 0.198 PACU时间(min,
±s) 19.66±0.539 21.21±1.15 0.198 PACU时间(min, ±s) 76.91±6.32 84.18±3.26 0.3再次手术[n(%)]1(1.3) 2(1.7) >0.05心梗[n(%)]1(1.3) 2(1.7) >0.05肺部感染[n(%)]5(6.4) 6(5.2) >0.05
±s) 76.91±6.32 84.18±3.26 0.3再次手术[n(%)]1(1.3) 2(1.7) >0.05心梗[n(%)]1(1.3) 2(1.7) >0.05肺部感染[n(%)]5(6.4) 6(5.2) >0.05
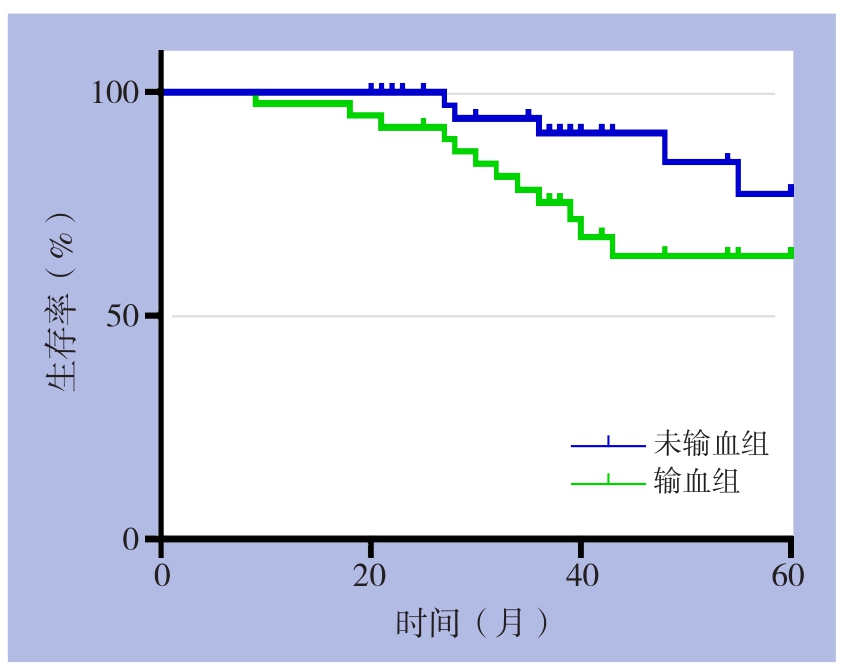
图1 输血组与未输血组患者的生存曲线
2.2 胃癌根治术后患者生存的影响因素分析
将术前贫血与否、输血量、侵袭与否、TNM分级进行Cox回归模型进行分析(表2)。输血量、侵袭与否、TNM分级、术后放化疗都是影响术后生存的独立影响因素(均P<0.05)。围手术期输血量>300 mL的患者死亡风险为未输血患者2.27倍(95% CI=1.66~3.12),围手术期输血量>300 mL的患者死亡风险为围手术期输血量≤300 mL的1.66倍(95% CI=1.45~1.98)。术前有侵袭者的死亡风险为无侵袭者的2.89倍(95% CI=1.5~5.78);TNM分级III/IV级的死亡风险为I/II级的3.36倍(95% CI=1.98~4.34);ASA、年龄、失血量对患者术后生存率的影响差异无统计学意义(均P>0.05)。
表2 胃癌根治术后患者生存影响因素的Cox多元回归分析
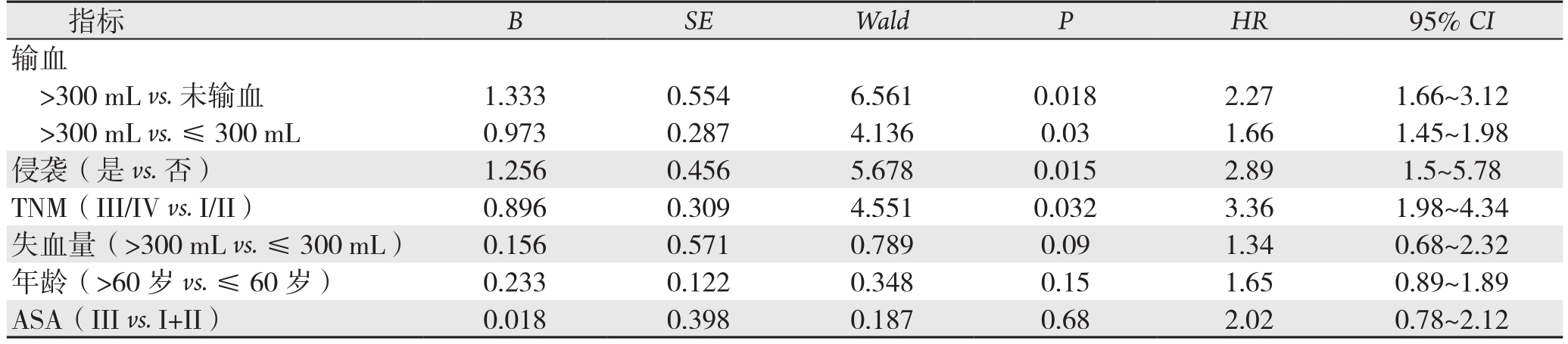
指标 B SE Wald P HR 95% CI输血>300 mL vs.未输血 1.333 0.554 6.561 0.018 2.27 1.66~3.12>300 mL vs. ≤ 300 mL 0.973 0.287 4.136 0.03 1.66 1.45~1.98侵袭(是vs.否) 1.256 0.456 5.678 0.015 2.89 1.5~5.78 TNM(III/IV vs. I/II) 0.896 0.309 4.551 0.032 3.36 1.98~4.34失血量(>300 mL vs. ≤ 300 mL) 0.156 0.571 0.789 0.09 1.34 0.68~2.32年龄(>60 岁 vs. ≤ 60 岁) 0.233 0.122 0.348 0.15 1.65 0.89~1.89 ASA(III vs. I+II) 0.018 0.398 0.187 0.68 2.02 0.78~2.12
3 讨 论
胃癌是消化道最多发的肿瘤,胃癌根治术是最主要的治疗手段[13-14]。围术期输血是常见的治疗手段,能有效补充血容量、改善循环、增加携氧能力等,为治疗贫血、提高手术安全性、促进患者康复有重要意义[15-16]。但输血也可能影响患者的预后[17]。本研究结果提示:围术期输血能降低胃癌根治术术后患者总生存率。有研究[18-19]报道,围术期输血能影响患者术后生存,但机制不明。最常见的解释为,非特异的免疫抑制,如增加抑制性T细胞活性,降低NK细胞活性,刺激抗独特型抗体的产生等[20-21]。还有其他的解释,如网状内皮系统的过载,IL-2和前列腺素的代谢等[22-23]。也有报道发现,围术期输血并未影响患者的生存时间。这可能是由于研究设计不足,样本量小,或统计分析不足等所致。
有研究[24]报道,胃癌患者侵袭性、TNM分级越高的患者,更容易发生相关并发症,输血量越大。为了进一步验证输血是否是患者术后生存的独立影响因素,本研究进行了Cox回归分析,结果提示,围术期输血量、侵袭与否、TNM分级等都是影响患者术后生存率的因素。不同输血成分,如红细胞、血浆、血小板等,对机体的免疫调节可能不同。如血浆中富含的细胞基质黏附分子,能促进血液中游离的肿瘤细胞黏附和转移[25]。故本研究中,仅纳入输注浓缩红细胞的病例。本研究也存在一些不足,如研究为回顾性单中心研究,更多前瞻性随机对照研究有待研究;另外,本研究样本量较少;且本研究仅探讨了输血对术后总生存期的影响,没有研究输血对术后并发症的影响。总之,此研究提示,围术期应当严格把握输血指征,减少不必要输血。尽量通过补充铁剂、叶酸等方式纠正贫血;同时术中谨慎操作,减少术中出血,以期为患者提供好的预后。
[1]Venerito M,Vasapolli R,Rokkas T,et al.Gastric cancer:epidemiology,prevention,and therapy[J].Helicobacter,2018,23(Suppl 1):e12518.doi: 10.1111/hel.12518.
[2]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893–2917.doi: 10.1002/ijc.25516.
[3]Guggenheim DE,Shah MA.Gastric cancer epidemiology and risk factors[J].J Surg Oncol,2013,107(3):230–236.doi: 10.1002/jso.23262.
[4]Daniyal M,Ahmad S,Ahmad M,et al.Risk Factors and Epidemiology of Gastric Cancer in Pakistan[J].Asian Pac J Cancer Prev,2015,16(12):4821–4824.
[5]Tavare AN,Perry NJ,Benzonana LL,et al.Cancer recurrence after surgery: direct and indirect effects of anesthetic agents[J].Int J Cancer,2012,130(6):1237–1250.doi: 10.1002/ijc.26448.
[6]Burrows L,Tartter P.Effect of blood transfusions on colonic malignancy recurrence rate[J].Lancet,1982,2(8299):662.
[7]Acheson AG,Brookes MJ,Spahn DR.Effects of allogeneic red blood cell transfusions on clinical outcomes in patients undergoing colorectal cancer surgery: a systematic review and meta-analysis[J].Ann Surg,2012,256(2):235–244.doi: 10.1097/SLA.0b013e31825b35d5.
[8]Moriguchi S,Maehara Y,Akazawa K,et al.Lack of relationship between perioperative blood transfusion and survival time after curative resection for gastric cancer[J].Cancer,1990,66(11):2331–2335.
[9]Hyung WJ,Noh SH,Shin DW,et al.Adverse effects of perioperative transfusion on patients with stage III and IV gastric cancer[J].Ann Surg Oncol,2002,9(1):5–12.
[10]Rice TW,Ishwaran H,Ferguson MK,et al.Cancer of the Esophagus and Esophagogastric Junction: An Eighth Edition Staging Primer[J].J Thorac Oncol,2017,12(1):36–42.doi: 10.1016/j.jtho.2016.10.016.
[11]徐国梅,周亚昭.美国围手术期护理流程管理见闻与启迪[J].护士进修杂志,2011,26(16):1502–1503.doi:10.3969/j.issn.1002–6975.2011.16.031.Xu GM,Zhou YZ.Perioperative nursing process in America: observations and enlightenments[J].Journal of Nurses Training,2011,26(16):1502–1503.doi:10.3969/j.issn.1002–6975.2011.16.031.
[12]American Society of Anesthesiologists Task Force on Perioperative Blood Transfusion and Adjuvant Therapies.Practice guidelines for perioperative blood transfusion and adjuvant therapies: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Blood Transfusion and Adjuvant Therapies[J].Anesthesiology,2006,105(1):198–208.
[13]Waddell T,Verheij M,Allum W,et al.Gastric cancer: ESMOESSO-ESTRO clinical practice guidelines for diagnosis,treatment and follow-up[J].Eur J Surg Oncol,2014,40(5):584–591.doi:10.1016/j.ejso.2013.09.020.
[14]陈思曾,穆建成.术前ASA分级及手术范围对胃癌根治术患者预后的影响[J].中国普通外科杂志,2015,24(10):1363–1366.doi:10.3978/j.issn.1005–6947.2015.10.004.Chen SZ,Mu JC.Influence of preoperative ASA classification and scope of surgical operation on prognosis of gastric cancer after radical gastrectomy[J].Chinese Journal of General Surgery,2015,24(10):1363–1366.doi:10.3978/j.issn.1005–6947.2015.10.004.
[15]Garona J,Sobol N T,Alonso D F.Impact of Perioperative Blood Transfusion on Survival Among Women With Breast Cancer:Potential Benefits of Blood-Saving Agent Desmopressin Use During Surgery[J].Am J Ther,2018,25(5):e569-e570.doi: 10.1097/MJT.0000000000000647.
[16]陈启斌,荚卫东,许戈良,等.肝癌肝切除的输血因素分析[J].中国普通外科杂志,2011,20(7):687–690.Chen QB,Jia WD,Xu GL,et al.Predictive factors of blood transfusion requirement in liver resection for hepatocellular carcinoma[J].Chinese Journal of General Surgery,2011,20(7):687–690.
[17]Lee J,Chin JH,Kim JI,et al.Association between red blood cell transfusion and long-term mortality in patients with cancer of the esophagus after esophagectomy[J].Dis Esophagus,2018,31(2).doi: 10.1093/dote/dox123.
[18]Tzounakas VL,Seghatchian J,Grouzi E,et al.Red blood cell transfusion in surgical cancer patients: Targets,risks,mechanistic understanding and further therapeutic opportunities[J].Transfus Apher Sci,2017,56(3):291–304.doi: 10.1016/j.transci.2017.05.015.
[19]Wada H,Eguchi H,Nagano H,et al.Perioperative allogenic blood transfusion is a poor prognostic factor after hepatocellular carcinoma surgery: a multi-center analysis[J].Surg Today,2018,48(1):73–79.doi: 10.1007/s00595–017–1553–3.
[20]Bushell A,Karim M,Kingsley CI,et al.Pretransplant blood transfusion without additional immunotherapy generates CD25+CD4+ regulatory T cells: a potential explanation for the bloodtransfusion effect[J].Transplantation,2003,76(3): 449–455.doi:10.1097/01.TP.0000083043.84630.99.
[21]Blumberg N,Heal JM.Immunomodulation by blood transfusion:an evolving scientific and clinical challenge[J].Am J Med,1996,101(3):299–308.doi: 10.1016/S0002–9343(96)00124–6.
[22]Wu HS,Little AG.Perioperative blood transfusions and cancer recurrence[J].J Clin Oncol,1988,6(8):1348–1354.doi: 10.1200/JCO.1988.6.8.1348.
[23]Singh SK,Marquet RL,de Bruin RW,et al.Consequences of blood loss on growth of articial metastases[J].Br J Surg,1988,75(4):377–379.
[24]Park YH,Kim YJ,Kang SH,et al.Association between Perioperative Blood Transfusion and Oncologic Outcomes after Curative Surgery for Renal Cell Carcinoma[J].J Cancer,2016,7(8):965–972.doi: 10.7150/jca.15073.
[25]Blumberg N,Triulzi DJ,Heal JM.Transfusion-induced immunomodulation and its clinical consequences[J].Transfus Med Rev,1990,4(4):24–35.