近年来,食管胃结合部腺癌(adenocarcinoma of esophagogastric junction,AEG)发病率在东、西方国家均有上升[1]。手术目前仍然是治疗AEG的主要手段,淋巴结的清扫是AEG手术中的关键步骤,特别是下纵膈的淋巴结清扫越来越受到重视[2]。经腹食管裂孔是Siewert II、III型AEG手术的有效入路。AEG经腹食管裂孔入路淋巴结清扫有以下特点和进展。
1 AEG的流行病学特点
胃癌在过去的100年里,发病率在全球呈下降趋势。但是,近年来AEG的发病率却在上升[3-5]。这一现象在我国乃至东亚地区与世界上其它地区是一致的[6-7]。AEG虽然位于食管和胃连接部,但是,不同于食管癌和胃癌,更容易浸润胃壁深层,也更容易发生淋巴结转移及术后复发[8-9]。
目前临床上应用的AEG分型主要有两种,Siewert分型和Nishi分型,Siewert分型在国际上应用更为广泛[10-11]。在3种Siewert分型的AEG治疗中,对Siewert I、III型的治疗基本达成共识,Siewert II型的治疗尚存在诸多争议[12]。
2 AEG淋巴结转移特点
AEG的淋巴结转移较为独特,具有向上、向下2个转移方向[13-14]。以齿状线为界胃侧主要向下方引流,通过胃周淋巴结汇入腹主动脉旁淋巴结,然后经胸导管流入上腔静脉。以齿状线为界食管侧的淋巴结引流有上行、下行两个方向,向上可达110、111和112组淋巴结甚至中、上纵膈淋巴结[15]。
3 AEG下纵膈淋巴结清扫的要求
Siewert等[10]指出AEG患者中 Siewert I、II、III型纵隔淋巴结转移率分别为 65%、12%和 6%。肿瘤累及食管越高、其发生纵隔淋巴结转移的概率越大[16-17]。
Kurokawa等[15]进行的一项多中心回顾性研究发现:SiewertII型AEG存在上、中、下纵隔淋巴结移,食管受侵犯的长度即肿瘤上缘距齿状线的距离是纵隔淋巴结转移的唯一影响因素。肿瘤侵犯食管<1 cm时,下纵隔淋巴结转移率仅有1.7 %;肿瘤侵犯食管1~2 cm时,下纵隔淋巴结转移率为5.6%;侵犯食管为2~3 cm时,下纵隔淋巴结转移率升高为24.3%;侵犯食管>3 cm时,下纵隔淋巴结转移率为30.6%,同时中、上纵隔淋巴结转移率也出现升高。
日本一项新的大型前瞻性研究显示,AEG食管受侵犯的长度<2 cm时,下纵膈淋巴结转移率均较低,不必要清扫;食管受侵犯的长度>2 cm时,下纵膈淋巴结转移率增高,其中主要是110组淋巴结,清扫110组即可;食管受侵犯的长度>4 cm时,不但要追加清扫111组淋巴结,还要清扫上纵膈淋巴结[18]。
综上,进展期 Siewert II、III型AEG具有向纵隔淋巴结转移的趋势,尤其是下纵隔淋巴结。肿瘤侵犯食管<2 cm下纵膈不必要清扫;而侵犯食管>4 cm,不仅要清扫下纵隔淋巴结,还要清扫至上纵隔淋巴结;肿瘤侵犯食管2~4 cm之间,纵隔内单独进行下纵膈淋巴结清扫即以足够。
4 AEG的手术入路
AEG的手术入路,主要是Siewert II型目前尚未达成一致。JCOG-9502临床研究的10年随访结果发现,Siewert II、III型经左胸腹联合切口入路与经腹食管裂孔入路相同术式比较,长期生存按Siewert 分型分层分析差异无统计学意义,但术后并发症风险经左胸腹联合切口入路较经腹食管裂孔入路增高[19]。
Kumamoto等[12]认为,行经腹食管裂孔入路近端胃切除加下纵隔淋巴结清扫术,适用于食管侵犯≤3 cm,远端侵犯不超过胃的上1/3。对于食管侵犯≤3 cm,远端侵犯超过胃上部1/3的情况,建议采用经腹食管裂孔入路全胃切除加下纵隔淋巴结清扫术。
Mine等[20]的研究显示,经食管裂孔入路治疗Siewert II、III型AEG,离体标本近端切缘>20 mm的病例术后长期生存率较优,由于离体标本存在组织回缩,所以Siewert II、III型AEG在体切除时需保证食管侧28 mm的切缘。所以临床中,Siewert II、III型AEG在体近端切缘为3 cm时是安全的距离,可满足肿瘤根治的需求。
综上,经食管裂孔入路对食管侵犯<4 cm的AEG行下纵隔淋巴结清扫术是安全、可行的,同时也可满足食管近端3 cm安全切缘的要求,既最多切除食管至7 cm即可。
5 基于心下囊的手术路径
通过腹部经食管裂孔进行下纵膈淋巴结的清扫,由于空间狭小、位置深在;下纵膈内又有食管、主动脉、胸导管等结构;同时,还要避免胸膜、心包等的损伤。手术操作困难,界限难以辨识,如何在如此困难的环境下进行下纵膈淋巴结的完整清扫是一个难题。
在食管和右脚膈肌之间的有一个封闭的腔隙。100多年前,瑞典胚胎学家Ivar Broman将该空间命名为心下囊(infracardiac bursa,ICB)。由于没有发现其特定的功能,近百年来,一直不被重视,甚至几近淡忘。只是在手术中经常会碰到这个结构,但是,大多数医生不知道它的名称。Nakamura等[21]通过研究人胚胎标本、胎儿标本、成人尸体标本、手术录像和外科手术标本,发现ICB在成人中通常都存在。利用ICB为外科医生提供了一个识别胸膜、右肺和下腔静脉位置的标志(图1)。外科医生可以根据病变的恶性程度选择手术路径;ICB的内侧路径可用于良性疾病,经ICB路径、ICB外侧路径可用于恶性疾病。ICB手术径路的提出,有助于安全、准确地经腹食管裂孔入路进行下纵膈淋巴结的清扫。
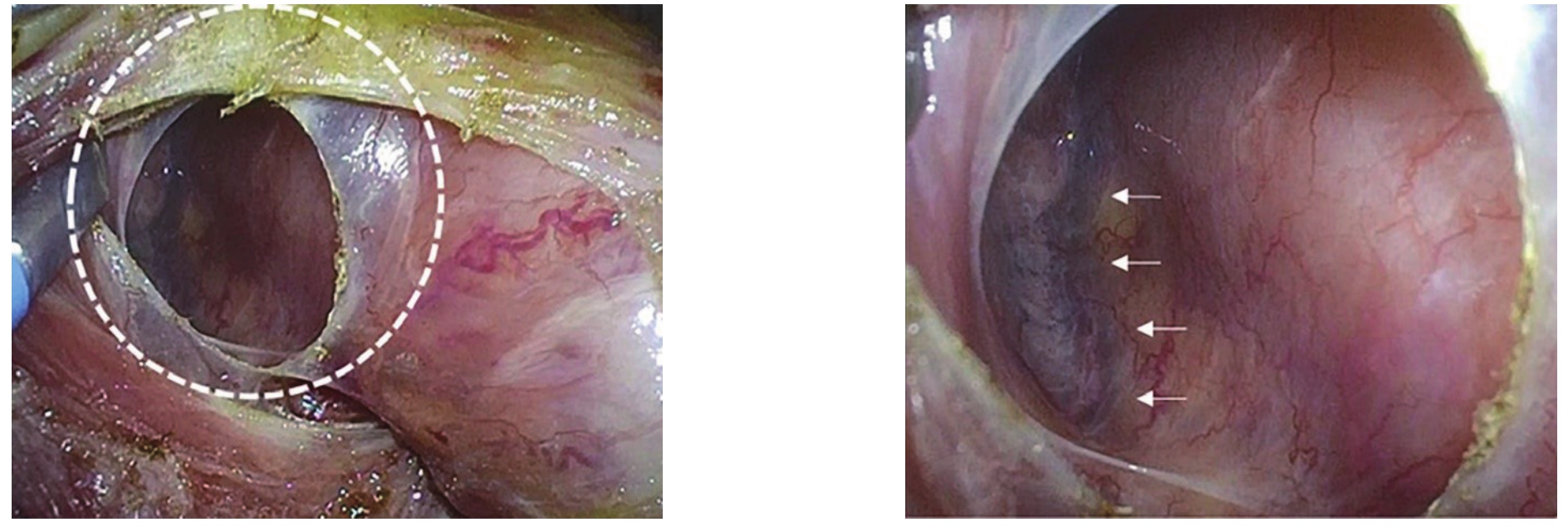
图1 腹腔镜术中所见ICB[21]
Figure 1 View of the ICB during a laparoscopic surgery[21]
6 食管胃结合部的“全系膜切除”
胃肠道癌的根治性手术包括整体切除原发肿瘤和通过切除器官所属系膜而整体清除引流区域淋巴结[22]。这种手术理念的典型应用包括完整结肠系膜切除和全直肠系膜切除(图2),上述手术已经在结直肠癌手术中得到了广泛的接受和应用[23]。
胃的全系膜切除虽然有探索,然而,由于胃周围系膜的复杂性,目前,该理念还没有被广泛接受及应用于胃癌手术中[24]。实际上,食管胃结合部周围解剖与直肠中上段有着类似的结构,可以进行局部的完整系膜切除。
第5版日本《胃癌治疗指南》提出建议:由于很难准确划分第19、20组淋巴结和第110、111、112组淋巴结的具体范围,建议一并清扫食管裂孔周围和下纵隔淋巴结,以减少肿瘤细胞的残余和播散[25]。因此,食管胃结合部淋巴结及其周围结缔组织(包括下纵膈)的完整清扫,既符合肿瘤学的en-bloc原则,又具有临床需求。
心下囊结构的重新提出和认识,优化了下纵膈淋巴结清扫的流程,提高了了下纵膈完整清扫的安全性和可操作性。AEG常规清扫下纵膈淋巴结主要包括110、111、12aoA、112pul组淋巴结,其下界是食管裂孔、上界是右侧下肺静脉、前界是心包、后界是主动脉、两边是左右胸膜。
主要手术步骤:打开食管裂孔,根据显露需要可以切开两侧膈肌脚1~2 cm,向上完整游离食管下段及周围脂肪组织;在清扫上缘向食管壁“瘦身”;然后,沿食管向下裸化(图3)。

图2 全直肠系膜切除手术入路
Figure 2 Surgical approach for total mesenteric excision
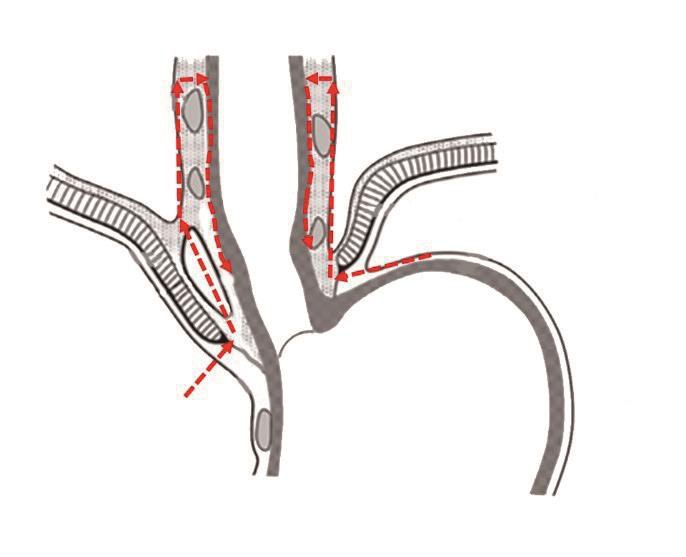
图3 食管胃结合部全系膜切除
Figure 3 Total mesenteric excision of the esophagogastric junction
7 小 结
经食管裂孔入路的下纵隔淋巴结清扫适用于Siewert II、III型AEG齿状线以上受侵2~4 cm者;心下囊可以作为经腹食管裂孔入路下纵隔淋巴结清扫的解剖标志;全系膜切除理念可以提高下纵隔淋巴结清除率,提高肿瘤学安全性;建议规范下纵隔淋巴结清扫的手术流程,提高清扫质量;下纵隔淋巴结清扫的临床价值需要更多的临床研究证实。
[1]Mullen JK, Kwak EL, Hong TS.What's the Best Way to Treat GE Junction Tumors? Approach Like Gastric Cancer[J].Ann Surg Oncol, 2016, 23(12):3780-3785.doi:10.1245/s10434-016-5426-6.
[2]Orditura M, Galizia G, Fabozzi A, et al.Preoperative treatment of locally advanced Esophageal carcinoma (Review)[J].Int Oncol,2013, 43(6):1745-1753.doi:10.3892/ ijo.2013.2118.
[3]Devesa SS, Blot WJ, Fraumeni JF Jr.Changing patterns in the incidence of esophageal and gastric carcinoma in the United States[J].Cancer, 1998, 83:2049-2053.
[4]Bollschweiler E, Wolfgarten E, Gutschow C, et al.Demographic variations in the rising incidence of esophageal adenocarcinoma in white males[J].Cancer, 2001, 92(3):549-555.doi: 10.1002/1097-0142(20010801)92:3<549::aid-cncr1354>3.0.co;2-l.
[5]Buas MF, Vaughan TL.Epidemiology and risk factors for gastroesophageal junction tumors: understanding the rising incidence of this disease[J].Semin Radiat Oncol, 23(1):3-9.doi:10.1016/j.semradonc.2012.09.008.
[6]Zhou YN, Zhang ZY, Zhang ZK, et al.A rising trend of gastric cardia cancer in Gansu Province of China[J].Cancer Lett, 2008,269(1):18-25.doi: 10.1016/j.canlet.2008.04.013.
[7]Yamashita H, Seto Y, Sano T, et al.Results of a nation-wide retrospective study of lymphadenectomy for esophagogastric junction carcinoma[J].Gastric Cancer, 2017, 20(Suppl 1):69-83.doi: 10.1007/s10120-016-0663-8.
[8]Ohno S, Tomisaki S, Oiwa H, et al.Clinicopathologic characteristics and outcome of adenocarcinoma of the human gastric cardia in comparison with carcinoma of other regions of the stomach[J].J Am Coll Surg,1995, 180(5):577-582.
[9]Saito H, Fukumoto Y, Osaki T, et al.Distinct recurrence pattern and outcome of adenocarcinoma of the human gastric cardia in comparison with carcinoma of other regions of the stomach[J].World J Surg, 2006, 30(10):1864-1869.doi:10.1007/ s00268-005-0582-z.
[10]Siewert JR, Stein HJ, Feith M.Adenocarcinoma of the esophagogastric junction[J].Scand J Surg, 2006, 95(4):260-269.doi: 10.1177/145749690609500409.
[11]Nishi M, Noumura H, Kajisa T, et al.Surgical problem of carcinoma in the esophagogastric junction (In Japanese with English abstract)[J].Stomach Intest, 1978, 13:1497-1507.
[12]Kumamoto T, Kurahashi Y, Niwa H, et al.True esophagogastric junction adenocarcinoma: background of its definition and current surgical trends[J].Surgery Today, 2019.doi: 10.1007/s00595-019-01843-4.[Epub ahead of print]
[13]Rüdiger Siewert J, Feith M, Werner M, et al.Adenocarcinoma of the esophagogastric junction: results of surgical therapy based on anatomical/topographic classification in 1,002 consecutive patients[J].Ann Surg, 2000, 232(3):353-361.doi:10.1097/00000658-200009000-00007.
[14]Grotenhuis BA, Wijnhoven BP, van Marison R, et al.The sentinel node concept in adenocarcinoma of the distal esophagus and gastroesophageal junction[J].J Thorac Cardiovasc Surg, 2009,138(3):608-612.doi: 10.1016/j.jtcvs.2008.11.061.
[15]Kurokawa Y, Hiki N, Yoshikawa T, et al.Mediastinal lymph node metastasis and recurrence in adenocarcinoma of the esophagogastric junction[J].Surgery, 2015, 157(3):551-555.doi:10.1016 /j.surg.2014.08.099.
[16]Hosokawa Y, Kinoshita T, Konishi M, et al.Clinicopathological features and prognostic factors of adenocarcinoma of the esophagogastric junction according to Siewert classification :experiences at a single institution in Japan[J].Ann Surg Oncol,2012,19(2):677-683.doi:10.1245 / s10434-011-1983-x.
[17]Kakeji Y, Yamamoto M, Ito S, et al.Lymph node metastasis from cancer of the esophagogastric junction, and determination of the appropriate nodal dissection[J].Surg Today, 2012, 42(4):351-358.doi:10.1007 / s00595-011-0114-4.
[18]Kurokawa Y, Takeuchi H, Doki Y, et al.Mapping of Lymph Node Metastasis From Esophagogastric Junction Tumors: A Prospective Nationwide Multicenter Study [J].Ann Surg, 2019.doi: 10.1097/SLA.0000000000003499.[Epub ahead of print]
[19]Sasako M, Sano T, Yamamoto S, et al.Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomised controlled trial[J].Lancet Oncol, 2006, 7(8):644-651.doi:10.1016 / S1470-2045(06)70766-5.
[20]Mine S, Sano T, Hiki N, et al.Proximal margin length with transhiatal gastrectomy for Siewert type II and III adenocarcinomas of the oesophagogastric junction[J].Br J Surg, 2013, 100(8):1050-1054.doi: 10.1002/bjs.9170.
[21]Nakamura T, Shinohara H, Okada T, et al.Revisiting the infracardiac bursa using multimodal methods: topographic anatomy for surgery of the esophagogastric junction[J].J Anat, 2019,235(1):88-95.doi: 10.1111/joa.12989.
[22]Enker WE, Laffer UTH, Block GE.Enhanced survival of patients with colon and rectal cancer is based upon wide anatomic resection[J].Ann Surg, 1979, 190(3):350-357.doi:10.1097/00000658-197909000-00010.
[23]West NP, Kobayashi H, Takahashi K, et al.Understanding optimal colonic cancer surgery: comparison of Japanese D3 resection and European complete mesocolic excision with central vascular ligation[J].J Clin Oncol, 2012, 30(15):1763-1769.doi: 10.1200/JCO.2011.38.3992.
[24]Kumamoto T, Kurahashi Y, Haruta S, et al.Laparoscopic modified lymphadenectomy in gastric cancer surgery using systematic mesogastric excision: a novel technique based on a concept[J].Langenbecks Arch Surg, 2019, 404(3):369-374.doi: 10.1007/s00423-019-01770-5.
[25]日本胃癌學會.胃癌治療(Ⅰ)イドfflイン[M].5版.東京: 金原出版株式会社, 2018.
Japanese Gastric Cancer Association.Guidelines for treatment of gastric cancer[M].5th edition.Tokyo: Kanehara Publishing Co.Ltd., 2018.

