胃癌是最常见的恶性肿瘤之一,在中国农村,胃癌居各类恶性肿瘤之首[1-2]。早期胃癌(early gastric cancer,EGC)的概念,自1963年由日本胃肠病学会(JSGE)提出,定义为肿瘤位于胃壁黏膜层(T1a)或黏膜下层(T1b),无论病灶大小和有无淋巴结转移者[3]。在日本和韩国,EGC检出可达到60%,然而在我国,大部分患者确诊胃癌已属进展期,EGC的诊断率不到10%。EGC患者经手术治疗后预后较好,5年生存率可达到90%以上,局限于黏膜层无淋巴结转移的EGC患者5年生存率甚至可接近100%[4],然而EGC出现区域淋巴结转移则严重影响患者预后[5]。因此研究EGC淋巴结转移的临床及病理特点,对指导临床规范化治疗、延长预后有重要的意义。本文回顾性分析安徽医科大学附属安庆医院2010年10月—2018年12月所有施行根治性手术的EGC病例,探讨EGC的临床病理特征和淋巴结转移的关系以及淋巴结转移对EGC预后的影响,为EGC的手术治疗和规范的淋巴结清扫提供指导和理论依据。
1 资料与方法
1.1 研究对象
安徽医科大学附属安庆医院肿瘤外科自2010年10月开始对所有胃癌手术患者资料建立EXCEL数据库,2017年开始建立云端数据库,由专人负责登记,包含患者基本信息、检查结果、手术过程、术后病理、后续治疗、并发症及随访信息等一系列完整资料。2010年10月—2018年12月共登记EGC患者186例,其中男135例,女51例,男女比例2.6:1.0;年龄28~85岁,平均(61.0±10.7)岁。所有患者均行D1+或D2根治手术,行近端胃切除术21例,远端胃切除术111例,全胃切除术54例。所有患者术后标本处理、淋巴结分组、分站均按照日本胃癌处理规约第14版及日本胃癌指南第4版进行重新评估。
1.2 研究内容
分析年龄、性别、手术方式、肿瘤部位、最大径、大体类型、浸润深度、分化程度、脉管癌栓、总淋巴结清扫数目与淋巴结转移的关系。年龄分为<65岁和≥65岁;肿瘤部位分为胃上1/3、胃中1/3以及胃下1/3;肿瘤最大径以2 cm为界点分为≤2 cm与>2 cm;大体类型分为隆起型、浅表型和凹陷型;浸润深度分为T1a和T1b;分化程度分高、中(包括高-中分化)、低分化组(包括中-低分化),黏液腺癌、黏液细胞癌及印戒细胞癌归为低分化癌。总淋巴结清扫数目分为不足15枚组及15枚以上组。
1.3 随访
通过数据库管理员电话随访以及患者门诊复查方式进行随访,随访截点为患者死亡,随访截至2019年2月,随访时间2~95个月,中位随访37.3个月。
1.4 统计学处理
使用SPSS 23.0软件进行统计学分析。淋巴结转移与临床病理资料的单因素分析采用χ2检验,对χ2检验筛选出具有统计学意义的因素采用Logistic回归模型进行多因素分析。生存曲线采用Kaplan-Meier法计算并绘制,淋巴结转移对EGC患者生存率的影响采用Log-rank法进行检验。P<0.05为差异有统计学意义。
2 结 果
2.1 淋巴结转移情况
186例EGC患者行D1+或D2根治手术后淋巴结检出数目3~46枚,平均20.4枚,其中17例患者出现区域淋巴结转移,本组EGC患者淋巴结转移率9.1%(17/186)。17例淋巴结转移患者检出阳性淋巴结1~8枚,共44枚,平均2.5枚。16例仅出现第1站淋巴结转移,1例同时出现第1站和第2站淋巴结转移(第2站转移发生于第8a组);12例转移淋巴结仅累及1个组,3例转移淋巴结累及2个组,2例转移淋巴结累及3个组;淋巴结转移率最高的为第3组共11例(5.9%),其次为第4组和第6组各5例(均为2.7%)(表1)。
表1 17例淋巴结转移EGC患者资料
Table 1 Data of the 17 EGC patients with lymph metastasis

编号 手术方式 浸润深度 位置 转移组 转移数目1 全胃切除术 T1a 胃体 N0.3 1 2 全胃切除术 T1a 胃体 N0.3 1 3 远端胃切除术 T1a 胃窦 N0.3 1 4 全胃切除术 T1b 胃体 N0.3 1 5 远端胃切除术 T1b 胃角 N0.3 1 6 远端胃切除术 T1b 胃窦 N0.4 1 7 远端胃切除术 T1a 胃角 N0.1 1 8 远端胃切除术 T1b 胃窦 N0.4 1 9 全胃切除术 T1b 胃体 N0.6 1 10 远端胃切除术 T1a 胃窦 N0.3、4 2 11 远端胃切除术 T1b 胃窦 N0.4、6 2 12 远端胃切除术 T1b 胃窦 N0.4 3 13 全胃切除术 T1b 胃窦 N0.3、6 3 14 近端胃切除术 T1b 贲门 N0.3 4 15 远端胃切除术 T1a 胃体 N0.3 4 16 远端胃切除术 T1b 胃窦 N0.3、6、8a 8 17 全胃切除术 T1b 胃体 N0.3、4、6 8
2.2 淋巴结转移的危险因素分析
单因素分析结果显示:本组黏膜下癌(T1b)淋巴结转移率15.1%(11/73),高于黏膜内癌(T1a)淋巴结转移率5.3%(6/113),差异有统计学意义(χ2=5.177,P=0.023);病灶最大径>2 cm者淋巴结转移率14.3%(11/77),高于病灶最大径≤2 cm者的5.5%(6/109),差异有统计学意义(χ2=4.190,P=0.041);伴有脉管浸润组淋巴结转移率50.0%(5/10),高于无脉管浸润组6.8%(12/176),差异有统计学意义(χ2=21.247,P=0.000);总淋巴结清扫≥15枚组淋巴结转移率12.5%(17/136),淋巴结清扫<15枚组无1例发生淋巴结转移(0/50),差异有统计学意义(χ2=6.879,P=0.009)。患者年龄、性别、肿瘤部位、大体类型、分化程度、手术方式与EGC淋巴结转移均无明显关系(均P>0.05)(表2)。
将单因素分析筛选出的与淋巴结转移有关的因素:浸润深度、最大径及脉管浸润纳入Logistic回归模型进行多因素分析(淋巴结检出数目受主观因素影响不纳入分析),结果显示,有脉管浸润是EGC淋巴结转移的独立危险因素(表3)。
表2 EGC淋巴结转移的单因素分析[n(%)]
Table 2 Univariate analysis of factors for lymph node metastasis in EGC patients [n(%)]
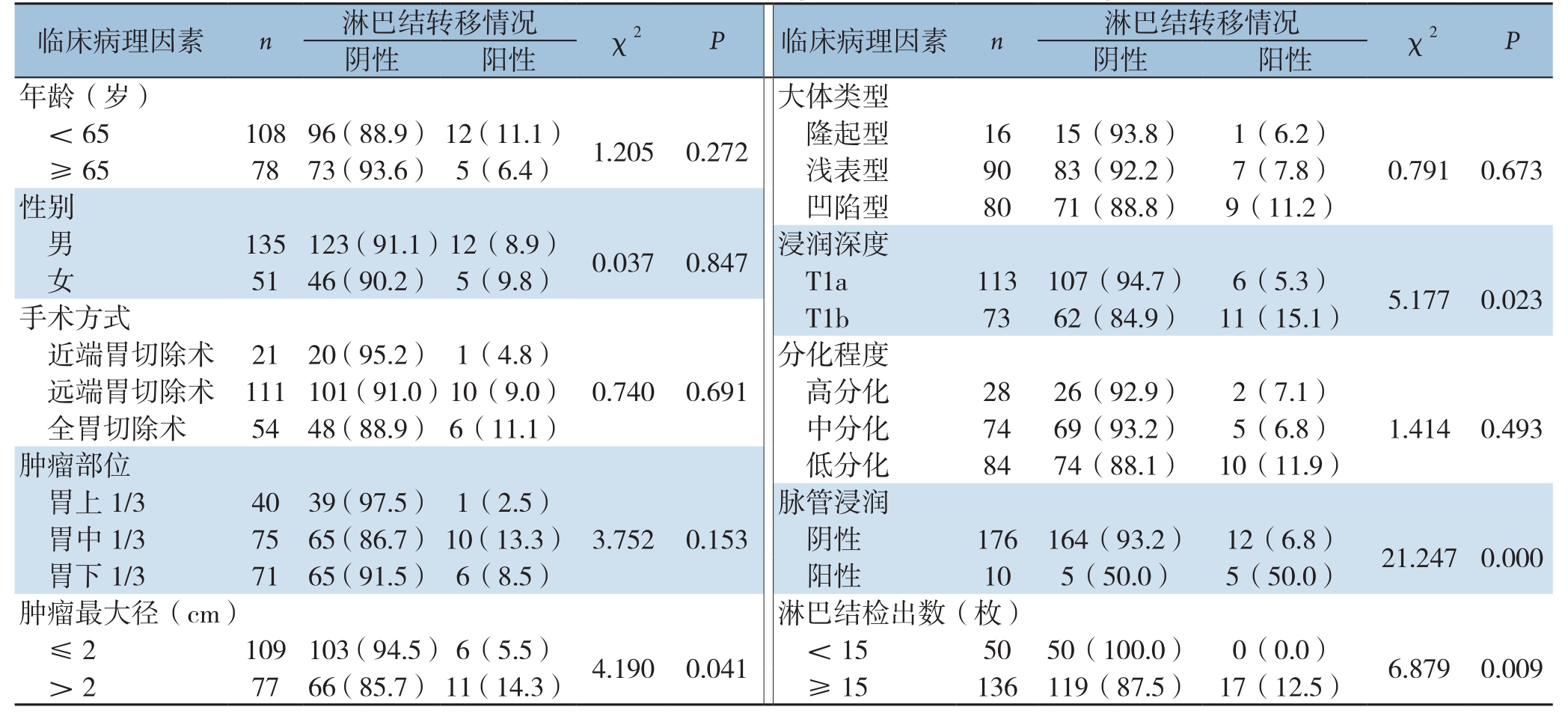
临床病理因素 n 淋巴结转移情况 χ2 P 临床病理因素 n 淋巴结转移情况 χ2 P阴性 阳性 阴性 阳性年龄(岁) 大体类型<65 108 96(88.9) 12(11.1) 1.205 0.272 隆起型 16 15(93.8) 1(6.2)≥65 78 73(93.6) 5(6.4) 浅表型 90 83(92.2) 7(7.8) 0.791 0.673性别 凹陷型 80 71(88.8) 9(11.2)男135 123(91.1)12(8.9) 0.037 0.847 浸润深度女51 46(90.2) 5(9.8) T1a 113 107(94.7) 6(5.3) 5.177 0.023手术方式 T1b 73 62(84.9) 11(15.1)近端胃切除术 21 20(95.2) 1(4.8) 分化程度远端胃切除术 111 101(91.0)10(9.0) 0.740 0.691 高分化 28 26(92.9) 2(7.1)全胃切除术 54 48(88.9) 6(11.1) 中分化 74 69(93.2) 5(6.8) 1.414 0.493肿瘤部位 低分化 84 74(88.1) 10(11.9)胃上1/3 40 39(97.5) 1(2.5) 脉管浸润胃中1/3 75 65(86.7) 10(13.3) 3.752 0.153 阴性 176 164(93.2) 12(6.8) 21.247 0.000胃下1/3 71 65(91.5) 6(8.5) 阳性 10 5(50.0) 5(50.0)肿瘤最大径(cm) 淋巴结检出数(枚)≤2 109 103(94.5)6(5.5) 4.190 0.041 <15 50 50(100.0) 0(0.0) 6.879 0.009> 2 77 66(85.7) 11(14.3) ≥ 15 136 119(87.5) 17(12.5)
表3 EGC淋巴结转移的多因素分析
Table 3 Multivariate analysis of factors for lymph node metastasis in EGC patients

临床病理特征 回归系数 Wald P RR 95% CI浸润深度(T1a vs.T1b) 0.807 1.875 0.171 2.242 0.706~7.121肿瘤最大径(≤ 2 cm vs.>2 cm) 0.313 0.544 0.461 1.368 0.595~3.142脉管浸润(阴性vs.阳性) 2.100 7.233 0.007 8.168 1.768~37.744常量 -6.625 17.964 0.000 0.001 —
2.3 随访及生存结果分析
全组1 8 6例患者具有完整随访资料1 7 3例(93.0%),失访13例,随访时间2~95个月,中位随访37.3个月。截至2019年2月,173例患者中7例死亡。全组EGC患者3年累计生存率96.1%,5年累计生存率92.4%。其中淋巴结转移组17例(死亡2例),无淋巴结转移组156例(死亡5例),无淋巴结转移组3年累计生存率97.1%及5年累计生存率95.5%,高于淋巴结转移组的87.5%及65.6%,但Log-rank检验显示两组生存曲线之间差异无统计学意义(χ2=2.478,P=0.115)(图1)。

图1 EGC患者生存曲线 A:全组患者;B:有、无淋巴结转移患者
Figure 1 Survival curves of the EGC patients A: Entire group of patients; B:Patients with or without lymph node metastasis
3 讨 论
目前国内文献报道的EGC检出率差别较大,波动在5%~21%之间,这可能与各地患者经济水平及医疗条件有关[6]。但是与国外相比仍有较大差距,据报道日本与韩国EGC的比例能达到50%以上[7-9],杨映红等[10]报道一组1972—2003年间2 792例胃癌手术患者的病理资料,其中EGC患者158例,所占比例为5.65%。王聪等[11]报道一组2002—2007年3 108例胃癌患者手术资料,其中EGC患者467例,所占比例为15%。最近10年,本院EGC检查率明显上升,但是各地区仍然存在明显差异[12]。本组资料时间跨度为2010年10月—2018年12月,共登记EGC患者186例,EGC占同期胃癌患者百分比为15.2%。考虑到有相当部分患者确诊EGC后直接行内镜下治疗,EGC实际的检出率应该高于这个数值。虽然与日本、韩国比仍有差距,但随着民众观念的改变以及胃镜检查的普及,相信今后的文献报道的EGC检出率还会逐年上升。
影响EGC预后最主要的因素是区域淋巴结出现转移[13]。文献报道:黏膜内癌淋巴结转移率仅为3%~5%左右,而黏膜下癌淋巴结转移率可达10%~25%左右[14-16],不同位置[17]、不同年龄[18]的EGC淋巴结转移又有不同。本组研究显示黏膜内癌淋巴结转移率5.3%,黏膜下癌淋巴结转移率15.1%与文献报道相仿。王力等[19]报道一组242例EGC患者,淋巴结转移22例(9.1%),其中转移率最高的为第3组及第7组,各8例,其次为第1组和第6组,各4例。本组患者17例淋巴结转移者16例只出现第1站转移,1例同时出现第1站及第2站转移,淋巴结转移率最高的为第3组共11例(5.9%),其次为第4组和第6组各5例(均为2.7%)。仔细分析出现第3组淋巴结转移者病灶主要位于胃体及胃窦部,说明对于胃体、胃窦部的EGC,胃小弯-胃左血管可能是重要的淋巴结引流途径,对于此类EGC患者,手术要规范清扫第1站,特别是第3组淋巴结。
目前多数研究认为EGC出现淋巴结转移主要与肿瘤大小、分化程度、浸润深度以及有无脉管癌栓有关[14,20-24]。武治铭等[25]通过对157例EGC淋巴结转移特点进行单因素及多因素分析得出:肿瘤大小、分化程度、浸润深度、脉管内癌栓均为影响EGC淋巴结转移的独立危险因素。王力等[19]证实肿瘤浸润深度与有无脉管癌栓是EGC淋巴结转移的独立危险因素,在其实验中并未发现肿瘤大小与淋巴结转移的相关性,但其结果随着肿瘤最大径的增加,淋巴结转移率呈显著增加趋势。也有研究[26]认为EGC男性比女性发病率高,但是女性(特别是绝经前女性)比男性更容易发生区域淋巴结转移,考虑不同研究样本选择会有偏移导致最终结果有些误差。本组研究经单因素分析得出肿瘤浸润、肿瘤最大径以及脉管浸润与EGC区域淋巴结转移有关,多因素分析显示脉管浸润是独立危险因子。提示我们临床上对于浸润至黏膜下层、最大径>2 cm的EGC应慎重选择内镜下治疗,若内镜治疗后发现有脉管浸润,应果断追加外科根治手术。
众多文献已表明,淋巴结清扫数目是评价胃癌手术质量及根治度的标尺[27-28]。第5版UICC/AJCC分期系统就提出将胃癌术后清扫淋巴结数目不低于15枚作为准确评价淋巴结分期的必要前提,NCCN胃癌指南亦推荐胃癌D2根治术至少检获15枚淋巴结[29]。然后对于EGC行D1或DD1+手术往往未必能达到检获15枚淋巴结的要求。本组186例EGC淋巴结清扫数目<15枚有50例,淋巴结清扫≥15枚有136例。值得注意的是发生淋巴结转移的17例均出现在淋巴结清扫数目≥15枚组,淋巴结清扫数目<15枚组无1例发生淋巴结转移,两组之间差异具有统计学意义,提示临床上对于EGC患者,若手术清扫淋巴结不足15枚,有可能漏检阳性淋巴结,从而难以正确地进行临床病理分期,影响患者的后续治疗及预后。
韩国学者[30]的研究显示,无淋巴结受累的患者5年生存率为95%,1~3枚淋巴结转移的患者5年生存率为88%,3枚以上淋巴结转移的患者5年生存率为77%。本研究结论与之相仿,全组EGC患者总体3年累计生存率96.1%,5年累计生存率92.4%,但是伴有淋巴结转移者3年及5年累计生存率分别为87.5%及65.6%,低于无淋巴结转移者的97.1%及95.5%。可能是样本量较少的缘故,淋巴结转移组仅17例且截至随访截点已有2例出现死亡,故Log-rank检验显示两组生存曲线之间差异并无统计学意义,有待进一步随访。
综上所述,EGC发生淋巴结转移与肿瘤浸润深度、肿瘤大小以及脉管浸润有关,临床上对于浸润至黏膜下层、最大径>2 cm的EGC应慎重选择内镜下治疗,若内镜治疗后发现有脉管浸润,应果断追加外科根治手术。外科手术必须行规范的淋巴结清扫,特别是第3组淋巴结的清扫,总的淋巴结清扫数目不应低于15枚。
[1]秦新裕, 刘凤林.早期胃癌及其临床现状[J].中国实用外科杂志,2007, 27(11):857-859.doi:10.3321/j.issn:1005-2208.2007.11.004.
Qin XY, Liu FL.Early gastric cancer and its clinical situation[J].Chinese Journal of Practical Surgery, 2007, 27(11):857-859.doi:10.3321/j.issn:1005-2208.2007.11.004.
[2]Chen W, Zheng R, Baade PD, et al.Cancer statistics in China,2015[J].CA Cancer J Clin, 2016, 66(2):115-132.doi: 10.3322/caac.21338.
[3]Murakami T.Pathomorphological diagnosis: definition and gross classification of early gastric cancer[J].Gann Monogr Cancer Res,1971, 11:53-55.
[4]Yuasa N, Nimura Y.Survival after surgical treatment of early gastric cancer, surgical techniques and long-term survival[J].Langenbecks Arch Surg, 2005, 390(4):286-293.doi: 10.1007/s00423-004-0482-y.
[5]宋武, 何裕隆.早期胃癌淋巴结转移特点、规律和意义[J].中国实用外科杂志, 2019, 39(5):444-447.doi:10.19538/j.cjps.issn1005-2208.2019.05.09.
Song W, He YL.Characteristics, regularity and significance of lymph node metastasis in early gastric cancer[J].Chinese Journal of Practical Surgery, 2019, 39(5):444-447.doi:10.19538/j.cjps.issn1005-2208.2019.05.09.
[6]苗儒林, 李子禹, 季加孚.从中国胃肠肿瘤外科联盟相关数据分析我国早期胃癌诊治现状和发展趋势[J].中国实用外科杂志, 2019, 39(5):419-423.doi:10.19538/j.cjps.issn1005-2208.2019.05.03.
Miao RL, Li ZY, Ji JF.Current treatment status and trends of early gastric cancer in China: analyzed based on the data of China Gastrointestinal Cancer Surgery Union[J].Chinese Journal of Practical Surgery, 2019, 39(5):419-423.doi:10.19538/j.cjps.issn1005-2208.2019.05.03.
[7]Information Committee of Korean Gastric Cancer Association.Korean Gastric Cancer Association Nationwide Survey on Gastric Cancer in 2014[J].J Gastric Cancer, 2016, 16(3):131-140.doi:10.5230/jgc.2016.16.3.131.
[8]The Editorial Board of the Cancer Statistics in Japan.Cancer statistics in Japan 2016[M].Japan: Foundation for Promotion of Cancer Research (FPCR), 2017.
[9]The Editorial Board of the Cancer Statistics in Japan.Cancer statistics in Japan 2018[M].Japan: Foundation for Promotion of Cancer Research (FPCR), 2019.
[10]杨映红, 赵文新, 侯培峰,等.158例早期胃癌病理特征分析[J].中国肿瘤临床, 2008, 35(14):793-796.doi:10.3969/j.issn.1000-8179.2008.14.004.
Yang YH, Zhao WX, Hou PF, et al.Pathological Characteristics of Early Gastric Cancer: an Analysis of 158 Cases[J].Chinese Journal of Clinical Oncology, 2008, 35(14):793-796.doi:10.3969/j.issn.1000-8179.2008.14.004.
[11]王聪, 孙益红, 沈振斌, 等.早期胃癌患者临床病理因素与预后的关系[J].中华消化外科杂志, 2009, 8(5):338-340.doi:10.3760/cma.j.issn.1673-9752.2009.05.010.
Wang C, Sun YH, Shen ZB, et al.Relationship between clinicopathologic factors and prognosis of patients with early gastric cancer[J].Chinese Journal of Digestive Surgery, 2009, 8(5):338-340.doi:10.3760/cma.j.issn.1673-9752.2009.05.010.
[12]王胤奎, 李子禹, 陕飞, 等.我国早期胃癌的诊治现状——来自中国胃肠肿瘤外科联盟数据的启示[J].中华胃肠外科杂志, 2018,21(2):168-174.doi:10.3760/cma.j.issn.1671-0274.2018.02.010.
Wang YK, Li ZY, Shan F, et al.Current status of diagnosis and treatment of early gastric cancer in China ——Data from China Gastrointestinal Cancer Surgery Union[J].Chinese Journal of Gastrointestinal Surgery, 2018, 21(2):168-174.doi:10.3760/cma.j.issn.1671-0274.2018.02.010.
[13]欧阳喜, 郝腾飞, 朱培谦.胃癌淋巴结微转移的研究进展[J].中国普通外科杂志, 2015, 24(4):589-592.doi:10.3978/j.issn.1005-6947.2015.04.023.
Ouyang X, Hao TF, Zhu PQ.Lymph node micrometastasis in gastric cancer: research advances[J].Chinese Journal of General Surgery,2015, 24(4):589-592.doi:10.3978/j.issn.1005-6947.2015.04.023.
[14]Roviello F, Rossi S, Marrelli D, et al.Number of lymph node metastases and its prognostic significance in early gastric cancer:a multicenter Italian study[J].J Surg Oncol, 2006, 94(4):275-280.doi: 10.1002/jso.20566.
[15]Pelz J, Merkel S, Horbach T, et al.Determination of nodal status and treatment in early gastric cancer[J].Eur J Surg Oncol, 2004,30(9):935-941.doi: 10.1016/j.ejso.2004.07.016.
[16]Jin EH, Lee DH, Jung SA, et al.Clinicopathologic factors and molecular markers related to lymph node metastasis in early gastric cancer[J].World J Gastroenterol, 2015, 21(2):571-577.doi:10.3748/wjg.v21.i2.571.
[17]刘峥嵘, 张静, 鲁翀, 等.胃上部癌与胃下部癌临床病理特点及预后的对比分析[J].中国普通外科杂志, 2008, 17(4):299-302.doi:10.3969/j.issn.1005-6947.2008.04.001.
Liu ZR, Zhang J, Lu C, et al.Comparision of clinicopathologic characters and prognosis between upper and lower part gastric carcinoma[J].Chinese Journal of General Surgery, 2008, 17(4):299-302.doi:10.3969/j.issn.1005-6947.2008.04.001.
[18]李华, 路平, 刘彩刚, 等.青年早期胃癌临床病理特征及预后因素探讨[J].中国普通外科杂志, 2007, 16(9):910-912.doi:10.3969/j.issn.1005-6947.2007.09.024.
Li H, Lu P, Liu CG, et al.Clinicopathologic features and prognosis of early gastric cancer in the young patient[J].Chinese Journal of General Surgery, 2007, 16(9):910-912.doi:10.3969/j.issn.1005-6947.2007.09.024.
[19]王力, 梁寒, 王晓娜, 等.早期胃癌淋巴结转移规律及影响因素[J].中华胃肠外科杂志, 2013, 16(2):147-150.doi:10.3760/cma.j.issn.1671-0274.2013.02.015.
Wang L, Liang H, Wang XN, et al.Mode of lymph node metastasis in early gastric cancer and risk factors [J].Chinese Journal of Gastrointestinal Surgery, 2013, 16(2):147-150.doi:10.3760/cma.j.issn.1671-0274.2013.02.015.
[20]Gotoda T, Yanagisawa A, Sasako M, et al.Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers[J].Gastric Cancer, 2000, 3(4):219-225.
[21]Nakamura K, Morisaki T, Sugitani A, et al.An early gastric carcinoma treatment strategy based on analysis of lymph node metastasis[J].Cancer, 1999, 85(7):1500-1505.
[22]Seto Y, Nagawa H, Muto T.Impact of lymph node metastasis on survival with early gastric cancer[J].World J Surg, 1997,21(2):186-189.doi: 10.1007/s002689900213.
[23]Lee HH, Yoo HM, Song KY, et al.Risk of limited lymph node dissection in patients with clinically early gastric cancer: indications of extended lymph node dissection for early gastric cancer[J].Ann Surg Oncol, 2013, 20(11):3534-3540.doi: 10.1245/s10434-013-3124-1.
[24]Li X, Liu S, Yan J, et al.The characteristics, prognosis,and risk factors of lymph node metastasis in early gastric cancer[J].Gastroenterol Res Pract, 2018, 2018:6945743.doi:10.1155/2018/6945743.
[25]武治铭, 武爱文, 李子禹, 等.157例早期胃癌淋巴结转移特点及预后分析[J].中华胃肠外科杂志, 2009, 12(4):350-353.doi:10.3760/cma.j.issn.1671-0274.2009.04.008.
Wu ZM, Wu AW, Li ZY, et al.Characteristics of lymph node metastasis and prognostic analysis in 157 early gastric cancer patients[J].Chinese Journal of Gastrointestinal Surgery, , 2009,12(4):350-353.doi:10.3760/cma.j.issn.1671-0274.2009.04.008.
[26]孙本龙, 康星, 丁杰, 等.影响早期胃癌患者淋巴结转移的性别因素分析[J].中华普通外科杂志, 2017, 32(1):26-29.doi:10.3760/cma.j.issn.1007-631X.2017.01.009.
Sun BL, Kang X, Ding J, et al.Effect of gender factor on lymph node metastasis in early gastric cancer[J].Zhong Hua Pu Tong Wai Ke Za Zhi, 2017, 32(1):26-29.doi:10.3760/cma.j.issn.1007-631X.2017.01.009.
[27]Chen S, Zhao BW, Li YF, et al.The prognostic value of harvested lymph nodes and the metastatic lymph node ratio for gastric cancer patients: results of a study of 1101 patients[J].PLoS One, 2012,7(11):e49424.doi: 10.1371/journal.pone.0049424.
[28]Marrelli D, Morgagni P, de Manzoni G, et al.Prognostic value of the 7th AJCC/UICC TNM classification of noncardia gastric cancer:analysis of a large series from specialized Western centers[J].Ann Surg, 2012, 255(3):486-491.doi: 10.1097/SLA.0b013e3182389b1a.
[29]Sobin LH, Wittekind CH.International Union Against Cancer(UICC): TNM Classification of Malignant Tumors[M].5th ed.New York: John Wiley & Sons, 1997.
[30]Kim JP, Hur YS, Yang HK.Lymph node metastasis as a significant prognostic factor in early gastric cancer: analysis of 1136 early gastric cancers[J].Ann Surg Oncol, 1995, 2(4):308-313.doi:10.1007/bf02307062.
