胃癌是全球第四大常见的恶性肿瘤,也是导致癌症相关死亡的第二大常见原因[1]。根治性手术对于胃癌的治疗至关重要[2],而胃癌手术风险较大,术后并发症仍维持在较高水平[3];因此,如何促进胃癌手术患者恢复具有重要的临床意义。多项随机对照研究显示:相比开腹胃癌根治术,腹腔镜辅助胃癌根治术安全有效,可缩短胃癌患者住院时间,加快术后功能恢复[4-6]。
加速康复外科(enhanced recovery after surgery,ERAS),旨在对外科患者围手术期中实施以循证医学为基础的各项措施,以减少应激反应和尽快恢复正常生理功能,最终目的是减少术后并发症、缩短住院时间、促进快速康复[7]。ERAS的特点在于其综合性,其涵盖了围手术期管理的全过程,包括术前患者宣教、肠道准备、麻醉镇痛、手术、术后营养、术后活动等。ERAS在胃癌手术的临床实践中存在执行不到位,仍有很大提升空间[8];因此,仍亟需循证医学证实。当前,胃癌根治术应用ERAS的研究主要集中在临床指标的变化上。因此,本研究旨在确定ERAS在胃癌根治术患者中的临床疗效,并探讨ERAS对术后营养状况、炎症反应的影响。
1 资料与方法
1.1 临床资料
前瞻性选取我院胃肠外科从2016年12月—2018年12月拟行腹腔镜辅助胃癌根治术的患者,所有患者需符合腹腔镜胃癌手术操作指南(2007版)中规定的腹腔镜辅助下D2根治术,电脑随机分为常规组和ERAS组。纳入标准为:术前胃镜病理确诊为胃癌;经患者及其家属同意;无严重器官功能障碍;无严重营养不良。排除标准为:有消化道梗阻;术前接受化疗的患者;未行标准淋巴结根治术患者;因各种原因退出研究的患者。本研究经我院伦理委员会批准。
本研究最终纳入患者8 0例,常规组和ERAS组各40例,年龄范围40~70岁,平均年龄(60.90±6.93)岁;男56例,女24例,体质量指数(body mass index,BMI),平均为(21.08±1.77)kg/cm2。常规组:男26例,女14例;平均年龄(60.45±7.63)岁;平均BMI(21.23±1.66)kg/cm2。ERAS组:男24例,女16例;平均年龄(61.35±6.23)岁;平均BMI(20.90±1.88)kg/cm2。两组年龄、性别组成、BMI差异均无统计学意义(均P>0.05)。
1.2 围手术期处理方案
ERAS组患者采用加速康复围手术期处理方案,常规组用传统的围手术期处理方案,具体措施见表1。
表1 ERAS组与常规组围手术期处理方法
Table 1 Perioperative managements in ERAS group and conventional group

项目 ERAS组 常规组术前宣教 强化沟通交流 常规宣教术前营养评估干预 入院后开展NRS 2002营养风险筛查,并常规予以肠内营养粉能全素(纽迪希亚,1 500 kcal/320 g)1听/2 d进行口服营养补充,必要时给予补充性肠外营养支持对于存在营养风险及营养不良患者,根据患者自愿情况进行口服肠内营养粉能全素或肠内营养液能全力(纽迪希亚,1 kcal/mL)术前肠道准备 无需肠道准备 术前晚口服泻药术前禁食 术前6 h禁食,术前晚21:00口服术能(宜昌人福,57.66 kcal/100 m L,每瓶355 mL)2瓶,术前3 h口服术能1瓶术前12 h禁食,8 h禁水术中麻醉管理 全麻+胸段硬膜外麻醉(减少阿片类药物使用,选用短效麻醉药物)全麻+静脉复合麻醉术中体温控制 保温毯、输液加热器、温水腹腔冲洗 不强调术中保温措施腹腔引流管 术中常规放置肝下引流管1根,术后引流量<50 mL,复查CT明确腹腔内无异常及时拔除常规放置,待恢复饮食后拔除术后放置鼻胃管 不常规放置 常规放置,3~5 d后拔除术后留置尿管 术后第1天早晨拔除尿管(24 h内) 下床活动后拔除(48~72 h后)液体管理 术中检测桡动脉,根据每搏心输出量决定补液量(目标导向液体治疗);术后液体1 500~2 000 mL/d左右,耐受流质饮食后尽快停止静脉输液术中不限制补液;术后液体2 500~3 000 mL/d左右术后疼痛管理 多模式镇痛方案:术后静脉注射帕瑞昔布纳(40 mg/8 h),缝皮前切口注射罗哌卡因浸润(75 mg:20 mL),手术当天及术后第1天静脉滴注氢化可的松琥珀酸钠40 mg,逐渐过渡至口服对乙酰氨基酚;用数字疼痛强度量表(numerical rating scale,NRS)进行疼痛评分术后静脉给予非阿片类止痛药氟比洛芬脂(50 mg/12 h),必要时追加哌替啶肌肉注射早期下床活动 术后麻醉清醒即开始协助其床上活动,术后第1天早上下床逐渐活动24~48 h后动员患者下床活动术后饮食、营养指导 术后返回病房后6 h鼻饲250 mL 5%糖盐水,术后第1天启动肠内营养并口服肠内营养粉,之后逐渐增量,并过渡至流食、半流食常规静脉营养4~7 d至肛门排气后,给予试饮水,逐步过渡至流食、半流食
1.3 出院标准
无需静脉补液;日常生活可自理;可耐受经口流质饮食;无需内镜下处理或手术处理的并发症;患者同意出院。
1.4 观察指标
详细记录患者一般临床资料、手术时间、术中出血量、术中补液总量、淋巴结清扫数目;首次通气时间、首次排便时间、术后静脉输液时间、术后住院时间及住院总费用情况。检测两组患者术前1 d、术后第1、3、7天晨空腹血清白蛋白(albumin,ALB)、C-反应蛋白(C-reactive protein,CRP)、白介素6(interleukin 6,IL-6)、降钙素原(procalcitonin,PCT)水平;比较两组患者术后第1、3、7、30天的体质量与术前体质量比值(body weight ratio,BWR)变化。
1.5 统计学处理
应用SPSS 22软件进行数据统计学分析,两组患者连续性资料呈正态分布时用均数±标准差(x±s)表示,非正态分布时用中位数(四分位间距)[M(IQR)]表示;符合正态分布的计量资料予以t检验,不符合正态分布的计量资料予以Mann-Whitney U检验;分类资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者手术及术后情况比较
两组患者的手术方式、吻合方式、手术时间、术中出血量、淋巴结的清扫数量、术后病理分期、肿瘤大小间差异均无统计学意义(均P>0.05);与常规在比较,ERAS组患者术中补液总量、术后首次通气时间、术后排便时间、术后静脉输液时间、术后住院时间、住院总费用均明显减少,差异有统计学意义(均P<0.05)(表2)。
表2 两组患者手术及术后指标比较(n=40)
Table 2 Comparison of the surgical performance and postoperative variables between the two groups of patients (n=40)
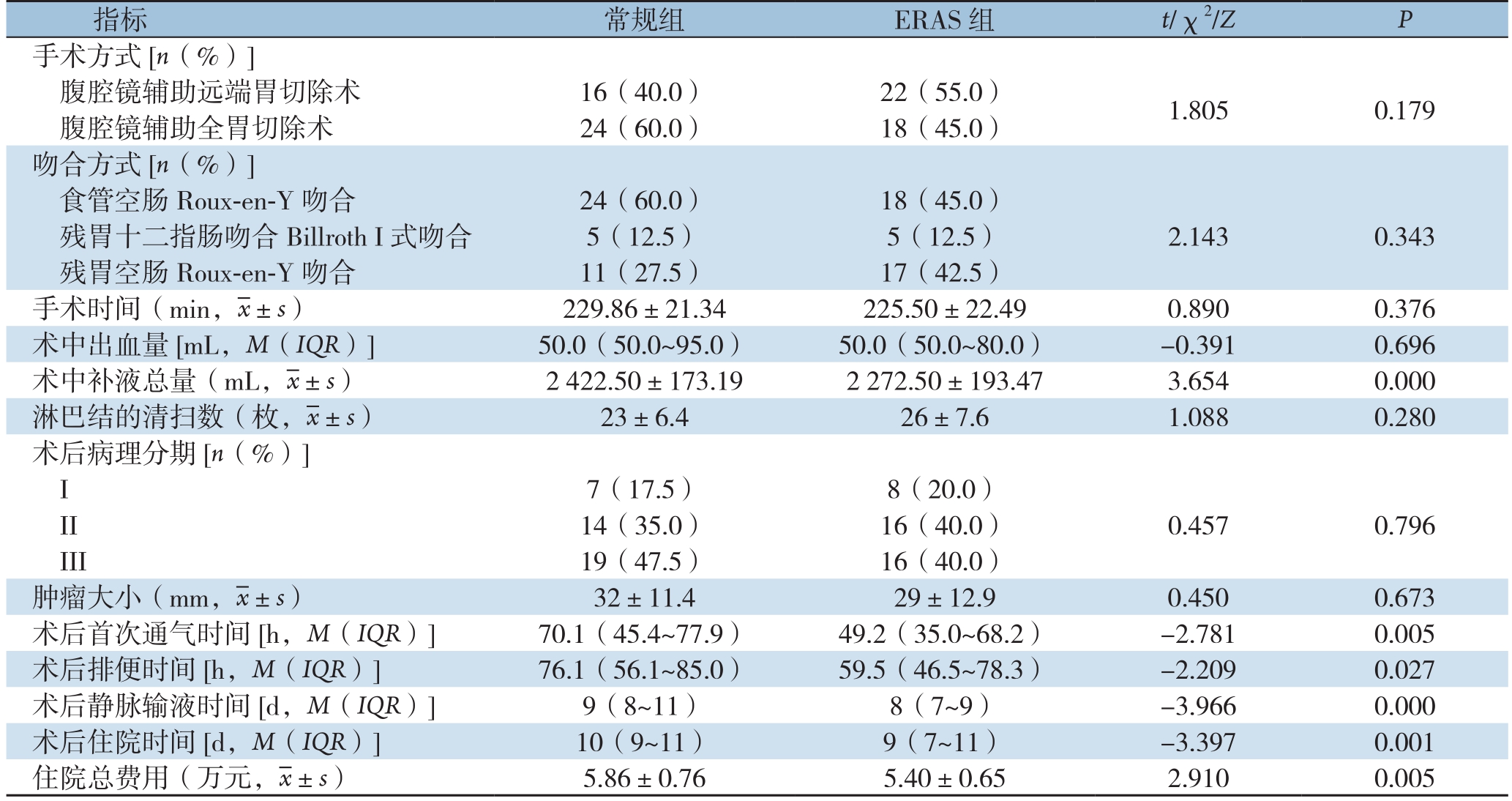
指标 常规组 ERAS组 t/χ2/Z P手术方式[n(%)]腹腔镜辅助远端胃切除术 16(40.0) 22(55.0) 1.805 0.179腹腔镜辅助全胃切除术 24(60.0) 18(45.0)吻合方式[n(%)]食管空肠Roux-en-Y吻合 24(60.0) 18(45.0)残胃十二指肠吻合Billroth I式吻合 5(12.5) 5(12.5) 2.143 0.343残胃空肠Roux-en-Y吻合 11(27.5) 17(42.5)手术时间(min,x±s) 229.86±21.34 225.50±22.49 0.890 0.376术中出血量[mL,M(IQR)] 50.0(50.0~95.0) 50.0(50.0~80.0) -0.391 0.696术中补液总量(mL,x±s) 2 422.50±173.19 2 272.50±193.47 3.654 0.000淋巴结的清扫数(枚,x±s) 23±6.4 26±7.6 1.088 0.280术后病理分期[n(%)]I 7(17.5) 8(20.0)II 14(35.0) 16(40.0) 0.457 0.796 III 19(47.5) 16(40.0)肿瘤大小(mm,x±s) 32±11.4 29±12.9 0.450 0.673术后首次通气时间[h,M(IQR)] 70.1(45.4~77.9) 49.2(35.0~68.2) -2.781 0.005术后排便时间[h,M(IQR)] 76.1(56.1~85.0) 59.5(46.5~78.3) -2.209 0.027术后静脉输液时间[d,M(IQR)] 9(8~11) 8(7~9) -3.966 0.000术后住院时间[d,M(IQR)] 10(9~11) 9(7~11) -3.397 0.001住院总费用(万元,x±s) 5.86±0.76 5.40±0.65 2.910 0.005
2.2 两组患者手术前后ALB水平变化
相比术前ALB水平,术后第1天两组患者术后ALB水平均较术前均下降,差异均有统计学意义(均P<0.05);至术后第3天,两组患者ALB水平较术前水平均无统计学差异(均P>0.05);至术后第7天开始,两组患者ALB水平较术前水平均增加,差异均有统计学意义(均P<0.05)。术前及术后第1、3天,两组间同一时间点ALB水平无统计学差异(均P>0.05),术后第7天ERAS组ALB水平高于对照组,差异有统计学意义(P<0.05)(表3)。
2.3 两组患者手术前后炎症应激指标变化
两组患者术前CRP、IL-6、PCT水平差异均无统计学意义(均P>0.05);两组患者术后第1、3、7天CRP、IL-6、PCT水平均高于术前对应的水平,差异均有统计学意义(均P<0.05)。术后第1、3、7天,ERAS组中CRP、IL-6、PCT水平均低于常规组对应的水平,差异均有统计学意义(均P<0.05)(表4)。
2.4 两组患者BWR比较
两组患者术后BWR逐渐下降,至术后第30天时最低,其中在术后第1、3、30天时两组之间BWR无统计学差异(均P>0.05),仅在术后第7天时可见ERAS组BWR水平明显高于常规组水平(P<0.05)(表5)。
表3 两组患者手术前后ALB指标变化(n=40, ±s)
±s)
Table 3 Changes in ALB levels before and after operation in the two groups of patients (n=40, ±s)
±s)

注:1)与术前1 d比较,P<0.05
Note: 1) P<0.05 vs.the value 1 d before operation
组别 术前1 d 术后1 d 术后3 d 术后7 d常规组 33.0±2.7 31.4±1.91) 34.1±2.7 35.6±1.91)ERAS 组 32.3±2.2 31.5±3.11) 34.1±2.6 36.6±2.61)t 1.291 0.24 0.049 2.101 P 0.200 0.808 0.961 0.039
表4 两组患者手术前后炎症应激指标变化(n=40, ±s)
±s)
Table 4 Changes in inflammatory and stress indexes before and after operation in the two groups of patients (n=40, ±s)
±s)

注:1)与术前1 d比较,P<0.05
Note: 1) P<0.05 vs.the value 1 d before operation
指标 常规组 ERAS组 t P CRP(mg/L)术前1 d 3.0±2.17 2.9±2.13 0.311 0.757术后1 d 89.8±28.651) 72.5±22.401) 2.916 0.005术后3 d 82.3±11.81) 56.4±8.841) 11.129 0.000术后7 d 31.3±10.651) 13.65±6.121) 9.136 0.000 IL-6(ng/mL)术前1 d 2.21±1.09 2.53±1.16 1.290 0.201术后1 d 51.72±7.861) 37.71±13.551)5.657 0.000术后3 d 40.52±9.171) 29.62±7.631) 5.781 0.000术后7 d 15.30±4.101) 13.28±4.071) 2.216 0.030 PCT(μg/L)术前1 d 0.077±0.025 0.080±0.035 0.508 0.613术后1 d 1.082±0.2431)0.890±0.4831)2.254 0.027术后3 d 0.904±0.5431)0.620±0.3231)2.615 0.011术后7 d 0.163±0.0491)0.139±0.0401)2.342 0.022
表5 两组患者术后BWR比较(n=40, ±s)
±s)
Table 5 Comparison of the postoperative BWR values between the two groups of patients (n=40, ±s)
±s)
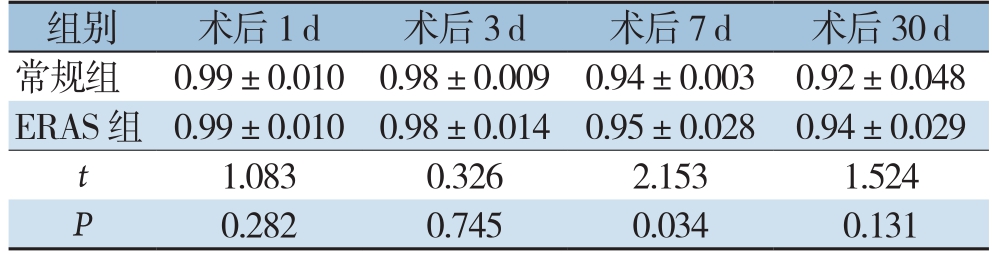
组别 术后1 d 术后3 d 术后7 d 术后30 d常规组 0.99±0.010 0.98±0.009 0.94±0.003 0.92±0.048 ERAS组 0.99±0.010 0.98±0.014 0.95±0.028 0.94±0.029 t 1.083 0.326 2.153 1.524 P 0.282 0.745 0.034 0.131
3 讨 论
本研究ERAS组采用责任护士制度,强化、系统、全面完成个体化术前宣教,以了解手术方案,明确术后康复中注意事项,以减轻焦虑及内心不安[9]。开展ERAS前需对全身状况和脏器功能进行评估,积极开展多学科协作诊治,尽早进行干预、优化脏器功能、积极治疗并发症。多数胃癌患者存在营养不良,ERAS理念的实施就包括了临床营养支持,术前常规进行NRS 2002营养风险筛查[7],是营养风险的患者进行营养支持治疗的前提条件。首选肠内营养支持,对于经口或肠内营养途径不能满足机体60%代谢需要的患者,需给予补充性肠外营养支持[10]。本研究ERAS组常规予以肠内营养口服,尽管部分患者营养状况尚可,但是笔者认为术前常规给予肠内营养口服有助于营养吸收;可减轻肠道内容物,避免术后肠麻痹时肠腔内压增加,导致肠源性细菌移位感染可能;有助于术后早期肠道通气、通便。
ERAS多数指南推荐术前不行机械性肠道准备,避免带来术前不适和水电解质丢失[7]。胡艳杰等[11]报道:行一期吻合的结肠癌手术患者,术前机械性肠道准备增加伤口感染和腹腔内感染的发生率,增加术后首次通气时间,并降低术后第1天前ALB水平。ERAS推荐术前口服碳水化合物,美国麻醉医师学会的指南也允许在手术前2 h摄入清饮料[12]。术前口服碳水化合物可以减轻围手术期的不适和焦虑,2014年发表的考克兰系统评价结果[13]表明:患者在术前或麻醉前4 h内摄入至少45 g碳水化合物,会使首次通气时间缩短0.39 d、住院时间缩短0.30 d。本组所有患者术前均口服术能,术中无1例出现误吸,表明其安全可行。目标导向液体治疗即通过监测心脏搏出量补充实际液体需要量,而不需要补充丢失到第三间隙内的液体,并可通过血管活性药维持血流动力学稳定[14]。围手术期减少液体输入可减轻术后肺水肿及肠道水肿,从而降低术后肺部感染、促进肠功能恢复。一项研究[15]表明结直肠手术围手术期液体管理可作为改善临床结局的独立预后指标,并发现手术当天每额外增加1 L静脉输液,术后影响康复的症状增加了16%,术后并发症增加了32%。
术中保温可降低术后切口感染,保护机体心血管及免疫功能[16]。ERAS麻醉方案推荐实施全麻加胸段硬膜外麻醉。一项Meta分析表明:8 754例在腹部手术中使用胸段硬膜外麻醉的患者,术后可以更快地恢复肠道功能,改善疼痛症状,缩短住院时间[17]。本组术后使用多模式镇痛方案,选择不同给药途径、不同作用机制的药物联合使用,首选非甾体类抗炎药,从而避免阿片类药物对胃肠功能恢复的干扰,并结合小剂量激素减轻炎症应激反应,其镇痛效果良好[9,18]。
ERAS的核心理念是减少围手术期的各种应激反应,而手术创伤是患者术后康复的主要影响因素。近期研究[19-20]表明,联合微创手术可以进一步提高ERAS的疗效,且在提高ERAS方案的依从性、降低术后并发症率、缩短术后恢复时间等方面也有着独特的作用。笔者前期研究已证实腹腔镜辅助胃癌根治术安全、有效,具有切口小、出血少、近期疗效相当等优势;并发现腹腔镜胃癌手术与开腹胃癌手术一样,对肠屏障功能影响较小[21]。因此,将ERAS模式与腹腔镜胃癌根治术的联合应用可加速患者术后康复。当然,手术质量的控制是核心环节,只有保证手术顺利实施,尽量减少手术操作直接相关的并发症,才是ERAS在术后能否顺利开展的基础。
ERAS强调术后早期进食,这符合人体生理性进食需求,可缩短静脉输液时间;目前研究已证实术后早期进食不会增加吻合口瘘等并发症,术后进食可直接营养肠道黏膜细胞,促进肠功能恢复;同时术后早期进食可维持肠黏膜结构和功能的完整性,避免术后肠源性感染[7,9]。ERAS的核心之一是术后早期下床活动,术后早期下床活动可促进肠功能恢复,本组所有患者术后制定个体化活动计划,由责任护士每日记录下床活动距离,并注意指导、督促其活动。术后尿管、腹腔引流管的早期拔除,进一步提高患者术后的舒适度。腹腔引流管可及时引流腹腔积液、发现腹腔出血、建立术后瘘的冲洗通道。结合笔者地市级医院实际医患环境、医疗安全因素,目前对不放置腹腔引流管仍持谨慎态度,但是尽量做到早拔管,如术后引流量<50 mL,即复查腹部CT并结合实验室感染指标如白细胞、降钙素原变化,综合评估无异常后遂及时拔除腹腔引流管。我国第一届加速康复外科会议协作组专家已达成共识,术中吻合口血运欠佳、张力大或存在导致愈合不良的其它因素,术后发生瘘的风险较高,则应该放置腹腔引流管[22]。
本研究表明腹腔镜辅助胃癌根治术患者实施ERAS后,术后首次通气时间、术后排便时间、术后住院时间、术后静脉输液时间均明显缩短,表明ERAS可促进胃癌患者术后康复;且从经济成本效益来考虑,ERAS患者住院总费用也少于对照组。日本Aoyama等[23]报道腹腔镜辅助根治性远端胃切除患者实施ERAS,相比开腹手术行ERAS的胃癌患者,术后住院时间及术后并发症无差异,但是腹腔镜组术后疼痛明显减轻。韩国Kang等[24]也报道完全腹腔镜下根治性远端胃切除的胃癌患者,相比常规组,ERAS组恢复时间更快[(111.6±34.3)h vs.(126.7±30.7)h,P=0.026]。综上所述,腹腔镜胃癌手术患者实施ERAS后可促进术后恢复。本研究亦存在不足,在于未比较两组患者术后并发症发生率,但是笔者既往研究均表明ERAS并不会增加术后并发症[7,9]。最近一项Meta分析[25]共纳入198例实施ERAS的胃癌患者和202例围手术期采取传统方法的胃癌患者,结果表明术后并发症发生率无差异。Makuuchi等[26]报道胃癌ERAS患者术后Clavien-Dindo分级为II或以上的并发症与传统组无差异(11.1% vs.15.7%,P=0.325)。因此,胃癌手术患者实施ERAS模式是安全、可行的。
胃癌患者术前存在一定程度的营养不良和免疫缺陷,手术和麻醉引起的强烈应激反应进一步削弱了营养状况和免疫系统。各种应激导致下丘脑—垂体—肾上腺皮质轴激和交感—肾上腺髓质轴激活,导致代谢通路的改变而出现负氮平衡[27-28]。而ERAS的精髓正是减少各种应激反应,其中优化营养支持是加速康复外科促进术后康复的基础[18]。ERAS通过术前营养支持、术前代谢调控(进食碳水化合物)、术后早期进食的营养管理模式改善了患者的营养状态,当然E R A S所致的应激反应减轻也是核心环节。本研究选用人血ALB作为营养状况的观察指标,术后第7天ERAS组ALB水平高于对照组,差异有统计学意义(P<0.05)。Wang等[29]也报道:相比传统组,ERAS组患者术后第7天血清ALB升高[(36.91±5.69)g/L vs.(34.09±4.83)g/L,P=0.0 4 3]。笔者前期研究[18]也表明:胃癌患者实施E R A S可以促进术后A L B、前白蛋白(prealbumin,PA)、转铁蛋白、视黄醇结合蛋白的恢复,能明显改善患者术后近期的营养状况。同时,本研究发现胃癌术后患者均存在体质量下降,术后1周时,ERAS组体质量减轻较对照组低,差异有统计学意义,表明ERAS可减轻术后短期体质量的下降。因此,ERAS可以维持胃癌患者术后的营养状态,可一定程度改善负氮平衡。
手术创伤将会激发大量炎性介质物质的释放,如CRP、IL-6等,从而介导全身炎症反应,影响机体免疫功能,增加其术后并发症如感染、器官功能不全的的发生率[30]。CRP 是研究机体急性期反应中被应用最多的炎性蛋白之一,IL-6作为促炎性细胞因子参与免疫应答及炎症反应,其表达水平高低与手术的的创伤应激亦相关[31]。PCT是由甲状腺C细胞和遍布胃肠道的神经内分泌细胞产生的。在健康的非手术患者中,PCT水平非常低;而作为手术后炎症反应的一部分导致PCT的释放,主要是由循环中细菌的脂多糖诱导,或间接地通过各种炎症生物标记物如IL-6和肿瘤坏死因子α所诱导[32-33]。因此,PCT也反映了全身炎症反应的活跃程度,可反应机体的应激水平。研究发现在ERAS组的一系列措施中,可减少手术引起的代谢应激反应,术后第1、3、7天,ERAS组中CRP、IL-6、PCT水平均低于对照组的CRP水平,差异有统计学意义。Wang等[29]也报道:胃癌患者实施ERAS术后第3天[(79.31±19.04)mg/L vs.(9 0.2 3±2 1.2 4)m g/L,P=0.0 4 0]、第7天[(23.14±13.49)mg/L vs.(32.78±15.35)mg/L,P=0.012]CRP较对照组的降低。宋兴超等[34]也报道:相比传统组,ERAS理念应用于全腹腔镜远端胃癌D2根治手术后24、48、72 h的IL-6、CRP均显著降低。因此,ERAS可减轻术后炎症应激反应。
综上所述,ERAS可促进腹腔镜辅助胃癌手术患者术后恢复,改善术后近期营养状态,减轻炎症应激反应。未来,仍需循证医学的临床试验证实,并需根据患者具体病情,制定个体化的ERAS临床路径,考虑到胃癌ERAS各项措施繁琐复杂,需要多学科协作,共同参与到胃癌的围手术期治疗中。
[1]Torre LA, Bray F, Siegel RL, et al.Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87-108.doi: 10.3322/caac.21262.doi: 10.3322/caac.21262.
[2]Aoyama T, Yoshikawa T.Adjuvant therapy for locally advanced gastric cancer[J].Surg Today, 2017, 47(11):1295-1302.doi:10.1007/s00595-017-1493-y.
[3]董兵斌, 徐阿曼.胃癌手术风险及影响因素研究现状[J].中国肿瘤临床, 2015, 42(2):125-128.doi:10.3969/j.issn.1000-8179.20141400.
Dong BB, Xu AM.Research status on the risk factors for postoperative mortality and morbidity in gastric cancer patients after gastrectomy[J].Chinese Journal Clinical Oncology, 2015,42(2):125-128.doi:10.3969/j.issn.1000-8179.20141400.
[4]Kim W, Kim HH, Han SU, et al.Decreased morbidity of laparoscopic distal gastrectomy compared with open distal gastrectomy for stage i gastric cancer: short-term outcomes from a multicenter randomized controlled trial (KLASS-01)[J].Ann Surg,2016, 263(1):28-35.doi: 10.1097/SLA.0000000000001346.
[5]Hu Y, Huang C, Sun Y, et al.Morbidity and mortality of laparoscopic versus open d2 distal gastrectomy for advanced gastric cancer: a randomized controlled trial[J].J Clin Oncol, 2016,34(12):1350-1357.doi: 10.1200/JCO.2015.63.7215.
[6]陈起跃, 吕陈彬, 郑朝辉, 等.腹腔镜辅助根治性全胃切除术治疗Siewert II、III型胃食管结合部腺癌疗效分析[J].中国实用外科杂志, 2016, 36(9):995-1000.doi:10.7504/CJPS.ISSN1005-2208.2016.09.19.
Chen QY, Lu CB, Zheng ZH, et al.Surgical outcomes after laparoscopic-assisted radial total gastrectomy for Siewert type II and type III adenocarcinoma of the esophagogastric junction[J].Chinese Journal of Practical Surgery, 2016, 36(9):995-1000.doi:10.7504/CJPS.ISSN1005-2208.2016.09.19.
[7]程康文, 王贵和, 束宽山, 等.腹腔镜胃癌根治术中应用快速康复外科理念的研究[J].腹腔镜外科杂志, 2016, 21(4):292-296.doi:10.13499/j.cnki.fqjwkzz.2016.04.292.
Cheng KW, Wang GH, Shu KS, et al.Study of application of fast track surgery ideas in laparoscopic gastrectomy for gastric cancer [J].Journal of Laparoscopic surgery, 2016, 21(4):292-296.doi:10.13499/j.cnki.fqjwkzz.2016.04.292.
[8]Jeong O, Kim HG.Implementation of Enhanced Recovery after Surgery (ERAS) Program in Perioperative Management of Gastric Cancer Surgery: a Nationwide Survey in Korea[J].J Gastric Cancer,2019, 19(1):72-82.doi: 10.5230/jgc.2019.19.e3.
[9]刘红霞, 程康文, 王贵和.加速康复外科护理在腹腔镜胃癌根治术中的应用效果[J].安徽医学, 2018, 39(5):613-616.doi:10.3969/j.issn.1000-0399.2018.05.030.
Liu HX, Cheng KW, Wang GH.Application efficacy of enhanced recovery after surgery nursing in laparoscopic radical resection for gastric cancer[J].Anhui Medical Journal, 2018, 39(5):613-616.doi:10.3969/j.issn.1000-0399.2018.05.030.
[10]中华医学会肠外肠内营养学分会.成人补充性肠外营养中国专家共识[J].中华胃肠外科杂志, 2017, 20(1):9-13.doi:10.3760/cma.j.issn.1671-0274.2017.01.002.
Society of Parenteral and Enteral Nutrition of Chinese Medical Association.Expert consensus on supplementary parenteral nutrition for adults in China[J].Chinese Journal of Gastrointestinal surgery,2017, 20(1):9-13.doi:10.3760/cma.j.issn.1671-0274.2017.01.002.
[11]胡艳杰, 李卡, 李立, 等.术前机械性肠道准备对结肠癌患者早期康复疗效的影响:随机对照试验[J].南方医科大学学报, 2017,37(1):13-17.doi:10.3969/j.issn.1673-4254.2017.01.03.Hu YJ, Li K, Li L, et al.Early outcomes of elective surgery for colon cancer with preoperative mechanical bowel preparation:a randomized clinical trial[J].Journal of Southern Medical University,2017, 37(1):13-17.doi:10.3969/j.issn.1673-4254.2017.01.03.
[12]No authors listed.Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: application to healthy patients undergoing elective procedures[J].Anesthesiology, 2017, 126(3):376-393.doi: 10.1097/ALN.0000000000001452.
[13]Smith MD, McCall J, Plank L, et al.Preoperative carbohydrate treatment for enhancing recovery after elective surgery[J].Cochrane Database Syst Rev, 2014, (8):CD009161.doi: 10.1002/14651858.CD009161.
[14]Rollins KE, Lobo DN.Intraoperative goal-directed fl uid therapy in elective major abdominal surgery: a meta-analysis of randomized controlled trials[J].Ann Surg, 2016, 263(3):465-476.doi: 10.1097/SLA.0000000000001366.
[15]Gustafsson UO, Hausel J, Thorell A, et al.Adherence to the enhanced recovery after surgery protocol and outcomes after colorectal cancer surgery[J].Arch Surg, 2011, 146(05):571-577.doi: 10.1001/archsurg.2010.309.
[16]中华医学会外科学分会, 中华医学会麻醉学分会.加速康复外科中国专家共识及路径管理指南 (2018版)[J].中国实用外科杂志,2018, 38(1):1-20.doi:10.19538/j.cjps.issn1005-2208.2018.01.01.
Society of Surgery of Chinese Medical Association, Society of Anesthesiology of Chinese Medical Association.Expert consensus on enhanced recovery after surgery and guidelines for management of its pathway (2018 edition)[J].Chinese Chinese Journal of Practical Surgery, 2018, 38(1):1-20.doi:10.19538/j.cjps.issn1005-2208.2018.01.01.
[17]Guay J, Nishimori M, Kopp S.Epidural local anaesthetics versus opioid-based analgesic regimens for postoperative gastrointestinal paralysis, vomiting and pain after abdominal surgery[J].Cochrane Database Syst Rev, 2016, 7:CD001893.doi: 10.1002/14651858.
[18]王贵和, 程康文.腹腔镜胃癌根治术中应用加速康复外科对术后近期营养指标的影响[J].腹部外科, 2017, 30(4):278-282.doi:10.3969/j.issn.1003-5591.2017.04.011.
Wang GH, Cheng KW.Effect of enhanced recovery after surgery on the postoperative short-term nutrition indicators after laparoscopic gastrectomy for gastric cancer[J].Journal of Abdominal Surgery,2017, 30(4):278-282.doi:10.3969/j.issn.1003-5591.2017.04.011.
[19]Braga M, Borghi F, Scatizzi M, et al.Impact of laparoscopy on adherence to an enhanced recovery pathway and readiness for discharge in elective colorectal surgery: Results from the PeriOperative Italian Society registry[J].Surg Endosc, 2017,31(11):4393-4399.doi: 10.1007/s00464-017-5486-0.
[20]Kennedy RH, Francis EA, Wharton R, et al.Multicenter randomized controlled trial of conventional versus laparoscopic surgery for colorectal cancer within an enhanced recovery programme:EnROL[J].J Clin Oncol, 2014, 32(17):1804-1811.doi: 10.1200/JCO.2013.54.3694.
[21]程康文, 王贵和, 束宽山, 等.腹腔镜辅助与开腹胃癌根治术临床效果及对肠道屏障功能影响的比较[J].中国普通外科杂志,2017, 26(4):450-456.doi:10.3978/j.issn.1005-6947.2017.04.008.
Cheng KW, Wang GH, Shu KS, et al.Laparoscopic-assisted versus open radical gastrectomy for gastric cancer: comparison of clinical effects and influence on intestinal barrier function[J].Chinese Journal of General Surgery, 2017, 26(4):450-456.doi:10.3978/j.issn.1005-6947.2017.04.008.
[22]中国加速康复外科专家组.中国加速康复外科围术期管理专家共识(2016版)[J].中华消化外科杂志,2016, 15(6):527-533.doi:10.3760/cma.j.issn.1673.9752.2016.06.001.
Chinese Expert Group for Enhanced Recovery after Surgery.Chinese expert consensus on enhanced recovery after surgery in perioperative management (2016 edition) [J].Chinese Journal of Digestive Surgery, 2016, 15(6):527-533.doi:10.3760/cma.j.issn.1673-9752.2016.06.001.
[23]Aoyama T, Yoshikawa T, Sato T, et al.Equivalent feasibility and safety of perioperative care by ERAS in open and laparoscopyassisted distal gastrectomy for gastric cancer: a singleinstitutionancillary study using the patient cohort enrolled in the JCOG0912 phase IIItrial[J].Gastric Cancer, 2019, 22(3):617-623.doi: 10.1007/s10120-018-0873-3.
[24]Kang SH, Lee Y, Min SH, et al.Multimodal Enhanced Recovery After Surgery (ERAS) Program is the Optimal Perioperative Care in Patients Undergoing Totally Laparoscopic Distal Gastrectomy for Gastric Cancer: A Prospective, Randomized, Clinical Trial[J].Ann Surg Oncol, 2018, 25(11):3231-3238.doi: 10.1245/s10434-018-6625-0.
[25]Li MZ, Wu WH, Li L, et al.Is ERAS effective and safe in laparoscopic gastrectomy for gastric carcinoma? A meta-analysis[J].World J Surg Oncol, 2018, 16(1):17.doi: 10.1186/s12957-018-1309-6.
[26]Makuuchi R, Sugisawa N, Kaji S, et al.Enhanced recovery after surgery for gastric cancer and an assessment of preoperative carbohydrate loading[J].Eur J Surg Oncol, 2017, 43(1):210-217.doi: 10.1016/j.ejso.2016.07.140.
[27]Scott MJ, Baldini G, Fearon KC, et al.Enhanced Recovery After Surgery (ERAS) for gastrointestinal surgery, part 1:pathophysiological considerations[J].Acta Anaesthesiol Scand,2015, 59(10):1212-1231.doi: 10.1111/aas.12601.
[28]Carli F.Physiologic considerations of Enhanced Recovery After Surgery(ERAS) programs: implications of the stress response[J].Can J Anaesth, 2015, 62(2):110-119.doi: 10.1007/s12630-014-0264-0.
[29]Wang WK, Tu CY, Shao CX, et al.Impact of enhanced recovery after surgery on postoperative rehabilitation, inflammation,and immunity in gastric carcinoma patients: a randomized clinical trial[J].Braz J Med Biol Res, 2019, 52(5):e8265.doi:10.1590/1414-431X20198265.
[30]Tashiro T, Yamamori H, Takagi K, et al.Changes in immune function following surgery for esophageal carcinoma[J].Nutrition,1999, 15(10):760-766.doi: 10.1016/s0899-9007(99)00151-3.
[31]程康文, 王贵和.加速康复外科对腹腔镜胃癌根治术患者炎症因子与免疫功能的影响[J].腹腔镜外科杂志, 2017, 22(1):30-35.doi:10.13499/j.cnki.fqjwkzz.2017.01.030.
Cheng KW, Wang GH.Effect of enhanced recovery after surgery on inflammatory factor and immune function after laparoscopic radical operation for patients with gastric cancer[J].Journal of Laparoscopic Surgery, 2017, 22(1):30-35.doi:10.13499/j.cnki.fqjwkzz.2017.01.030.
[32]Su'a B, Tutone S, MacFater W, et al.Diagnostic accuracy of procalcitonin for the early diagnosis of anastomotic leakage after colorectal surgery: a meta-analysis[J].ANZ J Surg, 2019.doi:10.1111/ans.15291.[Epub ahead of print]
[33]Vijayan AL, Vanimaya RS, Ravindran S, et al.Procalcitonin: a promising diagnostic marker for sepsis and antibiotic therapy[J].J Intensive Care, 2017, 5:51.doi: 10.1186/s40560-017-0246-8.
[34]宋兴超, 路要武, 吴超, 等.ERAS 对全腹腔镜远端胃癌 D2根治术患者应激反应、生命体征及细胞免疫的影响[J].中国普通外科杂志, 2019, 28(8):1031-1036.doi:10.7659/j.issn.1005-6947.2019.08.019.
Song XC, Lu YW, Wu C, et al.The influence of ERAS for total laparoscopic D2 radical resection of distal gastric cancer on stress reaction, vital signs and cellular immunity of patients[J].Chinese Journal of General Surgery, 2019, 28(8):1031-1036.doi:10.7659/j.issn.1005-6947.2019.08.019.
