肿瘤干细胞(cancer stem cells,CSCs)是肿瘤内少数具有长期克隆生长、自我更新和多向分化能力的特殊肿瘤细胞亚群,与肿瘤的生长、侵袭、转移及复发关系密切[1]。但因为CSCs含有量很少、较难获得且费用高昂,所以使得建立CSCs的扩增模型更具必要性。有幸的是Cariati等[2]发现,利用无血清培养液培养出的肿瘤球细胞具有CSCs样特点,从而为CSCs的研究提供了广阔的空间。CSCs的恶性程度与其自我更新、增殖、侵袭和转移等生物特性密切相关[3-4],因此抑制其恶性生物学特性表达成为了CSCs治疗的重要策略之一。自噬(autophagy)是细胞内一种高度保守的、受基因调控的代谢过程,其通过供能、清除异常细胞器和蛋白质、防止染色体异常,在维持细胞的自稳态、生长分化以及对抗环境压力等过程中发挥重要作用[5]。而目前,细胞自噬在结直肠癌CSCs上述生物学特性中可能具有的作用还未曾探索。因此,本实验用无血清培养法培养人结直肠癌肿瘤球细胞(结直肠癌肿瘤干样细胞),并探索结直肠癌细胞及其球细胞自我更新、增殖、侵袭和迁移能力,以及自噬在上述两种细胞中发生的差异。
1 材料与方法
1.1 主要材料、试剂和设备
主要材料和试剂:人结直肠癌HCT116细胞系购于美国模式菌种收集中心(ATCC),DMEM/F-12培养基、McCoy's 5a培养基、无血清培养基添加因子(B27)和牛血清白蛋白(BSA)均购于博士德生物工程有限公司,生长因子购于美国PeproTech公司,Gibco胎牛血清购于美国赛默飞世尔科技公司,4%多聚甲醛购于北京索莱宝科技有限公司,兔抗人LC3B(microtubule-associated protein 1 light chain 3β,微管相关蛋白1轻链3β)、ATG5(autophagy related gene 5,自噬相关基因5)、ATG7(autophagy related gene 7,自噬相关基因7)和羊抗兔二抗均购于美国CST公司,CY3红色荧光羊抗兔二抗购自上海优宁维生物科技公司,RT-PCR试剂盒购自Takara公司,PCR引物(F/R)LC3B:GAG AGC AGC ATC CAA CCA AA/CTG AGA TTG GTG TGG AGA CG;ATG5:GAA GCT GTT TCG TCC TGT GG/TCT GTT GGC TGT GGG ATG AT;ATG7:TTC TGC AAT GAT GTG GTG GC/CAA GAG AGG TTG GAG GCT CA购自上海生物工程有限公司,Western blot试剂盒和结晶紫染液购于上海碧云天生物技术公司。
主要设备:BIO-RAD电泳仪及Biorad Transblot SD Semi-Dry Transfer Cell转膜仪均系Bio-Rad中国公司产品,Vilber FusionSolo4显影成像系统系北京VILBER公司产品,实时定量荧光PCR仪购自ROCHE公司,免疫荧光激光共聚焦仪购自OLYMPUS科技公司,DMIL Leica显微镜购于徕卡显微镜中国有限公司,CCL-170B-8 ESCO恒温箱购于艺斯高上海贸易有限公司。
1.2 实验方法
1.2.1 细胞培养 HCT116细胞的培养:HCT116细胞复苏后接种于培养瓶中,加入含10%胎牛血清的McCoy's 5a培养基,放置于CO2恒温孵箱培养,待培养瓶中细胞贴壁70%~80%活性较高时进行消化传代。HCT116球细胞的培养:在HCT116细胞活性状态较高时弃原培养液,更换为不含血清的培养基饥饿培养24 h,消化离心、调整密度,最终以3×104/mL的细胞密度悬浮培养HCT116细胞以获得其球细胞,隔日添加含生长因子的无血清培养基2 mL,共培养2周。
1.2.2 肿瘤细胞克隆集落形成实验 分别取对数期的HCT116细胞和HCT116球细胞进行消化、离心,吹打分散为单细胞悬浮液,最终均以500个细胞/孔的密度分别接种于含血清培养基的6孔板中(每组3个复孔)。放置入恒温孵箱中培养,待形成肉眼可见的细胞集落时停止培养,4%多聚甲醛固定,结晶紫染色,拍照并计数。
1.2.3 成球实验 取对数期的HCT116细胞和HCT116球细胞进行消化、离心,加入含生长因子的无血清培养基并吹打分散为单细胞悬浮液,最终每孔含有4 mL无血清培养基和1×103的细胞数目(每组3个复孔),放置于恒温孵育箱中培养,显微镜下观察并计数每视野下形成的细胞球。
1.2.4 Transwell细胞侵袭和迁移实验 取Mateigel胶置于4 ℃冰箱溶解并稀释至10 mg/mL的浓度,加入稀释后的胶于Transwell小室的上室内震荡铺平,恒温孵箱中3 h凝固成胶(迁移实验省略此步骤)。分别取对数期HCT116细胞和HCT116球细胞进行消化、离心,吹打分散为单细胞悬浮液并调整密度为5×105个/mL待用,最终Transwell小室上室加入200 µL体积约105个的HCT116细胞和HCT116球细胞,Transwell小室下室加入700 µL含10%胎牛血清的McCoy's 5a培养基(每组3个复孔),置于恒温孵箱中继续培养48 h(迁移实验24 h)后取出小室清除上层凝胶,4%多聚甲醛固定,结晶紫染色,倒置显微镜下拍照、计数。
1.2.5 免疫荧光激光共聚焦实验 取对数期的HCT116细胞和HCT116球细胞消化、离心,吹打均匀调整细胞密度,取少量细胞均匀涂抹于防脱片载玻片上,滴加遇冷的4%多聚甲醛固定,0.2%Triton X-100增加细胞膜通透性,0.5%BSA液封闭,继而滴加LC3B一抗4 ℃冰箱过夜,CY3荧光二抗再次孵育,最后于激光共聚焦显像系统下拍照。
1.2.6 RT-PCR实验 提取对数期的HCT116细胞和HCT116球细胞的RNA,进行浓度和纯度检测后逆转录合成cDNA,并以cDNA为模板加入合成的LC3B、ATG5、ATG7等特异引物置于实时荧光定量PCR仪中进行PCR扩增,每个样本设置3个复孔,重复3次,采用2-ΔΔCT算法计算目的基因mRNA的相对表达量。
1.2.7 Western blot实验 提取对数期的HCT116细胞和HCT116球细胞的蛋白质,利用BCA法进行测定蛋白浓度测定。采用聚丙烯酰氨凝胶行蛋白电泳,以半干转法行蛋白转膜,再加入LC3B、ATG5、ATG7等兔抗人单克隆抗体和羊抗兔二抗进行抗体孵育,最后成像系统曝光显影。以目的蛋白条带和内参GAPDH条带灰度值的比值作为目的蛋白的相对表达水平,其中LC3B的蛋白表达水平由LC3II/LC3I的比值表示。
1.3 统计学处理
采用GraphPad prism 7.0和Image J统计软件进行数据分析,计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验,以α=0.05作为检验水准。
2 结 果
2.1 HCT116细胞和HCT116球细胞的培养结果
HCT116细胞在含血清的普通培养液中的生长状态表现为分叉且不规则的贴壁生长(图1A),而在含生长因子的无血清培养基中,HCT116球细胞则表现为聚集成球的球团样生长(图1B)。
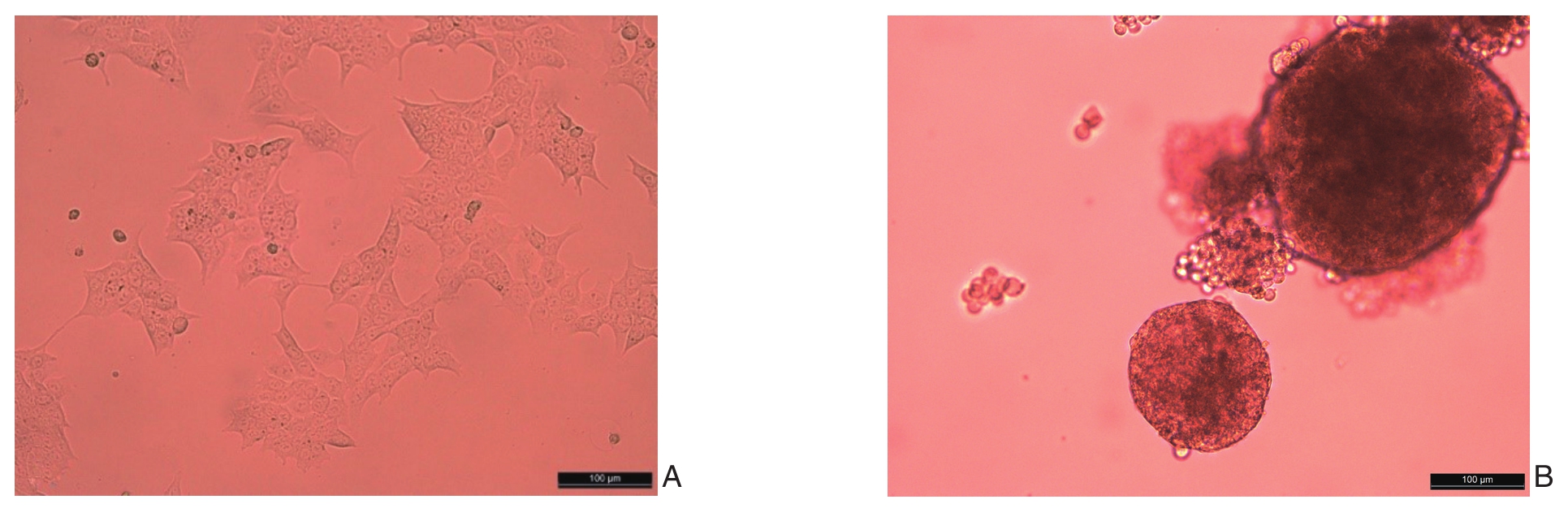
图1 HCT116细胞及HCT116球细胞的生长状态(×200) A:HCT116细胞;B:HCT116球细胞
Figure 1 Growth status of HCT116 cells and HCT116 sphere cells (×200) A: HCT116 cells; B: HCT116 sphere cells
2.2 HCT116细胞和HCT116球细胞的增殖能力
采用平板克隆集落形成实验检测细胞在体外增殖能力,结果显示:HCT116球细胞形成的克隆集落数目为(154.7±4.63)个,而HCT116细胞形成的克隆集落数目为(41.0±1.53)个,HCT116球细胞的克隆形成数明显多于HCT116细胞(t=22.57,P<0.05)(图2)。
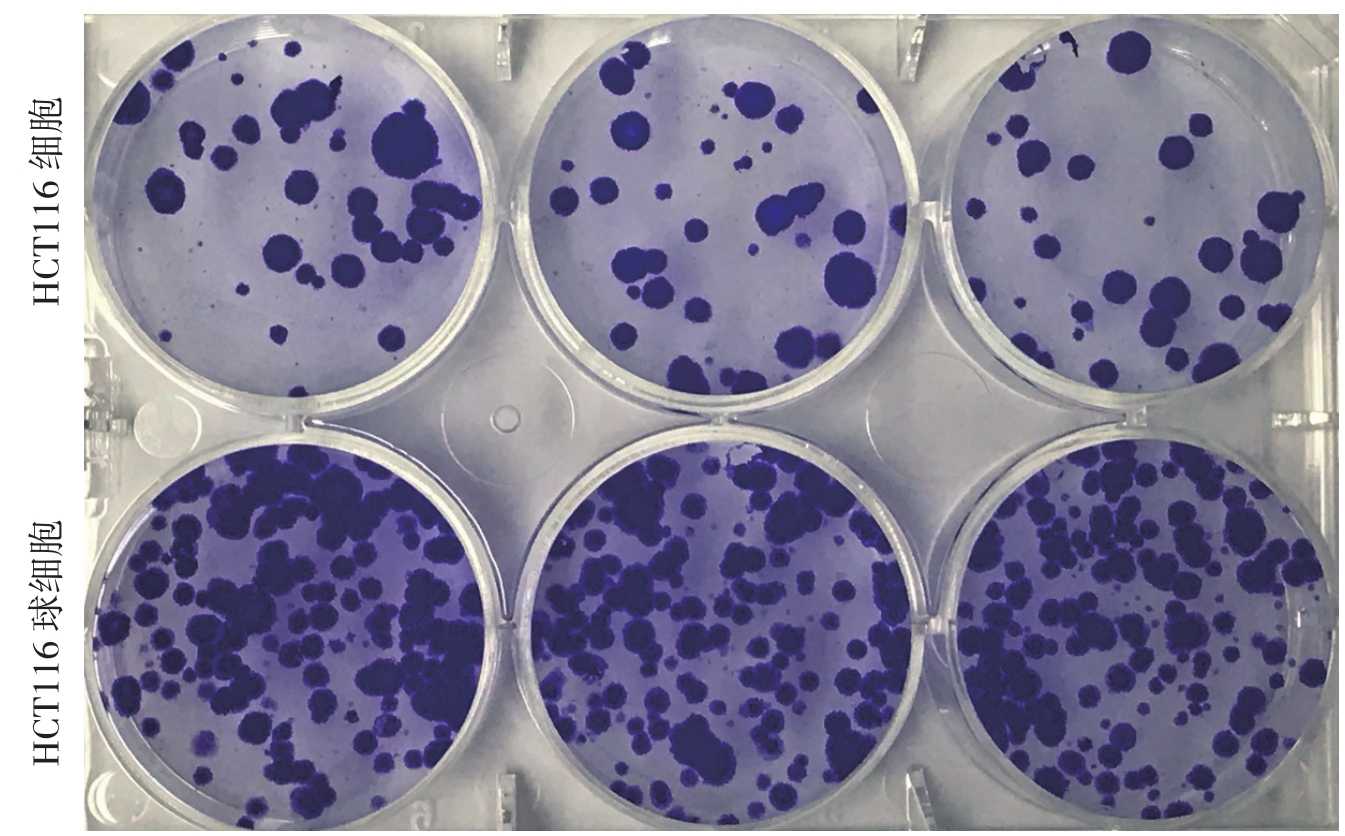
图2 HCT116细胞与HCT116球细胞的克隆集落形成情况
Figure 2 Colony formations of HCT116 cells and HCT116 sphere cells
2.3 HCT116细胞和HCT116球细胞的自我更新能力
采用成球实验检测细胞自我跟新能力,结果显示:HCT116球细胞形成新的细胞球数目为(3.2±0.2)个,HCT116细胞形成新的细胞球数目为(1.4±0.24)个,HCT116球细胞具有更强的自我更新能力(t=4.81,P<0.05)(图3)。
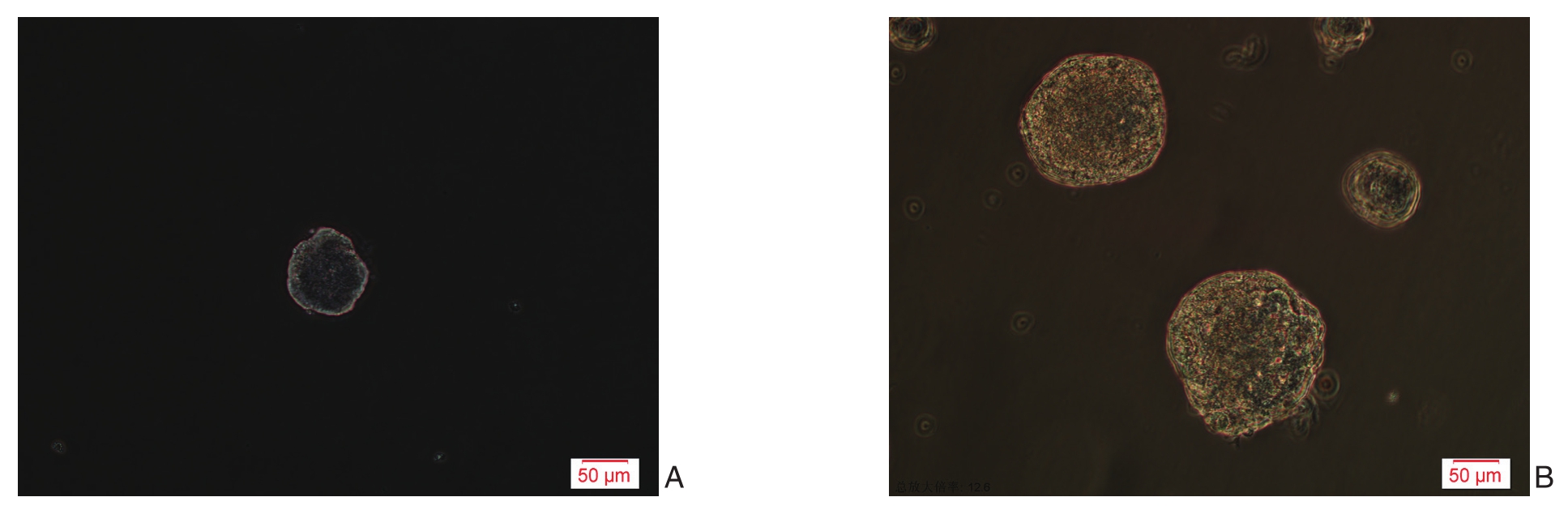
图3 HCT116细胞与HCT116球细胞新形成细胞球的情况(×400) A:HCT116细胞;B:HCT116球细胞
Figure 3 Newly formed spheres from HCT116 cells and HCT116 sphere cells (×400) A: HCT116 cells; B: HCT116 sphere cells
2.4 HCT116细胞和HCT116球细胞的侵袭、迁移情况
T r a n s w e l l侵袭、迁移实验结果显示:HCT116细胞和HCT116球细胞侵袭细胞数分别为(10.66±2.16)个、(28.50±0.56)个,差异有统计学意义(t=17.05,P<0.05);侵袭细胞数分别为(41.17±2.30)个、(156.5±4.87)个,差异有统计学意义(t=21.39,P<0.05)(图4)。
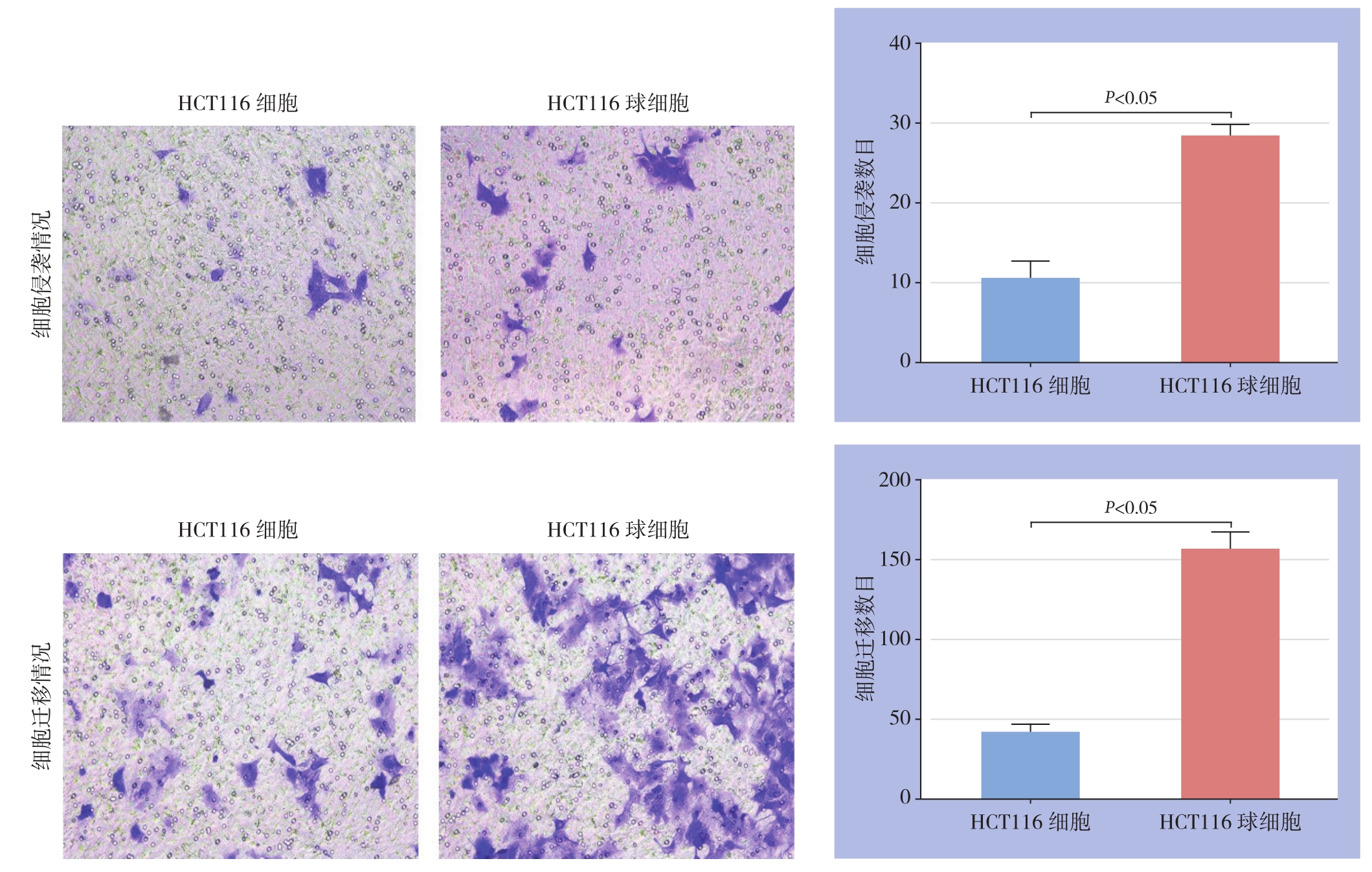
图4 HCT116细胞与HCT116球细胞侵袭、迁移的发生情况(×200)
Figure 4 Invasion and migration abilities of HCT116 cells and HCT116 sphere cells (×200)
2.5 自噬相关基因LC3B的荧光表达情况
LC3是自噬相关基因ATG8的哺乳动物类似物,可以始终与自噬体膜结合,是自噬过程中膜动力学的重要标志物,也是目前被确认最肯定的自噬体标志物[6],CY3二抗发出的红色荧光可显示目的蛋白LC3B的表达强弱。本研究结果显示,HCT116球细胞的红色荧光强度较HCT116细胞明显升高(t=3.52,P<0.05)(图5)。
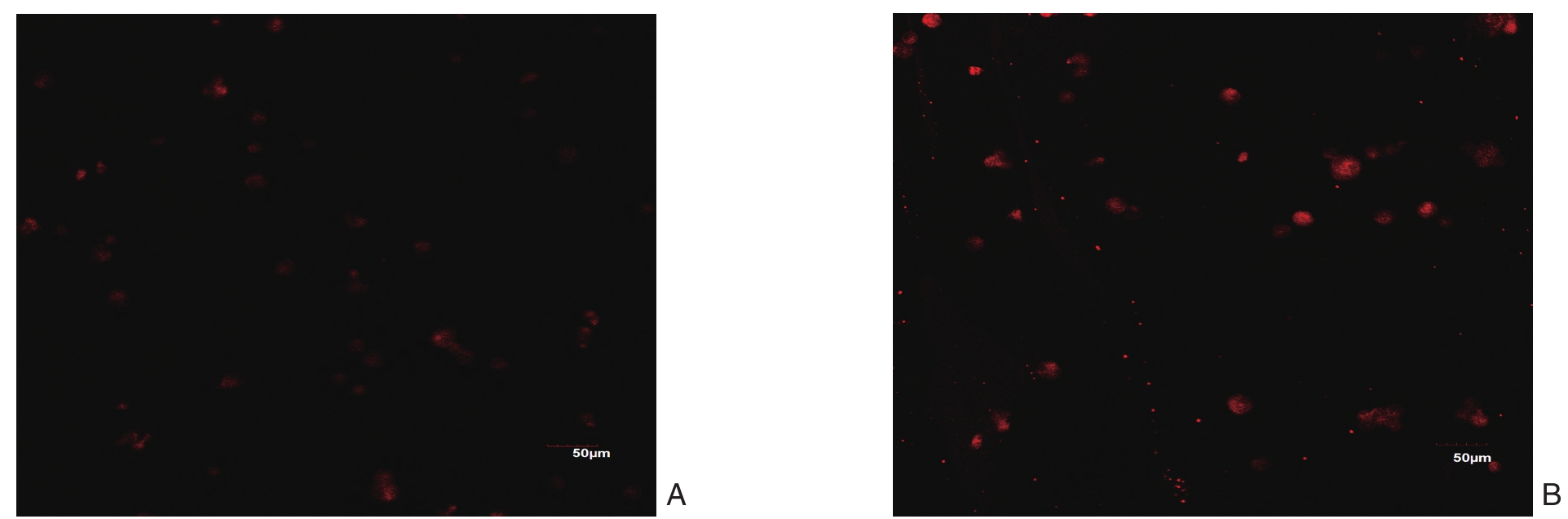
图5 两种细胞中LC3的CY3红色荧光表达情况(×400) A:HCT116细胞;B:HCT116球细胞
Figure 5 Expressions of CY3 red fl uorescence in the two types of cells (×400) A: HCT116 cells; B: HCT116 sphere cells
2.6 自噬相关基因的mRNA表达情况
ATG5、ATG7与LC3B一样是自噬发生相关的重要基因,它们参与了自噬体的形成和延伸等重要过程,也是自噬发生良好的标志物[7]。RT-PCR结果显示,HCT116球细胞组中自噬相关基因LC3B、ATG5、ATG7等mRNA的表达明显较HCT116细胞组更高(P<0.05)(图6)。
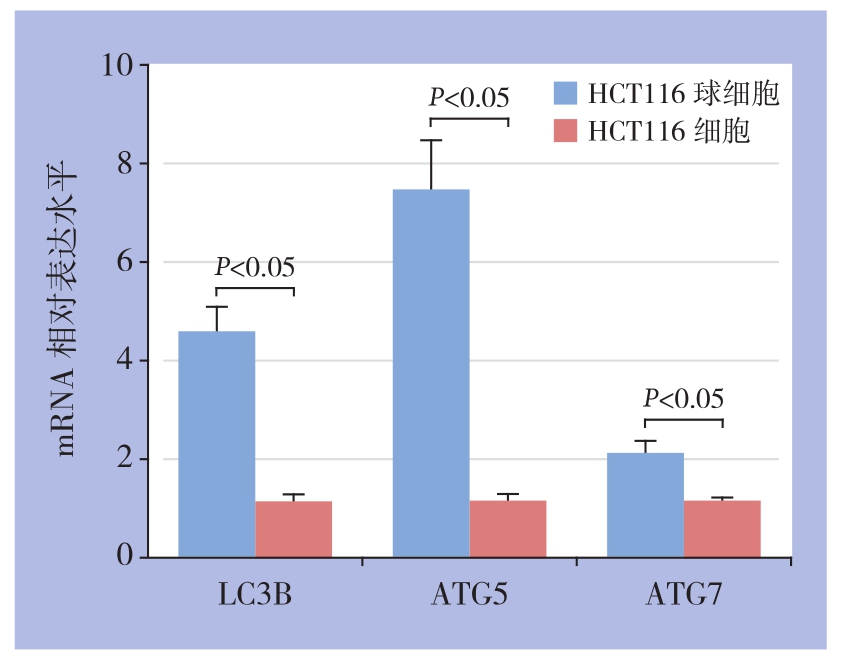
图6 HCT116球细胞和HCT116细胞LC3B、ATG5、ATG7的mRNA表达情况
Figure 6 The mRNA expressions of LC3B, ATG5 and ATG7 in HCT116 cells and HCT116 sphere cells
2.7 自噬相关基因的蛋白表达情况
Western blot结果显示,与HCT116细胞组相比,HCT116球细胞组中自噬相关基因LC3B、A T G 5、A T G 7等的蛋白表达水平均明显增高(P<0.05)(图7)。
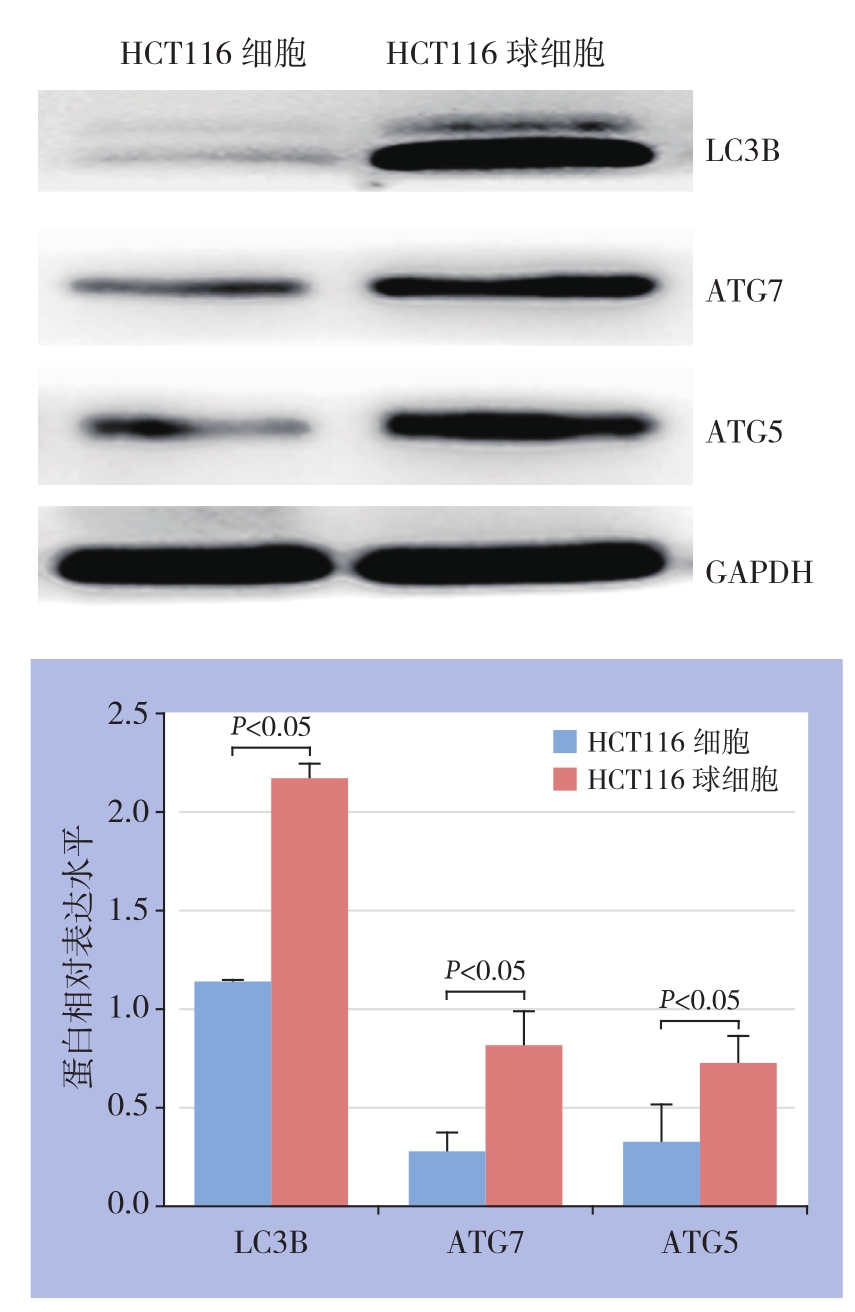
图7 HCT116球细胞和HCT116细胞中LC3B、ATG5、ATG7的蛋白表达情况
Figure 7 The protein expressions of LC3B, ATG5 and ATG7 in HCT116 cells and HCT116 sphere cells
3 讨 论
结直肠癌作为世界上最常见的消化系统恶性肿瘤之一,其发病率、病死率已分别高居世界恶性肿瘤第3位和第2位,并且其不断上升的发病趋势也给人们的生命健康带来了重大风险[8]。目前,结直肠癌的治疗措施主要采用手术切除或联合放化疗,但是部分患者的临床预后却不甚理想。近年来的研究[9-10]表明,结直肠癌较差的临床预后可能与结直肠癌CSCs的持续存在有密切关系,因此,针对结直肠癌CSCs的治疗策略被认为可能是从根本上治愈结直肠癌的重要方法。
自20世纪90年代Bonnet等[11]首次从白血病患者的血液中获取白血病干细胞以来,诸如乳腺癌、肝癌、宫颈癌等多种实性肿瘤组织中的CSCs也被不断发现和证实[12-14]。而Ricci-Vitianil等[15]在2007年首次分离出并证实了结直肠癌CSCs的存在后,从而也开启了对结直肠癌CSCs的研究步伐。CSCs拥有特殊的生长方式,其在含有生长因子的无血清培养液中可以悬浮生长并形成CSCs球团,而普通肿瘤细胞则由于不能贴壁生长而发生失巢性凋亡[16]。研究发现,在无血清培养基中培养的肿瘤球细胞较普通肿瘤细胞更加接近CSCs的特性,而且能够高表达如CD133、CD44等CSCs特异性表面标记物[17-18],除此之外,多位学者[19-21]在把无血清培养法与流式细胞术或免疫磁珠筛选法进行比较后发现,上述3种方法筛选获得的肿瘤细胞均可展现出较强的干细胞特性,从而进一步肯定了无血清培养法富集筛选CSCs的价值[22-23]。
由于CSCs具备较强的恶性生物学特点,如更强的致瘤能力、更高的侵袭和迁移能力,其恶性程度影响着治疗效果[1,24],因此,探索影响CSCs恶性生物学特性的潜在机制具有重要意义。自噬本质上是一种细胞内的代谢过程,负责细胞内的各组分循环利用,与正常组织相比,实体肿瘤处于缺氧、高乳酸、细胞外低pH值和营养物质高消耗的微环境下,而自噬则可通过提高细胞内代谢活性和物质利用效率进而增强肿瘤细胞适应外部微环境的压力。近年来,国内外学者不断的研究发现[25-26],自噬参与了对肿瘤细胞增殖、分化、凋亡和药物抵抗的调节,以促进肿瘤细胞的生存。在此基础上,部分学者探索了自噬与CSCs的关系,他们发现自噬可能以某种机制同样地参与了对干细胞增殖、分化、干性表达及凋亡发生的调控过程,并影响CSCs对放化疗药物的敏感性从而致使抗癌治疗失败[27-29]。同时,Zhai等[30]在动物学实验中发现,在扰乱结直肠癌CSCs中自噬的表达后,裸鼠形成的种植性肿瘤体积更小,并且更不易形成肝肺的转移性肿瘤,说明了自噬可能具有促进结直肠癌CSCs的增殖和转移的作用。然而令人遗憾的是,目前从细胞生物学角度对CSCs和自噬的关系研究还相对不足,而对于自噬与结直肠癌CSCs生物学行为的关系研究更是缺乏。故本次实验以结直肠癌肿瘤球细胞为基础,从细胞学角度进一步探索自噬与结直肠癌CSCs恶性生物学行为的关系。
本次实验通过成球实验和克隆集落形成实验,比较了HCT116细胞和HCT116球细胞自我更新和体外增殖能力,采用Tranwell侵袭和迁移实验比较了它们发生侵袭和迁移的能力,结果显示:⑴ HCT116球细胞形成新细胞球的数目较HCT116细胞明显增多,表明HCT116球细胞具有更强的自我更新能力;⑵ HCT116球细胞形成的细胞集落数目明显高于HCT116细胞,表明HCT116球细胞具有更强的体外增殖能力;⑶ HCT116球细胞较HCT116细胞穿透基底膜侵袭到小室下层或直接迁移到下层的细胞数目显著增多,提示HCT116球细胞具有更强的侵袭和迁移能力。上述的结果不同程度的表明了HCT116球细胞具有更强的恶性生物学行为能力。同时,通过Western blot和RT-PCR实验检测出在HCT116球细胞中自噬特异标记基因LC3B、自噬相关基因ATG5、ATG7均呈现显著的高表达,而HCT116球细胞中LC3B也具有较高的荧光表达强度,上述结果均显示出HCT116球细胞中自噬的表达具有更高的活性。
本实验结果表明,细胞自噬在具有更高恶性生物学行为能力的HCT116球细胞中的表达显著高于HCT116细胞,提示出较高的自噬活性可能与人结直肠癌HCT116球细胞较高的自我更新、致瘤、侵袭和迁移能力有关,抑制自噬可能具有降低结直肠癌CSCs生物学恶性程度的作用,自噬或许能够成为未来针对结直肠癌CSCs治疗的重要靶点。
[1]Nassar D, Blanpain C.Cancer Stem Cells: Basic Concepts and Therapeutic Implications[J].Annu Rev Pathol, 2016, 11:47-76.doi:10.1146/annurev-pathol-012615-044438.
[2]Cariati M, Naderi A, Brown JP, et al.Alpha-6 integrin is necessary for the tumourigenicity of a stem cell-like subpopulation within the MCF7 breast cancer cell line[J].Int J Cancer, 2008, 122(2):298-304.doi: 10.1002/ijc.23103.
[3]Dou J, He XF, Cao WH, et al.Overexpression of microRna-200c in CD44+CD133+ CSCS inhibits the cellular migratory and invasion as well as tumorigenicity in mice[J].Cell Mol Biol (Noisy-le-grand),2013, (Suppl 59):OL1861-1868.
[4]Wang MC, Jiao M, Wu T, et al.Polycomb complex protein BMI-1 promotes invasion and metastasis of pancreatic cancer stem cells by activating PI3K/AKT signaling, an ex vivo, in vitro, and in vivo study[J].Oncotarget, 2016, 7(8):9586-9599.doi: 10.18632/oncotarget.7078.
[5]Yun CW, Lee SH.The Roles of Autophagy in Cancer[J].Int J Mol Sci, 2018, 19(11).pii: E3466.doi: 10.3390/ijms19113466.
[6]Huang R, Liu W.Identifying an essential role of nuclear LC3 for autophagy[J].Autophagy, 2015, 11(5):852-853.doi:10.1080/15548627.2015.1038016.
[7]Cao QH, Liu F, Yang ZL, et al.Prognostic value of autophagy related proteins ULK1, Beclin 1, ATG3, ATG5, ATG7, ATG9,ATG10, ATG12, LC3B and p62/SQSTM1 in gastric cancer[J].Am J Transl Res, 2016, 8(9):3831-3847.
[8]Bray F, Ferlay J, Soerjomataram I, et al.Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin, 2018,68(6):394-424.doi: 10.3322/caac.21492.
[9]Farhana L, Antaki F, Anees MR, et al.Role of cancer stem cells in racial disparity in colorectal cancer[J].Cancer Med, 2016,5(6):1268-1278.doi: 10.1002/cam4.690.
[10]Fan CW, Wen L, Qiang ZD, et al.Prognostic significance of relevant markers of cancer stem cells in colorectal cancer-a meta analysis[J].Hepatogastroenterology, 2012, 59(117):1421-1427.doi:10.5754/hge10727.
[11]Bonnet D, Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med, 1997, 3(7):730-737.doi: 10.1038/nm0797-730.
[12]Yamamoto M, Taguchi Y, Ito-kureha T, et al.NF-kappaB non-cellautonomously regulates cancer stem cell populations in the basallike breast cancer subtype[J].Nat Commun, 2013, 4:2299.doi:10.1038/ncomms3299.
[13]Huang R, Rofstad EK.Cancer stem cells (CSCs), cervical CSCs and targeted therapies[J].Oncotarget, 2017, 8(21):35351-35367.doi: 10.18632/oncotarget.10169.
[14]Xu X, Liu RF, Zhang X, et al.DLK1 as a potential target against cancer stem/progenitor cells of hepatocellular carcinoma[J].Mol Cancer Ther, 2012, 11(3):629-638.doi: 10.1158/1535-7163.MCT-11-0531.
[15]Ricci-Vitiani L, Lombardi DG, Pilozzi E, et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature, 2007,445(7123):111-115.doi: 10.1038/nature05384.
[16]Fan X, Liu S, Su F, et al.Effective enrichment of prostate cancer stem cells from spheres in a suspension culture system[J].Urol Oncol, 2012, 30(3):314-318.doi: 10.1016/j.urolonc.2010.03.019.
[17]杨君, 刘军权, 吕小婷, 等.白藜芦醇抑制结肠癌干细胞增殖并增强MICA/B的表达[J].细胞与分子免疫学杂志, 2015, 31(7):889-893.
Yang J, Liu JQ, Lu XT, et al.Resveratrol inhibits cell proliferation and up-regulates MICA/B expression in human colon cancer stem cells[J].Journal of Cellular and Molecular Immunology, 2015,31(7):889-893.
[18]Ma B, Lei X, Guan Y, et al.Maintenance of retinal cancer stem celllike properties through long-term serum-free culture from human retinoblastoma[J].Oncol Rep, 2011, 26(1):135-143.doi: 10.3892/or.2011.1291.
[19]Sheng X, Li Z, Wang DL, et al.Isolation and enrichment of PC-3 prostate cancer stem-like cells using MACS and serumfree medium[J].Oncol Lett, 2013, 5(3):787-792.doi: 10.3892/ol.2012.1090.
[20]王晓博, 邓小峰, 朱建伟, 等.胆管癌干细胞的分离、培养及鉴定[J].中国普通外科杂志, 2016, 25(2):219-224.doi:10.3978/j.issn.1005-6947.2016.02.011.
Wang XB, Deng XF, Zhu JW, et al.Isolation, cultivation and identification of cholangiocarcinoma stem cells[J].Chinese Journal of General Surgery, 2016, 25(2):219-224.doi:10.3978/j.issn.1005-6947.2016.02.011.
[21]Clotier M, Jobin C, Simard C, et al.In Vitro Culture of Human Hematopoietic Stem Cells in Serum Free Medium and Their Monitoring by Flow Cytometry[J].Methods Mol Biol, 2016,1516:227-241.doi: 10.1007/7651_2016_329.
[22]Liu ZZ, Chen P, Lu ZD, et al.Enrichment of breast cancer stem cells using a keratinocyte serum-free medium[J].Chin Med J (Engl),2011, 124(18):2934-2936.
[23]Wang L, Huang X, Zheng X, et al.Enrichment of prostate cancer stem-like cells from human prostate cancer cell lines by culture in serum-free medium and chemoradiotherapy[J].Int J Biol Sci, 2013,9(5):472-479.doi: 10.7150/ijbs.5855.
[24]Yang M, Liu P, Huang P.Cancer stem cells, metabolism, and therapeutic significance[J].Tumour Biol, 2016, 37(5):5735-5742.doi: 10.1007/s13277-016-4945-x.
[25]谢杰斌, 庞月珊, 王崇树, 等.自噬抑制剂3-甲基腺嘌呤对结直肠腺癌细胞生长与Notch1蛋白表的影响[J].中国普通外科杂志,2015, 24(4):527-531.doi:10.3978/j.issn.1005-6947.2015.04.013.
Xie JB, Pang YS, Wang CS, et al.Effects of autophagy inhibitor 3-methyladenine on growth and Notch1 protein expression in colorectal cancer cells[J]Chinese Journal of General Surgery, 2015,24(4):527-531.doi:10.3978/j.issn.1005-6947.2015.04.013.
[26]Li L, Peng W, Zhou Q, et al.LRP6 regulates Rab7-mediated autophagy through the Wnt/β-catenin pathway to modulate trophoblast cell migration and invasion [J].J Cell Biochem, 2019,doi: 10.1002/jcb.29394.[Epub ahead of print]
[27]Nguyen-McCarty M, Klein PS.Autophagy is a signature of a signaling network that maintains hematopoietic stem cells[J].PLoS One, 2017, 12(5):e0177054.doi: 10.1371/journal.pone.0177054.
[28]Jang J, Wang Y, Lalli MA, et al.Primary Cilium-Autophagy-Nrf2(PAN) Axis Activation Commits Human Embryonic Stem Cells to a Neuroectoderm Fate[J].Cell, 2016, 165(2):410-420.doi: 10.1016/j.cell.2016.02.014.
[29]Tsao T, Beretov J, Ni J, et al.Cancer stem cells in prostate cancer radioresistance[J].Cancer Lett, 2019, 465:94-104.doi: 10.1016/j.canlet.2019.08.020.
[30]Zhai H, Fesler A, Ba Y, et al.Inhibition of colorectal cancer stem cell survival and invasive potential by hsa-miR-140-5p mediated suppression of Smad2 and autophagy[J].Oncotarget, 2015,6(23):19735-19746.doi: 10.18632/oncotarget.3771.
