三阴性乳腺癌(Triple-negative breast cancer,TNBC)是指雌激素和孕激素激素受体阴性,HER-2受体阴性的一类乳腺癌分子亚型,其发病率占乳腺癌总体发病率10%~15%[1]。TNBC异质性和侵袭性强,治疗至复发时间短,内脏转移发生率高,远期预后较其他亚型乳腺癌差,一旦出现复发转移,其中位生存期不足1年。
由于缺少雌激素受体及HER-2受体蛋白等特异性治疗靶点,TNBC在辅助治疗及晚期治疗阶段仍以蒽环、紫杉类等化疗为主。但耐药及多重耐药机制极大程度降低了TNBC患者对于标准蒽环或紫杉类化疗的敏感性,限制了辅助及晚期各线化疗的有效性,使30%~40%的早至中期TNBC患者因肿瘤进展而死亡[2]。
目前,基于对肿瘤细胞DNA同源重组修复缺陷(homologous recombination defects,HRD)机制、聚腺苷二磷酸核糖聚合酶(Ppoly ADP-ribose polymerase)抑制剂、抗体药物偶联物(antibodydrug coupling drugs,ADC)、肿瘤免疫治疗等多方面的不断探索,为晚期TNBC的精准治疗开辟了新的方向。
1 铂类药物治疗BRCA1/2突变的晚期TNBC
BRCA1/2为乳腺癌和卵巢癌易感基因,60%~80%胚系BRCA1突变(gBRCA1/2)携带者为TNBC患者[3]。现有研究[4]表明,BRCA1/2基因在肿瘤细胞DNA同源重组修复中起重要作用,BRCA1参与启动同源重组修复并调控信号转导,BRCA2同DNA重组酶RAD51结合并促进其同DNA损伤位点结合,进而稳定复制叉、维持基因组完整性。BRCA1/2基因发生突变或表观遗传改变可导致DNA同源重组缺陷,使基因组或染色体高度不稳定,进一步导致细胞对铂类等DNA损伤药物敏感性提高[5]。
TBCRC009[6]、CBCSG006[7]和 TNT[8]等研究表明,晚期各线治疗中,蒽环或紫杉类药物耐药且携带胚系BRCA1/2突变的TNBC患者对铂类药物(卡铂或顺铂)的治疗反应性良好,且可改善患者预后(表1)。其中,TNT研究[8]是一项III期、多中心、交叉设计的随机对照研究,探索单药卡铂(AUC6,第1天,1次/3周)对比多西他赛(100 mg/m2,第1天,1次/3周)治疗gBRCA1/2突变晚期乳腺癌或转移性TNBC患者疗效。在55例(14.62%)携带gBRCA1/2突变基因的患者亚组中,卡铂较多西他赛具有治疗优势,治疗客观反应率提高34.7%(P=0.03),无进展生存期取得2.6个月获益(P=0.04)。在BRCA1/2野生型(wBRCA1/2)患者亚组中,顺铂对比多西他赛治疗反应性及预后情况并无明显差异。
2017年第4版晚期乳腺癌国际共识会议(ABC4)指南推荐:对于gBRCA1/2相关的晚期TNBC,在辅助和/或晚期各线治疗进展后推荐使用铂类药物(II/A级别推荐)。同时,推荐晚期TNBC患者尽早接受gBRCA1/2突变检测(I/A级别推荐)。
表1 铂类治疗gBRCA1/2突变晚期TNBC疗效有关临床研究
Table1 Clinical studies concerning platinum therapy in gBRCA1/2-mutated advanced breast cancer
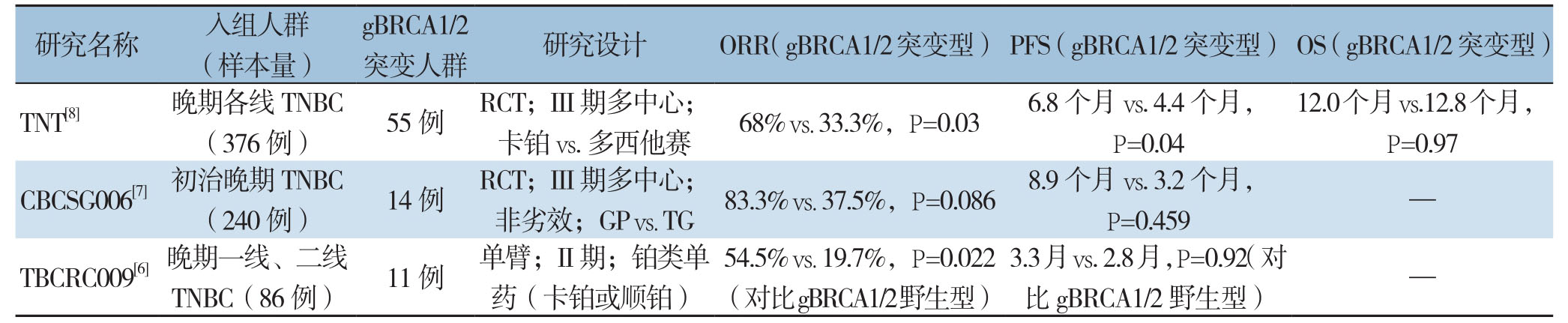
研究名称 入组人群(样本量)gBRCA1/2突变人群 研究设计 ORR(gBRCA1/2突变型)PFS(gBRCA1/2突变型)OS(gBRCA1/2突变型)TNT[8] 晚期各线TNBC12.0个月vs.12.8个月,P=0.97 CBCSG006[7]初治晚期TNBC(376例)55例 RCT;III期多中心;卡铂vs.多西他赛 68% vs.33.3%,P=0.036.8个月vs.4.4个月,P=0.04(240例)14例 RCT;III期多中心;非劣效;GP vs.TG 83.3% vs.37.5%,P=0.0868.9个月vs.3.2个月,P=0.459 —TBCRC009[6]晚期一线、二线TNBC(86例)11例 单臂;II期;铂类单药(卡铂或顺铂)54.5% vs.19.7%,P=0.022(对比gBRCA1/2野生型)3.3月vs.2.8月,P=0.92(对比gBRCA1/2野生型)—
2 PARP抑制剂治疗BRCA1/2突变的晚期TNBC
PARP是一种广泛存在于真核细胞中的多功能蛋白质翻译后修饰酶家族,对保持基因组稳定性发挥重要意义。PARP抑制剂可抑制PARP的催化活性,通过“PARP trapping”机制[9],从而阻碍“PARP化”过程导致DNA单链损伤修复障碍[10]。2015年Farmer等[11]研究发现BRCA1/2突变的小鼠胚胎干细胞(ES细胞)对PARP抑制剂敏感度较BRCA1/2野生型细胞提高1000倍。随后,OlympiAD研究[12]和EMBRACA研究[13]证实PARP抑制剂olaparib(奥拉帕尼)和talazoparib(他唑帕利)单药用于晚期各线gBRCA1/2基因突变TNBC患者的良好临床疗效与安全性。
OlympiAD[12]是一项III期、开放的随机对照研究,入组晚期gBRCA1/2突变的乳腺癌患者(其中49.6%为TNBC),对比单药olaparib(300 mg,2次/d)与标准化疗的疗效差异。olaparib组在首要研究终点PFS方面取得2.8个月获益(HR=0.58,P<0.001),且治疗客观反应率提高31.1%。单药olaparib组3级以上不良反应发生率低于标准化疗组(36.6% vs.50.5%),因副反应导致治疗中断olaparib组发生率为5%,标准化疗组发生率为8%,无明显统计学差异。
EMBRACA研究[13]是一项开放、III期的随机对照临床研究,在gBRCA1/2突变的晚期HER-2阴性乳腺癌患者人群中,对比talazoparib单药(1 mg/d,287例)与标准化疗方案的有效性和安全性。talazoparib单药组在首要终点PFS中取得3.0月获益(HR=0.542,P<0.0001),24周总缓解率较标准治疗组提高35.4%(62.6% vs.27.2%,HR=4.99,P<0.0001),CBR提高32.5%(68.6% vs.36.1%)。不良反应方面,talazoparib单药组3级以上血液学不良反应发生率较高(55% vs.39%),但非血液学不良反应发生率低。
目前,奥拉帕尼及他唑帕利已经由FDA批准上市。2017年第4版晚期乳腺癌国际共识会议(ABC4)指南推荐:对于胚系BRCA1/2突变晚期TNBC在辅助和/或晚期各线治疗进展后推荐使用PARP抑制剂奥拉帕尼或他唑帕利(I/B级别推荐)。除此之外,其他种类PARP抑制剂,如:niraparib(尼拉帕尼)、rucaparib(鲁卡帕尼)和veliparib(维利帕尼),治疗gBRCA1/2突变晚期TNBC有关临床试验仍处I~II期阶段,以期为晚期TNBC癌患者提供高效、低毒的精准靶向治疗新选择。
3 “BRCAness”表型检测揭示晚期TNBC治疗新靶点
“BRCAness”的概念最先由Ashworth等[14]于2004年提出,发现在部分散发性乳腺癌和卵巢癌患者中,具有和gBRCA1/2突变遗传性肿瘤相同的HRD表型,基因组及染色体不稳定性增加,对DNA损伤类化疗药物敏感性上升。通过同源重组系统相关基因检测、启动子甲基化检测、基因组及染色体不稳定性特征检测以及有关基因体外功能分析等方法,可有效识别“BRCAness”表型,进而扩大同源重组缺陷人群识别范围,使散发性、耐药性TNBC患者从DNA损伤药物治疗中进一步取得获益。但目前“BRCAness”表型检测尚未应用于临床实践,其预测价值有待高级别循证医学证据支持。
4 ADC治疗晚期TNBC
ADC治疗是实体肿瘤治疗的新方法。ADC药物由一个单克隆抗体及与之结合的某种化学药物构成,抗体特异性结合于细胞表面受体,使得化学药物内在化从而发挥作用,从而提高肿瘤细胞内的化疗药物浓度而降低药物的副反应及耐药性。T-DM1是最早应用于HER-2过表达晚期乳腺癌治领域的ADC药物,且取得一定疗效[15]。受此启发,部分ADC药物,如第二代ADC药物sacituzumab govitecan(IMMU-132),开始用于晚期TNBC患者的治疗。
IMMU-132是人源化抗滋养层细胞表面抗原2(trop-2)单克隆抗体hRS7与SN-38(拓扑异构酶I抑制剂)的偶联物。trop-2在TNBC中过表达,研究证实,将trop-2抗体与SN-38偶联后使SN-38更精准的作用于肿瘤细胞,提高肿瘤细胞内SN-38药物浓度,同时降低不良反应发生率[16]。
IMMU-132-01[17]是一项I/II期、单臂、多中心的临床研究,纳入至少接受过一线治疗的晚期TNBC患者108例,研究其接受单药sacituzumab govitecan治疗的疗效及安全性。结果表明,治疗客观缓解率为33.3%,缓解持续时间为7.7个月(95% C I=4.9~10.8个月),临床获益率为45.4%,中位总生存期为13.0个月(95% CI=11.2~13.7个月)。不良反应方面,同伊利替康相比,sacituzumab govitecan-hziy(IMMU-132)在最常见的血液学与消化道不良反应发生率和严重程度上都明显降低。
IMMU-132-01是全球第一项ADC单药治疗晚期TNBC前瞻性研究,虽缺少有效对照组,但其研究结果令人鼓舞,为晚期TNBC的精准治疗开辟了新的思路与方向。
5 肿瘤免疫治疗与晚期TNBC
随着对肿瘤免疫的不断深入研究,免疫检查点抑制剂、PD1/PD-L1抑制剂以及CTLA-4抑制剂开始用于以肺癌为主的实体肿瘤晚期治疗。免疫治疗的问世为治疗多重耐药TNBC提供了新方法。研究证实,在TNBC中,PD-L1表达较其他亚型高(特别是在免疫调节型TNBC分子亚型中)[18],肿瘤浸润T淋巴结细胞(TILs)水平高[19],为TNBC的免疫治疗提供理论基础。
I期临床研究结果证实pembrolizumab(MK-3475,PD-1单克隆抗体)[20]、atezolizumab(MPDL3280A、PD-L1单克隆抗体)[21]治疗3线以上耐药晚期TNBC有效率分别为18.5%及33%。III期IMpassion130研究[22]结果亦提示atezolizumab联合白蛋白紫杉醇治疗多重化疗耐药TNBC的有效性并可改善患者预后。2018年圣安东尼奥(SABCS)乳腺癌大会上首次报道其阶段性性研究结果,对比安慰剂联合白蛋白紫杉醇治疗,联用atezolizumab可使PD-L1阳性患者亚组无进展生存期延长2.5个月(P=0.0025),总生存期延长9.5个月(P<0.01)。
晚期TNBC免疫治疗仍待突破,在免疫治疗的应答模式、安全性以及除PD1/PD-L1之外其他免疫治疗标志物的检测等多方面仍需进一步探索。
6 其他晚期TNBC治疗的新方法
10%~15%TNBC表达雄激素受体(AR),该患者亚群化疗耐药性强,但对雄激素抑制治疗反应较好[23]。两项II期临床研究TBCRC011[24]、MDV3100-11[25]结果提示口服雄激素受体拮抗剂比卡鲁胺、恩扎鲁胺治疗多重耐药性AR阳性型TNBC临床获益率分别为19%和35%。目前AR拮抗剂还未被批准用于乳腺癌临床治疗,但其用于AR阳性晚期TNBC内分泌治疗的前景相当广阔。
血管内皮生长因子受体(VEGFR)抑制剂如贝伐单抗等,可通过抑制肿瘤血管的形成从而阻碍肿瘤的生长,发挥抗肿瘤作用。ECOG2100研究[26]结果提示贝伐珠单抗联合紫杉醇治疗HER-2阴性型晚期乳腺癌患者可获得无进展生存优势,但无总生存优势,且可增加不良反应发生率,故尚未获批临床应用。
除此之外,PI3K/Akt/mTOR通路抑制剂、热休克蛋白90与组蛋白脱乙酰酶抑制剂治疗晚期、多重耐药性TNBC的相关基础及临床研究正在进行,其结果值得期待。
7 小 结
总体来讲,对于蒽环或紫杉类药物耐药晚期各线TNBC患者,尚缺少高效、精准的治疗靶点及有关药物,随着TNBC再分型、DNA损伤修复机制、肿瘤免疫及肿瘤耐药机制的不断深入,将为TNBC精准治疗提供更加有效、高频的分子靶点,最大限度改善TNBC患者预后。
[1]Carey L,Winer E,Viale G,et al.Triple-negative breast cancer:disease entity or title of convenience?[J].Nat Rev Clin Oncol,2010,7(12):683-692.doi:10.1038/nrclinonc.2010.154.
[2]Trivers KF,Lund MJ,Porter PL,et al.The epidemiology of triplenegative breast cancer,including race [J].Cancer Causes Control,2009,20(7):1071-1082.doi:10.1007/s10552-009-9331-1.
[3]Atchley DP,Albarracin CT,Lopez A,et al.Clinical and pathologic characteristics of patients with BRCA-positive and BRCA-negative breast cancer[J].J Clin Oncol,2008,26(26):4282-4288.doi:10.1200/JCO.2008.16.6231.
[4]Prakash R,Zhang Y,Feng W,et al.Homologous recombination and human health:the roles of BRCA1,BRCA2,and associated proteins[J].Cold Spring Harb Perspect Biol,2015,7(4):a016600.doi:10.1101/cshperspect.a016600.
[5]Rottenberg S,Nygren AO,Pajic M,et al.Selective induction of chemotherapy resistance of mammary tumors in a conditional mouse model for hereditary breast cancer[J].Proc Natl Acad Sci U S A,2007,104(29):12117-12122.doi:10.1073/pnas.0702955104.
[6]Isakoff SJ,Mayer EL,He L,et al.TBCRC009:A Multicenter Phase II Clinical Trial of Platinum Monotherapy With Biomarker Assessment in Metastatic Triple-Negative Breast Cancer[J].J Clin Oncol,2015,33(17):1902-1909.doi:10.1200/JCO.2014.57.6660.
[7]Hu XC,Zhang J,Xu BH,et al.Cisplatin plus gemcitabine versus paclitaxel plus gemcitabine as first-line therapy for metastatic triplenegativebreast cancer (CBCSG006):a randomised,open-label,multicentre,phase3 trial[J].Lancet Oncol,2015,16(4):436-446.doi:10.1016/S1470-2045(15)70064-1.
[8]Tutt A,Tovey H,Cheang MCU,et al.Carboplatin in BRCA1/2-mutated and triple-negative breast cancer BRCAness subgroups:the TNT Trial[J].Nat Med,2018,24(5):628-637.doi:10.1038/s41591-018-0009-7.
[9]Murai J,Huang SY,Das BB,et al.Trapping of PARP1 and PARP2 by Clinical PARP Inhibitors[J].Cancer Res,2012,72(21):5588-5599.doi:10.1158/0008-5472.CAN-12-2753.
[10]Wei H,Yu X.Functions of PARylation in DNA Damage Repair Pathways[J].Genomics Proteomics Bioinformatics,2016,14(3):131-139.doi:10.1016/j.gpb.2016.05.001.
[11]Farmer H,McCabe N,Lord CJ,et al.Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy[J].Nature,2005,434(7035):917-921.doi:10.1038/nature03445.
[12]Robson M,Im SA,Senkus E,et al.Olaparib for Metastatic Breast Cancer in Patients with a Germline BRCA Mutation[J].N Engl J Med,2017,377(6):523-533.doi:10.1056/NEJMoa1706450.
[13]Litton J,Rugo HS,Ettl J,et al.Abstract GS6-07:A phase 3 trial comparing talazoparib,an oral PARP inhibitor,to physician's choice of therapy in patients with advanced breast cancer and a germline BRCA mutation[J].Cancer Res,2018,78(4 Suppl):Abstract GS6-07.doi:10.1158/1538-7445.SABCS17-GS6-07.
[14]Turner N,Tutt A,Ashworth A.Hallmarks of “BRCAness” in sporadic cancers[J].Nat Rev Cancer,2004,4(10):814-819.doi:10.1038/nrc1457.
[15]Junutula JR,Flagella KM,Graham RA,et al.Engineered thiotrastuzumab-DM1 conjugate with an improved therapeutic index to target human epidermal growth factor receptor 2-positive breast cancer[J].Clin Cancer Res,2010,16(19):4769-4778.doi:10.1158/1078-0432.CCR-10-0987.
[16]Goldenberg DM,Cardillo TM,Govindan SV,et al.Trop-2 is a novel target for solid cancer therapy with sacituzumab govitecan(IMMU-132),an antibody-drug conjugate (ADC)[J].Oncotarget,2015,6(26):22496-22512.doi:10.18632/oncotarget.4318.
[17]Bardia A,Mayer IA,Diamond JR,et al.Efficacy and Safety of Anti-Trop-2 Antibody Drug Conjugate Sacituzumab Govitecan(IMMU-132)in Heavily Pretreated Patients With Metastatic Triple-Negative Breast Cancer[J].J Clin Oncol,2017,35(19):2141-2148.doi:10.1200/JCO.2016.70.8297.
[18]Mittendorf EA,Philips AV,Meric-Bernstam F,et al.PD-L1 expression in triple-negative breast cancer[J].Cancer Immunol Res,2014,2(4):361-370.doi:10.1158/2326-6066.CIR-13-0127.
[19]Stanton SE,Adams S,Disis ML.Variation in the Incidence and Magnitude of Tumor-Infiltrating Lymphocytes in Breast Cancer Subtypes:A Systematic Review[J].JAMA Oncol,2016,2(10):1354-1360.doi:10.1001/jamaoncol.2016.1061.
[20]Nanda R,Chow LQ,Dees EC,et al.Pembrolizumab in Patients With Advanced Triple-Negative Breast Cancer:Phase Ib KEYNOTE-012 Study[J].J Clin Oncol,2016,34(21):2460-2467.doi:10.1200/JCO.2015.64.8931.
[21]Dirix LY,Takacs I,Jerusalem G,et al.Avelumab,an anti-PD-L1 antibody,in patients with locally advanced or metastatic breast cancer:a phase 1b JAVELIN Solid Tumor study[J].Breast Cancer Res Treat,2018,167(3):671-686.doi:10.1007/s10549-017-4537-5.
[22]Schmid P,Chui SY,Emens LA.Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer.Reply[J].N Engl J Med,2019,380(10):987-988.doi:10.1056/NEJMc1900150.
[23]Gucalp A,Gupta G,Patil S,et al.Androgen Receptor (AR)Expression in a Cohort of Patients (pts)with Triple Negative Breast Cancer (TNBC)[J].Cancer Res,2011,71(24 Suppl):P4-02-04.doi:10.1158/0008-5472.SABCS11-P4-02-04.
[24]Gucalp A,Tolaney S,Isakoff SJ,et al.Phase II trial of bicalutamide in patients with androgen receptor-positive,estrogen receptornegative metastatic Breast Cancer [J].Clin Cancer Res,2013,19(19):5505-5512.doi:10.1158/1078-0432.CCR-12-3327.
[25]Traina TA,O'Shaughnessy J,Nanda R,et al.Preliminary results from a phase 2 single-arm study of enzalutamide,an androgen receptor(AR)inhibitor,in advanced AR+ triple-negative breast cancer(TNBC)[J].Cancer Res,2015,75(9 Suppl):P5-19-09.doi:10.1158/1538-7445.SABCS14-P5-19-09.
[26]Miles DW,Diéras V,Cortés J,et al.First-line bevacizumab in combination with chemotherapy for HER2-negative metastatic breast cancer:pooled and subgroup analyses of data from 2447 patients[J].Ann Oncol,2013,24(11):2773-2780.doi:10.1093/annonc/mdt276.

