乳腺血管肉瘤是Schmidt于1887年首次描述,是一类显示内皮细胞分化的恶性肿瘤,发病率是所有原发性乳腺恶性肿瘤的0.05%[1]。血管肉瘤既往也被称为“恶性血管内皮瘤、淋巴管肉瘤”。有学者[2]根据不同组织学亚型将其分为实体上皮样、微小血管瘤样、颗粒细胞变异型、多形性血管肉瘤。世界卫生组织根据组织分化程度将其分为高分化、中等分化、低分化血管肉瘤;根据发病部位不同分为原发性和继发性乳腺血管肉瘤。继发性血管肉瘤多由乳腺癌术后放疗或其他恶性肿瘤引起的慢性淋巴水肿发展而来[3]。原发性乳腺血管肉瘤起源于乳腺实质,病因和发病机制尚不清楚。原发性乳腺血管肉瘤少见,目前国内外报道不足300例,鲜有大样本研究其临床特征和预后情况。
美国国立癌症研究所支持的监测、流行病学和最终结局(The Surveillance,Epidemiology,and End Results,SEER)项目数据库是美国权威登记的恶性肿瘤数据,包含美国18个州县的28%左右的人口,SEER报告的生存结果具有较高的准确性和阳性预测价值 [4-5]。该中心纳入多中心医疗结构的数百万恶性肿瘤患者的人口信息、随访、病理诊断、手术和放化疗等信息,可避免单机构和患病人群的选择偏倚。因此,本研究回顾性研究分析SEER数据库中166例原发性乳腺血管肉瘤患者临床资料,以研究该病的临床病理特征及影响预后的因素。
1 资料与方法
1.1 对象来源与选择标准
筛选并分析美国国立研究所SEER数据库登记的原发性乳腺血管肉瘤患者资料。纳入标准包括:⑴诊断血管肉瘤(ICD-O-3=9120/3);⑵女性;⑶发生部位在乳腺;⑷血管肉瘤为首发的原发性肿瘤。排除标准:⑴重复病例;⑵分化程度及分期不清;⑶手术方式不明;⑷无具体肿瘤直径者;⑸排除2016年间诊断的患者。
1.2 研究方法
用SEER*Stat8.3.5软件在2018年11月提交的最新数据中筛选符合纳入标准的患者资料,通过上述排除标准确定最终研究的患者资料。所有患者从病理确诊时开始随访,随访截止时间为2016年12月31日。对纳入本研究的年龄、种族、偏侧、分期、多原发癌、分化程度、肿瘤直径、手术、放疗和化疗等因素,对连续性变量年龄、肿瘤大小应用X-tile软件获取最佳截断值作为分类变量。应用IMB SPSS Statistics 25进行临床病理资料的统计描述、Cox单因素分析,最后将影响因素(P<0.1)纳入Cox多因素分析;应用GraphPad Prism 8软件对有显著统计学意义的影响因素进行生存曲线作图(P值为Log-Rank检验的结果)。所有假设检验取双侧,P<0.05为差异有统计学意义。
2 结 果
2.1 病例筛选结果
应用SEER*Stat8.3.5软件初步筛选原发性乳腺血管肉瘤277例,均具有完整随访资料。按照排除标准再次筛选,得到符合研究条件的166例原发性乳腺血管肉瘤。X-tile软件(Kaplan-Meier曲线法)获取年龄的最佳截断值为52、74岁,故按照年龄分组为52岁及以下组、53~74岁组、75岁及以上组;获取肿瘤大小的最佳截断值为32、102 mm,故按照肿瘤病灶分组为32 mm及以下组、>32~102 mm组、102 mm以上组。
2.2 纳入患者的基本特征
纳入本研究的166例患者的年龄范围为15~89岁,中位年龄48.5岁;肿瘤病灶最大径为290 mm,中位肿瘤病灶大小为49.5 mm。所有病灶均位于单侧乳房,其中有6例位于中央区,15例位于内上象限、13例位于内下象限、22例位于外上象限,6例位于腋尾区,53例覆盖象限边缘,51例未具体登记乳房部位。研究对象的临床病理特征见表1。
表1 研究病例的临床病理特点
Table1 Clinicopathologic characteristics of the studied cases
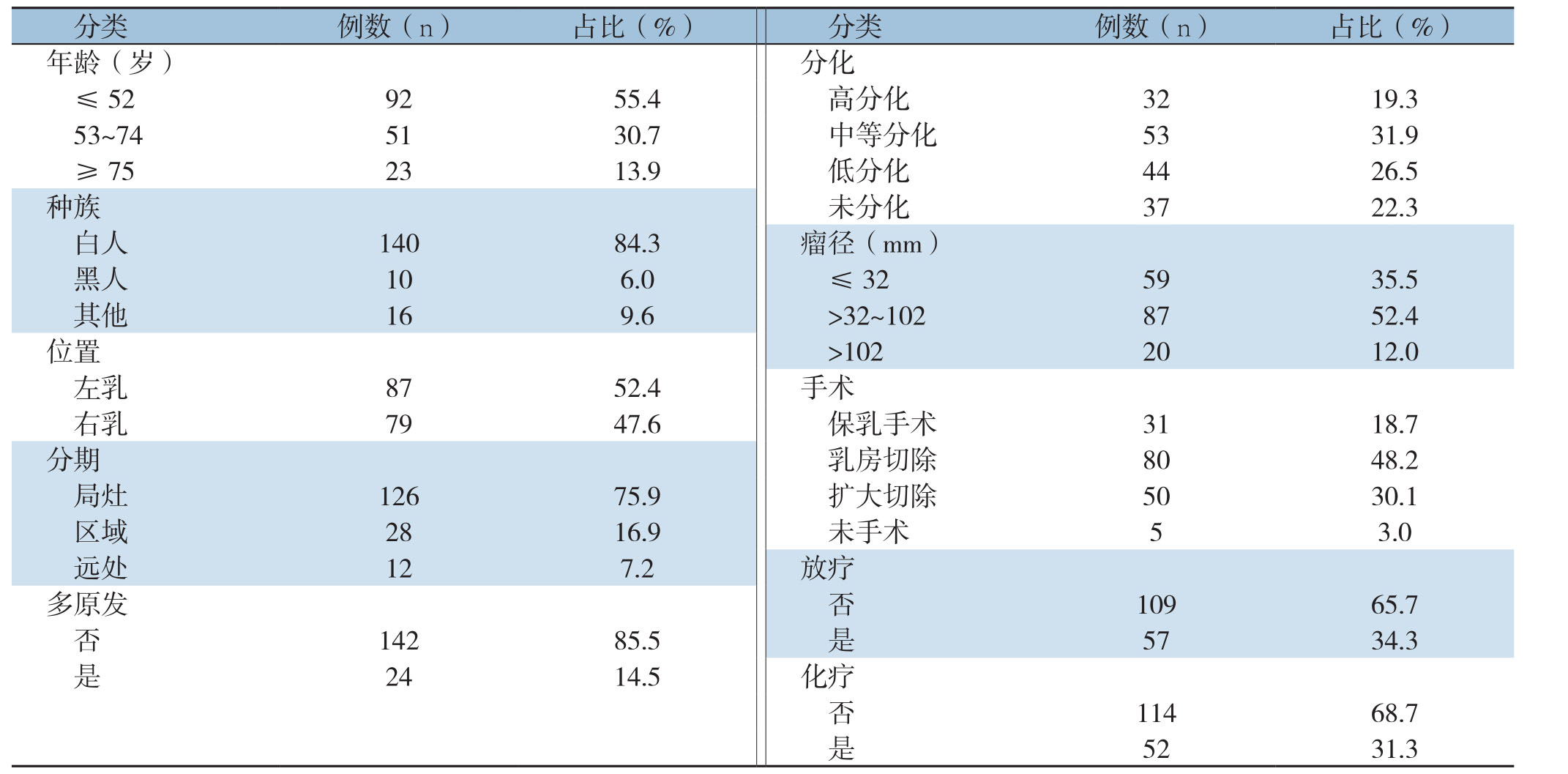
分类 例数(n)占比(%)分类 例数(n)占比(%)年龄(岁)分化≤529255.4 高分化 3219.353~745130.7 中等分化 5331.9≥752313.9 低分化 4426.5种族 未分化 3722.3白人 14084.3 瘤径(mm)黑人 106.0 ≤325935.5其他 169.6 >32~1028752.4位置 >1022012.0左乳 8752.4 手术右乳 7947.6 保乳手术 3118.7分期 乳房切除 8048.2局灶 12675.9 扩大切除 5030.1区域 2816.9 未手术 53.0远处 127.2 放疗多原发 否 10965.7否14285.5 是 5734.3是2414.5 化疗否11468.7是5231.3
2.3 患者生存情况分析
本研究随访的截止时间为2016年12月,其中66例存活,75例发生肿瘤特异性死亡,25例发生非特异性死亡。随访的生存时间为1~390个月,中位生存期37个月,1年总生存率为85.47%。种族(P=0.341)、肿瘤位置(P=0.165)、是否放疗(P=0.311)和是否化疗(P=0.180)组间的生存曲线分布无明显不同。在未发生转移的手术患者中,是否放疗组(P=0.689)、是否化疗(P=0.620)的生存曲线分布无明显不同。对发生区域转移或淋巴结转移的患者行姑息性保乳治疗者3例,随访10~47个月后死亡。对转移患者进行Kaplan-Meier生存分析发现,是否放疗(P=0.737,HR=1.118,95% CI=0.569~2.199)、是否化疗(P=0.913,HR=0.965,95% CI=0.497~1.874)对生存预后的影响均无统计学意义。不同年龄、不同分期、单/多原发肿瘤、不同分化程度、不同肿瘤直径、不同手术方式的组间生存曲线分布差异具有统计学意义(均P<0.05)(图1)。
2.4 预后影响因素的单变量分析
将年龄、种族、偏侧、分期、多原发癌、分化级别、肿瘤直径、手术、放疗和化疗纳入单因素分析,结果显示,年龄、分化程度、分期、多原发癌、手术情况、肿瘤直径对预后有明显影响(均P<0.05)(表2)。
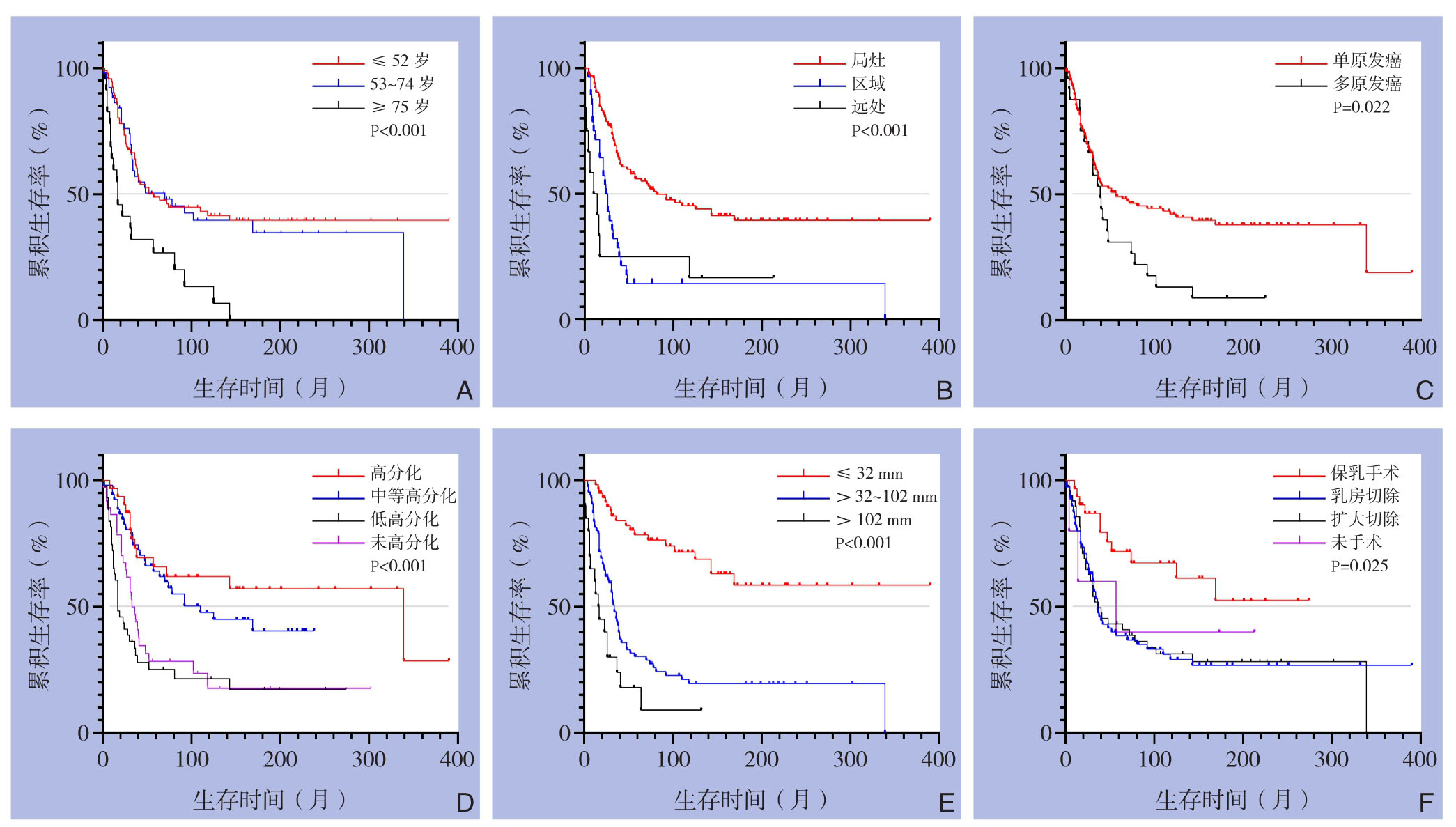
图1 不同因素分组患者的生存曲线 A:不同年龄;B:不同分期;C:单/多原发肿瘤;D:不同分化级别;E:不同肿瘤直径;F:不同手术方式
Figure1 Survival curves of patients grouped by different factors A:Different ages;BDifferent stages;C:Single/multiple primary tumors;D:Different differentiation degrees;E:Different tumor diameters;F:Different surgical types
表2 单因素Cox比例风险回归模型分析影响总生存预后的因素
Table2 Univariate Cox proportional hazard regression model for analysis of factors affecting overall survival prognosis
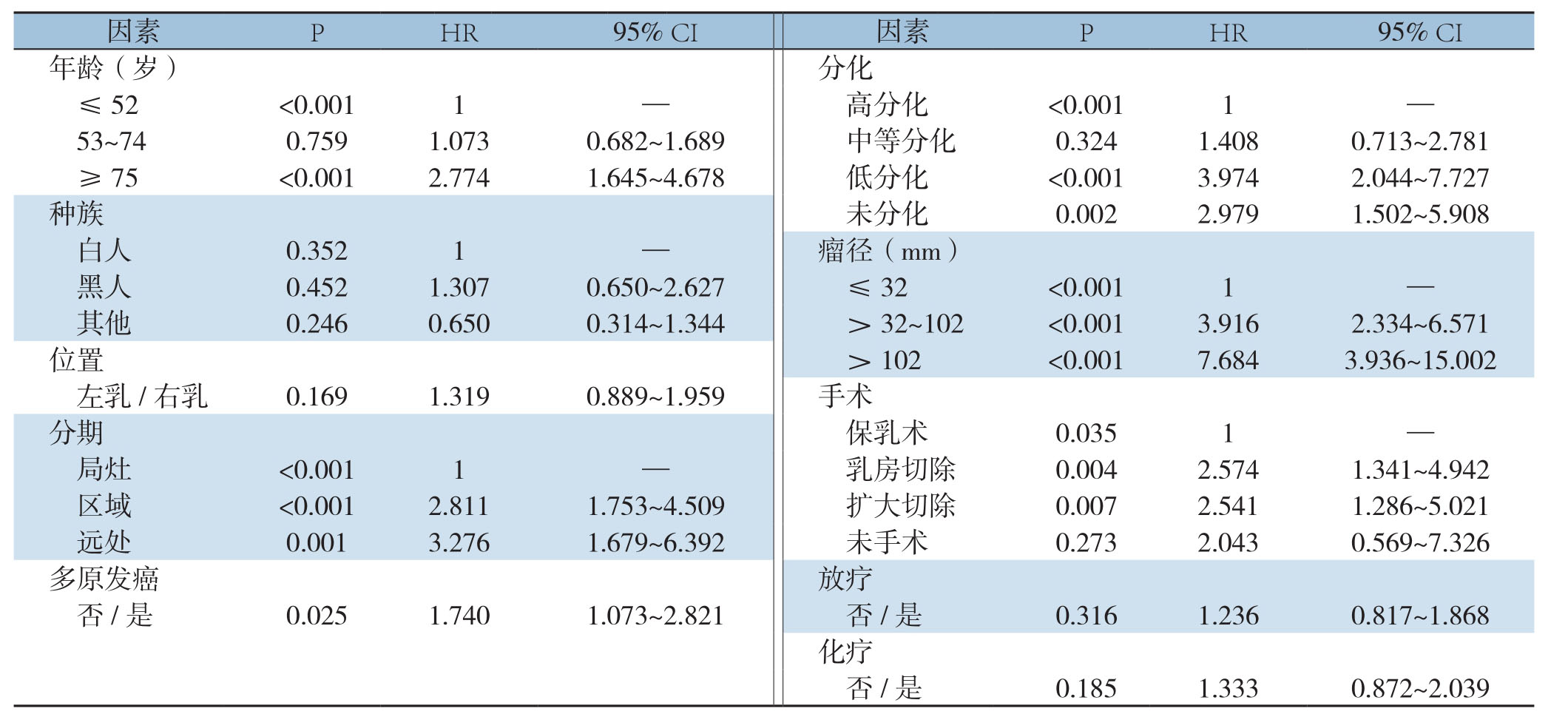
因素 P HR 95% CI 因素 P HR 95% CI年龄(岁)分化≤52 <0.0011 — 高分化 <0.0011 —53~740.7591.0730.682~1.689 中等分化 0.3241.4080.713~2.781≥75 <0.0012.7741.645~4.678 低分化 <0.0013.9742.044~7.727种族 未分化 0.0022.9791.502~5.908白人 0.3521 — 瘤径(mm)黑人 0.4521.3070.650~2.627 ≤32 <0.0011 —其他 0.2460.6500.314~1.344 >32~102 <0.0013.9162.334~6.571位置 >102 <0.0017.6843.936~15.002左乳/右乳 0.1691.3190.889~1.959 手术分期 保乳术 0.0351 —局灶 <0.0011 — 乳房切除 0.0042.5741.341~4.942区域 <0.0012.8111.753~4.509 扩大切除 0.0072.5411.286~5.021远处 0.0013.2761.679~6.392 未手术 0.2732.0430.569~7.326多原发癌 放疗否/是 0.0251.7401.073~2.821 否/是 0.3161.2360.817~1.868化疗否 /是 0.1851.3330.872~2.039
2.5 影响因素的多变量分析
根据Cox单因素分析结果,将部分影响因素(P<0.1)纳入多因素回归分析,并以第一组作为分类参照,结果显示,年龄、分化程度、分期、多原发、肿瘤直径是影响预后的独立危险因素(P<0.05)(表3)。
表3 多因素Cox比例风险回归模型分析影响总生存预后的因素
Table3 Multivariate Cox proportional hazard regression model for analysis of factors affecting overall survival prognosis
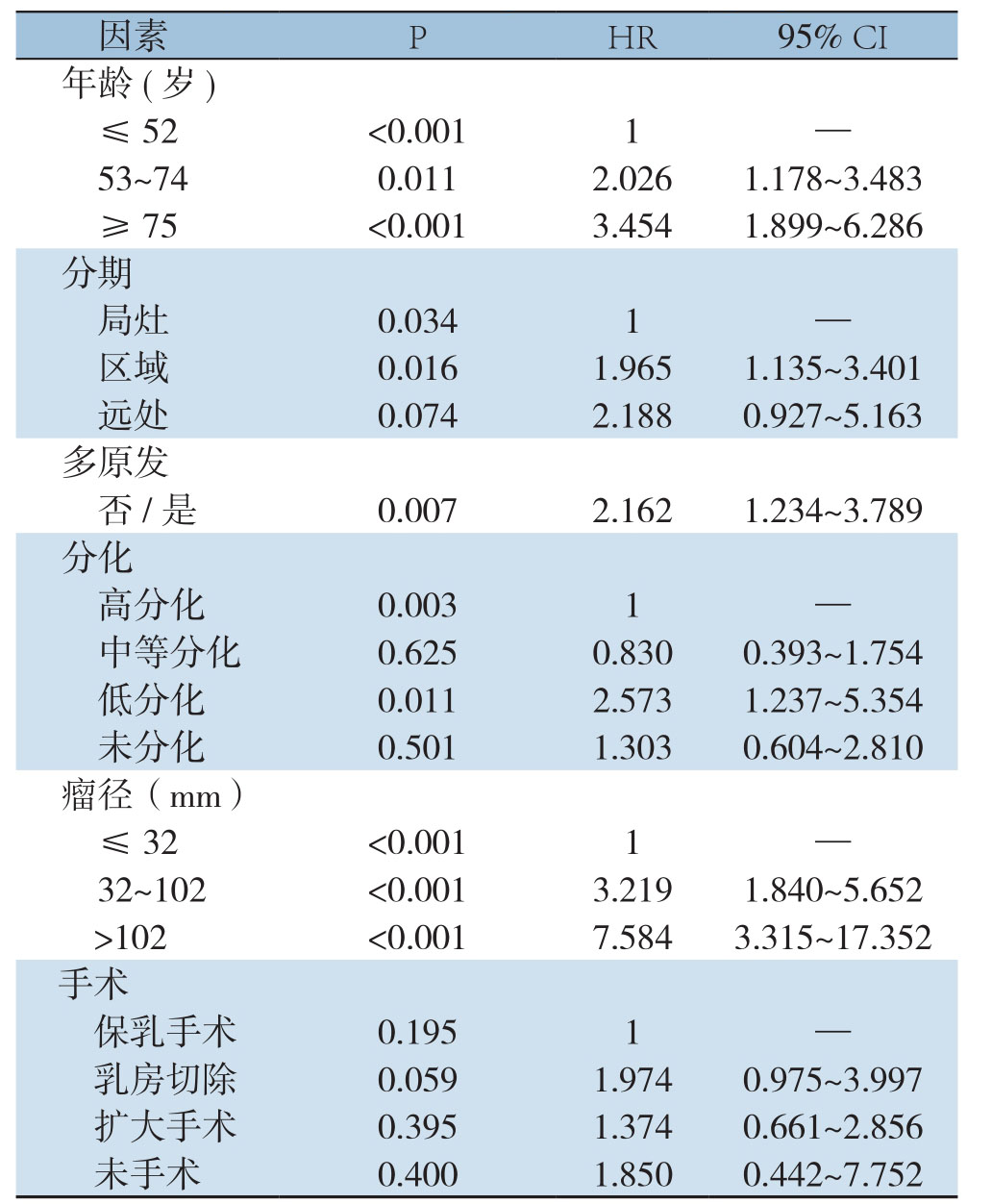
因素 P HR 95% CI年龄(岁)≤52 <0.0011 —53~740.0112.0261.178~3.483≥ 75 <0.0013.4541.899~6.286分期局灶 0.0341 —区域 0.0161.9651.135~3.401远处 0.0742.1880.927~5.163多原发否 /是 0.0072.1621.234~3.789分化高分化 0.0031 —中等分化 0.6250.8300.393~1.754低分化 0.0112.5731.237~5.354未分化 0.5011.3030.604~2.810瘤径(mm)≤32 <0.0011 —32~102 <0.0013.2191.840~5.652>102 <0.0017.5843.315~17.352手术保乳手术 0.1951 —乳房切除 0.0591.9740.975~3.997扩大手术 0.3951.3740.661~2.856未手术 0.4001.8500.442~7.752
3 讨 论
虽然原发性血管肉瘤发病率低,但疾病进展快,预后不良[6]。目前研究以个案报道或单一机构回顾性分析为主,样本量较小。本研究从1973—2016年登记在美国SEER数据库的原发性乳腺血管肉瘤资料中筛选,并分析该病不良预后的影响因素。
现有文献[7]报道该病的发病年龄最小为12岁,最大为107岁。既往同类型研究报道的发病中位年龄为50~54岁,统计分析发现年龄与不良预后相关[8]。本研究纳入的患者年龄为15~89岁,中位年龄是48.5岁,53~74岁组发生不良预后的风险是53岁以下组2.026倍(P=0.011,95% C I=1.178~3.483),而74岁以上组发生不良预后的风险则是3.454倍(P<0.001,95% CI=1.899~6.286)。研究发现疾病诊断时年龄似乎较前研究有更年轻化的趋势,可能与近年来的诊疗手段提高、就诊意识加强等方面有关。
Hu等[9]发现肿瘤组织分级越高,预后越差(P=0.01);另外一项单中心回顾性分析36例原发性乳腺血管肉瘤,发现肿瘤分化程度是影响预后的独立危险因素[10]。这项大样本的病例资料在Cox单因素分析和多因素分析中均显示血管肉瘤的分化程度显著影响预后,其中低分化患者发生死亡的风险比是高分化患者的2.573倍(P=0.011,95% CI=1.237~5.354)。
原发性乳腺血管肉瘤常表现为单个病灶的乳房肿块,少数患者为无肿块或双侧乳腺病灶[11-12]。有研究[13]发现肿瘤大小是影响局灶性乳腺血管肉瘤患者预后的独立危险因素,Cox多因素分析发现20~50 mm组的HR值为1.89,50 mm以上组的HR值为2.48。本研究中,仅有1例无明显肿块,其他均为单侧乳房病灶,直径范围为0~290 mm,中位大小46.5 mm,随着肿瘤直径的增大,发生不良预后的风险比越高。当肿瘤大小为32~102 mm时,HR值为3.219;102 mm以上组的HR为7.584。临床医师应当尽早行手术干预,以降低肿瘤继续增大的趋势,可能改善患者的预后。
纳入研究的166例患者均以原发性乳腺血管肉瘤为首发,其中85.5%仅有1种原发肿瘤,14.5%患者有多种原发肿瘤。Cox单因素分析和多因素分析都表现为伴发其他肿瘤是患者不良预后的影响因素,且患有多种肿瘤患者的死亡风险比是仅有血管肉瘤患者的2.162倍。
血管肉瘤是间质来源的恶性肿瘤,很少发生淋巴结受累的情况[10],罕见合并有乳腺浸润性导管癌[14],故腋窝淋巴结清扫不作为常规手术治疗。此外,有研究[15]发现乳腺血管肉瘤手术后的局部复发率高达45%,与阳性切缘率相同,考虑切缘阳性为肿瘤局部复发的重要原因。另一项研究[16]中,即使所有患者接受乳房全部切除术,5年生存率仅为50%。多项研究已经发现乳腺恶性肿瘤患者接受保乳手术后的生存质量优于改良根治术[17-19]。虽然本研究未登记切缘状态和复发情况,生存分析显示保乳手术治疗的预后优于其他手术方式的预后,且差异具有统计学意义(P=0.025)。本研究中生存分析发现在未发生转移的早期乳腺血管肉瘤患者中采取保乳手术的生存预后较其他手术方式好,而采取乳房切除术和扩大乳房切除并不能带了生存获益。经过调整混杂因素后,Cox多因素分析发现乳房切除术组、扩大切除术组与保乳术组间生存差异并不具有统计学意义(P=0.195)。在已有乳腺血管肉瘤局部侵犯或远处浸润的患者中,尽管已有姑息性保乳治疗效果差,但该类患者仅3例,需要更多研究进一步支持。在临床应用中,具体手术方式可结合病灶浸润范围、肿瘤大小、乳房体积、生存质量、患者意愿等情况采取个体化手术方式治疗,但不主张腋窝淋巴结清扫。
血管肉瘤转移部位常为肺部、肺外脏器和骨[20],而淋巴结侵犯罕见,考虑该病以血管途径转移为主。除了原发灶行手术治疗外,全身治疗可能有效。有研究[21]发现血管肉瘤首次就诊时应用手术治疗,辅助紫杉醇为基础的化疗可以改善生存结局,也有原发性乳腺血管肉瘤回顾性分析发现化疗对不良临床结局并无影响[8]。本研究的化疗因素经过Cox单因素和多因素分析,结果发现化疗对不良预后无显著统计学意义。尽管如此,在近年来的临床试验中,脂质体阿霉素联合贝伐单抗可使转移性血管肉瘤的转移灶显著减小[22],免疫检查点抑制剂如派姆单抗(pembrolizumab)联合阿西替尼(axitinib)等靶向药物正在进行血管肉瘤临床试验[23]。随着临床药物的研发,包括化疗、抗血管生成治疗、靶向治疗等全身治疗的疗效有待前瞻性临床研究进一步阐明。
目前已有质子束放疗用于原发性乳腺血管肉瘤术后治疗,不良反应轻[24]。此外,近年来基于一项对北美放射医师和肿瘤学医师大规模调查发现,半数以上的医师推荐乳腺血管肉瘤手术后辅以化疗、放疗[25],但是放射治疗在血管肉瘤的辅助治疗中仍然存有争议。一项单中心回顾性分析血管肉瘤状态发现5年总生存率为40%,中位数为16个月;放疗在局灶性血管肉瘤患者中无生存获益,但对转移性血管肉瘤的原发灶病情控制有显著意义[26];而较大样本的研究发现放疗对血管肉瘤患者并无生存获益[21]。本研究经过Cox单因素发现是否放疗对于总体的不良预后无显著统计学意义(P=0.316,HR=1.236),对转移病例的预后也无显著影响(P=0.737,HR=1.118),故不推荐放疗作为常规术后治疗。
综上,原发性血管肉瘤预后差,早期诊断和尽早手术干预是治疗本病的有效措施,在无转移的情况下优选考虑保乳治疗,不常规行腋窝淋巴结清扫,手术方式可以在切缘阴性的情况下选择个体化治疗。对于预后不良的高风险病例,全身辅助治疗的前景值得进一步探讨。
[1]Lakhani SR,Elis IO,Schnitt SJ,et al.WHO Classification of Tumours of the Breast[M].Lyon:IARC,2012:135-136.
[2]Mendoza R,Loukeris K.Primary Epithelioid Angiosarcoma of the Breast:A Rare and Challenging Biopsy Diagnosis[J].Am J Case Rep,2019,20:437-440.doi:10.12659/ajcr.913068.
[3]Co M,Lee A,Kwong A.Cutaneous Angiosarcoma Secondary to Lymphoedema or Radiation Therapy - A Systematic Review[J].Clin Oncol (R Coll Radiol),2019,31(4):225-231.doi:10.1016/j.clon.2019.01.009.
[4]Wang XK,Hu N,Herget K,et al.The effect of the 2013 American Society of Clinical Oncology/College of American Pathologists(ASCO/CAP)guidelines in HER2 positivity rates among women with breast cancer in SEER registries[J].Cancer Res,2019,79(4S):Abstract P4-02-15.doi:10.1158/1538-7445.SABCS18-P4-02-15.
[5]Sharma A,Jung MK,Polce SA,et al.Surveillance Epidemiology and End Results (SEER)Reported Survival Outcomes Have a High Accuracy and Positive Predictive Value When Tested Using Randomized Controlled Trials (RCTs)As Gold Standard[J].Int J Radiat Oncol Biol Phys,2019,105(1):E467-468.doi:10.1016/j.ijrobp.2019.06.1435.
[6]Cantile M,Di Bonito M,Cerrone M,et al.Primary breast angiosarcoma in young women from the same geographic region in a short period of time:Only a coincidence or an increased risk?[J].Breast J,2018,24(1):91-93.doi:10.1111/tbj.12848.
[7]马小波,钟艳平,邹亚斌,等.乳腺原发性血管肉瘤2例并文献复习[J].中国实验诊断学,2011,15(8):1401-1403.doi:10.3969/j.issn.1007-4287.2011.08.072.Ma XB,Zhong YP,Zou YB,et al.Primary breast angiosarcoma:a report of 2 cases and literature review[J].Chinese Journal of Laboratory Diagnosis,2011,15(8):1401-1403.doi:10.3969/j.issn.1007-4287.2011.08.072.
[8]Yin M,Wang W,Drabick JJ,et al.Prognosis and treatment of non-metastatic primary and secondary breast angiosarcoma:a comparative study[J].BMC Cancer,2017,17(1):295.doi:10.1186/s12885-017-3292-7.
[9]Hu QC,Mei X,Feng Y,et al.Management experiences of primary angiosarcoma of breast:a retrospective study from single institute in the People's Republic of China[J].Onco Targets Ther,2015,8:3237-3243.doi:10.2147/ott.s92769.
[10]Wang L,Lao IW,Yu L,et al.Primary Breast Angiosarcoma:A Retrospective Study of 36 Cases from a Single Chinese Medical Institute with Clinicopathologic and Radiologic Correlations[J].Breast J,2017,23(3):282-291.doi:10.1111/tbj.12731.
[11]Lokanatha D,Anand A,Lakshmaiah KC,et al.Primary breast angiosarcoma - a single institution experience from a tertiary cancer center in South India[J].Breast Dis,2018,37(3):133-138.doi:10.3233/bd-170291.
[12]胡维维,石慧娟,吕晋,等.乳腺血管肉瘤8例临床病理分析[J].临床与实验病理学杂志,2018,34(9):1045-1047.doi:10.13315/j.cnki.cjcep.2018.09.027.
Hu WW,Shi HJ,Lu J,et al.Clinicopathologic analysis of primary breast angiosarcoma in 8 cases[J].Chinese Journal of Clinical and Experimental Pathology,2018,34(9):1045-1047.doi:10.13315/j.cnki.cjcep.2018.09.027.
[13]McClelland S 3rd,Hatfield J,Degnin C,et al.Extent of resection and role of adjuvant treatment in resected localized breast angiosarcoma[J].Breast Cancer Res Treat,2019,175(2):409-418.doi:10.1007/s10549-019-05172-5.
[14]赵敏,黄江梅,周颖,等.乳腺原发性血管肉瘤和浸润性导管癌形成的碰撞瘤1例[J].临床与实验病理学杂志,2015,31(11):1313-1314.doi:10.13315/j.cnki.cjcep.2015.11.032.
Zhao M,Huang JM,Zhou Y,et al.Collision tumor caused by primary breast angiosarcoma and invasive ductal carcinoma in 1 case[J].Chinese Journal of Clinical and Experimental Pathology,31(11):1313-1314.doi:10.13315/j.cnki.cjcep.2015.11.032.
[15]Kunkiel M,Maczkiewicz M,Jagiello-Gruszfeld A,et al.Primary angiosarcoma of the breast-series of 11 consecutive cases-a singlecentre experience[J].Curr Oncol,2018,25(1):e50-53.doi:10.3747/co.25.3816.
[16]Aljohani B,Al-Twajeri T,Alameer A,et al.Clinicopathological features of breast angiosarcoma:A 16-years single-institution experience[J].Int J Surg Case Rep,2017,37:211-215.doi:10.1016/j.ijscr.2017.06.040.
[17]刘瀛.保乳术与改良根治术治疗早期乳腺癌的临床疗效分析[J].中国普通外科杂志,2014,23(5):709-711.doi:10.7659/j.issn.1005-6947.2014.05.033.
Liu Y.The clinical effects of breast-conserving operation and modified radical mastectomy for early breast cancer[J].Chinese Journal of General Surgery,2014,23(5):709-711.doi:10.7659/j.issn.1005-6947.2014.05.033.
[18]郭峰,侯信明,任立军,等.保乳术与改良根治术对育龄期乳腺癌患者复发及生存情况的影响[J].中国普通外科杂志,2013,22(11):1398-1402.doi:10.7659/j.issn.1005-6947.2013.11.006.
Guo F,Hou XM,Ren LJ,et al.Breast-conserving surgery versus modified radical operation for breast cancer women in child bearing age:analysis of postoperative recurrence and survival[J].Chinese Journal of General Surgery,2013,22(11):1398-1402.doi:10.7659/j.issn.1005-6947.2013.11.006.
[19]张亚男,瞿欢,胡浩霖,等.不同手术方式对绝经前乳腺癌患者生活质量的影响[J].中国普通外科杂志,2016,25(5):761-763.doi:10.3978/j.issn.1005-6947.2016.05.024.
Zhang YN,Qu H,Hu HL,et al.Influence of different types of operations on quality of life of premenopausal breast cancer patients[J].Chinese Journal of General Surgery,2016,25(5):761-763.doi:10.3978/j.issn.1005-6947.2016.05.024.
[20]D'Angelo SP,Munhoz RR,Kuk D,et al.Outcomes of Systemic Therapy for Patients with Metastatic Angiosarcoma[J].Oncology,2015,89(4):205-214.doi:10.1159/000381917.
[21]Singla S,Papavasiliou P,Powers B,et al.Challenges in the treatment of angiosarcoma:a single institution experience[J].Am J Surg,2014,208(2):254-259.doi:10.1016/j.amjsurg.2014.01.007.
[22]Orozco KM,Trujillo LF,Sua LF.P2.15:Treatment Outcome of Metastatic Breast Angiosarcoma to the Lung,in a Reference Hospital in Latin America:A Case Report:Track:Pathology[J].J Thorac Oncol,2016,11(10S):S225.doi:10.1016/j.jtho.2016.08.088.
[23]Florou V,Rosenberg AE,Wieder E,et al.Angiosarcoma patients treated with immune checkpoint inhibitors:A case series of seven patients from a single institution[J].J Immunother Cancer,2019,7(1):213.doi:10.1186/s40425-019-0689-7.
[24]Thorpe CS,Niska JR,Brunnhoelzl DC,et al.First report of proton beam therapy for breast angiosarcoma from the prospective PCG registry[J].Acta Oncol,2018,57(7):992-994.doi:10.1080/0284186x.2017.1423179.
[25]Hatfield J,McClelland S 3rd,Luo J,et al.Management of Localized Breast Angiosarcoma by North American Radiation and Medical Oncologists[J].Clin Breast Cancer,2018,18(6):498-503.doi:10.1016/j.clbc.2018.09.009.
[26]Buehler D,Rice SR,Moody JS,et al.Angiosarcoma outcomes and prognostic factors:a 25-year single institution experience[J].Am J Clin Oncol,2014,37(5):473-479.doi:10.1097/COC.0b013e31827e4e7b.
