目前,新辅助化疗(neoadjuvant chemotherapy,NAC)已成为局部晚期乳腺癌规范化治疗方案之一[1-2]。新辅助化疗过程中如何早期、准确预测疗效并及时更改治疗方案至关重要。MRI扩散加权成像(diffusion weighted imaging,DWI)作为无创的影像学检查,可反映病灶内水分子的布朗运动,提供细胞完整性及病理方面的信息,间接反映病变组织微观结构的改变。通过测量表观扩散系数(apparent diffusion coefficient,ADC)值,还可以反映细胞密度。国外研究[3-4]显示,乳腺癌M R I下不同的形态特征和ADC值可以预测侵袭性。本文回顾性分析了80例接受新辅助化疗的局部晚期乳腺癌患者的临床资料,重点探讨肿瘤组织ADC值的变化(ΔADC)与病理反应分级(Miller&Payne分级,M P分级)的相关性,并通过R O C观察ADC值判断新辅助疗效的敏感度和特异度,确定预测新辅助化疗后肿瘤组织病理反应的最佳ΔADC值。
1 资料与方法
1.1 一般资料
收集2017年1月—2018年12月我中心诊治的80例局部晚期乳腺癌患者资料。所有患者均为女性;临床分期cT2或cT3,cN1或cN2;年龄26~69岁,平均49.68岁。化疗前空芯针穿刺活检证实为浸润性乳腺癌;腋下淋巴结穿刺证实转移。化疗4~8个周期,化疗方案主要以紫衫、蒽环类药物为基础,包括AC/EC-D方案、TA/TE案、单周紫杉醇(weekly paclitaxel,wP)方案(表1)。HER-2阳性型乳腺癌同时给予抗HER-2靶向治疗(不与蒽环类药物联合使用)。所有患者在新辅助化疗第1周期前、手术前常规行乳腺MRI检查。化疗结束后行改良根治术或保乳手术,术后标本由我院病理科评定肿瘤组织的病理反应分级(Miller&Payne分级,MP分级)。
1.2 仪器
MRI检查采用德国Siemens Magnetom Avanto 1.5 T磁共振扫描仪,专用双穴乳腺表面线圈,美国Madrad SS300 MRI专用高压注射器。
1.3 测量方法
患者检查时采用俯卧位,双乳自然下垂并固定于线圈内。DWI使用单次激发平面回波成像(SE-echo-planar imaging,SE-EPI)技术。扫描参数如下:b=800 s/mm2:TR/TE:6500/84.6 ms。视野(FOV)340×340,层厚5 mm,扫描时间30 s。在DWI图像下确定肿物位置,取病变最大层面,避开囊性坏死及血管,描画圆形感兴趣区(ROI),选取多个病灶区域ADC值并取平均值计入统计。
表1 80例乳腺癌患者的基本资料
Table1 The general data of the 80 breast cancer patients

资料 n(%)年龄(岁)≤ 4529(36.2)> 4551(63.8)临床分期IIB 期 58(72.5)IIIA 期 22(27.5)新辅助化疗方案AC/EC-D 55(68.8)wP 6(7.5)TA/TE 14(17.5)AC/EC 5(6.2)分子分型luminal A 型 21(26.2)luminal B 型 35(43.8)HER-2阳性型 14(17.5)三阴型 10(12.5)
1.4 病理评价
MP分级系统:是将患者手术后病理组织切片和化疗前进行比较,根据镜下肿瘤细胞的消退状态,分为5级:l级,细胞总数无变化;2级,肿瘤细胞数量轻微减少,减少比例≤30%;3级,肿瘤细胞数量减少比例介于30%~90%;4级,肿瘤细胞数减少>90%;5级,肿瘤细胞全部消失,镜下无浸润癌组织,仅见血管细微间质残留(导管原位癌亦归属此类)。定义1、2、3级为组织学非显著反应(non major histo1ogical response,NMHR),4、5级为组织学显著反应(major histological response,MHR)。因本研究未分析ADC值对腋窝淋巴结病理反应的评估,故病理完全缓解(pathological complete response,pCR)定义为原发肿瘤无残留浸润性癌细胞。
1.5 统计学处理
所有数据采用SPSS 21.0统计软件进行分析。化疗前、后ADC值和MHR和NMHR组ΔADC值的差异采用t检验进行分析,P<0.05为差异有统计学意义。根据术后病理MHR,绘制ROC曲线分析评价化疗疗效的最佳ΔADC值。
2 结 果
2.1 术后病理结果和化疗前后ADC值
80例患者中(结合术前穿刺病理)浸润性导管癌77例,黏液腺癌1例,浸润性微乳头状癌2例。所有患者化疗前ADC平均值为0.985×10-3 mm2/s,手术前末次检查的ADC平均值为1.271×10-3 mm2/s。化疗后病灶ADC明显升高,差异具有统计学意义(P=0.000)。依据肿瘤组织免疫组化ER、PR、HER-2、Ki-67 的表达情况,分为luminal A型、luminal B型、三阴型和HER-2阳性型。其中luminal A 型21例,luminal B型 35例,HER-2阳性型14例,三阴型10例。三阴型乳腺癌ADC值化疗前后未见统计学差异(P>0.05),其他3种亚型乳腺癌ADC值均较化疗前升高,具有统计学差异(均P<0.05)(表2)。
表2 不同类型乳腺癌化疗前后ADC值差异
Table2 The differences in ADC values in patients with different types of breast cancer before and after chemotherapy

病理特征 n ADC值(10-3 mm2/s)t P化疗前 化疗后分子分型luminal A型 211.0191.219 -2.8480.007 luminal B型 350.9581.282 -5.0580.000 HER-2阳性型 140.9141.377 -3.0920.005三阴型 101.1071.195 -0.8040.432 HER-2表达过表达 240.9481.367 -4.5190.000非过表达 561.0001.230 -4.6350.000
2.2 ΔADC与病理反应的关系
根据患者术后病理反应将80例患者分为MHR组与NMHR组,其中,乳房原发病灶病pCR 12例,MHR组(4~5级)26例;NMHR组(1~3级)54例。MHR组化疗前后ΔADC值变化较NMHR组更为明显,分别是0.448×10-3 mm2/s、0.209×10-3 mm2/s,差异有统计学意义(P=0.004)(表3)。
表3 ΔADC与不同病理反应的关系
Table3 Relationship between ΔADC and different histological responses
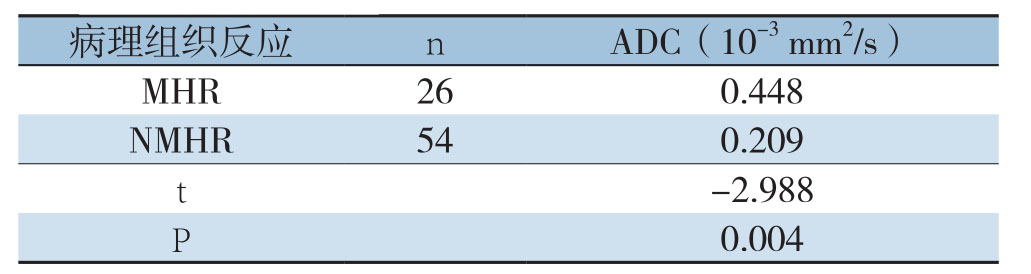
病理组织反应 n ADC(10-3 mm2/s)MHR 260.448 NMHR 540.209 t-2.988 P 0.004
2.3 ROC曲线结果
以ΔADC值作为评估参数,肿瘤组织病理反应分类为“金标准”作ROC曲线,曲线下面积AUC=0.717,Youden指数最大值为0.397,评价疗效的敏感度73.1%,特异度66.7%。ΔADC评价肿瘤组织化疗后显著反应的截断值为0.239×10-3 mm2/s,阳性预测值51.4%,阴性预测值83.7%,准确度68.8%(图1)。
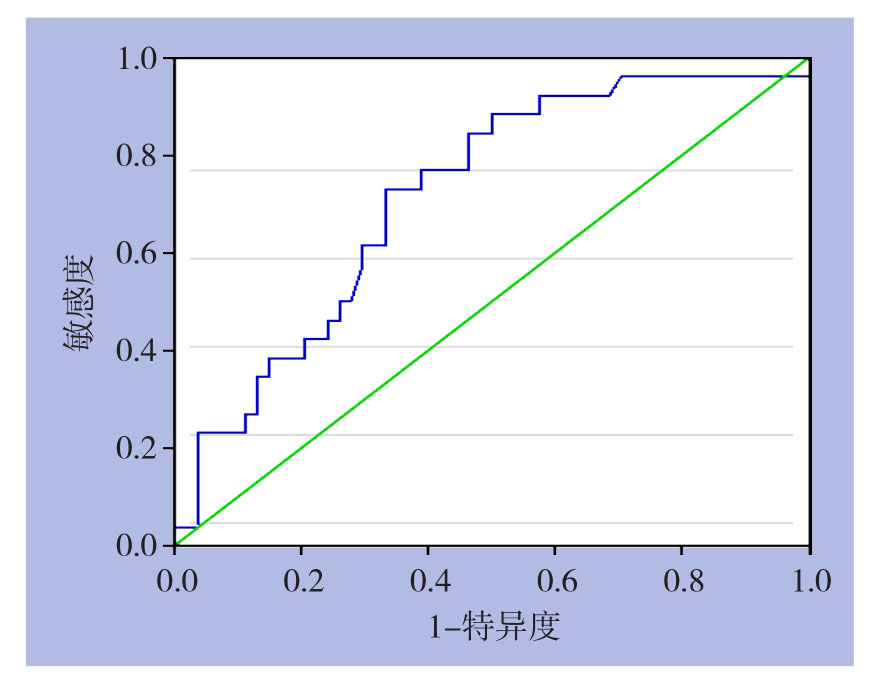
图1 ΔADC为参数判断病理反应的ROC曲线
Figure1 ROC curve of ΔADC in estimating pathological response
3 讨 论
乳腺癌新辅助化疗后疗效评估最佳方式尚不明确。临床上常采用肿瘤实体瘤疗效评定标准(response evaluation criteria in solid tumors,RECIST)[5]进行疗效评估。评估手段一般采用临床触诊、乳腺超声、MRI等方法测量肿瘤最大径的变化。但是,不同的乳腺癌分子亚型肿瘤退缩模式不同,三阴型和HER-2阳性型乳腺癌多呈现单中心退缩,而激素受体阳性型乳腺癌呈现多中心退缩模式[6]。退缩模式的不同常导致不同影像学检查评估获取的结果存在较大的差异。DWI作为无创的影像学检查,可以预测乳腺癌的免疫组织化学受体状态、脉管侵犯、增殖率[7-8],同时对化疗后残留肿瘤的大小和病理反应具有高敏感性[9-10]。
乳腺癌MRI检查通过检测人体组织中水分子扩散运动,提供病变组织的微观结构及成分信息协助判断疾病,因其无创、高敏感度已常规应用于临床。报道[11-12]显示ADC值在乳腺恶性肿瘤、良性病变和正常组织中依次升高。恶性肿瘤组织中细胞密度较高,细胞内水分子的布朗运动受限,导致ADC值减低。化疗后肿瘤细胞的死亡引起细胞密度降低,水分子扩散受限降低,ADC值反而升高。因此,ADC值可以在肿瘤体积与直径的改变之前,早期预测化疗疗效,对治疗决策的指导提供重要信息。罗宁斌等[13]通过分析54例乳腺癌新辅助化疗后ADC值与Ki-67表达水平的相关性,发现新辅助化疗后ADC值较化疗前明显增高(P=0.000),Ki-67表达较化疗前降低(P=0.007),认为ADC值的变化可以反映肿瘤细胞增殖活性的变化趋势。Sharma等[14]对14例乳腺癌新辅助化疗的患者进行了前瞻性研究,发现时间信号曲线下的初始面积和ADC值是化疗后可靠区分应答和非应答的唯一参数,ADC可以预测病理反应。Pereira等[15]纳入的62例接受新辅助化疗患者的单中心前瞻性研究发现化疗后第1个周期ADC值的增加与pCR密切相关,这种变化出现在肿瘤变小之前,因此可以用作治疗反应的早期预测指标。本研究发现80例乳腺癌患者化疗前ADC平均值为0.985×10-3 mm2/s,手术前末次检查ADC平均值为1.271×10-3 mm2/s。化疗后肿瘤组织的ADC值明显升高,差异具有统计学意义(P=0.000)。与前述报道一致。在四种不同的分子分型中,化疗前ADC值在四组间未见显著差异(F=1.515,P=0.217)。根据HER-2表达情况,进一步分析了HER-2过表达及非过表达组,ADC值在两组间未见显著差异(P=0.379)。与其它研究[16-17]报道的HER-2过表达型乳腺癌的ADC值相对较高不一致。
由于乳腺癌新辅助化疗后的病理组织反应一般在术后获取,缺乏对新辅助化疗的指导意义,化疗后再次穿刺活检明确Ki-67表达情况虽然可以反映肿瘤组织的增殖状态,但作为一种有创的检查方法,对患者有一定的伤害性。国外报道[18-20]显示多参数DWI检查可以预测乳腺癌病理和预后。本研究试图通过分析ADC值的变化与术后乳腺癌组织病理反应间的关系,明确ADC值是否可以作为早期预测疗效的指标。一项纳入13项研究共672例研究对象的Meta分析显示ADC值的变化率可以反映早期乳腺癌新辅助化疗疗效[21]。Partridge等[22]对272例接受紫杉醇和蒽环新辅助化疗乳腺癌患者进行了前瞻性研究,发现ADC值随着化疗周期的增多总体呈升高趋势,并且ADC值在治疗中期可预测pCR(AUC=0.60,95% CI=0.52,0.68,P=0.017)。本研究显示MHR组化疗前、后ADC的平均变化值为0.448×10-3mm2/s,NMHR组的平均变化值为0.209×10-3 mm2/s,MHR组和NMHR组ΔADC值具有统计学差异(P=0.004),提示ADC值可以预测肿瘤反应。Park等[23]研究显示区分化疗响应(肿瘤直径缩小至少30%)和非响应者的最佳ADC cutoff值为1.17×10-3 mm2/s,灵敏度为94%(95% CI=81%~99%)、特异度为71%(95% CI=44%~90%)。本研究以ΔADC值评价肿瘤组织病理反应,ROC曲线下面积AUC=0.717,Youden指数最大值为0.397,评价疗效的敏感度73.1%,特异度 66.7%。A D C评价肿瘤组织显著反应的c u t o f f值为0.239×10-3 mm2/s,阳性预测值51.4%,阴性预测值83.7%,准确度 68.8%。本研究以ΔADC值评价原发肿瘤组织病理反应未能获得更高的敏感性,考虑与入组患者腋窝淋巴结均证实转移、病期相对偏晚、同时未设立腋窝淋巴结阴性对照组有关。
本研究存在一些不足之处,不同分子亚型乳腺原发病灶和腋窝淋巴结病理反应存在不一致,本研究仅对原发病灶的ADC值进行统计分析。目前研究[24]认为,在图像质量和信噪比满足诊断前提下,尽量选择高b值,保证ADC的稳定性。Xing等[4]发现b值选择800 s/mm2,转移灶和非转移病灶ADC值差异性更大。曲宁等[25]研究发现b值选择800s/mm2时,乳腺癌平均ADC值低于良性病变ADC值。因此,本研究中b值选择了800 s/mm2。但目前以MRI评估乳腺癌新辅助化疗疗效的标准尚不统一,选取不同的b值及不同参数条件,可能导致ADC值测量上存在差异。
本研究结果显示,ADC值可以预测乳腺癌新辅助化疗后病理反应,为临床疗效监测提供了新的指标。
[1]Gradishar WJ,Anderson BO,Balassanian R,et al.Breast Cancer,Version 4.2017,NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr Canc Netw,2018,16(3):310-320.doi:10.6004/jnccn.2018.0012.
[2]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2017年版)[J].中国癌症杂志,2017,27(9):695-759.doi:10.19401/j.cnki.1007-3639.2017.09.004.
Committee of Breast Cancer of Chinese Anti-Cancer Association.Guidelines for diagnosis and treatmentof breast cancer of Chinese Anti-Cancer Association (2017edition)[J].China Oncology,2017,27(9):695-759.doi:10.19401/j.cnki.1007-3639.2017.09.004.
[3]Boria F,Tagliati C,Baldassarre S,et al.Morphological MR features and quantitative ADC evaluation in invasive breast cancer:Correlation with prognostic factors [J].Clinical Imaging,2018,50:141-146.doi:10.1016/j.clinimag.2018.02.011.
[4]Xing H,Song CL,Li WJ.Meta-analysis of lymph node metastasis of breast cancer patients:Clinical value of DWI and ADC value[J].Eur J Radiol,2016,85(6):1132-1137.doi:10.1016/j.ejrad.2016.03.019.
[5]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:Revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.doi:10.1016/j.ejca.2008.10.026.
[6]姚凡,金锋.《中国临床肿瘤学会乳腺癌诊疗指南2018.V1》外科问题解读[J].中国实用外科杂志,2018,38(11):1281-1284.doi:10.19538/j.cjps.issn1005-2208.2018.11.14.
Yao F,Jin F.Surgical management of breast cancer in guidelines of Chinese Society of Clinical Oncology[J].Chinese Journal of Practical Surgery,2018,38(11):1281-1284.doi:10.19538/j.cjps.issn1005-2208.2018.11.14.
[7]Horvat JV,Bernard-Davila B,Helbich TH,et al.Diffusionweighted imaging (DWI)with apparent diffusion coefficient(ADC)mapping as a quantitative imaging biomarker for prediction of immunohistochemical receptor status,proliferation rate,and molecular subtypes of breast cancer[J].J Magn Reson Imaging,2019,50(3):836-846.doi:10.1002/jmri.26697.
[8]Igarashi T,Furube H,Ashida H,et al.Breast MRI for prediction of lymphovascular invasion in breast cancer patients with clinically negative axillary lymph nodes[J].Eur J Radiol,2018,10(7):111-118.doi:10.1016/j.ejrad.2018.08.024.
[9]Rauch GM,Adrada BE,Kuerer HM,et al.Multimodality Imaging for Evaluating Response to Neoadjuvant Chemotherapy in Breast Cancer[J].AJR Am J Roentgenol,2017,208(2):290-299.doi:10.2214/AJR.16.17223.
[10]Chu W,Jin W,Liu D,et al.Diffusion-weighted imaging in identifying breast cancer pathological response to neoadjuvant chemotherapy:A meta-analysis[J].Oncotarget,2018,9(6):7088-7100.doi:10.18632/oncotarget.23195.
[11]Surov A,Meyer HJ,Wienke A.Correlation between apparent diffusion coefficient (ADC)and cellularity is different in several tumors:a meta-analysis[J].Oncotarget,2017,8(35):59492-594929.doi:10.18632/oncotarget.17752.
[12]Ramírez-Galván YA,Cardona-Huerta S,Ibarra-Fombona E,et al.Apparent diffusion coefficient (ADC)value to evaluate BI-RADS 4 breast lesions:Correlation with pathological findings[J].Clin Imaging,2015,39(1):51-55.doi:10.1016/j.clinimag.2014.09.015.
[13]罗宁斌,苏丹柯,黄向阳,等.乳腺癌新辅助化疗前后MR扩散加权成像ADC值与Ki-67表达水平的相关性研究[J].临床放射学杂志,2018,37(6):922-925.
Luo NB,Su DK,Huang XY,et al.Correlation of ADC Value of the Breast Cancer with Ki-67 Expression During Neoadjuvant Chemotherapy[J].Journal of Clinical Radiology,2018,37(6):922-925.
[14]Sharma A,Sharma S,Sood S,et al.DCE-MRI and parametric imaging in monitoring response to neoadjuvant chemotherapy in breast carcinoma:a preliminary report[J].Pol J Radiol,2018,83:e220-228.doi:10.5114/pjr.2018.76271.
[15]Pereira NP,Curi C,Osório CABT,et al.Diffusion-Weighted Magnetic Resonance Imaging of Patients with Breast Cancer Following Neoadjuvant Chemotherapy Provides Early Prediction of Pathological Response -A Prospective Study[J].Sci Rep,2019,9(1):16372.doi:10.1038/s41598-019-52785-3.
[16]Kim EJ,Kim SH,Park GE,et al.Histogram analysis of apparent diffusion coefficient at 3.0t:Correlation with prognostic factors and subtypes of invasive ductal carcinoma[J].J Magn Reson Imaging,2015,42(6):1666-1678.doi:10.1002/jmri.24934.
[17]Park SH,Choi HY,Hahn SY.Correlations between apparent diffusion coefficient values of invasive ductal carcinoma and pathologic factors on diffusion-weighted MRI at3.0 Tesla[J].J Magn Reson Imaging,2015,41(1):175-182.doi:10.1002/jmri.24519.
[18]Suo S,Cheng F,Cao M,et al.Multiparametric diffusion-weighted imaging in breast lesions:Association with pathologic diagnosis and prognostic factors[J].J Magn Reson Imaging,2017,46(3):740-750.doi:10.1002/jmri.25612.
[19]Baxter GC,Graves MJ,Gilbert FJ,et al.A Meta-analysis of the Diagnostic Performance of Diffusion MRI for Breast Lesion Characterization[J].Radiology,2019,291(3):632-641.doi:10.1148/radiol.2019182510.
[20]Durando M,Gennaro L,Cho GY,et al.Quantitative apparent diffusion coefficient measurement obtained by 3.0Tesla MRI as a potential noninvasive marker of tumor aggressiveness in breast cancer[J].Eur J Radiol,2016,85(9):1651-1658.doi:10.1016/j.ejrad.2016.06.019.
[21]杨培培,余玉盛,何柳,等.DWI-ADC值评估乳腺癌新辅助化疗疗效价值的Meta分析[J].临床放射学杂志,2017,36(11):1600-1605.
Yang PP,Yu YS,He L,et al.A meta-analysis of DWI-ADC Value for the Evaluation of Neoadjuvant Chemotherapy in Breast Cancer[J].Journal of Clinical Radiology,2017,36(11):1600-1605.
[22]Partridge SC,Zhang Z,Newitt DC,et al.Diffusion-weighted MRI Findings Predict Pathologic Response in Neoadjuvant Treatment of Breast Cancer:The ACRIN 6698 Multicenter Trial[J].Radiology,2018,289(3):618-627.doi:10.1148/radiol.2018180273.
[23]Park SH,Moon WK,Cho N,et al.Diffusion-weighted MR imaging:pretreatment prediction of response to neoadjuvant chemotherapy in patients with breast cancer[J].Radiology,2010,257(1):56-63.doi:10.1148/radiol.10092021.
[24]张丹丹,庄治国,耿小川,等.肿瘤直径联合ADC值对不同亚型乳腺癌NAC疗效的评估价值[J].实用放射学杂志,2018,34(3):366-369.doi:10.3969/j.issn.1002-1671.2018.03.010.
Zhang DD,Zhuang ZG,Geng XC,et al.The evaluation of the tumor diameter combined ADC values for the therapeutic efficacy of neoadj uvant chemotherapy in each subtype of breast cancer[J].Journal of Practical Radiology,2018,34(3):366-369.doi:10.3969/j.issn.1002-1671.2018.03.010.
[25]曲宁,罗娅红,赵英杰,等.扩散敏感因子800时乳腺良恶性病变ADC界值的确定[J].放射学实践,2010,25(5):515-518.doi:10.3969/j.issn.1000-0313.2010.05.013.
Qu N,Luo YH,Zhao YJ,et al.Value of diffusion weighted MR imaging in the differential diagnosis of benign and malignant breast lesions:affirmation of ADC cut-off value as b value equals to 800s/mm2[J].Radiologic Practice,2010,25(5):515-518.doi:10.3969/j.issn.1000-0313.2010.05.013.
