深静脉血栓形成(deep vein thrombosis,DVT)是指血液在深静脉不正常的凝结,在我国的发病率已由逐渐上升的趋势[1-2]。DVT在急性阶段如不及时诊断和处理,一些患者可因血栓脱落造成肺梗死[3-4]。急性髂股静脉血栓形成未能及时处理者,及易造成血栓后综合征(post thrombosis syndrome,PTS)的发生。国内外专家共识以及指南中均指出使用经导管溶栓(catheter-directed thrombosis,CDT)联合抗凝治疗已经成为首选治疗方法[5-7]。注射用重组人尿激酶原(rhPro-UK),为新一代溶栓药物,已广泛应用于急性心肌梗死的治疗[8]。本文通过回顾性分析,比较CDT中rhPro-UK与尿激酶(UK)这两种药物对10 d以内的DVT患者的临床疗效,初步探讨rhPro-UK治疗急性DVT有效性和安全性。
1 资料与方法
1.1 一般资料
收集于2016年10月—2018年12月就诊我科的急性DVT患者66例,其中使用rhPro-UK溶栓治疗33例(观察组),使用UK溶栓治疗33例(对照组)。所有患者均符合急性DVT临床诊断标准,均经超声检查证实为髂股段静脉血栓。均为首次发病,病程10 d以内,本次治疗前未作溶栓、抗凝及血液稀释等治疗。纳入标准:⑴年龄18~75岁;⑵单侧肢体发病急性,发病时间≤10 d;⑶彩色多普勒超声确诊的腘静脉以上的单侧肢体深静脉血栓形成;⑷住院期间配合完成标准的置管溶栓疗程,随访次数≥1次,随访时间≥6个月。排除标准:⑴年龄<18岁或年龄>75岁;⑵慢性下肢深静脉血栓形成患者,起病时间>10 d;⑶双侧肢体均有深静脉血栓形成;⑷发病后给予全身抗凝溶栓治疗,效果不佳后改用置管溶栓治疗者;⑸合并其他系统严重的疾病不能耐受或配合治疗者(恶性高血压、3个月内出现心脑血管意外、3周内出现过消化道等其他系统大出血、1周内做过创伤较大的手术、精神系统疾病、重度虚弱、严重营养不良等);⑹因非医源性因素终止置管溶栓治疗或不配合者。
1.2 治疗方法
患者或其家属同意溶栓治疗并签字。两组均行CDT前经健侧穿刺股静脉释放临时下腔静脉滤器(inferior vena cava filter,IVCF)[9]。血栓累及髂、股静脉者选择经患侧腘静脉超声引导下穿刺插管,累及股静脉、腘静脉者经患侧小隐静脉切开穿刺插管。依据血栓范围,选择合适侧孔长度段溶栓导管,将溶栓导管的侧孔段埋入血栓远心端内,导管末端连接微量泵。溶栓均采用静脉输液泵低剂量持续溶栓模式[10]。观察组经持续泵入普佑克(上海天士力药业有限公司,5 mg/支,国药准字S20110003),采用生理盐水溶解,总量配置50 mL,在2 h内静脉泵泵入;24 h后继续普佑克20 mg+生理盐水50 mL(泵2 h),第3天复用普佑克10 mg+生理盐水50 mL(泵2 h)。对照组经溶栓导管持续泵入UK(丽珠集团丽珠制药厂,25万IU/瓶,国药准字H44020671),首剂给予4 000 U/kg,根据体质量每日总用量50~80万U,持续溶栓3 d。溶栓期间使用低分子肝素钠注射液(赛诺菲公司)皮下注射100 IU/(kg·12 h)。
溶栓期间每日监测血常规、凝血常规以及血栓弹力图等指标,纤维蛋白原低于1 g/L示暂停溶栓;每隔24 h复查下肢静脉造影,评估溶栓效果及调整溶栓导管有效段持续深埋于血栓中。当出现以下状况时停止溶栓:⑴患者肿胀消失或消退明显,造影证实血栓消失;⑵连续两次造影复查血栓溶解范围无变化;⑶纤维蛋白原低于1 g/L时暂停溶栓;⑷溶栓过程中出现并发症,如为小的出血暂停或者减慢给药速率,24 h视病情严重程度选择停止或继续溶栓治疗,大出血则是停止溶栓。造影复查显示髂静脉血栓溶解后残留率>70%时,行球囊(Mustang 8~12 mm,美国Boston Scientific)扩张。
1.3 溶栓效果的评估
主要指标:溶栓结束后对溶栓前后患肢深静脉通畅度评分,分别对下腔静脉、髂总静脉、髂外静脉、股总静脉、股浅静脉近端、股浅静脉远端、腘静脉这7条静脉进行评分(完全通畅为0分、部分通畅为1分、完全闭塞为3分)[11],并计算出溶解百分率。溶解百分率=(溶栓前得分-溶栓后得分)/溶栓前得分×100%,溶栓效果分级:1级溶解<50%,2级溶解50%~99%;3级溶解100%。结合深静脉通畅度评分、临床症状、患者体征以及造影图像进行临床疗效评估[12-13]。优:患肢肿胀、疼痛完全消失,患侧与健侧比较,周径差≤1.0 cm;造影示血流全部或基本恢复,对比剂未见滞留。良:患肢肿胀、疼痛完全消失,患侧与健侧比较,周径差>1.0~1.5 cm;造影示血流大部分恢复,对比剂无明显滞留,有少量侧支血管。中:患肢肿胀、疼痛有较明显改善,患侧与健侧比较,周径差>1.5~2.0 cm;造影示血流部分恢复,对比剂有轻度滞留,有较多侧支血管。差:患肢肿胀、疼痛无明显改善,患侧与健侧比较,周径差>2.0 cm;造影显示对比剂有明显滞留,有大量侧支血管代偿。临床疗效有效率=(优+良+中)例数/患者总例数×100%
1.4 安全性评价
并发症分为技术相关性并发症和溶栓并发症,前者包括严重的血管损伤、症状性肺栓塞、后者包括外出血和血肿。若静脉造影显示对比剂在血管壁滞留或外溢至血管外则视为严重的血管损伤。严重的出血性并发症包括颅内出血、需外科干预或输血治疗的出血、导致溶栓治疗中止或死亡的出血等。其他的并发症包括轻微出血或小血肿、发热、疼痛、恶心及呕吐等。
1.5 统计学处理
采用SPSS 23.0统计软件对数据进行分析处理,计量资料以均数±标准差(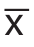 ±s)表示,组间比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
±s)表示,组间比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
两组患者的年龄、性别构成以及血栓发生部位的差异均无统计学意义(均P>0.05),具可比性(表1)。
表1 两组患者一般临床资料(n=33)
Table 1 The general clinical data of the two groups of patients(n=33)

资料 观察组 对照组 t/χ2 P年龄(岁,x±s) 44.3+11.2 42.6+13.4 0.559 0.578性别[n(%)]男10(30.3) 12(36.4) 0.273 0.602女23(69.7) 21(63.6)血栓部位[n(%)]左下肢 24(72.7) 22(66.7) 0.287 0.592右下肢 9(27.3) 11(33.3)
2.2 两组患者溶栓效果比较
观察组血栓溶解率(≥50%)为81.8%,对照组为60.6%,差异有统计学意义(χ2=4.889,P<0.05)(表2)。观察组达到3级血栓溶解率例数第1天为2例、第2天8例、第3天1例。两组出院时临床疗效比较,差异无统计学意义(χ2=0.363,P>0.05)(表3)。
表2 两组患者溶栓3 d时血栓溶解率的比较(n=33)
Table 2 Comparison of the thrombolytic rates between the two groups of patients at 3 d after thrombolysis(n=33)

组别 1级[n(%)]2、3级溶解率(%)观察组 5(15.2) 17(51.5) 11(33.3) 81.8对照组 13(39.4) 16(48.5) 4(12.1) 60.6 χ2 4.889 P 0.027 2级[n(%)]3级[n(%)]
表3 两组患者治疗后临床疗效比较(n=33)
Table 3 Comparison of the eff ective rates between the two groups of patients after treatment(n=33)
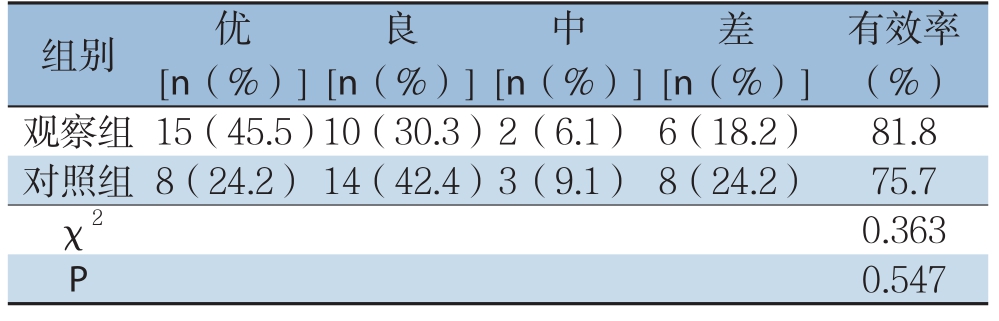
组别 优[n(%)]有效率(%)观察组 15(45.5)10(30.3)2(6.1) 6(18.2) 81.8对照组 8(24.2) 14(42.4)3(9.1) 8(24.2) 75.7 χ2 0.363 P 0.547良中差[n(%)][n(%)][n(%)]
2.3 两组患者不良反应比较
两组均无出现严重的血管损伤、症状性肺栓塞及严重出血并发症,观察组1例患者在第3天溶栓后出现牙龈出血,复查凝血常规,血小板减少,停止溶栓后出血停止。对照组两例患者分别在溶栓第3天及第2天出现鼻腔出血及牙龈出血,复查凝血指标,虽然纤维蛋白原指标>2 g/L,但考虑患者年纪较大,停止溶栓。两组未出现过敏反应。
3 讨论
髂股段DVT在DVT中占据一半以上,因其静脉管径较大,残留的血栓可导致回流障碍、血液倒流和瓣膜损坏等病变,造成长期的静脉高压,最后引起PTS[14]。因此对于急性期髂股DVT的治疗,使用CDT治疗急性DVT,能减少及防止发生PTS,该方法可使高浓度的溶栓药物经溶栓导管直接灌注进入血栓,增加药物与血栓的接触面积,大大提高局部药物浓度,缩短溶栓时间,提高溶栓效率。目前,CDT已成为治疗急性DVT的重要手段[1,15-17]。
目前所使用的溶栓药物中,UK最为普遍,直接作用于内源性纤维蛋白溶解系统,能催化裂解纤溶酶原转化为纤溶酶,从而发挥溶栓作用,但其特异性差,无靶向性,对血液循环中以及与血凝块结合的纤维蛋白(原)均起作用,可引起广泛的纤维蛋白原消耗,易出现出血并发症[18-19];rhPro-UK是一种纤溶酶原激活物,能直接激活血栓表面的纤溶酶原转化为纤溶酶。应用时对血管内源性纤溶酶原影响很小,而在血栓表面被纤溶酶激活,部分变成双链的UK,后者激活结合在血栓表面构型有所改变的纤溶酶原变成纤溶酶,使血栓纤维蛋白部分溶解,血栓溶解[20-21]。rhPro-UK在急性心肌梗死的治疗中的到了广泛的应用并取得了较好的效果,但是对于下肢静脉血栓的报道较少。在本次研究中,可以看到达到血栓溶解率(≥50%)方面,观察组与对照组相比,具有明显的显著性差异(χ2=4.889,P<0.05),这说明rhPro-UK对于急性髂股段血栓溶解优于UK。使用rhPro-UK所达到的血栓3级溶解的11例中,第1天有2例,第2天有8例,第3天有1例,可以看到观察组达到较好的血栓溶解效果在第2天,但第3天与前2天对比,则血栓溶解程度较小,可以说明观察组在前2天就可以达到治疗效果。综上考虑,rhPro-UK的有效溶栓时间在下肢静脉血栓中可定为4 h。而在溶栓剂量的选择上,额尔德木图等[22]采用10 mg rhPro-UK维持1 h进行下肢静脉血栓溶栓是安全的,张琴琴等[23]在肺栓塞中使用,溶栓剂量为20 mg,在2 h匀速泵完,均未发生严重的并发症。在心肌梗死中使用rhPro-UK 20 mg溶栓是有效的安全的[24-25]。综合考虑,本文中使用rhPro-UK剂量为20 mg维持2 h泵入,结果也证明,此溶栓剂量是有效安全的。本研究中,两组临床疗效率无统计学差异(χ2=0.363,P>0.05),考虑临床症状改善处于血栓溶解率呈正相关外,可能还与侧支循环开放及形成的血栓新旧等因素有关。Mewissen等[26]研究显示,2级和3级血栓溶解率在提高血管通畅性及降低血栓复发率均明显优于1级,故血栓溶解度与远期生活质量改善相关。本研究中观察组血栓溶解率(≥50%)百分比明显优于对照组。预测rhPro-UK治疗的患者较UK治疗的患者可能有较低PTS发生率及较好的预后,但远期疗效还需要进一步随访。
溶栓治疗中最常见的不良反应为出血,其发生率达20%,出血可发生在穿刺点局部、后腹膜、骨骼肌、胃肠道、泌尿系统等。本研究中两组均无严重出血并发症,两组均为出血轻微,以穿刺点、牙龈及鼻腔出血为主,观察组并发症例数较尿激酶组少。经对症处理后恢复,无严重内脏、颅内出血等并发症发生。
综上所述,本研究初步证明在急性期髂股段DVT的CDT溶栓治疗中,rhPro-UK血栓溶解率(≥50%)方面明显优于UK,提高了3级血栓溶解率。由于本次研究中使用剂量、溶栓时间以及样本量较小,可能有偏差,更权威决定性的结论,需要多中心,大样本的研究进一步证实。
[1]宋富波,张居文,杨牟,等.经腘静脉入路导管接触性溶栓治疗下肢深静脉血栓临床观察[J].中国医刊,2016,51(11):88-90.doi:10.3969/j.issn.1008-1070.2016.11.027.Song FB,Zhang JW,Yang M,et al.Clinical observation of catheterdirected thrombolysis for lower extremity deep venous thrombosis via popliteal vein approach[J].Chinese Journal of Medicine,2016,51(11):88-90.doi:10.3969/j.issn.1008-1070.2016.11.027.
[2]谌勇,韩智猛,向乾生,等.不同溶栓途径治疗下肢深静脉血栓形成的比较[J].中国普通外科杂志,2003,12(6):449-451.doi:10.3969/j.issn.1005-6947.2003.06.015.Shen Y,Han ZM,Xiang QS,et al.Therapeutic efficacy of various thrombolytic ways for deep venous thrombosis of lower extremity[J].Chinese Journal of General Surgery,2003,12(6):449-451.doi:10.3969/j.issn.1005-6947.2003.06.015.
[3]Burgazli KM,Atmaca N,Mericliler M,et al.Deep vein thrombosis and novel oral anticoagulants:a clinical review[J].Eur Rev Med Pharmacol Sci,2013,17(23):3123-3131.
[4]任贤英.深静脉给药治疗下肢深静脉血栓形成[J].中国普通外科杂志,2007,16(12):1217-1218.doi:10.3969/j.issn.1005-6947.2007.12.028.Ren XY.Deep venous thrombosis of lower extremities treated by drug administration into the deep veins[J].Chinese Journal of General Surgery,2007,16(12):1217-1218.doi:10.3969/j.issn.1005-6947.2007.12.028.
[5]Vedantham S,Piazza G,Sista AK,et al.Guidance for the use of thrombolytic therapy for the treatment of venous thromboembolism[J].J Thromb Thrombolysis,2016,41(1):68-80.doi:10.1007/s11239-015-1318-z.
[6]Watson L,Broderick C,Armon MP.Thrombolysis for acute deep vein thrombosis[J].Cochrane Database Syst Rev,2016,11:CD002783.doi:10.1002/14651858.CD002783.
[7]Behravesh S,Hoang P,Nanda A,et a1.Pathogenesis of thromboembolism and endovascular management[J].Thrombosis,2017,2017:3039713.doi:10.1155/2017/3039713.
[8]高仁芬.重组人尿激酶原治疗急性心肌梗死的疗效观察[J].吉林医学,2010,31(18):2818.doi:10.3969/j.issn.1004-0412.2010.18.036.Gao RF.Efficacy observation of recombinant human prourokinase in treatment of acute myocardial infarction[J].Jilin Medical Journal,2010,31(18):2818.doi:10.3969/j.issn.1004-0412.2010.18.036.
[9]中华医学会放射学分会介入学组.下腔静脉滤器置入术和取出术规范的专家共识[J].中华放射学杂志,2011,45(3):297-300.doi:10.3760/cma.j.issn.1005-1201.2011.03.015.Chinese Medical Association Chinese Society of Radiology(CSR)Interventional Group.Agreement on the guidelines ofinferior vena cava filter implantation and removal[J].Chinese Journal of Radiology,2011,45(3):297-300.doi:10.3760/cma.j.issn.1005-1201.2011.03.015.
[10]陈国平,顾建平,何旭,等.低剂量尿激酶较长时间经导管直接溶栓术治疗急性髂-股静脉血栓形成的安全性和临床疗效[J].中华放射学杂志,2012,46(12):1119-1125.doi:10.3760/cma.j.issn.1005-1201.2012.12.015.Chen GP,Gu JP,He X,et al.The safety and clinical efficacy of catheter-directed thrombolysis with prolonged infusion of low dose urokinase for treatment of acute iliac-femoral venous thrombosis[J].Chinese Journal of Radiology,2012,46(12):1119-1125.doi:10.3760/cma.j.issn.1005-1201.2012.12.015.
[11]Porter JM,Moneta GL.Reporting standards in venous disease:an update.International Consensus Committee on Chronic Venous Disease[J].J Vasc Surg,1995,21(4):635-645.doi:10.1016/s0741-5214(95)70195-8.
[12]中华医学会放射学分会介入学组.下肢深静脉血栓形成介入治疗规范的专家共识[J].中华放射学杂志,2011,45(3):293-296.doi:10.3760/cma.j.issn.1005-1201.2011.03.014.Chinese Medical Association Chinese Society of Radiology(CSR)Interventional Group.Agreement on the guidelines for the interventional treatment of deep venous thrombosis[J].Chinese Journal of Radiology,2011,45(3):293-296.doi:10.3760/cma.j.issn.1005-1201.2011.03.014.
[13]陈国平,顾建平,何旭,等.顺行与逆行插管途径介入治疗急性下肢深静脉血栓形成的疗效比较[J].中华医学杂志,2017,97(5):353-358.doi:10.3760/cma.j.issn.0376-2491.2017.05.007.Chen GP,Gu JP,He X,et al.Efficacy comparison ofinterventional treatment by anterograde or retrograde catheterization for acute lower extremity deep venous thrombosis[J].National Medical Journal of China,2017,97(5):353-358.doi:10.3760/cma.j.issn.0376-2491.2017.05.007.
[14]Srinivas BC,Patra S,Nagesh CM,et al.Catheter-Directed Thrombolysis Along with Mechanical Thromboaspiration versus Anticoagulation Alone in the Management of Lower Limb Deep Venous Thrombosis-A Comparative Study[J].Int J Angiol,2014,23(4):247-254.doi:10.1055/s-0034-1382157.
[15]Sillesen H,Just S,Jorgensen M,et a1.Catheter directed thrombolysis for Ixea Unent ofilio-femoral deep venous thrombosis is durable,preserves venous valve function and may prevent chronic venous insufficiency[J].Eur JVasc Endovasc Surg,2005,30(5):556-562.doi:10.1016/j.ejvs.2005.06.012.
[16]Akhtar OS,Lakhter V,Zack CJ,et a1.Contemporary Trends and Comparative Outcomes With Adjunctive Inferior Vena Cava Filter Placement in Patients Undergoing Catheter-Directed Thrombolysis for Deep Vein Thrombosis in the United States:Insights From the National Inpatient Sample[J].JACC Cardiovasc Interv,2018,11(14):1390-1397.doi:10.1016/j.jcin.2018.04.048.
[17]Chen JX,Sudheendra D,Stavropoulos SW,et al.Role of Catheterdirected Thrombolysis in Management of Iliofemoral Deep Venous Thrombosis[J].Radiographics,2016,36(5):1565-1575.doi:10.1148/rg.2016150138.
[18]余伟清,黄维国.尿激酶溶栓治疗急性脑梗死后出血的临床效果及机制研究[J].中国医学创新,2017,14(17):56-59.doi:10.3969/j.issn.1674-4985.2017.17.014.Yu WQ,Huang WG.Study on Clinical Effect and Mechanism of Urokinase Thrombolysis in the Treatment of Acute Hemorrhagic Cerebral Infarction[J].Medical Innovation of China,2017,14(17):56-59.doi:10.3969/j.issn.1674-4985.2017.17.014.
[19]李艳.尿激酶静脉溶栓应用于超早期脑梗塞的临床效果及安全性[J].临床医学研究与实践,2018,3(10):27-28.doi:10.19347/j.cnki.2096-1413.201810012.Li Y.Clinical effect and safety ofintravenous thrombolysis with urokinase in the super early cerebral infarction and the occurrence of cerebral hemorrhage[J].Clinical Research and Practice,2018,3(10):27-28.doi:10.19347/j.cnki.2096-1413.201810012.
[20]Pennica D,Holmes WE,Kohr WJ,et al.Cloning and expression of human tissue-type plasminogen activator cDNA in E.coli[J].Nature,1983,301(5897):214-221.doi:10.1038/301214a0.
[21]毛文苹,王辰,杨媛华,等.重组尿激酶原治疗对大鼠肺血栓栓塞症后血浆纤溶因子的影响[J].军事医学,2014,38(12):948-951.doi:10.7644/j.issn.1674-9960.2014.12.007.Mao WP,Wang C,Yang YH,et al.Changes of plasma fibrinolytic factors in pulmonary thromboembolism rats after rce-combinant prourokinase treatment[J]. Military Medical Sciences,2014,38(12):948-951.doi:10.7644/j.issn.1674-9960.2014.12.007.
[22]额尔德木图,吕文桃,高占峰,等.重组人尿激酶原与尿激酶在下肢深静脉血栓溶栓治疗疗效对比研究[J].临床和实验医学杂志,2017,16(17):1736-1739.doi:10.3969/j.issn.1671-4695.2017.17.024.Erdemtuu,Lu WT,Gao ZF,et al.A comparative study on the application of recombinant prourokinase and urokinase in treatment of lower extremity deep venous thrombosis[J].Journal of Clinical and Experimental Medicine,2017,16(17):1736-1739.doi:10.3969/j.issn.1671-4695.2017.17.024.
[23]张琴琴,梁宗安,秦先梅.重组人尿激酶原治疗急性肺栓塞的临床研究[J].世界临床药物,2018,39(5):313-317.Zhang QQ,Liang ZA,Qin XM.Clinical research of recombinant human prourokinase in the treatment of acute pulmonary embolism[J].World Clinical Drugs,2018,39(5):313-317.
[24]邱树霞,李亚昌,王尚涛,等.注射用重组人尿激酶原治疗急性ST段心肌梗死60例临床观察[J].中国继续医学教育,2015,(21):160-161.doi:10.3969/j.issn.1674-9308.2015.21.119.Qiu SX,Li YC,Wang ST,et al.The Clinical Observation of PuYouKe(rPA)Thrombolytic Therapy for Acute Myocardial Infarction[J].China Continuing Medical Education,2015,(21):160-161.doi:10.3969/j.issn.1674-9308.2015.21.119.
[25]宋志平,杜丹阳,黄平,等.急性心肌梗死患者采用重组人尿激酶原溶栓治疗的疗效及安全性分析[J].临床医学工程,2014,21(4):469-470.doi:10.3969/j.issn.1674-4659.2014.04.0469.Song ZP,Du DY,Huang P,et al.Efficacy and Safety of Thrombolytic Therapy with Recombinant Human Prourokinase for Acute Myocardial Infarction[J].Clinical Medical&Engineering,2014,21(4):469-470.doi:10.3969/j.issn.1674-4659.2014.04.0469.
[26]Mewissen MW,Seabrook GR,Meissner MH,et al.Catheterdirected thrombolysis for lower extremity deep venous thrombosis:report of a national multicenter registry[J].Radiology,1999,211(1):39-49.doi:10.1148/radiology.211.1.r99ap4739.
