乳腺癌是女性最常见的恶性肿瘤之一。严重威胁到了女性的健康和生活。在2012年,全球大约有170万人患病,其中有521 900人死亡[1]。在中国,乳腺癌是女性第五大致死性癌症[2]。乳腺浸润性导管癌(IDC)是乳腺癌中最常见的病理类型[3]。IDC的发生主要考虑与基因调控异常及性激素水平的紊乱有关,生物学因素的改变,可以影响到肿瘤相关信号通路的激活,导致早期细胞发生病变[4]。现阶段IDC患者的早期诊断的水平仍然较为局限,影像学筛查虽然能够提高诊断准确率,但漏诊率或者误诊率仍然较高[5];临床上通过手术及综合性的放疗方式辅助治疗IDC,但其治疗后患者的生存时间的改善并不理想,治疗后的3年生存率并无明显的提高[6]。虽然手术、放疗、化疗是肿瘤治疗的传统手段[7],但免疫治疗目前已经成为治疗肿瘤的新的方法,如PD-1/PD-L1抑制剂[8]等,备受人们关注。
犬尿氨酸酶(kynureninase,KYNU)或L-犬尿氨酸水解酶属于犬尿氨酸酶家族,基因组位置在2q22.2[9]。KYNU在肝脏、胎盘、肺、心脏、脑等多种组织器官中均有表达[10],能水解L-犬尿氨酸和3-羟基L-犬尿氨酸为邻氨基苯甲酸,通过色氨酸代谢通路参与NAD辅因子的生物合成[11-12]。色氨酸在肿瘤细胞中主要通过吲哚胺-2-3双加氧酶1(IDO-1)降解,其降解产物之一为犬尿氨酸。
人类许多肿瘤的发生、发展都与p53基因的突变有关。P53蛋白也是多种癌症进展与预后的一项重要指标[13]。因此,本研究应用免疫组织化学方法检测IDC标本中KYNU和突变型P53的表达情况,分析它们与IDC临床病理特征的相关性,进而探讨它们之间的相互关系。
1 材料与方法
1.1 材料
1.1.1 标本来源 从2012年9月—2015年在湘雅二医院接受外科介入和病理检查的IDC患者石蜡包埋标本。从患者的记录中回顾性地获得这些患者的临床和病理数据。
1.1.2 抗体 KYNU抗体购自GeneTex公司(兔多克隆抗体,GTX33291),适用的稀释浓度为1:1 000;使用UltraViewTM Universal DAB检测试剂盒(Ventana Medical Systems)常规染色针对P53的单克隆抗体。
1.2 实验方法
1.2.1 免疫组化 肿瘤组织放入10%福尔马林中固定,并包埋在石蜡块中,蜡块作厚度约4 μm的多张切片,其中1张行切片HE常规染色,另2张切片分别行KYNU、P53免疫组化检测,且HE常规染色均由湘雅二医院病理科高年资医生病理检查证实。采用SP法检测KYNU的表达,检测方法按试剂盒说明书进行。以磷酸盐缓冲液代替一抗作为阴性对照。P53使用自动Benchmark平台(Ventana Medical Systems,Tucson,USA)进行免疫组化实验(37 ℃孵育60 min)。使用Benchmark平台对所有标本使用细胞调节溶液(CC1,Ventana Medical Systems)的抗原修复,并用苏木精进行复染。
1.2.2 结果判断 根据美国临床肿瘤学会(ASCO)和美国病理学家学会(CAP)指南对P53染色进行评分。P53阳性定义为超过10%的肿瘤细胞染色。KYNU蛋白主要在肿瘤细胞的细胞质中表达。细胞质染色分数(CF)的得分为0(0~5%),1(5%~25%),2(26%~50%),3(51%~75%)或4(>75%),细胞质染色强度(CI)记为0(阴性)、1(弱)、2(中等)、3(强)。随后,通过将CF和CI(范围0~12)相乘来计算组合的细胞质评分(CS)。为了合理进行统计分析,减少异质性,使用对数秩和检验选择KYNU表达的临界范围值。最佳临界范围值被确定为低表达(分数≤4)或高表达(分数>4)KYNU表达。
1.3 统计学处理
使用Windows版的SPSS 19.0版进行统计分析。使用χ2检验评估KYNU表达与临床病理学特征之间的关系。使用单因素方差分析计算KYNU在IDC的肿瘤分级和TNM分期中的表达数据。
2 结果
2.1 KYNU在IDC中的表达
在131例IDC组织中进行KYNU的免疫组化分析,63个样本(48.1%)KYNU高表达(IHC得分>4),68个样本(51.9%)为KYNU低表达(IHC得分≤4)。在102例IDC组织中,46个样本P53表达阳性,阳性率为45.1%,56个样本P53表达阴性(图1)。
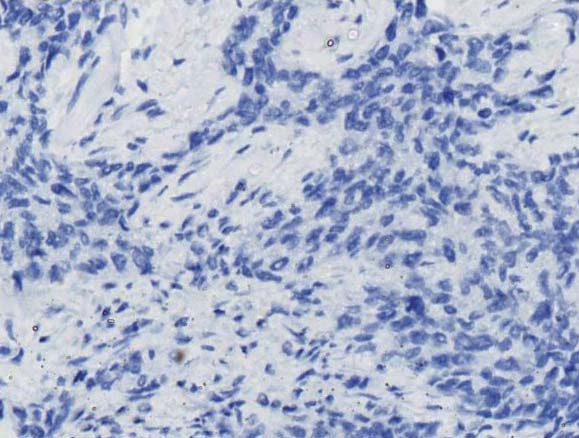
图1 免疫组化检测KYNU与P53蛋白表达(×400) A:乳腺癌组织中KYNU高表达;B:乳腺癌组织中KYNU低表达;C:乳腺癌组织中P53阳性表达;D:乳腺癌组织中P53阴性表
2.2 KYNU在IDC中的表达及与临床病理指标的关系
单因素分析结果显示,KYNU的表达T分期(P<0.001),组织学分级(P=0.01),内在亚型(P=0.032),突变型P53(P=0.02)有关,而与年龄及N分期无关(均P>0.05)(表1)。
表1 KYNU表达与IDC临床病理特征的相关性
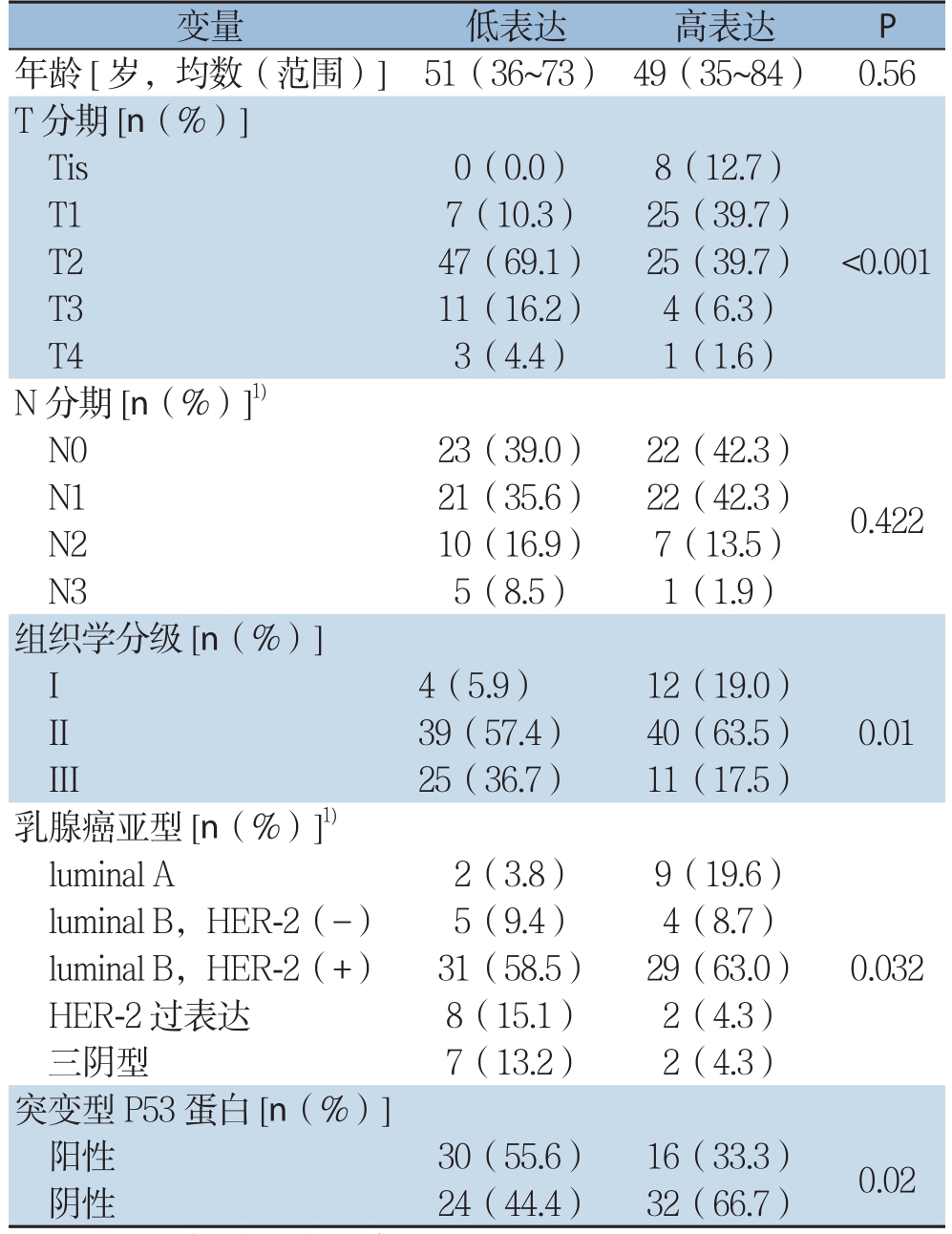
注:1)部分患者无资料
变量 低表达 高表达 P年龄[岁,均数(范围)] 51(36~73) 49(35~84) 0.56 T分期[n(%)]Tis 0(0.0) 8(12.7)T1 7(10.3) 25(39.7)T2 47(69.1) 25(39.7)T3 11(16.2) 4(6.3)T4 3(4.4) 1(1.6)N分期[n(%)]1)N0 23(39.0) 22(42.3)<0.001 N1 21(35.6) 22(42.3)N2 10(16.9) 7(13.5)N3 5(8.5) 1(1.9)组织学分级[n(%)]I 4(5.9) 12(19.0)0.422 II 39(57.4) 40(63.5)III 25(36.7) 11(17.5)乳腺癌亚型[n(%)]1)luminal A 2(3.8) 9(19.6)0.01 luminal B,HER-2(-) 5(9.4) 4(8.7)luminal B,HER-2(+) 31(58.5) 29(63.0)HER-2过表达 8(15.1) 2(4.3)三阴型 7(13.2) 2(4.3)突变型P53蛋白[n(%)]阳性 30(55.6) 16(33.3) 0.02阴性 24(44.4) 32(66.7)0.032
3 讨论
在本研究中,通过免疫组化的方法探讨了KYNU在IDC的表达及其对预后评估的价值。KYNU主要在细胞胞浆中表达,它的表达与乳腺癌病理分型相关,在不同分级中表达强弱有差异,组织学分级I级表达最强,组织学分级II级其次,组织学分级III级表达最弱。KYNU的表达在不同分期中表达强弱也有差异,T0表达最强,T3表达最弱。
而在乳腺癌的亚型中表达可见,高KYNU表达多存在于luminal A型,而不是三阴型;而低KYNU表达则多存在于三阴型,而三阴型乳腺癌是一种特殊类型的乳腺癌亚型,具有发病年龄小、家族史、有淋巴结转移等特点,其较早发生局部复发和远处转移[14],故从肿瘤的分期、分级及不同亚型的分析来看,KYNU的表达与肿瘤的侵袭性负相关。
笔者推测KYNU作为色氨酸代谢途径中另一关键酶在IDC发生与发展中起重要的作用。KYNU与色氨酸的利用和疾病的代谢有关,而色氨酸代谢中的重要酶,吲哚胺2,3-双加氧酶(IDO)与恶性肿瘤的免疫耐受密切相关[15]。一项髓质乳腺癌患者的研究表明,IDO-1的高表达与肿瘤良好的预后相关[16]。犬尿氨酸酶在癌症发展中的作用尚不十分清楚,其与癌症的关联仅有少量报道,如肺癌[17]。也有研究表明它与乳腺癌细胞的增殖和分化密切相关[18]。
人体内野生型p53基因作为抑癌基因,主要生物学功能为引起细胞周期阻滞,诱导凋亡和促进分化[19],但因其含量少,半衰期短而不能用免疫组化法测出。突变型P53蛋白失去抑癌作用,反而有促进细胞恶变的活性,由于其半衰期延长,且在细胞核内聚积,通过免疫组化方法可直接检测[20]。人类恶性肿瘤中多数存在p53基因突变[21],p53基因突变可导致缺陷DNA大量复制,甚至导致恶变[22]。
临床上乳腺恶性肿瘤的发生,导致患者生活质量和生存时间显著下降[23]。在探讨IDC的发病机制的过程中发现,P53蛋白能够通过影响到癌细胞的周期调控,导致上皮细胞的持续性增殖,提高了癌细胞对于导管基底部的浸润作用[24]。在浸润性导管癌患者病灶组织中,P53的表达阳性率显著的上升,高于正常对照乳腺组织,差异较为明显,提示了P53可能影响到了乳腺癌发生[25]。
在KYNU与肿瘤相关指标P53的关系分析中可见,KYNU高表达与P53(突变型)呈反向变化关系。还有报道也认为,在乳腺癌患者病灶组织中,P53的表达阳性率可平均上升30%以上,同时在临床分期较晚或者远期病死率较高的导管癌患者中,P53的表达阳性率可进一步的上升[26]。
恶性肿瘤是一个多因素、多步骤作用的结果,其发生要经过一系列基因表达变化的共同作用。基于笔者的上述数据,KYNU可能对乳腺癌起到了抑制作用,它的高表达可被认为是具有良好预后的IDC的标志物。因此KYNU是很有前途的乳腺癌治疗靶点,但需要对KYNU进行更深入的研究。未来将对影响乳腺癌发展的KYNU分子机制进行更进一步的研究。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.doi:10.1002/ijc.29210.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115 132.doi:10.3322/caac.21338.
[3]Wang T,Ma Y,Wang L,et al.Strong adverse effect of epidermal growth factor receptor 2 overexpression on prognosis of patients with invasive lobular breast cancer:a comparative study with invasive ductal breast cancer in Chinese population[J].Tumour Biol,2015,36(8):6113-6124.doi:10.1007/s13277-015-3293-6.
[4]马继斌,曾理,张保荣,等.特殊类型乳腺恶性病变与常见浸润性导管癌超声声像图的对比分析[J].癌症进展,2017,15(7):790-793.doi:10.11877/j.issn.1672-1535.2017.15.07.19.Ma JB,Zeng L,Zhang BR,et al.Comparative analysis of ultrasonographic features of rare malignant breast lesions andcommon invasive ductal carcinoma[J].Oncology Progress,2017,15(7):790-793.doi:10.11877/j.is sn.1672-1535.2017.15.07.19.
[5]Shi WB,Yang LJ,Hu X,et al.Clinico-pathological features and prognosis ofinvasive micropapillary carcinoma compared to invasive ductal carcinoma:a population-based study from China[J].PLoS One,2014,9(6):e101390.doi:10.1371/journal.pone.0101390.
[6]Paul Wright G,Davis AT,Koehler TJ,et al.Hormone receptor status does not affect prognosis in metaplastic breast cancer:a population-based analysis with comparison to infiltrating ductal and lobular carcinomas[J].Ann Surg Oncol,2014,21(11):3497-3503.doi:10.1245/s10434-014-3782-7.
[7]Prat A,Pineda E,Adamo B,et al.Clinical implications of the intrinsic molecular subtypes of breast cancer[J].Breast,2015,24(Suppl 2):S26-35.doi:10.1016/j.breast.2015.07.008.
[8]Schütz F,Stefanovic S,Mayer L,et al.PD-1/PD-L1 Pathway in Breast Cancer[J].Oncol Res Treat,2017,40(5):294-297.doi:10.1159/000464353.
[9]Koushik SV,Sundararaju B,McGraw RA,et al.Cloning,sequence,and expression of kynureninase from Pseudomonas fl uorescens[J].Arch Biochem Biophys,1997,344(2):301-308.doi:10.1006/abbi.1997.0220.
[10]Alberati-Giani D,Buchli R,Malherbe P,et al.Isolation and expression of a cDNA clone encoding human kynureninase[J].Eur J Biochem,1996,239(2):460-468.doi:10.1111/j.1432-1033.1996.0460u.x.
[11]Shi H,Enriquez A,Rapadas M,et al.NAD Deficiency,Congenital Malformations,and Niacin Supplementation[J].N Engl J Med,2017,377(6):544-552.doi:10.1056/NEJMoa1616361.
[12]Toma S,Nakamura M,Toné S,et al.Cloning and recombinant expression of rat and human kynureninase[J].FEBS Lett,1997,408(1):5-10.doi:10.1016/s0014-5793(97)00374-8.
[13]王逸君,徐自强,王志明,等.RCAS1/EBAG9与P53蛋白在肝内胆管癌中的表达及临床意义[J].中国普通外科杂志,2019,28(8):952-959.doi:10.7659/j.issn.1005-6947.2019.08.007.Wang YJ,Xu ZQ,Wang ZM,et al.RCAS1/EBAG9 and P53 protein expressions in intrahepatic cholangiocarcinoma and the clinical significance[J].Chinese Journal of General Surgery,2019,28(8):952-959.doi:10.7659/j.issn.1005-6947.2019.08.007.
[14]黄凯,陈夏.三阴性乳腺癌的临床病理特征和预后影响因素分析[J].中国普通外科杂志,2014,23(11):1578-1580.doi:10.7659/j.issn.1005-6947.2014.11.025.Huang K,Chen X.Analysis of clinicopathologic features and prognosis effects of triple negative breast cancer[J].Chinese Journal of General Surgery,2014,23(11):1578-1580.doi:10.7659/j.issn.1005-6947.2014.11.025.
[15]Hornyák L,Dobos N,Koncz G,et al.The Role of Indoleamine-2,3-Dioxygenase in Cancer Development,Diagnostics,and Therapy[J].Front Immunol,2018,9:151.doi:10.3389/fimmu.2018.00151.
[16]Jacquemier J,Bertucci F,Finetti P,et al.High expression ofindoleamine 2,3-dioxygenase in the tumour is associated with medullary features and favourable outcome in basal-like breast carcinoma[J].Int J Cancer,2012,130(1):96-104.doi:10.1002/ijc.25979.
[17]Fahrmann JF,Dennison J,Murage E,et al.Elevated kynureninase protein expression is associated with KEAP1 mutant non-small cell lung cancer and is predictive of poor overall survival[J].Cancer Res,2016,76(14):Abstract LB-311.doi I:10.1158/1538-7445.AM2016-LB-311.
[18]Liu Y,Feng X,Lai J,et al.A novel role of kynureninase in the growth control of breast cancer cells and its relationships with breast cancer[J].J Cell Mol Med,2019,doi:10.1111/jcmm.14547.[Epub ahead of print]
[19]Van Dyke T.p53 and tumor suppression[J].N Engl J Med,2007,356(1):79-81.doi:10.1056/NEJMcibr066301.
[20]孙丽梅,王鲁建,宋敏,等.乳腺癌组织突变型p53和抑癌基因PTEN表达及其临床意义的研究[J].中华肿瘤防治杂志,2008,15(6):430-433.doi:10.3969/j.issn.1673-5269.2008.06.009.Sun LM,Wang LJ,Song M,et al.Expressions of mutated p53 and tumor suppressor gene PTEN in breast cancer[J].Chinese Journal of Cancer Prevention and Treatment,2008,15(6):430-433.doi:10.3969/j.issn.1673-5269.2008.06.009.
[21]Synnott NC,Madden SF,Bykov VJN,et al.The Mutant p53-Targeting Compound APR-246 Induces ROS-Modulating Genes in Breast Cancer Cells[J].Transl Oncol,2018,11(6):1343-1349.doi:10.1016/j.tranon.2018.08.009.
[22]Li H,Zhou ZQ,Yang ZR,et al.MicroRNA-191 acts as a tumor promoter by modulating the TET1-p53 pathway in intrahepatic cholangiocarcinoma[J].Hepatology,2017,66(1):136-151.doi:10.1002/hep.29116.
[23]Liu Y,Huang X,Bi R,et al.Similar prognoses for invasive micropapillary breast carcinoma and pure invasive ductal carcinoma:a retrospectively matched cohort study in China[J].PLoS One,2014,9(9):e106564.doi:10.1371/journal.pone.0106564.
[24]陶曙,邱志远,雷珍,等.p53、CerbB-2、ER、PR和Ki67在乳腺浸润性小叶癌的表达及临床意义[J].江苏医药,2016,42(3):266-268.Tao S,Qiu ZY,Lei Z,et al.Expressions and clinical significance of p53,CerbB-2,ER,PR and Ki67 in breast invasive lobular carcinoma[J].Jiangsu Medical Journal,2016,42(3):266-268.
[25]祝志川,张喜平.P53、bcl-2及c-erbB-2蛋白在乳腺浸润性导管癌组织的表达及意义[J].中国普通外科杂志,2018,27(12):1619-1623.doi:10.7659/j.issn.1005-6947.2018.12.020.Zhu ZC,Zhang XP.Expression and significane of P53,bcl-2 and c-erbB-2 protein in invasive ductal breast carcinoma tissue[J].Chinese Journal of General Surgery,2018,27(12):1619-1623.doi:10.7659/j.issn.1005-6947.2018.12.020.
[26]赖静,顾军,许晶,等.p53在乳腺癌中的表达意义及5-氮杂脱氧胞苷对 p53的调控作用[J].医学研究生学报,2014,27(6):573-576.Nai J,Gu J,Xu J,et al.Expression of p53 in breast cancer and regulatory effects of 5-aza-2′-deoxycytidine on p53[J].Journal of Medical Postgraduates,2014,27(6):573-576.
