胆管癌(cholangiocarcinoma)是来源于胆管上皮细胞的恶性肿瘤,发生率占全部恶性肿瘤的比例低于1%,其发病隐匿,恶性程度高,预后较差[1-2],目前治疗胆管癌的方式包括手术切除、放疗、化疗及生物靶向治疗等,由于胆管癌早期症状不典型,多数患者就诊时已丧失根治手术机会,预后差,中位生存期不足1年[3]。对晚期的胆管癌患者来说,现有的临床姑息性治疗手段很难延长患者的生存时间及改善其生活质量。
光动力治疗(photodynamic therapy,PDT),是指利用特定波长的激光照射光敏剂,其受激发产生包括单线态氧在内的活性氧簇(reactive oxygen species,ROS),产生细胞毒性作用,进而导致细胞受损乃至死亡[4]。PDT对胆管癌患者来说是一种新型的治疗手段,临床实践表明PDT可用于不可手术胆管癌患者的辅助治疗,其能够有效恢复胆管引流、减少胆汁淤积,降低胆红素血清水平、改善生活质量、延长其生存时间[5-7]。 目前临床所使用的光敏剂多为第一代光敏剂,其在肿瘤部位富集浓度较低,产生皮肤毒性反应较明显,光动力杀伤效应较差,故探索一种能高浓度聚集于肿瘤部位并毒性低的光敏剂已成为临床P D T 发展趋势。方启程团队[8]通过研究提纯并自主合成了一种新型光敏剂华卟啉钠(sinoporphyrin sodium,DVDMS),其具有产率高、水溶性大、容易纯化等特点,且有研究[9]表明DVDMS介导的PDT(DVDMS-PDT)对人肝癌细胞H e p G 2、人肺癌细胞H 4 6 0、人胃癌细胞BGC823和人肾癌细胞Ketr-3均有明显的生长抑制作用,国内外暂无DVDMS 应用于胆管癌细胞的相关报道。脂质体是一种新型药物载体,具有提高药物的疗效,生物相容性高,减少药物的毒副反应等特点,已被美国食品药品监管局(Food and Drug Administration,FDA)批准临床应用。本文采用薄膜水化-超声法制备脂质体华卟啉钠(DVDMS-L),研究其表征,并比较DVDMS-L与DVDMS在体外对胆管癌细胞的光动力杀伤效应,以作为新的抗胆管癌光敏剂应用于临床,提供有价值的临床资料。
1 材料与方法
1.1 实验材料与仪器
⑴ 细胞系:胆管癌HICC-9810细胞系(购自中国医学科学院细胞中心)。⑵ 试剂:二棕榈酰磷脂酰胆碱(DPPC)(Avanti公司,美国),胆固醇(Avanti公司,美国),磷脂酰乙醇胺甲氧基聚乙二醇2000(DSPE-mPEG-2000)(Sigma-Aldrich 公司,美国),华卟啉钠(江西青龙高科技股份有限公司提供,中国),717型阴离子交换树脂(天津津达树脂厂,中国),CCK8 试剂(Sigma-Aldrich公司,美国),DMEM培养基(Hyclone公司,美国),胎牛血清(Hyclone公司,美国)。⑶ 仪器设备:R2205型旋转蒸发仪(BMCHI公司,瑞典),LD630半导体激光光动力仪(深圳雷迈公司,中国),JY922D型超声波细胞粉碎仪(宁波新芝科技有限公司,中国),电子分析天平(岛津公司,日本),JEOLJEM透射电镜(JEO公司,日本),UV-2550型紫外-可见光分光光度计(岛津公司,日本),Zetasizer Nano-S90型激光纳米粒度分析仪(Malvin公司,英国)。
1.2 实验方法
1.2.1 DVDMS-L 的制备 采用薄膜分散- 超声法[10-12] 制备DVDMS-L:分别精确称取DPPC、胆固醇、DSPE-mPEG2000 20 mg、5 mg、5 mg,以8 mL 甲醇彻底溶解,移入50 mL 圆底烧瓶中,在45 ℃、100 r/min 条件下减压旋转蒸发,直至烧瓶内壁形成一层均匀的薄膜,4 ℃抽真空过夜,以含DVDMS 0.5 mg 的生理盐水5 mL 水化,水化温度55 ℃,水化时间1 h,得到脂质体混悬液,超声细胞粉碎仪以400 mW 功率超声10 min,并依次挤压通过450 nm、220 nm 的聚碳酸酯膜,得澄清透明的DVDMS-L 溶液(以上操作均严格避光)。
1.2.2 DVDMS-L 表征测定 以Zetasizer Nano-S90型激光纳米粒度分析仪测定DVDMS-L 的粒径及Zeta 电位;以磷钨酸负染法[11, 13] 处理DVDMS-L样品,通过透射电镜观察DVDMS-L 的形态、结构和粒径分布。
1.2.3 DVDMS-L 包封率测定 精确称取一定量的DVDMS,甲醇溶解,配制标准品溶液;空白脂质体以甲醇破乳并稀释,配制空白溶液;DVDMS-L以甲醇破乳并稀释,配制对照品溶液。对以上标准品溶液、空白溶液、对照品溶液分别行200~700 nm波长范围扫描,得DVDMS 紫外最大吸收峰位于387 nm 附 近。 精 确 配 制6.25、3.125、1.563、0.781、0.39、0.195 mg/L 的DVDMS 甲 醇 溶 液,分别在387 nm 处测紫外吸光度,以吸光度(Y)对DVDMS 质量浓度(X,mg/L)作线性回归方程。采用阴离子交换树脂- 微柱离心法[14] 测定DVDMS-L 包封率:常规活化717 型阴离子交换树脂,移入2.5 mL 注射器针筒,1 000 r/min 离心 2 min,制成微柱;取100 µL 空白脂质体(同样以薄膜分散- 超声法制备,只是用不含DVDMS 的生理盐水水化),滴至微柱顶端中央,静置5 min,2 000 r/min 离心2 min,再以100 µL 生理盐水洗脱,2 000 r/min 离心2 min,重复4 次,分别收集每次洗脱液,甲醇破乳定容至5 mL,浊度法[15]测定各次洗脱液于450 nm 处吸光度(A1,A2,A3,A4);另取100 µL 空白脂质体,直接甲醇破乳定容至5 mL,于450 nm 处测定吸光度(A0),空白脂质体回收率按公式Σ(An/A0)×100%计算(n=1,2,3,4)。取100 mg/L 的DVDMS 水溶液取100 µL 滴至微柱顶端中央,按前述操作洗脱4 次,分别收集每次洗脱液,甲醇稀释并定容至5 mL,于387 nm 处测吸光度,经标准曲线转化为浓度(C1,C2,C3,C4);另 取100 mg/L 的DVDMS 水 溶 液取100 µL,直接甲醇定容至5 mL,于387 nm 处测吸光度,经标准曲线转化为浓度(C0),游离DVDMS 吸附率按公式1-Σ(Cn/C0)×100% 计算(n=1,2,3,4)。取100 µL DVDMS-L 滴 至 微柱顶端中央,按前述操作洗脱4 次,收集全部洗脱液,以甲醇破乳并定容至5 mL,于387 nm 处测吸光度,经标准曲线换算成浓度,记为Cin;另取100 µL DVDMS-L 以甲醇破乳并定容至5 mL,于387 nm 处测吸光度,通过标准曲线换算成浓度,记 为Ctotal; 包 封 率(encapsulation efficiency,EE)按公式下述公式计算:EE=Cin/Ctotal×100%。按此方法重复3 次,计算平均包封率。
1.2.4 细胞培养与传代 人胆管癌HICC-9810 细胞培养于含10%胎牛血清的DMEM 培养基(含1%双抗)中,置于37 ℃、5%CO2 的培养箱内,2 d换液1 次,3~4 d 传代1 次。
1.2.5 DVDMS-L 光动力效应检测 将胆管癌HICC-9810 细胞以104 个/ 孔的密度均匀种于96孔板中,待每孔长满细胞,分别用0、0.06、0.12、0.25、0.5、1 μmol/L 的DVDMS-L 与DVDMS,加10 J/cm2 光照,每个浓度设置4 个副孔,孵育HICC-9810 细胞4 h。同时用相同条件以上浓度的DVDMS-L 与DVDMS 但无光照,以及10 J/cm2 光照但无光敏剂处理HICC-9810 细胞,观察单纯光敏剂与单纯光照的作用。孵育4 h 后以630 nm 的激光照射各孔,光照后继续培养箱内孵育24 h,以CCK8 法[16]通过多功能酶标仪(波长570 nm)测定各孔OD 值,细胞存活率按下述公式计算:细胞存活率= 处理组OD 值/ 完全空白组OD 值×100%;Bliss 法[17]计算半数抑制浓度(inhibitory concentration 50,IC50)。
1.3 统计学处理
实验数据采用SPSS 22.0统计学软件进行分析。结果采用均数±标准差(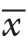 ±s)表示,采用 t检验及方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
±s)表示,采用 t检验及方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 DVDMS-L 性状
所制备出的DVDMS-L呈红色透明澄清溶液,如图1所示。

图1 DVDMS-L 外观
Figure 1 Appearance of DVDMS-L
2.2 DVDMS-L 表征
DVDMS-L平均粒径为(113.7±14.2)nm,粒径分布指数(PDI)为0.142(图2A);DVDMS-L平均Zeta电位为-(24.5±3.2)mV(图2B);DVDMS-L在透射电镜下呈圆形或椭圆形,粒径分布与激光粒度分析仪结果一致,可观察到脂质体双分子层结构(图2C)。
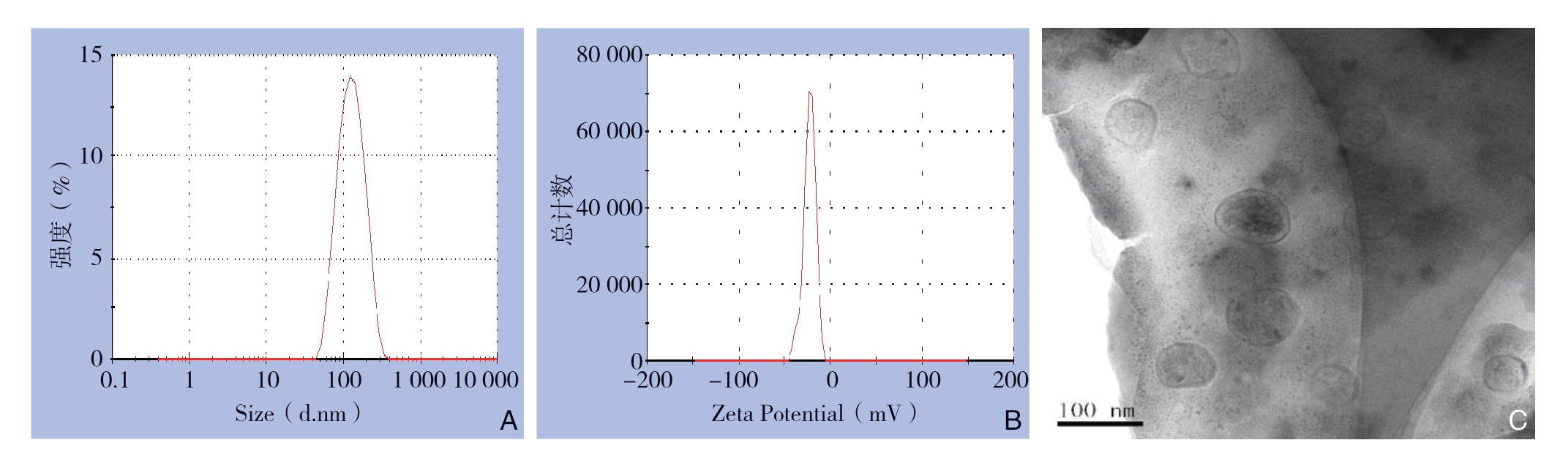
图2 DVDMS-L 表征检测 A:DVDMS-L 粒径分布;B:DVDMS-L Zeta 电位;C:DVDMS-L 透射电镜图
Figure 2 Characterization of DVDMS-L A: Particle size distribution of DVDMS-L; B: Zeta potential of DVDMS-L; C:Transmission electron microscopy of DVDMS-L
2.3 DVDMS-L 包封率
DVDMS标准曲线:以DVDMS甲醇溶液于387nm处吸光度(Y)对其质量浓度(X,m g/L)作线性回归方程,得回归方程:Y=0.16671X+0.006336,r2=0.9998,表明DVDMS在0.195~6.25 mg/L的浓度范围内其吸光度线性关系良好(图3)。空白脂质体回收率:每次洗脱后空白脂质体的回收率分别为72.1%、88.2%、9 7.4%、9 9.5%,可认为洗脱4 次后空白脂质体完全从阴离子交换树脂微柱上洗脱下来。游离DVDMS吸附率:每次洗脱后游离DVDMS的吸附率分别为99.7%、99.7%、99.5%、99.4%,可认为 4次洗脱内游离DVDMS被阴离子交换树脂微柱完全吸附,不能洗脱下来。
结合以上结果可知,洗脱4 次能将脂质体完全洗脱下来,而未包裹的药物不会被洗脱,故该方法能实现脂质体与未包裹药物完全分离。计算出DVDMS-L平均包封率为(61.74±1.49)%(n=3)。
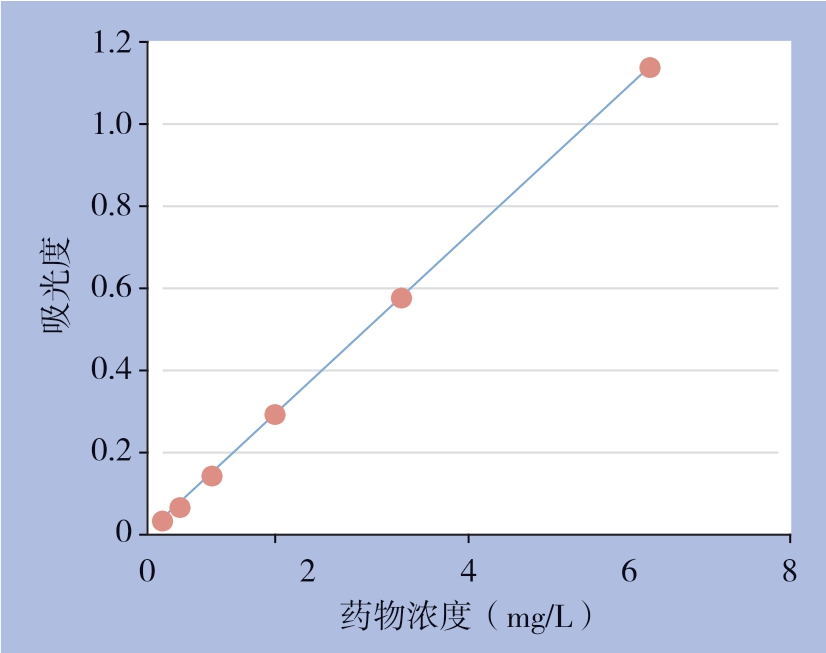
图3 DVDMS 标准曲线
Figure 3 Standard curve of DVDMS
2.4 光动力实验结果
光照条件下,DVDMS 与DVDMS-L 在达到0.25 μmol/L后均能引起HICC-9810细胞明显死亡,细胞存活率与光敏剂呈浓度依赖性关系,随着药物浓度升高,两组细胞存活率逐渐减少,每组内各浓度之间存活率差异有统计学意义(均P<0.05);当药物浓≥0.12 μmol/L后,同一浓度DVDMS-L组较DVDMS组细胞存活率明显减少(均P<0.05)(图4);DVDMS-L IC50为0.11 μmol/L,DVDMS IC50为0.29 μmol/L,两者差异有统计学意义(P<0.05)。此外,在无光照条件下,任何浓度DVDMS与DVDMS-L,或无光敏剂单纯光照对HICC-9810细胞均无杀伤作用(均P>0.05)。
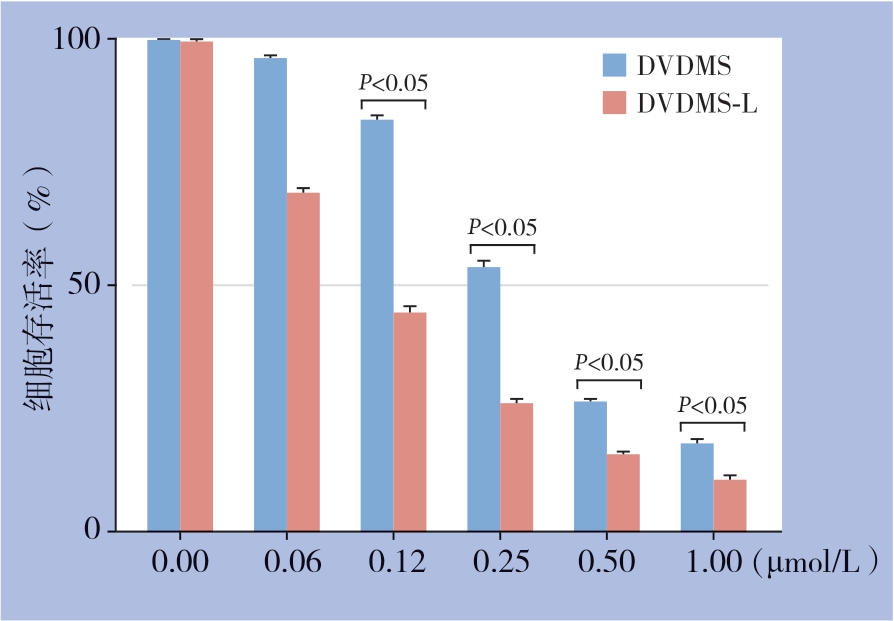
图4 DVDMS 与DVDMS-L 对HICC-9810 细胞活力的影响
Figure 4 Effects of DVDMS and DVDMS-L on viability of HICC-9810 cells
3 讨 论
为增加抗肿瘤药物的生物利用度,降低毒性、增加生物相容性,国内外研究出多种载药系统,如纳米有机多聚物颗粒[18]、纳米脂质体[19]、量子点[20]、上转换纳米颗粒[21]等,本实验选用脂质体作为DVDMS的载药系统,并通过查询相关文献[11-12]及大量预实验,初步摸索出制备DVDMS-L最佳处方及制备工艺,并选择薄膜超声-水化法作为脂质体的制备方法,在该条件下所制备出的DVDMS-L性状稳定,重复性好,包封率可观。包封率是评价脂质体质量的指标之一[22],预实验中,作者曾使用超滤离心法[23]、鱼精蛋白沉淀法[24]、低温超速离心法[25]、葡聚糖凝胶柱法[26]等常见包封率测定方法,均不能实现脂质体与药物完全分离,从而不能准确计算包封率。超滤离心法中超滤膜对DVDMS有一定程度的吸附和截留;鱼精蛋白沉淀法中鱼精蛋白对DVDMS 亦有吸附;低温超速离心法数据重复性低,对设备要求高;葡聚糖凝胶柱法耗时长,成本较高,对脂质体样品过度稀释,且得不到脂质体与未包封药物良好分离的洗脱曲线,故无法得到较为准确的包封率。本研究最终采用阴离子交换树脂-微柱离心法测定DVDMS-L 的包封率,该法操作相对简单,耗时较短,对样品无过度稀释,成本较低,能实现脂质体与未包裹的药物完全分离,最终计算出包封率为(61.74±1.49)%,与文献[12]报道的结果较为接近。粒径及其分布为评价脂质体质量的另一个指标[27]。研究[27]表明粒径>400 nm的脂质体易于被巨噬细胞捕获继而从血液循环中被清除,而粒径<200 nm的脂质体能在血液循环中保留较长时间,本研究中所制备的DVDMS-L平均粒径为(113.7±14.2)nm,PDI为0.142,说明该脂质体粒径分布较为均匀,且达到纳米脂质体的要求。
PDT经多年不断发展,如今越来越被重视和研究。本实验使用胆管癌HICC-9810细胞株,进行了光毒性实验、暗毒性实验,并对比了不同药物浓度下DVDMS-L与DVDMS对HICC-9810胆管癌细胞的光动力杀伤效应。结果显示,无光敏剂条件下,单纯光照并不造成胆管癌细胞的明显死亡;无光照条件下,在本研究的浓度范围内单纯光敏剂亦不能造成胆管癌细胞的明显死亡,说明光敏剂和光照为PDT两个必需的条件,缺一不可,且本研究的光敏剂浓度范围对胆管癌细胞不具备暗毒性,在无光照时可视为安全浓度范围。光照条件下,随着光敏剂浓度的增加,两组的细胞存活率逐渐降低,表现出浓度依赖性的趋势;光敏剂浓度达0.12 μmol/L后在同一浓度下,DVDMS-L相较于DVDMS表现出对HICC-9810胆管癌细胞更强的光动力杀伤效应,可能原因如下:DVDMS经脂质体包裹后,其对胆管癌细胞有更大亲和力,被胆管癌细胞摄取的量更大,产生的ROS更多,从而对胆管癌细胞杀伤作用更明显。这些可能的机制需要通过细胞对光敏剂摄取相关实验、细胞内ROS测定实验来验证,而作者暂未进行此类实验,是本文的不足之处之一,故在今后的研究中需要进行此类实验加以验证DVDMS脂质体化的效果。
手术治疗是临床治疗胆管癌的主要方式,但多数患者被诊断为胆管癌时已失去根治手术机会,且胆管癌对放化疗并不敏感,故胆管癌的总体预后较差,患者生存期短、生活质量较低[1, 28-29]。PDT的临床应用为胆管癌的临床治疗带来希望,尤其是无法手术切除的胆管癌患者,PDT能缓解胆道梗阻,延长患者寿命,提高生活质量[5-7]。PDT于2015年已被美国NCCN指南纳入胆管癌临床治疗的手段之一[30],PDT治疗胆管癌前景广阔。本文使用HICC-9810胆管癌细胞系,脂质体化的DVDMS进行PDT研究,旨在为临床PDT治疗胆管癌提供更多依据,为今后攻克胆管癌这一难题打下基础。遗憾的是,本研究仅进行了PDT杀伤胆管癌的体外研究,缺少动物实验,今后的研究中必须开展光动力治疗胆管癌的体内研究。今后还可以开展DVDMS-L对胆管癌细胞光动力杀伤作用的分子机制研究,进一步深入探索DVDMS-L对胆管癌细胞光动力杀伤作用的本质。
[1] 费健, 韩天权. 胆管癌流行病学、危险因素及分型、分期的研究进展[J]. 中华肝脏外科手术学电子杂志, 2015, 4(4):199-201. doi:10.3877/cma.j.issn.2095-3232.2015.04.002. Fei J, Han TQ. Research progress in cholangiocarcinoma concerning epidemiology, risk factors, classification and staging[J]. Chinese Journal of Hepatic Surgery, 2015, 4(4):199-201. doi:10.3877/cma.j.issn.2095-3232.2015.04.002.
[2] 晏益核, 黄玉斌, 蔡小勇. 肝门部胆管癌的外科治疗现状[J]. 中国普通外科杂志, 2017, 26(2):246-251. doi:10.3978/j.issn.1005- 6947.2017.02.019. Yan YH, Huang YB, Cai XY. Current status in surgical management of hilar holangiocarcinoma[J]. Chinese Journal of General Surgery, 2017, 26(2):246-251. doi:10.3978/j.issn.1005-6947.2017.02.019.
[3] Hezel AF, Zhu AX. Systemic therapy for biliary tract cancers[J]. Oncologist, 2008, 13(4):415-423.doi:10.1634/theoncologist.2007-0252.
[4] Castano AP, Mroz P, Hamblin MR. Photodynamic therapy and anti-tumour immunity[J]. Nat Rev Cancer, 2006, 6(7):535-545.doi:10.1038/nrc1894.
[5] Ortner ME, Caca K, Berr F, et al. Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study[J]. Gastroenterology, 2003, 125(5):1355-1363.
[6] Witzigmann H, Berr F, Ringel U, et al. Surgical and palliative management and outcome in 184 patients with hilar cholangiocarcinoma: palliative photodynamic therapy plus stenting is comparable to r1/r2 resection[J]. Ann Surg, 2006, 244(2):230-239. doi:10.1097/01.sla.0000217639.10331.47.
[7] Kahaleh M, Mishra R, Shami VM, et al. Unresectable cholangiocarcinoma: comparison of survival in biliary stenting alone versus stenting with photodynamic therapy[J]. Clin Gastroenterol Hepatol, 2008, 6(3):290-297.doi:10.1016/j.cgh.2007.12.004.
[8] 方起程. 癌症光动力治疗和新抗癌光敏剂华卟啉钠[J]. 中国新药杂志, 2014, 23(13):1540-1545. Fang QC. Photodynamic therapy for cancer treatment and the new antitumor photosensitizer sinoporphyrin sodium[J]. Chinese Journal of New Drugs, 2014, 23(13):1540-1545.
[9] 姜智换, 史蕤, 李超, 等. 华卟啉钠介导的光动力疗法在体外和体内对肿瘤生长的抑制作用[J]. 癌变·畸变·突变, 2013, 25(3):163-167. doi:10.3969/j.issn.1004-616x.2013.03.001. Jiang ZH, Shi R, Li C, et al. Inhibitory effects of DVDMS-2-based-photodynamic therapy on the growth of tumor in vitro and in vivo[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2013, 25(3):163-167. doi:10.3969/j.issn.1004-616x.2013.03.001.
[10] Lu Q, Li DC, Jiang JG. Preparation of a tea polyphenol nanoliposome system and its physicochemical properties[J]. J Agric Food Chem, 2011, 59(24):13004-13011. doi:10.1021/jf203194w.
[11] Sun Y, Wang H, Wang P, et al. Tumor targeting DVDMSnanoliposomes for an enhanced sonodynamic therapy of gliomas[J]. Biomater Sci, 2019. doi: 10.1039/c8bm01187g. [Epub ahead of print]
[12] Li YX, An HX, Wang XB, et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer[J]. Nano Res, 2018, 11(2):1038-1056. doi:10.1007/s12274-017-1719-8.
[13] Pan GH, Barras A, Boussekey L, et al. Preparation and characterization of decyl-terminated silicon nanoparticles encapsulated in lipid nanocapsules[J]. Langmuir, 2013, 29(41):12688-12696. doi:10.1021/la4029468.
[14] 尹鸿萍, 张明宇. 螺旋藻多糖脂质体包封率的测定[J]. 中国生化药物杂志, 2006, 27(4):225-227. doi:10.3969/j.issn.1005-1678.2006.04.010. Yin HP, Zhang MY. Determination of the entrapment rate of acidic polysaccharide of spirulina plantensisin liposomes[J]. Chinese Journal of Biochemical Pharmaceutics, 2006, 27(4):225-227. doi:10.3969/j.issn.1005-1678.2006.04.010.
[15] 李静, 姚亮, 陈伟, 等. 自制葡聚糖凝胶微型柱测定新藤黄酸聚乳酸-羟基乙酸共聚物纳米微球包封率[J]. 安徽中医学院学报, 2013, 32(6):77-80. doi:10.6969/j.ssn.1000-2219.2013.06.028. Li J, Yao L, Chen W, et al. Determination of encapsulation efficiency of gambogenic acid-PLGA nanospheres using self-assembled sephadex mini-column[J]. Journal of Anhui University of Chinese Medicine, 2013, 32(6):77-80. doi:10.6969/j.ssn.1000-2219.2013.06.028.
[16] Liu L, Liu R, Basnet BB, et al. New phenolic bisabolane sesquiterpenoid derivatives with cytotoxicity from Aspergillus tennesseensis[J]. J Antibiot (Tokyo), 2018, 71(5):538-542. doi:10.1038/s41429-018-0025-3.
[17] Shi DY, Li J, Guo SJ, et al. The antitumor effect of bromophenol derivatives in vitro and Leathesia nana extract in vivo[J]. Chin J Oceanol Limn, 2009, 27(2):277-282. doi:10.1007/s00343-008-0119-z.
[18] Shi Y, Deng X, Bao S, et al. Self-templated stepwise synthesis of monodispersed nanoscale metalated covalent organic polymers for in vivo bioimaging and photothermal therapy[J]. Chem Asian J, 2017, 12(17):2183-2188. doi:10.1002/asia.201700796.
[19] Oh EK, Jin SE, Kim JK, et al. Retained topical delivery of 5-aminolevulinic acid using cationic ultradeformable liposomes for photodynamic therapy[J]. Eur J Pharm Sci, 2011, 44(1/2):149-157. doi:10.1016/j.ejps.2011.07.003.
[20] Juzenas P, Chen W, Sun YP, et al. Quantum dots and nanoparticles for photodynamic and radiation therapies of cancer[J]. Adv Drug Deliv Rev, 2008, 60(15):1600-1614. doi:10.1016/j.addr.2008.08.004.
[21] Lim ME, Lee YL, Zhang Y, et al. Photodynamic inactivation of viruses using upconversion nanoparticles[J]. Biomaterials, 2012, 33(6):1912-1920. doi:10.1016/j.biomaterials.2011.11.033.
[22] Yamamoto E, Miyazaki S, Aoyama C, et al. A simple and rapid measurement method of encapsulation efficiency of doxorubicin loaded liposomes by direct injection of the liposomal suspension to liquid chromatography[J]. Int J Pharm, 2018, 536(1):21-28. doi:10.1016/j.ijpharm.2017.11.035.
[23] Ran C, Chen D, Xu M, et al. A study on characteristic of different sample pretreatment methods to evaluate the entrapment efficiency of liposomes[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1028:56-62. doi: 10.1016/j.jchromb.2016.06.008.
[24] 喻樊. 鞘磷脂-胆固醇为膜材的绞股蓝总皂苷脂质体的制备及其质量评价研究[J]. 中国中药杂志, 2013, 38(22):3875-3879. doi:10.4268/cjcmm20132216. Yu F. Study on preparation of gypenosides liposomes composed of sphingomyelin and cholesterol and its quality evaluation[J]. China Journal of Chinese Materia Medica, 2013, 38(22):3875-3879. doi: 10.4268/cjcmm20132216.
[25] 李旸, 陈晨. 替尼泊苷长循环脂质体的制备与质量评价[J]. 解放军药学学报, 2018, 34(3):236-240. doi: 10.3969/j.issn.1008- 9926.2018.03.011. Li Y, Chen C. Preparation and quality evaluation of teniposide long-circulating liposomes[J]. Pharmaceutical Journal of Chinese People's Liberation Army, 2018, 34(3):236-240. doi: 10.3969/j.issn.1008-9926.2018.03.011.
[26] 陈蓓, 袁明奎, 王建华, 等. 葡聚糖凝胶柱色谱法测定阿苯达唑纳米脂质体包封率的方法研究[J]. 中国药房, 2012, 23(45):4281-4284. doi:10.6039/j.issn.1001-0408.2012.45.21. Chen B, Yuan MK, Wang JH, et al. Methodology study on determination of entrapment efficiency of albendazole nanolipsomes using sephadex GEL column chromatography[J]. China Pharmacy, 2012, 23(45):4281-4284. doi: 10.6039/j.issn.1001-0408.2012.45.21.
[27] Maruyama K. Intracellular targeting delivery of liposomal drugs to solid tumors based on EPR effects[J]. Adv Drug Deliv Rev, 2011, 63(3):161-169. doi: 10.1016/j.addr.2010.09.003.
[28] Sagawa N, Kondo S, Morikawa T, et al. Effectiveness of radiation therapy after surgery for hilar cholangiocarcinoma[J]. Surg Today, 2005, 35(7):548-552. doi: 10.1007/s00595-005-2989-4.
[29] Todoroki T. Chemotherapy for bile duct carcinoma in the light of adjuvant chemotherapy to surgery[J]. Hepatogastroenterology, 2000, 47(33):644-649.
[30] Cai Y, Cheng N, Ye H, et al. The current management of cholangiocarcinoma: A comparison of current guidelines[J]. Biosci Trends, 2016, 10(2):92-102. doi: 10.5582/bst.2016.01048.
