肝细胞癌(hepatocellular carcinoma,HCC,以下简称肝癌)是最常见的恶性肿瘤之一。肝癌发病率在恶性肿瘤发病率中已上升至第6 位[1],病死率更是高居第3位[2]。肝癌病死率高、预后差的原因之一是早期症状不明显,出现症状时多数已处于中晚期,极易侵犯门静脉形成门静脉癌栓(portal vein tumor thrombus,PVTT),并沿血管形成肝内及肝外转移。文献[3]报道PVTT发生率高达44.0%~62.2%。如果治疗不及时,患者自然生存期仅为2.7~4.0个月[4-5]。对于合并PVTT的肝癌患者,巴塞罗那指南将索拉非尼作为唯一推荐治疗方案,而包括我国在内的东南亚国家逐步形成了以手术治疗为基础的治疗方案。但肿瘤复发仍是制约术后远期疗效的瓶颈。研究显示,术后行门静脉化疗(portal vein chemotherapy,PVC),可以有效降低术后肿瘤复发。本研究回顾性分析唐都医院2010年1月—2016年1月唐都医院收治的119例接受手术治疗的肝癌合并PVTT患者的临床资料,以明确术后门静脉泵灌注化疗在预防肝癌合并PVTT术后复发的作用。
1 资料与方法
1.1 一般资料
采用回顾性病例对照研究方法,分析我科119例肝癌合并PVTT患者的临床资料及术后随访资料。其中男94例,女25例;年龄24~76岁,平均年龄(51.58±10.84)岁;乙型肝炎表面抗原阳性 100例(84.0%);合并肝硬化88例(73.9%);血清甲胎蛋白(AFP)<400 mg/L 70例(58.8%);肝功能Child分级A级101例(84.9%);肿瘤直径≤10 cm 80例(67.2%);肿瘤位于左叶者41例,右叶者66 例,左右叶均有者12例。癌栓分型采用程氏分型[6]。将119例患者资料按术后是否行PVC,分为:⑴TACE+PVC组,术中放置门静脉化疗泵,术后行TACE治疗及通过门静脉化疗泵行门静脉灌注化疗。⑵TACE组,术中未放置门静脉化疗泵,术后仅行TACE治疗。TACE+PVC组平均年龄(50.0±10.5)岁,TACE组(53.4±11.0)岁,患者其他基本资料见表1。
1.2 纳入标准和排除标准
纳入标准:⑴ 术后病理证实为肝细胞肝癌;⑵ 影像学报告或术中见PVTT,或术后病理证实为癌栓者。排除标准:⑴ 发生远处转移者;⑵ 不能耐受化疗泵化疗或TACE者。
表1 两组患者临床资料比较[n(%)]
Table 1 Comparison of the clinical characteristics between the two groups of patients [n (%)]
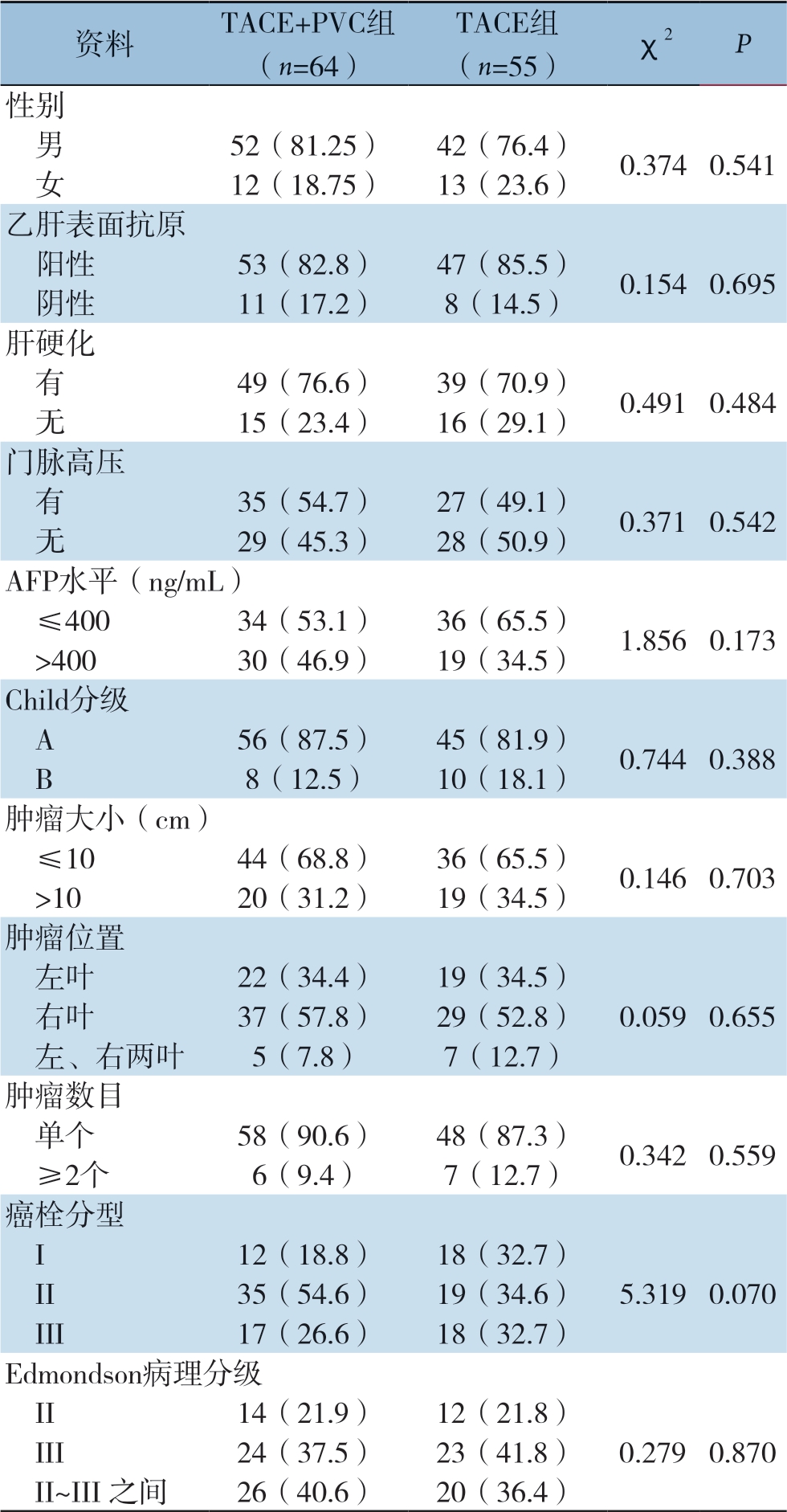
资料 TACE+PVC组(n=64)TACE组(n=55) χ2 P性别 男 52(81.25) 42(76.4) 0.374 0.541 女 12(18.75) 13(23.6)乙肝表面抗原 阳性 53(82.8) 47(85.5) 0.154 0.695 阴性 11(17.2) 8(14.5)肝硬化 有 49(76.6) 39(70.9) 0.491 0.484 无 15(23.4) 16(29.1)门脉高压 有 35(54.7) 27(49.1) 0.371 0.542 无 29(45.3) 28(50.9)AFP水平(ng/mL) ≤400 34(53.1) 36(65.5) 1.856 0.173 >400 30(46.9) 19(34.5)Child分级 A 56(87.5) 45(81.9) 0.744 0.388 B 8(12.5) 10(18.1)肿瘤大小(cm) ≤10 44(68.8) 36(65.5) 0.146 0.703 >10 20(31.2) 19(34.5)肿瘤位置 左叶 22(34.4) 19(34.5) 右叶 37(57.8) 29(52.8) 0.059 0.655 左、右两叶 5(7.8) 7(12.7)肿瘤数目 单个 58(90.6) 48(87.3) 0.342 0.559 ≥2个 6(9.4) 7(12.7)癌栓分型 I 12(18.8) 18(32.7) II 35(54.6) 19(34.6) 5.319 0.070 III 17(26.6) 18(32.7)Edmondson病理分级 II 14(21.9) 12(21.8) III 24(37.5) 23(41.8) 0.279 0.870 II~III 之间 26(40.6) 20(36.4)
1.3 手术方式
肿瘤位于右半肝时,肿瘤切除后,仔细游离肝圆韧带内闭锁脐静脉,用胆道探子扩张管腔,脐静脉再通,见血液流出,仔细游离脐静脉,将静脉化疗泵导管(静脉型埋人式化疗泵,B. Braun Medical法国)置入门静脉内约10 cm,并缝扎固定,远端结扎,将静脉化疗泵固定于右上腹切口旁皮下,注射肝素钠稀释液,确认是否通畅。肿瘤位于左半肝时,肿瘤切除术后,从肠系膜上静脉属支插管至门静脉主干。
1.4 TACE 联合PVC[7]
患者术后1 个月回医院复查,并行T A C E 及P V C。一般采用三联化疗方案。常用氟尿嘧啶500~1 000 mg/m2,盐酸吡柔比星25~40 mg/m2,奥沙利铂1 0 ~3 0 m g/m2。总量的1/3 用于P V C,2/3用于TACE。根据DSA显示结果,先将RH导管(COOK产)头端置于肝总动脉,缓慢依次注入稀释后的盐酸托烷司琼5 mg,以及上述化疗药物总量的2/3,再根据病灶情况,将RH导管依次放置于病灶所在的超选肝动脉,注入吡柔比星与超液态碘油混合后的栓塞剂,行相应的栓塞术。术后第1个月常规行TACE术,远期视复查病情情况,决定是否行TACE治疗。PVC:⑴ 首先冲管,术后第2周用20 mL稀释的肝素钠注射液(1.25万U稀释于100 mL生理盐水)穿刺皮下泵体后冲管1次,以后每2周冲管1次,以防血栓形成堵塞泵管。⑵ 化疗,先推注肝素钠注射液(5~20 mL)确定导管通畅,然后推注硫酸庆大霉素注射液(8万单位)、2%盐酸利多卡因注射液0.1 g、盐酸地塞米松注射液磷酸钠5 mg;化疗药各自稀释于20 mL盐水中,分别推注;不同化疗药物之间,推注稀释肝素钠注射液5 mL。术后前6个月,门静脉化疗每月1次/月,以后每2个月1次,逐渐过渡到每3个月1次。远期视复查情况,适当调节化疗间隔时间,计划内持续行PVC。
1.5 随访
术后半年内,每个月复查CT、MRI或超声造影。半年后,每2~3个月复查1次,直至死亡、失访或至2018年4月1日随访结束。
1.6 统计学处理
应用SPSS 19.0统计软件,计量资料以均数±标准差( ±s)表示,组间计量资料比较采用独立样本t检验或协方差分析。分类变量用率表示,组间比较采用χ2检验或Fisher精确概率法检验。生存率采用 Kaplan-Meier曲线法,并绘制生存函数曲线。生存率比较采用Log-rank时序检验。影响总生存时间的单因素分析采用Log-rank分析,单因素分析有意义(P<0.1)的因素采用Cox回归进行多因素分析,并发症及不良反应等分类资料采用χ2检验,P<0.05为差异有统计学意义。
±s)表示,组间计量资料比较采用独立样本t检验或协方差分析。分类变量用率表示,组间比较采用χ2检验或Fisher精确概率法检验。生存率采用 Kaplan-Meier曲线法,并绘制生存函数曲线。生存率比较采用Log-rank时序检验。影响总生存时间的单因素分析采用Log-rank分析,单因素分析有意义(P<0.1)的因素采用Cox回归进行多因素分析,并发症及不良反应等分类资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 总体情况
本组患者围手术期期间无死亡病例,115例获得完整随访。截止2018年4月随访结束时,中途失访4例,16例仍存活,其余均死亡。
2.2 术后生存情况
TACE+PVC组中位无瘤生存期为13.3个月,TACE组中位无瘤生存期为6.8个月,两组术后0.5、1、2及3年无瘤生存率分别为71.9% vs. 52.9%、57.5% vs. 26.7%、16.4% vs. 8.2%、6.9% vs. 2.1%,组间差异有统计学意义(P=0.004)。TACE+PVC组中位总体生存期 19.5个月,TACE组中位总体生存期12.5个月,两组术后0.5、1、2、3年生存率分别为90.5% vs. 89.1%、69.5% vs. 50.4%、37.9 % vs. 12.1%、22.4% vs. 8.1%,组间差异有统计学意义(P=0.001)(图1)。

图1 患者术后生存曲线
Figure 1 Postoperative survival curves of the patients
2.3 影响患者预后的因素
单因素分析提示,AFP水平、肿瘤大小、术后治疗方式、癌栓分型与患者术后生存时间有关(均P<0.05)(表2)。AFP≤400 ng/mL、肿瘤直径≤10 cm、术后行TACE+PVC双化疗、Ⅰ型癌栓的患者预后较好。多因素分析显示,AFP水平、肿瘤大小、术后治疗方式、癌栓分型是患者术后生存时间的独立影响因素(均P<0.05)(表3)。
2.4 不良反应及并发症
6 例术后出现肝衰竭,3 例在化疗后出现骨髓抑制,11 例出现转氨酶升高,56 例出现恶心呕吐等消化道反应。4 例出现与化疗泵相关的并发症,两组之间并发症发生率无统计学意义(均P>0.05)(表4)。
表2 患者预后影响因素的单因素分析
Table 2 Univariate analysis of factors for prognosis of the patients
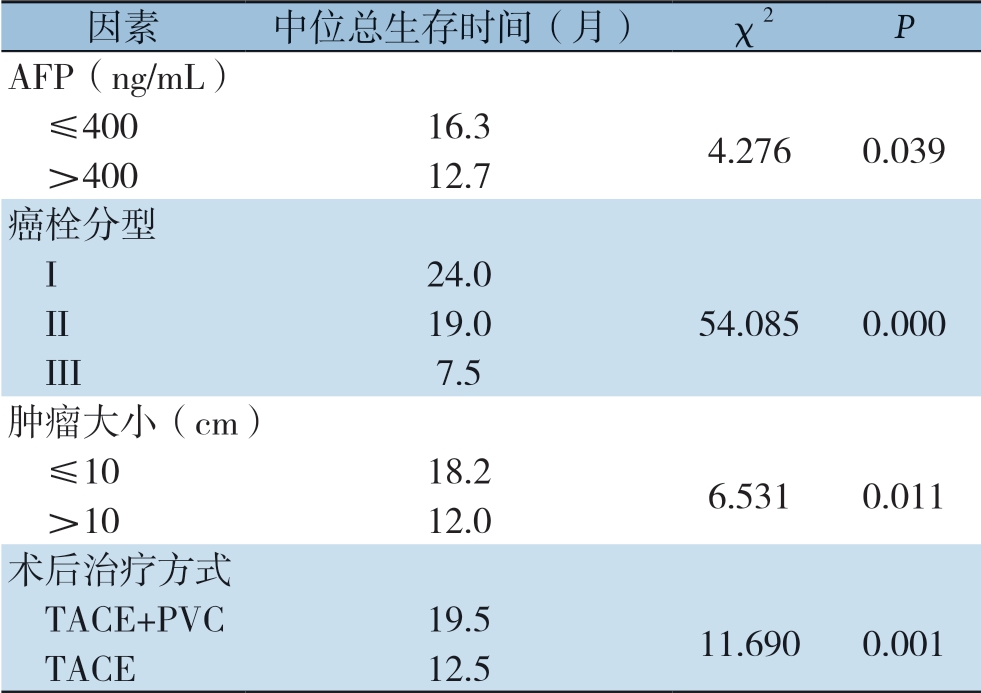
因素 中位总生存时间(月) χ2 P AFP(ng/mL) ≤400 16.3 4.276 0.039 >400 12.7癌栓分型 I 24.0 II 19.0 54.085 0.000 III 7.5肿瘤大小(cm) ≤10 18.2 6.531 0.011 >10 12.0术后治疗方式 TACE+PVC 19.5 11.690 0.001 TACE 12.5
表3 患者预后影响因素的多因素分析
Table 3 Multivariate analysis of factors for prognosis of the patients
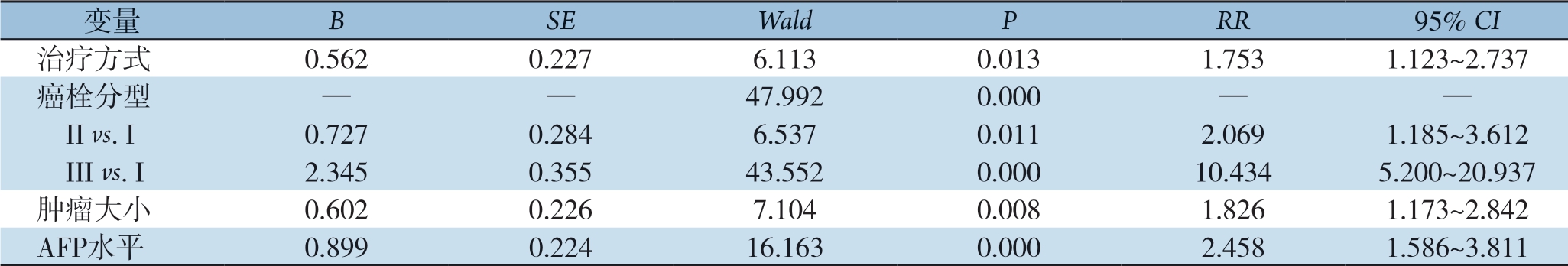
变量 B SE Wald P RR 95% CI治疗方式 0.562 0.227 6.113 0.013 1.753 1.123~2.737癌栓分型 — — 47.992 0.000 — — II vs. I 0.727 0.284 6.537 0.011 2.069 1.185~3.612 III vs. I 2.345 0.355 43.552 0.000 10.434 5.200~20.937肿瘤大小 0.602 0.226 7.104 0.008 1.826 1.173~2.842 AFP水平 0.899 0.224 16.163 0.000 2.458 1.586~3.811
表4 两组患者术后并发症情况[n(%)]
Table 4 The postoperative complications of the two groups of patients [n (%)]
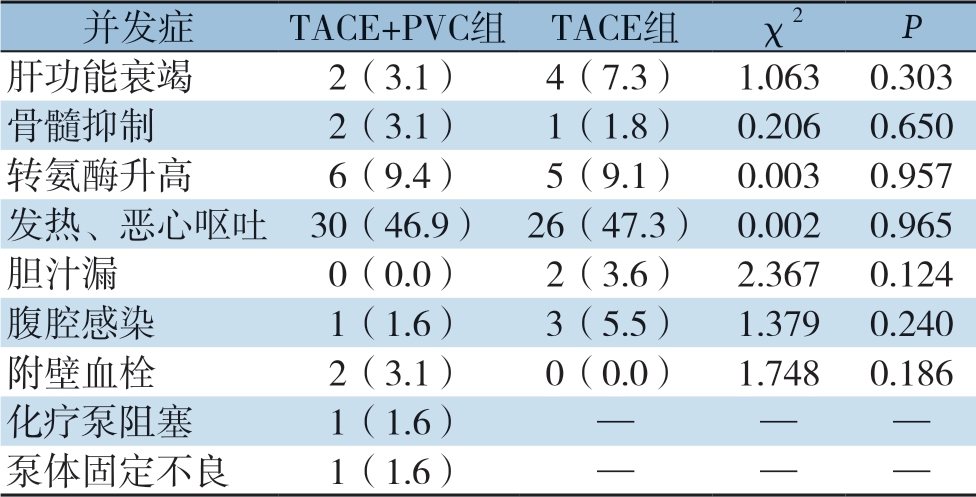
并发症 TACE+PVC组 TACE组 χ2 P肝功能衰竭 2(3.1) 4(7.3) 1.063 0.303骨髓抑制 2(3.1) 1(1.8) 0.206 0.650转氨酶升高 6(9.4) 5(9.1) 0.003 0.957发热、恶心呕吐 30(46.9) 26(47.3) 0.002 0.965胆汁漏 0(0.0) 2(3.6) 2.367 0.124腹腔感染 1(1.6) 3(5.5) 1.379 0.240附壁血栓 2(3.1) 0(0.0) 1.748 0.186化疗泵阻塞 1(1.6) — — —泵体固定不良 1(1.6) — — —
3 讨 论
PVTT一旦形成,其侵入到门静脉分叉或主干,阻塞血管,引起门静脉高压,从而出现腹水、上消化道出血,肝功能持续恶化甚至肝衰竭等严重并发症。另一方面,癌栓随通过门静脉播散,引起肝内外转移[8]。一旦出现PVTT,标志着患者已处于病程晚期,PVTT也成为制约原发性肝癌患者降低术后复发率及病死率的瓶颈。如果不采取治疗措施,其自然生存期仅2.7个月[9]。
目前国际上对PVTT的治疗尚未达成共识,欧美的BCLC指南中以靶向治疗或全身系统治疗作为主要治疗策略[10]。而包括我国在内的东南亚国家则强调以手术为主的综合治疗[11-12]。陈孝平等[13]报道,手术切除治疗肝癌合并PVTT的1、2、3、5年生存率分别为52.1%、33.1%、16.0%、11.8%,显著延长了患者的预后,随着外科技术的不断发展,肝癌手术切除率在提高[14]。然而,单纯手术切除的远期生存率并不尽如人意,术后复发是制约手术切除远期疗效的“瓶颈”。
研究[15]显示肿瘤组织接受肝动脉和门静脉的双重血供,肿瘤中心由肝动脉供血,肿瘤周边及纤维薄膜、包膜外浸润的癌组织、子病灶、PVTT等由门静脉供血。当行TACE栓塞肝动脉后,可减少肿瘤组织血液供应,使肿瘤缺血坏死,同时也对癌栓有效,却不会影响正常肝组织的血供[16]。故术后行TACE治疗能灭活残留癌细胞,阻断新生瘤体的血液供应,从而降低术后复发率[17-18]。而肿瘤周边才是肿瘤生长最为活跃的部分。单纯行TACE只是阻断了肝动脉血供,且由于肝动脉被栓塞,门静脉血流量代偿性增加,门静脉血通过吻合支成为肿瘤的主要血供。因此,单纯行TACE并不能很好地抑制肿瘤术后复发。而联合门静脉灌注化疗,不仅能完全阻断肝癌血供,使癌灶完全缺血坏死,还能最大程度地杀伤门静脉内可能残存的少量肿瘤病灶或癌细胞,降低癌细胞经门静脉系统播散的几率[19-21],从而更有效地抑制肿瘤复发和转移,延长患者生存时间。
为了探究术后辅助TACE联合PVC的有效性及安全性。笔者对本中心119例肝癌合并PVTT患者的临床资料及随访信息进行了回顾性分析。无瘤生存期方面,术后TACE+PVC组的中位无瘤生存期及术后0.5、1、2、3年无瘤生存率均高于TACE组。一项含有112例肝癌合并PVTT患者的随机对照试验显示[14],术后TACE+PVC双化疗与术后单纯TACE相比,其术后1、3、5年无瘤生存率分别为74.4% vs. 62.3%、46.1% vs. 23.7%、11.5% vs. 4%,与本研究所得结论相符。表明术后TACE联合P V C 能有效抑制肿瘤复发和转移。其术后1、 3年无瘤生存率均显著高于本研究,可能与TACE及PVC方案及剂量有关。
总体生存期方面,TACE+PVC组的中位总体生存期及术后总体生存率均高于术后TACE组。杨庆岩[22]对80例肝癌术后复发,再次行手术切除的患者术后行PVC与术后未行PVC进行对比,结果显示术后化疗组6 个月及1年复发率为7.5%、22.5%,明显低于未化疗组的25.0%、45.0%,而生存率为9 2.5%、8 5.0%,高于未化疗组的77.5%、65.0%。吴力群等[23]进行相似研究发现PVC组1、3、5年生存率分别是84.2%、42.1%、31.6%;非PVC组分别是71.4%、28.6%、14.3%。郑盛等[24]等对87例经手术切除的肝癌合并PVTT患者资料进行分析,结果显示,术后行TACE+PVC联合化疗与术后单纯行TACE的0.5、1、2、3年无瘤生存率分别为93.5% vs. 83.3%、80.6% vs. 70.0%、41.9% vs. 16.7%、29.0% vs. 3.3%,术后0.5、1、2、3年总体生存率分别为96.8% vs. 93.3%、87.1% vs. 76.7%、54.8% vs. 30.0%、46.2% vs. 20.0%。本研究结果也验证了以上结论。而半年生存率方面,两组相差不大,可能是由于III型PVTT预后较差,术后生存率较低,而Ⅰ型及Ⅱ型癌栓患者,术后生存率较高,术后辅助性TACE及PVC对其疗效较好[11, 25-26],因此半年之后的累积生存率,TACE+PVC组明显高于单独TACE组。
通过术中置入门静脉化疗泵,术后根据患者复查情况通过门静脉化疗泵进行灌注化疗。经皮下埋置式门静脉化疗泵,具有创伤较小,操作方便,肿瘤局部药物浓度高[27],减少了全身毒副反应,可在门诊完成注药,患者依从性好、护理简单等优点[28-30]。本组患者恶心呕吐等消化道反应常见,与注射的化疗药物有密切关系。术后肝衰竭、骨髓抑制、转氨酶升高等并发症经过积极治疗,均在短期内恢复正常。化疗泵堵塞,可通过定期(1~2周)用稀释的肝素钠冲管进行预防。
综上所述,对于肝癌合并PVTT患者,术后定期对患者进行复查,辅以肝动脉及门静脉双途径化疗,对肝癌进行多手段综合治疗,可以有效降低术后复发率,延长患者术后生存时间,是一种安全有效的治疗方式。本研究属于单中心回顾性研究,样本量较少,随访时间偏短,所得结论代表性尚不充足,尚需大样本、前瞻性随机对照研究来验证。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108. doi: 10.3322/caac.21262.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132. doi: 10.3322/caac.21338.
[3] Zhang ZM, Lai EC, Zhang C, et al. The strategies for treating primary hepatocellular carcinoma with portal vein tumor thrombus[J]. Int J Surg, 2015, 20:8-16. doi: 10.1016/j.ijsu.2015.05.009.
[4] Yang T, Lin C, Zhai J, et al. Surgical resection for advanced hepatocellular carcinoma according to Barcelona Clinic Liver Cancer (BCLC) staging[J]. J Cancer Res Clin Oncol, 2012, 138(7):1121-1129. doi: 10.1007/s00432-012-1188-0.
[5] Luo J, Guo RP, Lai EC, et al. Transarterial chemoembolization for unresectable hepatocellular carcinoma with portal vein tumor thrombosis: a prospective comparative study [J]. Ann Surg Oncol, 2011, 18(2):413-420. doi: 10.1245/s10434-010-1321-8.
[6] Shuqun C, Mengchao W, Han C, et al. Tumor thrombus types influence the prognosis of hepatocellular carcinoma with the tumor thrombi in the portal vein[J]. Hepatogastroenterology, 2007, 54(74):499-502.
[7] 杜锡林, 谭凯, 阴继凯, 等. 肝切除、肝动脉化疗栓塞、微波固化联合门静脉化疗对巨块型肝细胞癌的疗效分析[J]. 中华肝胆外科杂志, 2015, 21(12):853-854. doi:10.3760/cma.j.issn.1007-8118.2015.12.018. Du XL, Tan K, Yin JK, et al. Efficacy analysis of hepatectomy, transarterial chemoembolization, and microwave coagulation plus portal vein chemotherapy in treatment of huge hepatocellular carcinoma[J]. Chinese Journal of Hepatobiliary Surgery, 2015, 21(12):853-854. doi:10.3760/cma.j.issn.1007-8118.2015.12.018.
[8] Ye JZ, Wang YY, Bai T, et al. Surgical resection for hepatocellular carcinoma with portal vein tumor thrombus in the Asia-Pacific region beyond the Barcelona Clinic Liver Cancer treatment algorithms: a review and update[J]. Oncotarget, 2017, 8(54):93258-93278. doi: 10.18632/oncotarget.18735.
[9] 孙居仙, 石洁, 程树群. 肝癌合并门静脉癌栓诊治难点及对策[J]. 中国实用外科杂志, 2016, 36(6):614-617. 10.7504/CJPS.ISSN1005-2208.2016.06.07. Sun JX, Shi J, Cheng SQ. Difficulties and countermeasures of diagnosis and treatment for hepatocellular carcinoma with portal venous tumor thrombus[J]. Chinese Journal of Practical Surgery, 2016, 36(6):614-617. 10.7504/CJPS.ISSN1005-2208.2016.06.07.
[10] Forner A, Reig M, Bruix J. Hepatocellular carcinoma [J]. Lancet, 2018, 391(10127):1301-1314. doi: 10.1016/S0140-6736(18)30010-2.
[11] 中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范 (2017年版)[J]. 中华肝脏病杂志, 2017, 25(12):886-895. doi:10.3760/cma.j.issn.1007-3418.2017.12.002. Bureau of Medical Administration, National Health and Family Planning Committee. Diagnosis, management, and treatment of hepatocellular carcinoma (V2017)[J]. Chinese Journal of Hepatology, 2017, 25(12):886-895. doi: 10.3760/cma.j.issn.1007-3418.2017.12.002.
[12] 代柏树, 杨振宇, 杜锡林,等. 肝细胞癌合并门静脉癌栓的治疗进展[J]. 现代肿瘤医学, 2018, 26(10):1619-1623. doi:10.3969/j.issn.1672-4992.2018.10.036. Dai BS, Yang ZY, Du XL, et al. Recent advances on the treatment of hepatocellular carcinoma with portal vein tumor thrombus[J] Journal of Modern Oncology, 2018, 26(10):1619-1623. doi: 10.3969/j.issn.1672-4992.2018.10.036.
[13] Chen XP, Qiu FZ, Wu ZD, et al. Effects of location and extension of portal vein tumor thrombus on long-term outcomes of surgical treatment for hepatocellular carcinoma[J]. Ann Surg Oncol, 2006, 13(7):940-946. doi: 10.1245/ASO.2006.08.007.
[14] Li Q, Wang J, Sun Y, et al. Efficacy of postoperative transarterial chemoembolization and portal vein chemotherapy for patients with hepatocellular carcinoma complicated by portal vein tumor thrombosis--a randomized study[J]. World J Surg, 2006, 30(11):2004-2011. doi: 10.1007/s00268-006-0271-6.
[15] 童颖, 杨甲梅. 原发性肝癌的门静脉化疗进展[J]. 中国实用外科杂志, 2005, 25(2):116-118. Tong Y, Yang JM. Advances in portal vein chemotherapy for primary liver cancer[J]. Chinese Journal of Practical Surgery, 2005, 25(2):116-118.
[16] 江海中, 邓新, 钟永富. 肝癌合并门静脉癌栓的TACE治疗[J]. 中国普通外科杂志, 2015, 24(1):116-120. doi:10.3978/j.issn.1005- 6947.2015.01.022. Jiang HZ, Deng X, Zhong YF, et al. TACE treatment for liver cancer with portal vein tumor thrombus[J]. Chinese Journal of General Surgery, 2015, 24(1):116-120. doi:10.3978/j.issn.1005-6947.2015.01.022.
[17] 吴晓健, 罗放, 王济明, 等. 肝癌术后TACE的抗复发作用[J]. 激光杂志, 2011, 32(4):58-60. doi:10.3969/j.issn.0253-2743. 2011.04.033. Wu XJ, Luo F, Wang JM, et al. The effect and utilization of TACE on intrahepatic recurrence after hepatic resection for hepatocellular carcinoma[J]. Laser Journal, 2011, 32(4):58-60. doi:10.3969/j.issn.0253-2743.2011.04.033.
[18] Jiang JF, Lao YC, Yuan BH, et al. Treatment of hepatocellular carcinoma with portal vein tumor thrombus: advances and challenges [J]. Oncotarget, 2017, 8(20):33911-33921. doi: 10.18632/oncotarget.15411.
[19] 庄建彬, 王毅军, 杜智, 等. 肝动脉插管化疗栓塞联合门静脉化疗对肝细胞癌患者术后生存期的影响[J]. 中华肝胆外科杂志, 2010, 16(8):579-581. doi:10.3760/cma.j.issn.1007-8118.2010.08.007. Zhuang JB, Wang YJ, Du Z, et al. Effects of transcatheter arterial chemoembolization in combination with portal vein chemotherapy on survival of patients after resection of hepatocellular carcinoma[J] Chinese Journal of Hepatobiliary Surgery, 2010, 16(8):579-581. doi:10.3760/cma.j.issn.1007-8118.2010.08.007.
[20] 吕昕亮, 张坤, 朱锦德, 等. 门静脉化疗栓塞预防肝癌切除术后复发的临床分析[J]. 中华肝胆外科杂志, 2012, 18(1):15-18. doi:10.3760/cma.j.issn.1007-8118.2012.01.005. Lu XL, Zhang K, Zhu JD, et al. Adjuvant portal vein chemoembolization in partial hepatectomy for hepatocellular carcinoma[J] Chinese Journal of Hepatobiliary Surgery, 2012, 18(1):15-18. doi:10.3760/cma.j.issn.1007-8118.2012.01.005.
[21] 李成军, 鲁守堂. 再次手术切除辅以门静脉化疗治疗肝癌术后复发[J]. 中国普通外科杂志, 2015, 24(1):136-139. doi:10.3978/j.issn.1005-6947.2015.01.027. Li CJ, Lu ST. Repeat surgical resection and adjuvant portal vein chemotherapy for postoperative recurrent hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2015, 24(1):136-139. doi:10.3978/j.issn.1005-6947.2015.01.027.
[22] 杨庆岩. 对肝癌术后复发患者采用不同治疗方案的效果比较[J]. 中国普通外科杂志, 2014, 23(7):1002-1004. doi:10.7659/j.issn. 1005-6947.2014.07.030. Yang QY. Results of different therapeutic methods for postoperative recurrence of hepatic cancer[J] Chinese Journal of General Surgery, 2014, 23(7):1002-1004. doi:10.7659/j.issn.1005-6947.2014.07.030.
[23] 吴力群, 王祖森, 胡维昱, 等. 528例原发性肝细胞癌患者肝切除术后1年生存分析[j]. 中华普通外科杂志, 2012, 27(2):92-95. doi:10.3760/cma.j.issn.1007-631X.2012.02.002. Wu LQ, Wang ZS, Hu WY, et al. Analysis on factors influencing one-year-survival of hepatocellular carcinoma patients after hepatectomy[J] Zhong Hua Pu Tong Wai Ke Za Zhi, 2012, 27(2):92-95. doi:10.3760/cma.j.issn.1007-631X.2012.02.002.
[24] 郑盛, 唐映梅, 尤丽英, 等. 双途径化疗治疗肝癌并发门静脉癌栓患者对预后的影响[J]. 实用肝脏病杂志, 2013, 16(4):351-353. doi:10.3969/j.issn.1672-5069.2013.04.021. Zheng S, Tang YM, You LY, et al. A three year-followed up of patients with hepatocellular carcinoma complicated by portal vein tumor ;thrombus receiving TACE and PVC after resection of tumors[J] Journal of Clinical Hepatology, 2013, 16(4):351-353. doi:10.3969/j.issn.1672-5069.2013.04.021.
[25] 荚卫东, 刘文斌. 《肝细胞癌合并门静脉癌栓多学科诊治中国专家共识(2016年版)》解读[J]. 中国普通外科杂志, 2017, 26(7):815-820. doi:10.3978/j.issn.1005-6947.2017.07.001. Jia WD, Liu WB. Interpretation of Chinese Expert Consensus on Multidisciplinary Diagnosis and Treatment of Hepatocellular Carcinoma with Portal Vein Tumor Thrombus (2016 edition)[J]. Chinese Journal of General Surgery, 2017, 26(7):815-820. doi:10.3978/j.issn.1005-6947.2017.07.001.
[26] Fan J, Zhou J, Wu ZQ, et al. Efficacy of different treatment strategies for hepatocellular carcinoma with portal vein tumor thrombosis[J]. World J Gastroenterol, 2005, 11(8):1215-1219.
[27] 廖旺军, 石敏, 郑航, 等. 经皮化疗泵植入门静脉化疗治疗结直肠癌肝转移的临床观察[J]. 南方医科大学学报, 2008, 28(2):282-283. doi:10.3321/j.issn:1673-4254.2008.02.040. Liao WJ, Shi M, Zheng H, et al. Effect of percutaneous chemotherapy pump placement for portal vein chemotherapy on hepatic metastasis of colorectal cancer[J]. Journal of Southern Medical University, 2008, 28(2):282-283. doi:10.3321/j.issn:1673-4254.2008.02.040.
[28] 石好岭, 庞志刚, 尚闯. 门静脉泵灌注化疗预防肝癌术后复发的作用[J]. 肿瘤基础与临床, 2011, 24(1):23-24. doi:10.3969/j.issn.1673-5412.2011.01.010. Shi HL, Pang ZG, Shang C. The Preventive Effect of Portal Vein Chemotherapy on Postoperative Recurrence of Hepatocellular Carcinoma[J]. Journal of Basic and Clinical Oncology, 2011, 24(1):23-24. doi:10.3969/j.issn.1673-5412.2011.01.010.
[29] Li JQ, Zhang YQ, Zhang WZ, et al. Randomized study of chemoembolization as an adjuvant therapy for primary liver carcinoma after hepatectomy[J]. J Cancer Res Clin Oncol, 1995, 121(6):364-366.
[30] Shi M, Zhang CQ, Zhang YQ, et al. Micrometastases of solitary hepatocellular carcinoma and appropriate resection margin[J]. World J Surg, 2004, 28(4):376-381. doi: 10.1007/s00268-003-7308-x.
