乳腺肿瘤是全球妇女中最常见的肿瘤,尽管高收入国家的病死率趋势在下降,但低收入和中等收入国家的病死率趋势在上升[1-2]。根据乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)分类标准,BI-RADS 4类乳腺肿块的恶性危险性为3%~94%,良恶性重叠比例较高,因此对BI-RADS 4类乳腺肿块进行良恶性鉴别诊断为目前研究热点,且具有显著的临床应用价值[3]。目前乳腺癌的诊断方法包括超声弹性成像、X 线钼靶与超声引导下穿刺活检等。本研究旨在比较超声弹性成像、X 线钼靶与超声引导下穿刺活检在BI-RADS 4类乳腺肿块鉴别诊断中的价值,以便采用更完善的方式早期筛查出乳腺癌患者,并进行及时治疗,以期改善乳腺癌患者的预后。
1 资料与方法
1.1 一般资料
选择2016年8月—2018年2月因乳腺肿块在我院就诊的82例女性患者,共计84个病灶,患者年龄18~65岁,平均(48.3±10.6)岁。纳入标准:⑴ 乳腺触诊均提示有乳腺占位性病变;⑵ 患者均行超声弹性成像、X 线钼靶与超声引导下穿刺活检检查;⑶ 各项检查均于术前、月经后1~2周进行;⑷ 术前未行治疗;⑸ 均经手术病理证实。排除标准:⑴ 严重心功能不全者;⑵ 重度肾功能不全者;⑶ 临床资料不完全者。
以手术后病理结果为诊断金标准,良性组36例患者中共计36个病灶,年龄(47.3±9.9)岁,肿块直径0.6~3.4 cm;恶性组48例患者中共计50个病灶,年龄(54.1±12.4)岁,肿块最大直径0.7~3.9 cm。
所有患者均对本研究知情,且签署知情同意书。
1.2 检查方法
1.2.1 弹性成像检查 嘱患者仰卧于超声检查设备,依照患者主诉肿块部位及临床触诊的肿块位置,先行常规乳腺超声检查确定病灶的大小、形态、边界、内部回声、后方有无衰减等情况;再使用彩色多普勒检查病灶附近的血流信号和血流阻力指数;最后切换至弹性成像模式,探头尽可能显示肿块的最大切面,病灶尽量调至取样框的中心位置,依据弹性成像的硬度分级对病灶进行评分:1~3分为良性病变;4~5分为恶性病变[4-5]。
1.2.2 X 线钼靶 患者取站姿,将双侧乳房置于靶机照射范围内,常规拍摄双侧乳腺的轴位(CC)及侧斜位(MLO)片,依据初诊结果确定是否行腋区或切线方向的检查。记录肿块的位置、形态、大小、钙化情况、边缘类型,辨识有无血管异常,观察淋巴结的肿大情况,辨别病灶的类型[6]。主要根据肿块的大小、密度、边缘形态、内部钙化等来诊断乳腺肿块的性质,同时综合腺体结构变化进行分析[7]。
1.2.3 超声引导下穿刺活检 患者仰卧位,观察乳腺肿物的部位、大小、形态、边界等,确定病灶的穿刺点和进针路径。以穿刺点为中心对皮肤行常规消毒,局麻后在超声引导下实时观察针尖位置,确定活检长度后,击发活检枪,并迅速拔针,取出标本组织。每个病灶取3~5针,将其放入10%福尔马林液的小瓶内固定,行病理组织学检查[8]。
1.3 评价指标
分析超声弹性成像、X 线钼靶与超声引导下穿刺活检检测方法对乳腺良恶性肿块的诊断效能,具体指标包括敏感性、特异性、准确性、阳性预测值、阴性预测值、漏诊率和误诊率。
1.4 统计学处理
采用SPSS 20.0对本研究所得数据进行统计分析,计数资料采用率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 乳腺病灶的病理结果
在84个病灶中,良性36例,恶性48例。具体病理类型见表1。
表1 84个乳腺病灶的病理结果
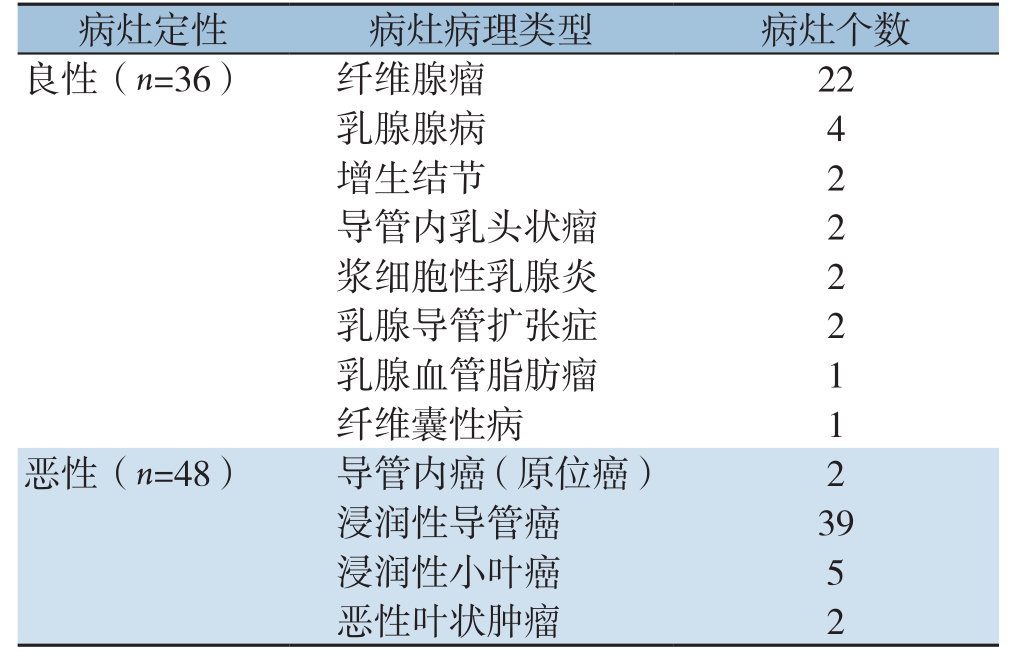
病灶定性 病灶病理类型 病灶个数良性(n=36) 纤维腺瘤 22乳腺腺病 4增生结节 2导管内乳头状瘤 2浆细胞性乳腺炎 2乳腺导管扩张症 2乳腺血管脂肪瘤 1纤维囊性病 1恶性(n=48) 导管内癌(原位癌) 2浸润性导管癌 39浸润性小叶癌 5恶性叶状肿瘤 2
2.2 超声弹性成像与病理结果对比分析
超声检查多表现为内部低回声的圆形、椭圆形肿块、中央存在或不存在沙砾样的钙化结节影,边缘清晰或不清。采用超声弹性成像诊断发现,良性36例,其中34例诊断正确,2例诊断错误,1例为纤维腺瘤,1例为导管内乳头状瘤;恶性48例,其中46例诊断正确,2例诊断错误,其硬度分级均为3分,组织内部出现液化,1例为浸润性小叶癌,1例为浸润性导管癌。超声弹性成像的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值、漏诊率、误诊率分别为95.8%(46/48)、94.4%(34/36)、95.2%(80/84)、95.8%(46/48)、94.4%(34/36)、4.17%(2/48)、5.56%(2/36)(表2-3)。
2.3 X 线钼靶与病理结果对比分析
X 射线钼靶检查影像学特征主要为片状致密影、结节状影及钙化影等。X线钼靶诊断发现,良性36例,其中32例诊断正确,4例诊断错误,3个为纤维腺瘤合并钙化,1个为导管内乳头状瘤;恶性48例,其中44例诊断正确,4例诊断错误,2例为浸润性小叶癌,2例为浸润性导管癌。可见,X 线钼靶的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值、漏诊率、误诊率分别为91.7%(44/48)、88.9%(32/36)、90.5%(76/84)、91.7%(44/48)、88.9%(32/36)、8.33%(4/48)、11.1%(4/36)(表2-3)。
2.4 超声引导下穿刺活检与病理结果对比分析
83个病灶均一次性获得病变组织,并实现病理诊断,其中有1例穿刺到病灶的坏死物,被诊断为炎症,经第2次穿刺成功获取病变组织,并最终病理诊断为浸润性小叶癌。穿刺成功率为100.0%(84/84),取材满意度为98.8%(83/84)。所有患者均未出现并发症(如感染或气胸等)。超声引导下穿刺活检的诊断敏感性、特异性、准确性、阳性预测值、阴性预测值、漏诊率、误诊率分别为97.9%(47/48)、100.0%(36/36)、98.8%(83/84)、100.0%(47/47)、97.3%(36/37)、2.08%(1/48)、0.00%(0/36)(表2-3)。
表2 超声弹性成像、X 线钼靶与超声引导下穿刺活检与病理结果对比
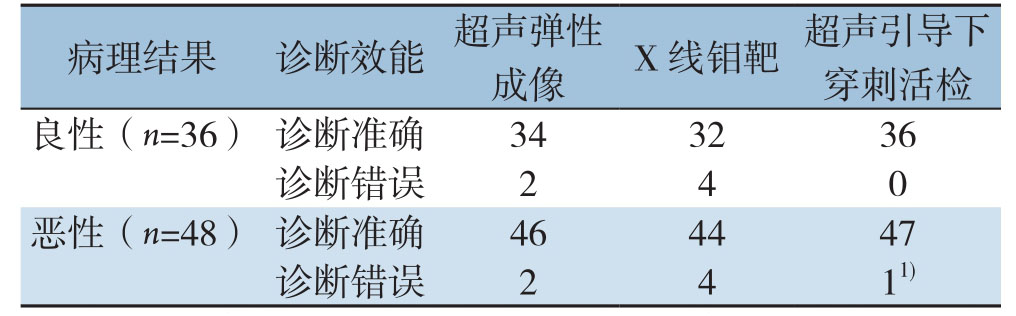
注:1) 1例首次诊断为炎症病灶,经第2次穿刺后证实组织病理为恶性
病理结果 诊断效能 超声弹性成像 X 线钼靶 超声引导下穿刺活检良性(n=36) 诊断准确 34 32 36诊断错误 2 4 0恶性(n=48) 诊断准确 46 44 47诊断错误 2 4 11)
表3 超声弹性成像、X 线钼靶与超声引导下穿刺活检在BI-RADS4类乳腺肿块鉴别诊断效能对比(%)
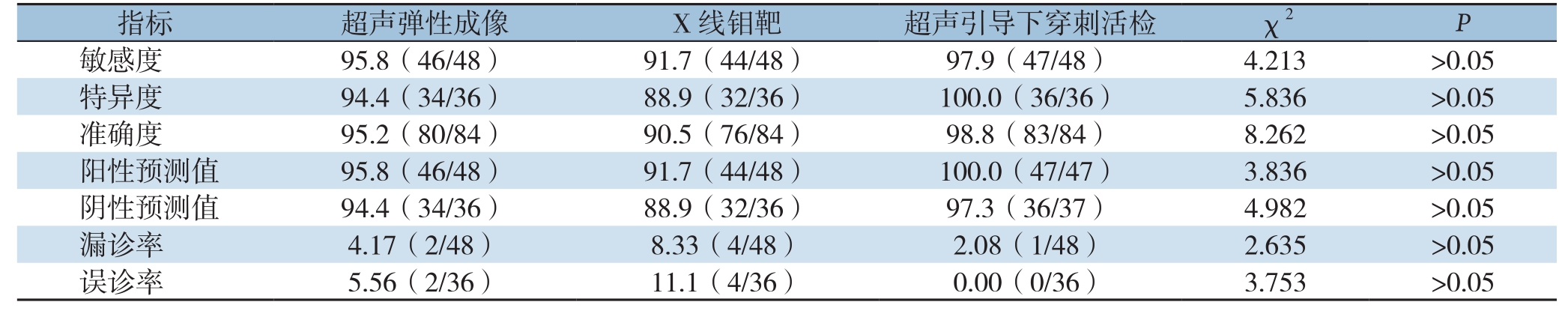
指标 超声弹性成像 X 线钼靶 超声引导下穿刺活检 χ2 P敏感度 95.8(46/48) 91.7(44/48) 97.9(47/48) 4.213 >0.05特异度 94.4(34/36) 88.9(32/36) 100.0(36/36) 5.836 >0.05准确度 95.2(80/84) 90.5(76/84) 98.8(83/84) 8.262 >0.05阳性预测值 95.8(46/48) 91.7(44/48) 100.0(47/47) 3.836 >0.05阴性预测值 94.4(34/36) 88.9(32/36) 97.3(36/37) 4.982 >0.05漏诊率 4.17(2/48) 8.33(4/48) 2.08(1/48) 2.635 >0.05误诊率 5.56(2/36) 11.1(4/36) 0.00(0/36) 3.753 >0.05
2.5 超声弹性成像、X 线钼靶与超声引导下穿刺活检对BI-RADS 4类乳腺肿块鉴别诊断效能对比分析
各项检测方法对BI-RADS 4类乳腺肿块鉴别诊断效能的具体数据见表3。超声引导下穿刺活检对乳腺病灶定性诊断的数值方面有一定优势,但三项检测方式的敏感度、特异度、准确度等差异均无统计学意义(P>0.05)。
3 讨 论
每年大约有167万新诊断乳腺癌病例。乳腺癌的发病率在高收入国家最高,但在低收入和中等收入国家一直在上升[9]。全球乳腺癌研究是一项具有挑战性的工作,因为全球不同地区存在显著的差异和极其异质的现实[10]。依据美国放射学会提出BI-RADS分级标准,IV级为可疑恶性,出现1~2项典型的恶性改变特征,4A恶性程度:2%~10%;4B恶性程度:11%~50%;4C恶性程度:51%~94%;建议活检。BI-RADS 4类乳腺肿块的良恶性重叠率较高,因此对该类患者进行无创或有创检查以明确诊断,有着积极的临床意义。本研究回顾性分析于我院治疗的82例84个乳腺病灶的术前超声弹性成像、X 线钼靶与超声引导下穿刺活检结果,以探寻更完备的乳腺肿块良恶性的鉴别诊断技术。
3.1 超声弹性成像
该技术日益成熟,通过不同组织间弹性系数差异对病变进行定性诊断,在乳腺癌的良恶性鉴别诊断中具有临床应用价值[11]。其优势为:操作简单、无创,较传统超声及彩色多普勒成像而言对恶性肿瘤具有较高的敏感性,且不受体位及腺体组织密度的影响,缺点为仅能单侧成像,不能同时对双侧乳腺情况进行对比[12]。在本研究采用超声弹性成像的鉴别诊断中,有4例诊断错误,其中2例(1例为纤维腺瘤,1例为导管内乳头状瘤)由于伴发钙化、玻璃样变或间质细胞丰富或导管上皮增生明显等导致弹性级别较高误诊为恶性,2例(1例为浸润性小叶癌,1例为浸润性导管癌)由于病灶内出现坏死或病灶本身弹性尚可而误诊为良性,由此可见单独使用弹性分级来区分良恶性存在一定的偏颇。其劣势为:有些病变硬度系数可能存在重叠情况,易出现假阴性或假阳性结果。有研究[13]显示,对于肿块内散在的、微小的钙化灶,由于超声检查回声信号较小,受到腺体内部高回声结构的影响,或与周边组织超声信号对比不足,使超声对其检出率低于X线钼靶。
3.2 X线钼靶
该技术可观察病灶大小、形态、位置、数量、边缘及腋窝淋巴结情况[14-15]。其优势[16]为:⑴ 易于发现微小钙化灶;⑵ 可同时对双侧乳房的腺体结构、淋巴结大小和形态进行比对。行乳腺摄像时,乳房会受到挤压或展平,常与其他组织重叠,从而引起影像学显示结构不良或边界模糊,可能增加误诊几率[17-18]。在本研究采用X 线钼靶的鉴别诊断中,有8例诊断错误,其中4例(3个为纤维腺瘤合并钙化,1个为导管内乳头状瘤)由于出现钙化及组织重叠致边界模糊误诊为恶性,4例(2例为浸润性小叶癌,2例为浸润性导管癌)由于腺体高密度且边界显示欠佳等而误诊为良性。其劣势为:由于乳腺和其他组织的重叠以及X线对于高致密腺体的穿透力下降,甚至受检查体位或其他组织影响均会使影像结果出现偏差。
3.3 超声引导下穿刺活检
伴随影像学技术日新月异的发展和完善,多数诊断不明的乳腺病灶都可经过超声或X线钼靶得以明确诊断,但仍有少数可疑的乳腺恶性病变成像不清,或与临床症状间差异较大,需要活检来明确诊断[19]。其优势为[20-24]:⑴ 患者可在仰卧位等多个体位接受活检,操作简便;⑵ 可实时监测与引导,显示进针途径、部位,随时根据具体情况对进针方向进行认真调整,使针尖准确抵达病灶,并进行取样;⑶ 对乳腺各区域的肿块均可行超声定位;⑷ 根据病理可对良、恶性肿瘤行鉴别诊断,为制定手术方案提供切实可靠的依据,有替代术中快速活检的潜力,可有效缩短手术时间;⑸ 取样量较为充足,可满足病理切片诊断;⑹ 创伤小,术后无瘢痕或瘢痕很小。本组中所有病灶均穿刺成功,其中有1例首次穿刺到病灶的坏死物,被病理诊断为炎症,经第2次穿刺成功获取病变组织,并最终病理诊断为浸润性小叶癌。其劣势为:有一定的创伤性。
3.4 三种检测方法诊断效能对比
本研究结果显示,在84个BI-RADS4类乳腺肿块病灶中,恶性48例,良性36例。超声弹性成像的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值、漏诊率、误诊率分别为95.8%(46/48)、94.4%(34/36)、95.2%(80/84)、95.8%(46/48)、94.4%(34/36)、4.17%(2/48)、5.56%(2/36)。X 线钼靶分别为91.7%(44/48)、88.9%(32/36)、90.5%(76/84)、91.7%(44/48)、88.9%(32/36)、8.33%(4/48)、11.1%(4/36)。超声引导下穿刺活检分别为97.9%(47/48)、100.0%(36/36)、98.8%(83/84)、100.0%(47/47)、97.3%(36/37)、2.08%(1/48)、0.00%(0/36)。三种检测方式的诊断效能差异均无统计学意义(均P>0.05),但超声引导下穿刺活检对乳腺病灶定性诊断具有相对优势,其次为超声弹性成像,X线钼靶在微小钙化灶的检出中优势明显,但超声引导下穿刺活检为有创检查,应慎重采用。我们的前期研究[25-27]对70例乳腺肿块患者进行分析,证实了超声弹性成像在乳腺肿块诊断中有较好的应用价值;有研究[28-29]提示钼靶X线与超声联合定位对病灶定位准确、手术方法合理、切除标本小,并能提供病灶在标本中的精确位置进行病理检查;还有文献[30]报道,对于疑难乳腺肿块行左乳腺空芯针穿刺活检术,穿刺病理提示浸润性癌,结合免疫组化考虑浸润性导管癌行左侧乳腺癌改良根治术后患者恢复良好。可见超声引导下穿刺活检对乳腺肿块性质的判断有绝对优势[31-32],但有研究[33]发现,核心针活检(core needle biopsy,CNB)虽然可用于早期乳腺癌的诊断,但可能增加肿瘤细胞远处转移的风险。因此要谨慎采用有创性检查手段,以防止穿刺活检增加肿瘤复发或转移潜能。既往研究[23]发现超声引导穿刺活检诊断乳腺良恶性病灶的敏感度为94.4%(17/18)、特异度为100.0%(12/12)、准确率为96.7%(29/30);声弹性成像诊断乳腺良恶性病灶的敏感度为88.9%(16/18)、特异度为83.3%(10/12)、准确率为86.7%(26/30),与本研究结果基本一致,本研究样本量更大,且对比了三种检测方法的诊断效能和特点,更客观地诠释三种检查手段的利弊,对乳腺良恶性病灶的鉴别诊断均具有一定的诊断价值,临床应根据具体情况,采用合理的个性化检测手段。
[1]Pace LE,Shulman LN.Breast Cancer in Sub-Saharan Africa:Challenges and Opportunities to Reduce Mortality[J].Oncologist,2016,21(6):739-744.doi: 10.1634/theoncologist.2015-0429.
[2]Barrios CH,Reinert T,Werutsky G.Global Breast Cancer Research:Moving Forward[J].Am Soc Clin Oncol Educ Book,2018,(38):441-450.doi: 10.1200/EDBK_209183.
[3]Chaiwerawattana A,Thanasitthichai S,Boonlikit S,et al.Clinical outcome of breast cancer BI-RADS 4 lesions during 2003-2008 in the National Cancer Institute Thailand[J].Asian Pac J Cancer Prev,2012,13(8):4063-4066.
[4]Carlsen J,Ewertsen C,Sletting S,et al.Ultrasound elastography in breast cancer diagnosis[J].Ultraschall Med,2015,36(6):550-562.doi: 10.1055/s-0035-1553293.
[5]Cha YJ,Youk JH,Kim BG,et al.Lymphangiogenesis in breast cancer correlates with matrix stiffness on shear-wave elastography[J].Yonsei Med J,2016,57(3):599-605.doi: 10.3349/ymj.2016.57.3.599.
[6]Fredenberg E,Kilburn-Toppin F,Willsher P,et al.Measurement of breast-tissue x-ray attenuation by spectral mammography:solid lesions[J].Phys Med Biol,2016,61(7):2595-2612.doi:10.1088/0031-9155/61/7/2595.
[7]Fiorica JV.Breast cancer screening,mammography,and other modalities[J].Clin Obstet Gynecol,2016,59(4):688-709.doi:10.1097/GRF.0000000000000246.
[8]Newell MS,Mahoney MC.Ultrasound-guided percutaneous breast biopsy[J].Tech Vasc Interv Radiol,2014,17(1):23-31.doi:10.1053/j.tvir.2013.12.005.
[9]Jedy-Agba E,McCormack V,Adebamowo C,et al.Stage at diagnosis of breast cancer in sub-Saharan Africa: a systematic review and meta-analysis[J].Lancet Glob Health,2016,4(12):e923-935.doi: 10.1016/S2214-109X(16)30259-5.
[10]Espina C,McKenzie F,Dos-Santos-Silva I.Delayed presentation and diagnosis of breast cancer in African women: a systematic review[J].Ann Epidemiol,2017,27(10):659-671.doi: 10.1016/j.annepidem.2017.09.007.
[11]周鹏,张家庭,贡雪灏,等.超声弹性成像在乳腺BI-RADS4类“微钙化非肿块型”病灶中的诊断价值[J].中国超声医学杂志,2015,31(7):580-582.Zhou P,Zhang JT,Gong XH,et al.Diagnostic Value of Breast Ultrasonic Elastography for BI-RADS 4 Breast " Microcalcification Non-mass Lesions"[J].Chinese Journal of Ultrasound Medicine,2015,31(7):580-582.
[12]郝少云,欧冰,钟文景,等.超声弹性成像在BI-RADS 4类乳腺肿物中的诊断价值[J].中国超声医学杂志,2014,30(4):303-306.Hao SY,Ou B,Zhong WJ,et al.Diagnostic Value of Breast Ultrasonic Elastography for BI-RADS 4 Breast Lesions[J].Chinese Journal of Ultrasound in Medicine,2014,30(4):303-306.
[13]Chou CP,Peng NJ,Chang TH,et al.Clinical roles of breast 3T MRI,FDG PET/CT,and breast ultrasound for asymptomatic women with an abnormal screening mammogram[J].J Chin Med Assoc,2015,78(12):719-725.doi: 10.1016/j.jcma.2015.06.018.
[14]陶阳阳,任敏,杜国庆,等.超声及钼靶评估乳腺肿块最大径线准确性的研究[J].中国超声医学杂志,2017,33(10):882-885.doi:10.3969/j.issn.1002-0101.2017.10.006.Tao YY,Ren M,Du GQ,et al.The Accurate Evaluation on the Largest Diameter Line of Breast Tumors Using Ultrasound and Mammography[J].Chinese Journal of Ultrasound in Medicine,2017,33(10):882-885.doi:10.3969/j.issn.1002-0101.2017.10.006.
[15]张惠美,徐华军,毛新峰,等.雄激素受体表达阳性与阴性的三阴乳腺癌的钼靶X线特征[J].中国医学影像技术,2018,34(9):1368-1371.doi:10.13929/j.1003-3289.201801187.Zhang HM,Xu HJ,Mao XF,et al.Mammographic imaging features of triple-negative breast cancer with positive and negative expression of androgen receptor[J].Chinese Journal of Medical Imaging Technology,2018,34 (9):1368-1371.doi: 10.13929/j.1003-3289.201801187.
[16]王琼,顾林,郑红,等.乳腺癌微钙化与预后因子的相关性分析[J].肿瘤,2017,37(11):1202-1208.doi: 10.3781/j.issn.1000-7431.2017.33.278.Wang Q,Gu L,Zheng H,et al.Relationship between micro-calcification and prognostic factors in breast cancer patients[J].Tumor,2017,37(11):1202-1208.doi: 10.3781/j.issn.1000-7431.2017.33.278.
[17]何其佳,赵玉珍,阳练,等.乳腺超声自动容积成像技术与钼靶诊断乳腺肿物的对比研究[J].中国超声医学杂志,2016,32(9):783-786.doi:10.3969/j.issn.1002-0101.2016.09.005.He QJ,Zhao YZ,Yang L,et al.Comparative Study of Automatic Breast Volume Scanner and Mammography in Diagnosing Breast Lesions[J].Chinese Journal of Ultrasound in Medicine,2016,32(9):783-786.doi: 10.3969/j.issn.1002-0101.2016.09.005.
[18]苑著,屈翔,王宇,等.钼靶、超声、乳管镜下放置定位针在引导切除触诊阴性乳腺病变中的应用探讨[J].中国实用外科杂志,2016,36(4):441-444.doi: 10.7504/CJPS.ISSN1005-2208.2016.04.19.Yuan Z,Qu X,Wang Y,et al.Application of localization needles under mammographic,ultrasound or fi beroptic ductoscopy guidance for the nonpalpable breast lesions[J].Chinese Journal of Practical Surgery,2016,36(4):441-444.doi: 10.7504/CJPS.ISSN1005-2208.2016.04.19.
[19]刘慧敏,曹小丽,刘瑞华.超声引导下穿刺活检对乳腺癌前病变的诊断价值[J].中国医学影像技术,2017,33(5):670-674.doi:10.13929/j.1003-3289.201609030.Liu HM,Cao XL,Liu RH.Value of ultrasound-guided core needle biopsy in diagnosing precancerous lesions of breast cancer[J].Chinese Journal of Medical Imaging Technology,2017,33(5):670-674.doi: 10.13929/j.1003-3289.201609030.
[20]许亚飞.超声引导下乳腺病灶导丝穿刺与定位技巧及临床意义[J].中国超声医学杂志,2016,32(8):694-695.doi:10.3969/j.issn.1002-0101.2016.08.007.Xu YF.The Localization Skills and Clinical Significance of Ultrasound-guided Wire Insertion in Diagnosing Tiny Breast Lesions[J].Chinese Journal of Ultrasound in Medicine,2016,32(8):694-695.doi: 10.3969/j.issn.1002-0101.2016.08.007
[21]王金祥,曹旭晨.超声引导下穿刺活检对BI-RADS分级4A至4C乳腺肿物诊断的价值[J].中国肿瘤临床,2017,44(2):83-86.doi:10.3969/j.issn.1000-8179.2017.02.236.Wang JX,Cao XC.Diagnosis value of ultrasound-guided coreneedle biopsy in breast masses under BI-RADS categories 4A to 4C[J].Chinese Journal of Clinical Oncology,2017,44(2):83-86.doi: 10.3969/j.issn.1000-8179.2017.02.236.
[22]郑恩海,吴燕娜,林诗彬,等.超声及超声引导下穿刺活检对早期乳腺癌的诊断价值分析[J].重庆医学,2017,46(9):1261-1263.doi:10.3969/j.issn.1671-8348.2017.09.035.Zheng EH,Wu YN,Lin SB,et al.Analysis of diagnostic value of ultrasound and ultrasound-guided needle-aspiration biopsy in diagnosis of early breast cancer[J].Chongqing Medine,2017,46(9):1261-1263.doi:10.3969/j.issn.1671-8348.2017.09.035.
[23]苗凤玲,李君,姜莉,等.声弹性成像及造影技术与超声引导穿刺活检对乳腺病灶鉴别诊断价值的对比研究[J].包头医学院学报,2014,30(4):44-48.Miao FL,Li J,Jiang L,et al.A ComparatiVe Study on the Diagnostic VaIue of Acoustic EIastography and UItrasonography and UItrasound-guided Biopsy in the DifferentiaI Diagnosis of Breast Lesions[J].Journal of Baotou Medical College,2014,30(4):44-48.
[24]吕淑贞,谢苗苗,李艳萍.X线钼靶联合超声检查在乳腺肿块鉴别诊断中的价值[J].中国老年学杂志,2018,38(5):1105-1107.doi:10.3969/j.issn.1005-9202.2018.05.031.Lu SZ,Xie MM,Li YP.Value of mammography X-ray plus ultrasound in differential diagnosis of breast mass[J].Chinese Journal of Gerontology,2018,38(5):1105-1107.doi:10.3969/j.issn.1005-9202.2018.05.031.
[25]吴文瑛,赵丽,王晓岩,等.超声弹性成像在乳腺肿块诊断中的应用价值[J].中国普通外科杂志,2018,27(5):664-668.doi:10.3978/j.issn.1005-6947.2018.05.023.Wu WY,Zhao L,Wang XY,et al.Application value of ultrasound elastography in diagnosis of breast mass[J].Chinese Journal of General Surgery,2018,27(5):664-668.doi: 10.3978/j.issn.1005-6947.2018.05.023.
[26]Özel D,Özel BD.Evaluating the role of strain ratio elastography in determining malignancy potential and calculating objective BIRADS US scores using ultrasonography and elastography features[J].Pol J Radiol,2018,83:e268-274.doi: 10.5114/pjr.2018.76790.
[27]Georgieva M,Prantl L,Utpatel K,et al.Diagnostic performance of ultrasound strain elastography for differentiation of malignant breast lesions.Clin Hemorheol Microcirc,2018,doi: 10.3233/CH-189415.[Epub ahead of print].
[28]彭友,罗中尧,丁金旺,等.钼靶联合超声引导双定位法在乳腺微钙化灶活检中的临床应用研究[J].中国普通外科杂志,2016,25(11):1633-1639.doi:10.3978/j.issn.1005-6947.2016.11.019.Peng Y,Luo ZY,Ding JW,et al.Clinical application of combined localization of X-ray mammography and ultrasonography in biopsy of breast microcalcification[J].Chinese Journal of General Surgery,2016,25(11):1633-1639.doi: 10.3978/j.issn.1005-6947.2016.11.019.
[29]Hadjipanteli A,Elangovan P,Mackenzie A,et al.The threshold detectable mass diameter for 2D-mammography and digital breast tomosynthesis[J].Phys Med,2019,57:25-32.doi: 10.1016/j.ejmp.2018.11.014.
[30]王增燕,吴雄,杨乐艺,等.三阴性乳腺癌术后对侧转移1例[J].中国普通外科杂志,2015,24(8):1211-1212.doi:10.3978/j.issn.1005-6947.2015.08.034.Wang ZY,Wu X,Yang LY,et al.Postoperative contralateral metastasis of triple-negative breast cancer: a case report [J].Chinese Journal of General Surgery,2015,24(8):1211-1212.doi:10.3978/j.issn.1005-6947.2015.08.034.
[31]Miyake T,Kim SJ,Shimoda M,et al.Diagnostic utility of thirdlook,contrast-enhanced sonography followed by needle biopsy for MRI,but not second-look ultrasonography-detected breast lesions[J].Anticancer Res,2019,39(2):915-921.doi: 10.21873/anticanres.13194.
[32]Schmitz KJ,Losch M,Agaimy A.Myositis ossificans mimicking metaplastic breast cancer on core needle biopsy[J].Hum Pathol,2019,pii: S0046-8177(19)30004-8.doi: 10.1016/j.humpath.2018.12.008.[Epub ahead of print]
[33]Fu Y,Guo F,Chen H,et al.Core needle biopsy promotes lung metastasis of breast cancer: An experimental study[J].Mol Clin Oncol,2019,10(2):253-260.doi: 10.3892/mco.2018.1784.
