胃癌(gastric cancer,GC)是世界上最常见的恶性肿瘤之一,具有较高的发病率和病死率,严重威胁着人们的身心健康[1-2]。由于大部分的GC在明确诊断时已处于中晚期,并伴有肿瘤浸润或者淋巴结转移,因此导致GC的治疗极为棘手[2-4]。目前GC首选的治疗措施仍然是手术切除,尽管近年来GC的诊治水平已经有了明显改善,但是患者的总体预后仍然不容乐观[2, 5-6]。因此寻找新的临床有效的GC诊治措施是目前最为迫切的任务之一。肿瘤靶向治疗是目前研究较为火热的领域之一,而作为其中热点领域之一的微小RNA(microRNA,miRNA)是一类由内源基因编码的长度约为18~25个核苷酸序列的小分子RNA,其在肿瘤的发生发展过程中扮演着重要的角色[7-9]。miRNA主要通过参与基因的转录后表达调控从而调节肿瘤细胞的增殖、凋亡、侵袭和迁移等恶性生物学行为[7,10-11]。 研究发现,miR-105-5p(既往被称为miR-105) 与结直肠癌[12]、肝癌[13]、胶质瘤[14]以及前列腺癌[15]等恶性肿瘤的发生发展密切相关。例如,Shen等[12]发现结直肠癌中高表达的miR-105-5p对TNF-α介导的上皮间质转化发挥着重要作用;Shen等[13]研究发现miR-105-5p可以通过抑制PI3K/Akt信号通路从而抑制肝癌的生长。但是miR-105-5p在GC中的表达及作用目前罕有报道。因此,本研究旨在探究miR-105-5p在GC中的表达情况、临床意义及其对GC细胞侵袭、迁移、增殖的影响,并初步探讨其可能的作用机制,为GC的预防和诊治提供一定的实验依据。
1 材料与方法
1. 1 组织标本
收集并筛选62对GC组织和对应的癌旁组织标本,所有标本均来自2009年1月1日—2012年12月31日在西安交通大学第一附属医院接受手术治疗并经术后病理诊断确诊的GC患者62例,其中男43例,女19例;年龄24~78岁,中位年龄59岁。所有患者术前均未接受放疗、化疗等其他辅助治疗。所有获得的新鲜组织取得后均尽快保存于液氮或者多聚甲醛(40 g/L)中。对术后62例患者进行随访,随访时间3~60个月。本研究获得西安交通大学第一附属医院伦理委员会审核批准并且获得患者知情同意。
1.2 主要试剂
TRIzol试剂和脂质体(LipofectamineTM 2000)均购自Invitrogen公司。胎牛血清(FBS)购自Gibco 公司; DMEM购自ThermoFisher Scientific公司;miRNA 逆转录试剂盒(Allin-One™ miRNA First-Strand cDNA Synthesis Kit)、miRNA qPCR试 剂 盒(All-in-One™ miRNA qPCR Kit)、miR-105-5p特异性引物(货号:HmiRQP0025)、miRNA内 参U6引 物(货号:HmiRQP9001)、miR-105-5p模拟物(货号:HmiR0408-MR04)、miR-105-5p抑制物(货号:HmiR-AN0024-AM02)均购自Genecopoeia公司;Transwell小室购自Becton Dickinson Labware公司;Matrigel基质胶购自BD公司;MTT试剂盒购自江苏凯基生物技术股份有限公司;RIPA裂解液(强)购自西安赫特生物科技有限公司;BC A蛋白定量试剂盒购自上海碧云天生物技术有限公司;兔抗人DIRAS3多克隆抗体购自Abcam公司;小鼠抗人β-actin单克隆抗体购自武汉博士德生物工程有限公司;ECL 发光剂购自Milipore公司。
1.3 实验方法
1.3.1 细胞培养与转染 人正常胃黏膜上皮细胞(GES-1)与胃癌细胞系(MGC-803,MKN-1,SGC-7901,BGC-823和AGS)均购自中科院上海生 物化学与细胞生物学研究所。细胞培养液为含100 mL/L胎牛血清的DMEM培养液,恒温培养箱的 条件为5% CO2、37 ℃。细胞转染参照LipofectamineTM 2000试剂说明书上的步骤进行。首先将待转染细胞接种于6孔板中并培养至细胞融合度为50%~70%。转染前24 h,将正常血清更换为无双抗100 mL/L胎牛血清的DMEM培养液。转染时,将100 nmol miR-105-5p模拟物与100 nmol阴性对照( miR-control)、以及100 nmol miR-105-5p抑制物与100 nmol阴性对照(anti-miR)用LipofectamineTM 2000分别进行转染,用无双抗100 mL/L胎牛血清的DMEM培养液继续培养8 h后换成正常培养液进行培养,后续转染效果检测及相关功能实验在转染48 h后收取细胞进行。
1.3.2 real-time PCR实验 应用TRIzol试剂按照说明书上的步骤提取组织和细胞中的总RNA,并应用超微量核酸定量光谱仪(Thermo Nanodrop 1000)测定RNA的浓度和纯度。逆转录操作分别按照miRNA逆转录试剂盒(All-in-One™ miRNA First-Strand cDNA Synthesis Kit)和逆转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)说明书上的步骤进行。MiRNA real-time PCR按照miRNA qPCR(All-in-One™ miRNA qPCR Kit)试剂盒说明书上的步骤进行,以U6为内参。结果均应用2-△△Ct法计算。独立重复实验3次。
1.3.3 Transwell迁移和侵袭实验 Transwell迁移实验时不铺胶;侵袭实验时,先按1:6的稀释比例将50 mg/L的Matrigel 胶稀释后均匀铺于上层小室底部。将待测细胞消化、离心、重悬。在Transwell下层小室中加入600 μL含100 mL/L 胎牛血清的完全培养基,取各组细胞悬液200 μL(细胞数为2×105)加入Transwell 小室的上室。每组重复3次。24 h后取出小室,首先用PBS溶液将小室清洗3次,然后用棉签将小室的微孔膜上层的Matrigel胶及细胞轻轻拭净,接着用40 g/L的多聚甲醛固定20 min,用1 g/L的结晶紫染色10 min,用PBS溶液洗净后将小室置于倒置显微镜下进行观察计数,每个样本随机选取5个视野进行计数并求其平均数,以此评估细胞的侵袭迁移能力。
1.3.4 MTT实验 收集转染24 h后的各组细胞,调整细胞悬液的浓度,将细胞悬液接种至96孔板,使得每孔细胞数为3×103,各组细胞分别设置3个复孔,继续培养。分别于接种24、48、72 h后弃去培养基,每孔加入50 μL浓度为5 g/L的二苯基溴化四氮唑蓝(MTT)后继续孵育4 h后,每孔加入200 μL二甲基亚枫(DMSO)进行终止。然后 应用光吸收酶标仪(S pectraMax 190,美谷分子仪器公司)测定490 nm处的吸光度并进行分析。
1.3.5 细胞蛋白抽提及Western blot实验 细胞转染48 h后,用RIPA裂解液抽提细胞总蛋白,用BCA法进行蛋白定量。Western blot实验时,首先将待检测蛋白样品按30 μg/孔上样后行SDSPAGE电泳,然后用湿转法将蛋白转移至PVDF膜上,用5%脱牛奶粉液封闭2.0 h后,加入相应的DIRAS3抗 体(1:1 000)或 者 β-actin 抗 体(1:1 000),4 ℃孵育过夜。次日取出膜,在室温孵育30 min,用TBST溶液(TBS,1 mL/L Tween-20)洗膜3次,10 min/次,洗去残余的一抗;分别加HRP标记的抗兔或抗小鼠二抗(1:5 000),室温孵育2 h。TBST(TBS,1 mL/L Tween-20)洗膜3次,10 min/次,洗去残余的二抗后在暗室用ECL 发光剂检测。
1.3.6 荧光素酶报告实验 设计合成DIRAS3-3'-UTR的野生序列和突变序列并进行扩增,将扩增的片段分别转入pMIR-reporterTM的miRNA表达载体(Applied Biosystems),构建能够表达荧光素酶的重组质粒;构建好的重组质粒分别与miR-105-5p模拟物或miR-105-5p抑制物共同转染至293T细胞,72 h后收集细胞,严格按照Luciferase Reporter Gene Assay Kit 说明书操作实验。最后通过发光化学仪检测萤火虫和海肾荧光比值。
1.4 统计学处理
应用SPSS 20.0等统计软件处理数据,计量资料以均数±标准差( ±s)表示,使用的统计学方法包括单因素方差分析、t检验、Pearson χ2检验、Kaplan-Meier法、Spearman相关性检验等;用Graphpad Prism 6及Adobe PhotoShop CS6等软件进行图表的绘制。P<0.05为差异有统计学意义。
±s)表示,使用的统计学方法包括单因素方差分析、t检验、Pearson χ2检验、Kaplan-Meier法、Spearman相关性检验等;用Graphpad Prism 6及Adobe PhotoShop CS6等软件进行图表的绘制。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-105-5p在GC组织和细胞中表达情况
首先,应用real-time PCR检测62对GC组织和对应的癌旁组织中miR-105-5p的表达水平。结果表明,miR-105-5p在GC组织中相对表达水平明显高于癌旁组织[(2.151±0.050) vs. (1.129±0.02),P<0.001](图1)。此外,5种GC细 胞 系(MGC-803,MKN-1,SGC-7901,BGC-823和AGS)中的miR-105-5p的表达水平均明显高于人正常胃黏膜上皮细胞(GES-1)(均P<0.001)(图2)。
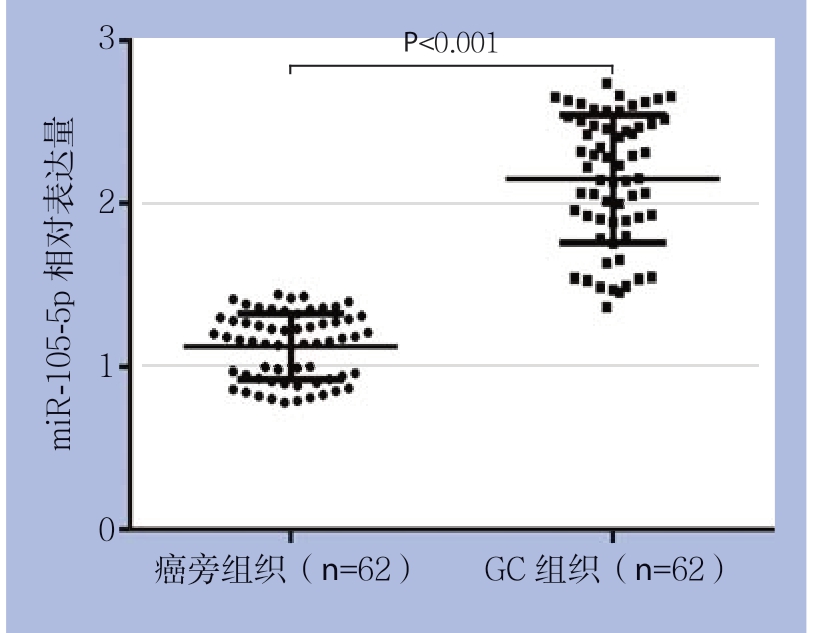
图1 real-time PCR检测miR-105-5p在GC组织和癌旁组织中的表达
Figure 1 The expressions of miR-105-5p in GC tissues and adjacent non-tumor tissues measured by real-time PCR
2.2 miR-105-5p表达与GC临床病理因素及预后的关系
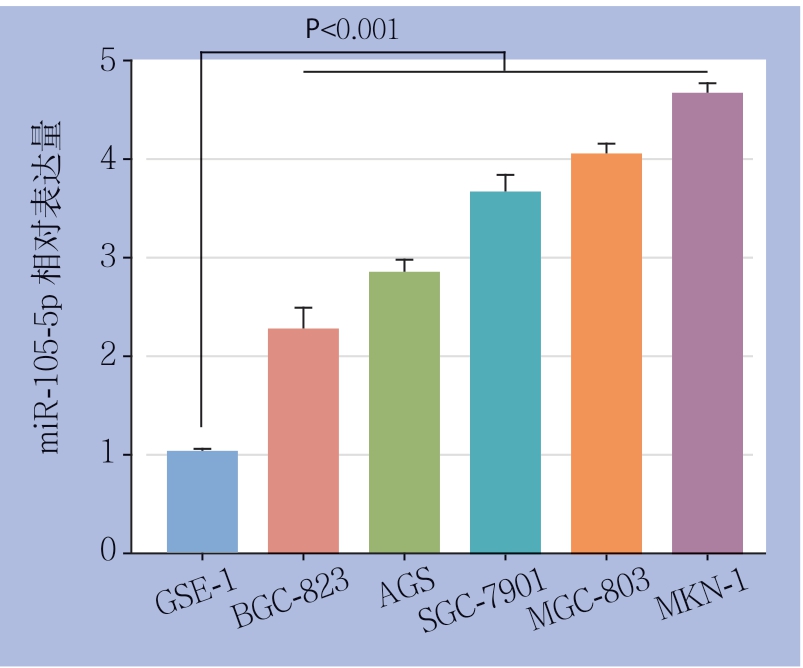
图2 real-time PCR检测GC细胞系与正常胃黏膜细胞中的miR-105-5p的表达
Figure 2 The expressions of miR-105-5p in GC cell lines and normal gastric mucosal cell line detected by real-time PCR
根据miR-105-5p在GC组织中的中位表达水平,62例GC患者被分为两组:miR-105-5p高表达组(n=31)和miR-105-5p低表达组(n=31)。结果显示,miR-105-5p与肿瘤大小(P=0.020)以及远处转移 (P=0.004)明显有关,而与年龄、性别等特征无明显关系(均P>0.05)(表1)。
表1 miR-105-5p的表达水平与GC患者临床病理特征的关系[n=62,n(%)]
Table 1 The relations of miR-105-5p expression with the clinicopathologic characteristics of GC patients [n=62, n (%)]
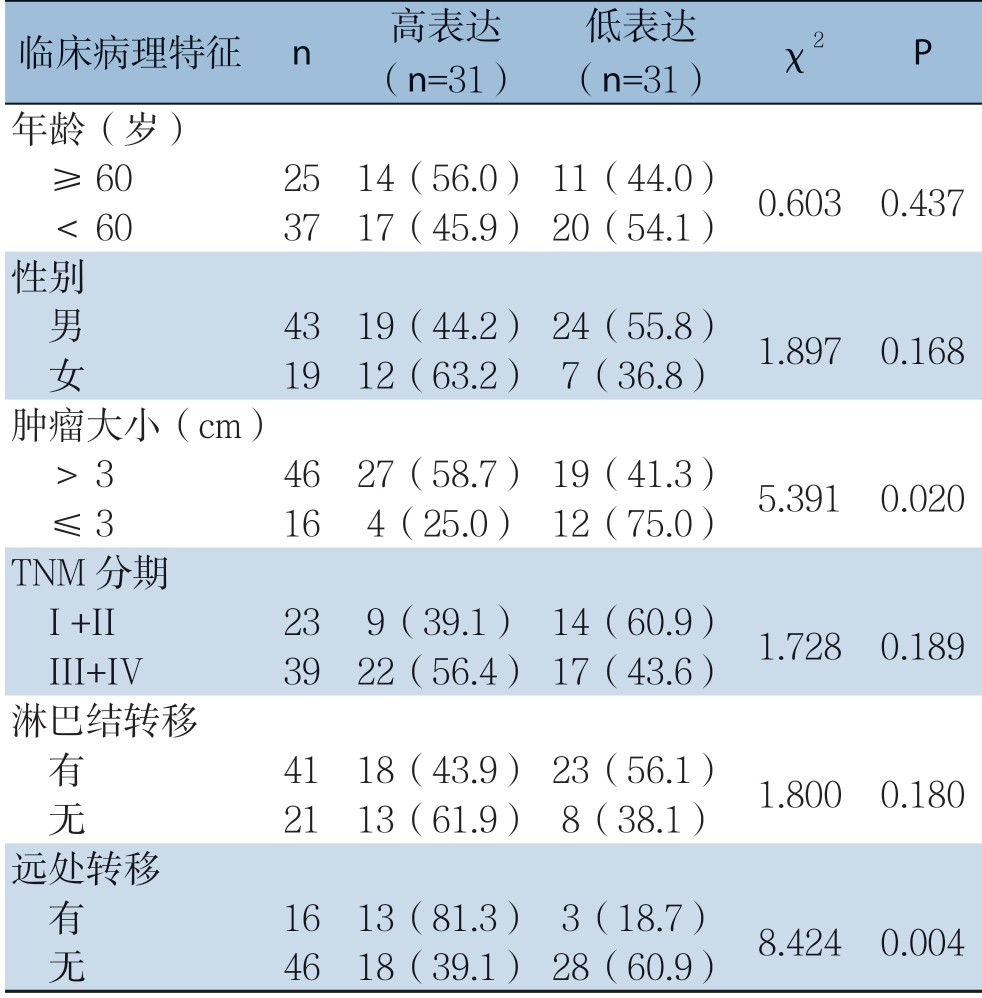
临床病理特征 n 高表达(n=31)低表达(n=31) χ2 P年龄(岁) ≥60 25 14(56.0)11(44.0) 0.603 0.437 <60 37 17(45.9)20(54.1)性别 男 43 19(44.2)24(55.8) 1.897 0.168 女 19 12(63.2)7(36.8)肿瘤大小(cm) >3 46 27(58.7)19(41.3) 5.391 0.020 ≤3 16 4(25.0)12(75.0)TNM分期 I +II 23 9(39.1)14(60.9) 1.728 0.189 III+IV 39 22(56.4)17(43.6)淋巴结转移 有 41 18(43.9)23(56.1) 1.800 0.180 无 21 13(61.9)8(38.1)远处转移 有 16 13(81.3)3(18.7) 8.424 0.004 无 46 18(39.1)28(60.9)
2.3 miR-105-5p对GC细胞迁移和侵袭的影响
将miR-105-5p模拟物、miR-105-5p抑制物分别转染至BGC-823和MKN-1细胞。realtime PCR检测结果显示,miR-105-5p模拟物能
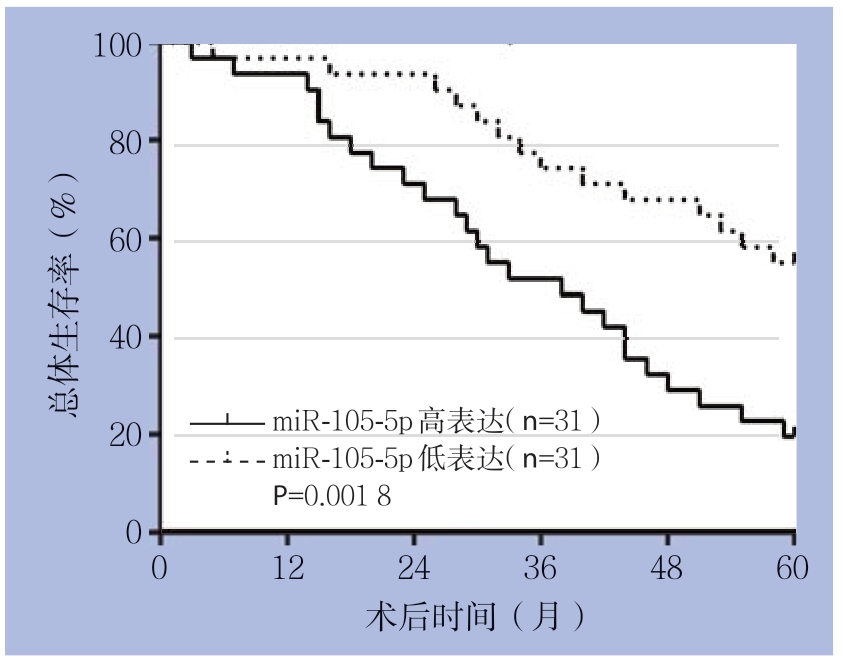
图3 Kaplan-Meier法分析miR-105-5p的表达水平对GC患者预后的影响
Figure 3 Inf l uence of miR-105-5p expression on prognosis of GC patients analyzed by Kaplan-Meier method
Kaplan-Meier法分析结果显示,miR-105-5p低表达患者的总体生存率明显高于miR-105-5p高表达患者(P=0.001 8)(图3)。够明显上调BGC-823细胞中miR-105-5p的表达水 平(P<0.001),而miR-105-5p抑 制 物 能 够明显下调MKN-1细胞中miR-105-5p的表达水平(P<0.001)(图4)。
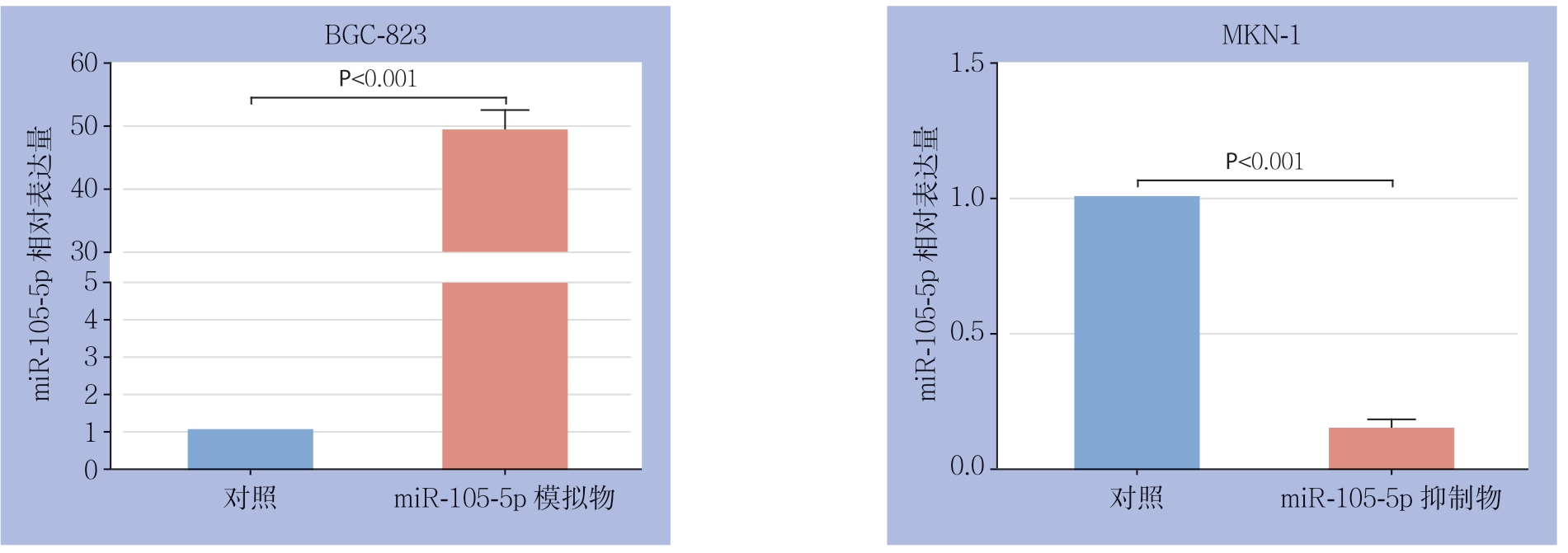
图4 real-time PCR检测miR-105-5p模拟物或者抑制物对GC细胞miR-105-5p表达的影响
Figure 4 Effect of miR-105-5p mimics or inhibitors on miR-105-5p expression in GC cells detected by real-time PCR
Transwell迁移实验结果显示,相较于对照组,miR-105-5p模拟物能够明显促进BGC-823细胞穿过小室膜的数目(P<0.01);而转染miR-105-5p抑制物后的MKN-1细胞穿过小室膜的数目明显减少(P<0.01)(图5A)。Transwell侵袭实验结果显示,与对照组相比,miR-105-5p模拟物能明显促进BGC-823细胞穿过小室膜(P<0.01),而miR-105-5p抑制物能明显抑制MKN-1细胞穿过小室膜(P<0.05)(图5B)。
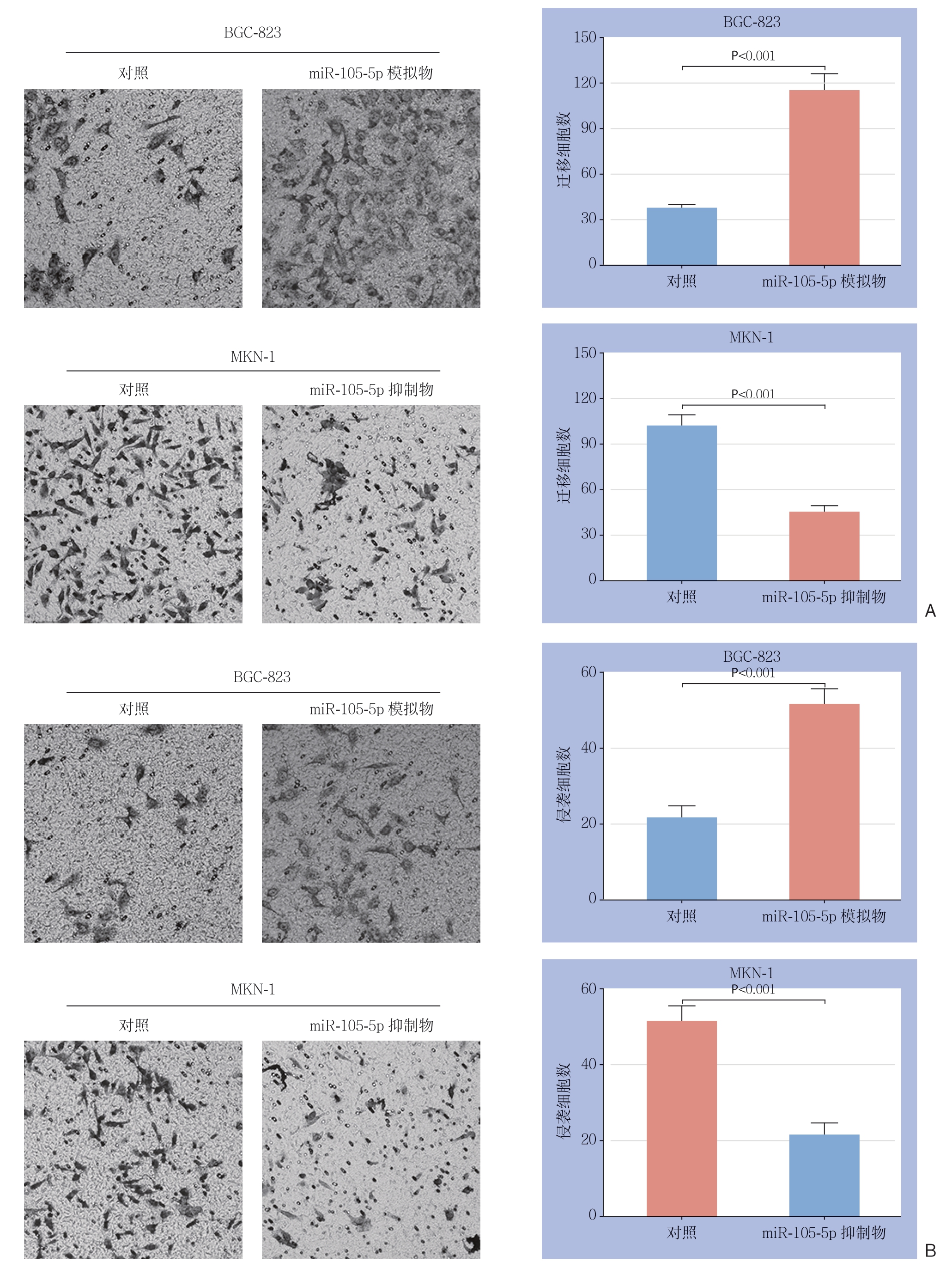
图5 Transwell实验检测miR-105-5p对GC细胞迁移、侵袭能力的影响
Figure 5 Effect of miR-105-5p on migration and invasion GC cells examined by Transwell assayanalysis
A:迁移实验;B:侵袭实验
A: Migration analysis; B: Invasion
2.4 miR-105-5p对GC细胞增殖的影响
MTT结果显示,将miR-105-5p模拟物转染至BGC-823细胞48 h和72 h 后,细胞增殖能力明显增强,而转染miR-105-5p抑制物48 h和72 h后的MKN-1细胞的增殖能力被明显抑制(图6)。

图6 MTT实验检测miR-105-5p表达对GC细胞增殖能力的影响
Figure 6 Effect of miR-105-5p expression on proliferative ability in GC cells examined by MTT
2.5 miR-105-5p的靶基因分析
应用生物信息学软件microRNA.org(http://www.microrna.org/microrna/home.do)、Targetscan(http://www.targetscan.org/vert_72)和miRBase(http://www.mirbase.org)预 测miR-105-5p的靶基因。如图7A所示,miR-105-5p能够与DIRAS家族GTP结合RAS样3(DIRAS3)(DIRAS Family GTPase 3,DIRAS3) 的3'非编码区(3'-UTR)结合,提示DIRAS3可能为miR-105-5p的靶基因。荧光素酶报告实验显示,miR-105-5p能负向调节野生型的DIRAS3-3'-UTR荧光素酶的活性,而对突变型的DIRAS3-3'-UTR的荧光素酶活性没有影响(图7B)。进一步研究发现,与对照组比较,miR-105-5p模拟物明显降低DIRAS3的蛋白水平(P<0.001),而miR-105-5p抑制物明显上调DIRAS3的蛋白水平(P<0.001)(图8)。
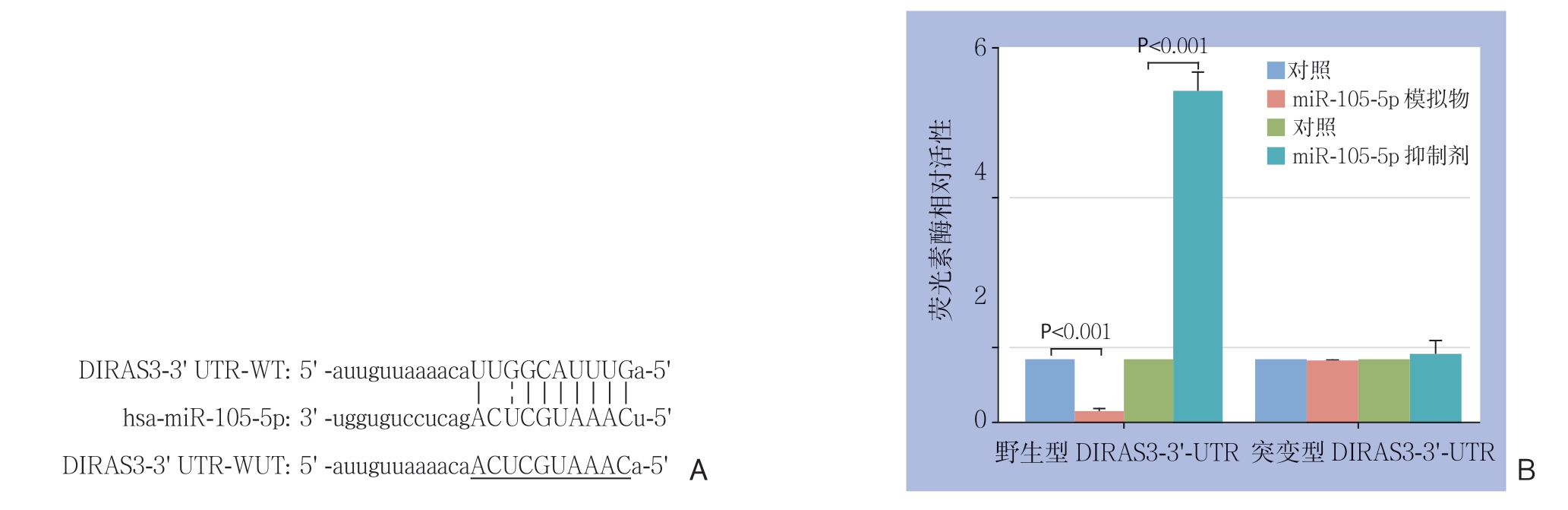
图7 miR-105-5p的靶基因预测
Figure 7 Prediction of the target gene of miR-105-5p
A:生物信息学分析显示,miR-105-5p可与野生型的DIRAS3的3'非编码区(3'UTR)结合(WT:野生型;MUT:突变型);B:荧光素酶报告实验显示,miR-105-5p能负向调节野生型的DIRAS3-3'-UTR荧光素酶的活性,而对突变型的DIRAS3-3'-UTR的荧光素酶活性没有影响
A: Bioinformatics analysis suggesting that miR-105-5p can bind to3' non-coding region of the wild-type DIRAS3 (WT: wild-type; MUT: mutant); B: Luciferase reporter assay indicating that miR-105-5p can negatively regulate the luciferase activity of the wild-type DIRAS3-3'-UTR and exerts no effect on the mutant type
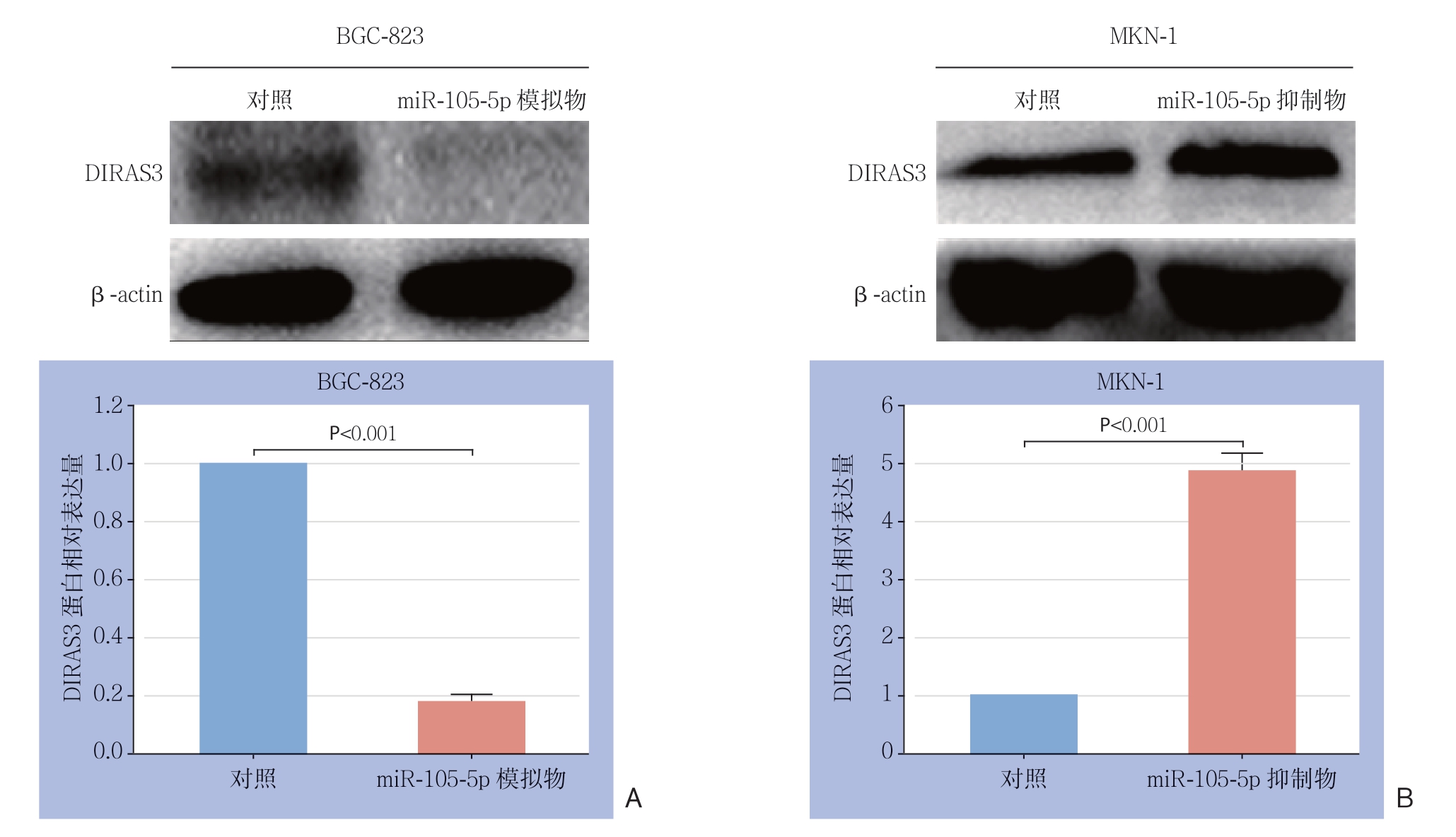
图8 miR-105-5p的靶基因验证
Figure 8 Verification of the target gene of miR-105-5p
A:转染miR-105-5p模拟物后,BGC-823细胞中DIRAS3的表达水平明显下调;B:转染miR-105-5p抑制物后,MKN-1细胞中DIRAS3的表达水平明显上调
A: DIRAS3 expression significantly down-regulated in BGC-823 after transfection with miR-105-5p mimics; B: DIRAS3 expression significantly up-regulated in MKN-1 cells after transfection with miR-105-5p inhibitors
3 讨 论
越来越多的研究表明,异常表达的miRNA与GC细胞的发生发展密切相关[8]。例如,GC中高表达的miR-371a-3p能够通过靶向作用于TOB1促进肿瘤细胞的侵袭、迁移、增殖和克隆形成能力[16];miR-495-3p能够调控GRP78/mTOR信号通路介导的细胞自噬,从而影响GC的进展[17]。值得注意的是,近年来研究发现miR-105-5p可能与结直肠癌[12]、胶质瘤[14]以及前列腺癌[15]等多种恶性肿瘤的侵袭、转移、增殖、化疗药物敏感性以及患者预后等密切相关。这就提示miR-105-5p可能与肿瘤的发生发展密切相关,具有可观的潜在临床应用价值。但是目前miR-105-5p在GC中的表达及功能尚罕有报道。
本研究首先探讨了miR-105-5p在GC中的表达情况和临床意义。结果显示miR-105-5p在GC组织和细胞中表达量均显著上调,并且5种细胞系中BGC-823表达最低,MKN-1表达最高。此外,高表达的miR-105-5p与肿瘤大小、远处转移及不良预后显著相关。上述结果表明,miR-105-5p可能为GC的促癌基因,并且可能具有一定的临床应用价值。
为了探讨miR-105-5p对GC细胞恶性生物学行为的影响,本研究检测了miR-105-5p表达量的改变对GC细胞的迁移、侵袭及增殖能力的影响。结果显示,当GC细胞中miR-105-5p的表达水平改变之后,GC细胞的侵袭、迁移及增殖能力也随之被正向调控。上述结果表明,miR-105-5p为GC的促癌基因,其能够促进GC细胞的侵袭、迁移和增殖。
大量的研究表明,miRNA能够通过与下游靶基因的3'-UTR结合从而抑制靶基因的表达来发挥作用[18]。本研究中,来自多种生物信息学软件的结果均显示,miR-105-5p能 够与DIRAS3基因的3'-UTR结合,即DIRAS3为m iR-105-5p潜在的靶基因。DIRAS3基因编码的蛋白是ras超家族的一员,与肿瘤的发生发展密切相关[1 9]。DIRAS3在乳腺癌、胰腺癌和 卵巢癌等多种肿瘤中均可作为抑癌基因参与肿瘤的生物进程,其能够通过作用于Ras/MAP、PI3K/Akt、APK/ERK1/2等通路调控肿瘤细胞的侵袭、转移、增殖能力及自噬等[20-22]。值得注意的是,近期研究[23-25]发现DIRAS3作为抑癌基因不仅能够抑制GC细胞的侵袭、转移、增殖和自噬,并且临床数据还表明其表达量与GC患者的预后也密切相关。例如,Qiu等[23]通过体外和体内实验对DIRAS3在GC细胞中的抑癌机制的深入研究发现,DIRAS3不仅能调控AKT1-MTOR和RAS-MAPK信号通路,还能调控自噬相关的转录因子FOXO3/FOXO3A和TFEB的核定位。因此,从本研究结果推测,miR-105-5p可能通过靶向作用于DIRAS3发挥其促GC的作用。为了证实DIRAS3为miR-105-5p的靶点,本研究应用荧光素酶报告基因实验和Western blot实验对这一假设进行了验证。结果发现,miR-105-5p能够通过与DIRAS3的3'-UTR直接结合从而负向调控GC细胞中的DIRAS3表达水平。上述结果表明,GC细胞中,DIRAS3是miR-105-5p的靶基因。结合既往研究,笔者推测,GC细胞中miR-105-5p通过靶向作用于DIRAS3,进而影响DIRAS3对FAK/Rho、PI3K等信号通路以及转录因子FOXO3/FOXO3A和TFEB的核定位的调节,从而影响GC细胞的迁移、侵袭以及增殖等。
综上所述,本研究通过一系列实验首次阐明了miR-105-5p在GC中的表达情况、临床意义以及可能的作用机制。结果表明miR-105-5p在GC中高表达,并且与GC的肿瘤大小、远处转移以及不良预后密切相关;此外,miR-105-5p能够通过靶向作用于DIRAS3促进GC细胞的迁移、侵袭和增殖能力,为GC靶向治疗的相关研究提供了一定的实验基础和理论依据。
[1]Zurleni T, Gjoni E, Altomare M, et al. Conversion surgery for gastric cancer patients: A review[J]. World J Gastrointest Oncol, 2018, 10(11):398-409. doi: 10.4251/wjgo.v10.i11.398.
[2]Einama T, Abe H, Shichi S, et al. Long-term survival and prognosis associated with conversion surgery in patients with metastatic gastric cancer[J]. Mol Clin Oncol, 2017, 6(2):163-166. doi: 10.3892/mco.2017.1128.
[3]吴永丰, 刘兴洲, 柳东, 等. 血管导向淋巴清扫术在腹腔镜胃癌根治术中的应用价值[J]. 中国普通外科杂志, 2018, 27(12):1589-1596. doi:10.7659/j.issn.1005-6947.2018.12.015.Wu YF, Liu XZ, Liu D, et al. Application value of vessel-guided lymph node dissection in laparoscopic radical gastrectomy for gastric cancer[J]. Chinese Journal of General Surgery, 2018, 27(12):1589-1596. doi:10.7659/j.issn.1005-6947.2018.12.015.
[4]殷凯, 瞿建国, 陈吉祥, 等. 胃癌神经侵犯的相关临床病理因素: 单中心509例分析[J]. 中国普通外科杂志, 2018, 27(4):396-400. doi:10.3978/j.issn.1005-6947.2018.04.002.Yin K, Qu JG, Chen JX, et al. Clinicopathologic factors related to perineural invasion of gastric cancer: analysis of 509 cases in a single center[J]. Chinese Journal of General Surgery, 2018, 27(4):396-400. doi:10.3978/j.issn.1005-6947.2018.04.002.
[5]Beom SH, Choi YY, Baek SE, et al. Multidisciplinary treatment for patients with stage IV gastric cancer: the role of conversion surgery following chemotherapy[J]. BMC Cancer, 2018, 18(1):1116. doi: 10.1186/s12885-018-4998-x.
[6]Lochman P, Koci J, Paral J. Quality of life after proximal gastrectomy a review[J]. Rozhl Chir, 2018, 97(8):368-372.
[7]Haider MT, Taipaleenmaki H. Targeting the Metastatic Bone Microenvironment by MicroRNAs[J]. Front Endocrinol (Lausanne), 2018, 9:202. doi: 10.3389/fendo.2018.00202.
[8]Yuan HL, Wang T, Zhang KH. MicroRNAs as potential biomarkers for diagnosis, therapy and prognosis of gastric cancer[J]. Onco Targets Ther, 2018, 11:3891-3900. doi: 10.2147/OTT.S156921.
[9]房锋, 宋天强. 微小RNA在肝细胞癌中的相关研究进展[J]. 中国普通外科杂志, 2018, 27(7):899-909. doi:10.3978/j.issn.1005- 6947.2018.07.015.Fang F, Song TQ. Research progress associated with microRNAs in hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2018, 27(7):899-909. doi:10.3978/j.issn.1005-6947.2018.07.015.
[10]Anfossi S, Fu X, Nagvekar R, et al. MicroRNAs, Regulatory Messengers Inside and Outside Cancer Cells[J]. Adv Exp Med Biol, 2018, 1056:87-108. doi: 10.1007/978-3-319-74470-4_6.
[11]王宇锋, 刘志奎, 姚博文, 等. 肝癌细胞中miR-376c的表达及其与高迁移率族蛋白A2的关系[J]. 中国普通外科杂志, 2017, 26(7):861-869. doi:10.3978/j.issn.1005-6947.2017.07.008.Wang YF, Liu ZK, Yao BW, et al. Expression of miR-376c in hepatocellular carcinoma cells and its relation with high mobility group A2[J]. Chinese Journal of General Surgery, 2017, 26(7):861-869. doi:10.3978/j.issn.1005-6947.2017.07.008.
[12]Shen Z, Zhou R, Liu C, et al. MicroRNA-105 is involved in TNFalpha-related tumor microenvironment enhanced colorectal cancer progression[J]. Cell Death Dis, 2017, 8(12):3213. doi: 10.1038/s41419-017-0048-x.
[13]Shen G, Rong X, Zhao J, et al. MicroRNA-105 suppresses cell proliferation and inhibits PI3K/AKT signaling in human hepatocellular carcinoma[J]. Carcinogenesis, 2014, 35(12):2748-2755. doi: 10.1093/carcin/bgu208.
[14]Liu X, Wang H, Zhu Z, et al. MicroRNA-105 targets SOX9 and inhibits human glioma cell progression[J]. FEBS Lett, 2016, 590(23):4329-4342. doi: 10.1002/1873-3468.12458.
[15]Honeywell DR, Cabrita MA, Zhao H, et al. miR-105 inhibits prostate tumour growth by suppressing CDK6 levels[J]. PLoS One, 2013, 8(8):e70515. doi: 10.1371/journal.pone.0070515.
[16]Guo H, Ji F, Zhao X, et al. MicroRNA-371a-3p promotes progression of gastric cancer by targeting TOB1[J]. Cancer Lett, 2019, 443:179-188. doi: 10.1016/j.canlet.2018.11.021.
[17]Chen S, Wu J, Jiao K, et al. MicroRNA-495-3p inhibits multidrug resistance by modulating autophagy through GRP78/mTOR axis in gastric cancer[J]. Cell Death Dis, 2018, 9(11):1070. doi: 10.1038/s41419-018-0950-x.
[18]Yang N, Zhu S, Lv X, et al. MicroRNAs: Pleiotropic Regulators in the Tumor Microenvironment[J]. Front Immunol, 2018, 9:2491. doi: 10.3389/fimmu.2018.02491.
[19]Yu Y, Fujii S, Yuan J, et al. Epigenetic regulation of ARHI in breast and ovarian cancer cells[J]. Ann N Y Acad Sci, 2003, 983:268-277.
[20]Ye K, Wang S, Yang Y, et al. Aplasia Ras homologue member overexpression inhibits tumor growth and induces apoptosis through inhibition of PI3K/Akt survival pathways in human osteosarcoma MG-63 cells in culture[J]. Int J Mol Med, 2015, 36(3):776-782. doi: 10.3892/ijmm.2015.2278.
[21]Hu Y, Yang H, Lu XQ, et al. ARHI suppresses pancreatic cancer by regulating MAPK/ERK 1/2 pathway[J]. Pancreas, 2015, 44(2):342-343. doi: 10.1097/MPA.0000000000000274.
[22]Lu Z, Yang H, Sutton MN, et al. ARHI (DIRAS3) induces autophagy in ovarian cancer cells by downregulating the epidermal growth factor receptor, inhibiting PI3K and Ras/MAP signaling and activating the FOXo3a-mediated induction of Rab7[J]. Cell Death Differ, 2014, 21(8):1275-1289. doi: 10.1038/cdd.2014.48.
[23]Qiu J, Li X, He Y, et al. Distinct subgroup of the Ras family member 3 (DIRAS3) expression impairs metastasis and induces autophagy of gastric cancer cells in mice[J]. J Cancer Res Clin Oncol, 2018, 144(10):1869-1886. doi: 10.1007/s00432-018-2708-3.
[24]Tang HL, Hu YQ, Qin XP, et al. Aplasia ras homolog member I is downregulated in gastric cancer and silencing its expression promotes cell growth in vitro[J]. J Gastroenterol Hepatol, 2012, 27(8):1395-1404. doi: 10.1111/j.1440-1746.2012.07146.x.
[25]Wang W, Bu XM, Wang J, et al. The expression of ARHI in pT2a and pT2b stage gastric cancer and its clinical significance[J]. Oncol Rep, 2012, 27(6):1953-1959. doi: 10.3892/or.2012.1727.
