胃癌(gastric carcinoma)是胃黏膜上皮的恶性肿瘤,是世界上最常见的恶性肿瘤之一,全世界每年约有100多万人被诊断为胃癌,2018年全球因胃癌死亡78.3万人。我国属于胃癌高发地区,在因癌症死亡患者人数中位于第2位[1-2]。寻找新型的抗肿瘤药物,有望让更多的胃癌患者获益。失控的翻译进程会引起多种不良后果,包括引发癌症、维持癌症表型、支持血管生成和调节药物反应[3-4],控制癌细胞内失控的翻译可能是开发新型抗肿瘤药物的关键点[5]。真核生物细胞内真核起始因子(eukaryotic initiation factor,eIF)包括eIF2和eIF4F,其中,eIF4F倾向于调节帽子依赖的mRNA的翻译,因此,eIF4F活性的变化只会影响一部分mRNA翻译,造成翻译不成比例的选择性改变。事实证明,多种致癌基因的翻译依赖eIF4F,因此阻断eIF4F活性可作为开发新型抗肿瘤药物的一个潜在靶点[3-4,6]。
hippuristanol是一种天然提取物,能阻碍eIF4F内的eIF4A1与RNA的结合,进而抑制eIF4A1的解旋酶活性,阻碍其参与翻译起始过程[7-8]。 研究[9-10]证实,hippuristanol可抵抗淋巴细胞性白血病,原发性渗出性淋巴瘤,成人T细胞白血病。本文将在胃癌细胞株AGS、MGC-803上,以eIF4A抑制剂hippuristanol为研究对象,探讨抑制eIF4A1对胃癌细胞株的增殖、侵袭及迁移的影响,为胃癌化疗药物的开发提供理论基础。
1 材料与方法
1.1 临床标本
收集并筛选胃癌组织和相应的正常组织(距离癌组织≥5 cm)116对,标本来自2014年6月—2016年12月在中南大学湘雅医院接受手术治疗并经术后病理诊断确诊的胃癌患者,其中男87例,女29例;年龄31~76岁,中位年龄58岁。所有患者术前未接受放化疗等辅助治疗。经10%中性福尔马林固定,脱水,包埋,切片。本研究获得中南大学湘雅医院伦理委员会审批批准并且获得患者知情同意。
1.2 细胞及主要试剂
胃癌细胞株AGS、MGC-803,RPMI-1640,FBS,双抗(盘尼西林+链霉素),hippuristanol(日本琉球大学Junichi Tanaka教授馈赠),DMSO(Sigma),eIF4A1抗体(兔源,CST),HRP标记羊抗兔二抗,MTT,RT-PCR试剂盒(TaKaRa)等。
1.3 实验方法
1.3.1 免疫组化 将胃癌及相应的正常对照的石蜡切片脱蜡和水化;将切片放入装有沸腾的抗原修复液的烧杯中,保鲜膜封闭烧杯口,将烧杯沸水浴15 min 后取出自然冷却至室温,完成抗原修复,PBS清洗3遍后,用3%过氧化氢浸泡10 min;5%马血清室温封闭30 min。吸弃封闭液,加入一抗,于4 ℃孵育过夜;吸弃一抗,PBS清洗3次后,加入HRP标记的二抗,室温孵育30 min;PBS清洗3遍后加入ABC混合液,室温孵育30 min;PBS清洗3遍后进行DAB显色,显微镜下观察,适当情况下终止与底物反应,苏木青复染,透明,封片。免疫组化评分方法:是染色强度与染色区域的乘积,在本文中,胞浆中显示棕色信号的现象定义为eIF4A1阳性反应。染色强度的分数定义:阴性为0分,弱阳性为1分,中等阳性为2分,强阳性为3分;染色区域的分数定义:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。评分结果为0~7分认为是低表达,8~12分认为是高表达。
1.3.2 胃癌组织RNA提取 将临床收集的胃癌及相应的正常对照组织速冻于液氮中,用研钵进行研磨,研磨至粉末状,加入1 mL TRIzol裂解充分,室温放置5 min,加入200 μL氯仿,剧烈涡旋 10 s,冰上放置10 min,4℃,12 000 r/min,离心10 min,小心吸取上清至新的无RNA酶的EP管中,加入等体积的异丙醇,-20 ℃沉淀1 h,4 ℃, 12 000 r/min,离心10 min,小心弃上清,加入75%乙醇,4 ℃,7 600 r/min,离心5 min,小心弃上清,瞬时离心10 s,吸弃痕液,室温风干5~10 min,加入适量的DEPC水溶解RNA。
1.3.3 RT-PCR 提取好的RNA进行浓度测定,各取1 μg RNA参照逆转录试剂盒(ThermoFisher Scientific,货号18080200)说明书进行逆转录合成cDNA。将cDNA进行一定的稀释,作为RT-PCR的模板,参照荧光定量PCR试剂盒(SYBR染料法)(ThermoFisher Scientific,货号11746100)说明书进行RT-PCR。mRNA相对表达水平的定量采用比较Ct法来计算相对定量,内参选择GAPDH,胃癌组织及相应的正常对照组织中eIF4A1 mRNA的相对表达水平为eIF4A1与GAPDH的2-△△Ct比值。
1.3.4 Western blot 将临床收集的胃癌及相应的正常对照组织速冻于液氮中,用研钵进行研磨,研磨至粉末状,加入适量的Western-blot裂解液,冰上裂解30 min,加入上样缓冲液,沸水浴10 min,冰上放置10 min,上样进行SDS-PAGE分离。低压湿转(12 V,13 h),加入10%脱脂牛奶室温封闭2 h,加入一抗,室温孵育4 h,加入相应的二抗,室温孵育1 h,加入显色液进行显影、定影。
1.3.5 MTT检测胃癌细胞株活性 分别用胰酶消化对数生长期的胃癌细胞株AGS、MGC-803,细胞计数,制备浓度为2×103个/100 μL的细胞悬液,按每孔100 μL的量接种96孔板,于5%CO2、37 ℃的培养箱培养12 h。小心吸弃培养上清,换成新鲜的含不同浓度hippuristanol(0.125、0.25、0.5、1、2 μmol/L)或DMSO(添加体积与 2 μmol/L hippuristanol对应的添加量相同)的培养基,于处理后不同时间点(12、24 h),MTT分析hippuristanol对胃癌细胞株的增殖情况。
1.3.6 Transwell实验 分别用胰酶消化对数生长期的胃癌细胞株AGS、MGC-803,细胞计数,稀释成浓度为2.5×104个/100 μL的细胞悬液,取200 μL细胞悬液接种于Transwell上室(12 μm),每种细胞系设置2组(DMSO组和hippuristanol组),DMSO组的Transwell下室添加500 μL含DMSO的培养基,hippuristanol组的Transwell下室添加500 μL含0.125 μMhippuristanol的培养基,于5%CO2、37 ℃的培养箱继续培养12 h,吸弃培养上清,细胞用0.1%的结晶紫染色,对Transwell下室的细胞计数。
1.3.7 划痕实验 用marker笔在6孔板背面均匀划5条横线,间隔1 cm,分别将胃癌细胞株AGS、MGC-803按1×105个/孔接种在背面已划线的6孔板中,于5%CO2、37 ℃的培养箱培养至细胞长成单层后,用灭菌的枪头垂直于背面的横线划痕,PBS洗去划落的细胞,换成含DMSO或者hippuristanol(0.125 μmol/L)的无血清培基,于5%CO2、37 ℃的培养箱继续培养,于0、12 h拍照并测量划痕宽度,计算迁移率。
1.4 统计学处理
所有实验数据均采用双样本等方差t检验进行处理,P<0.05为差异有统计学意义。
2 结 果
2.1 eIF4A1在胃癌及正常组织中的表达
收集116例病理确诊的胃癌标本,免疫组化结果显示,大部分患者(98例)癌组织中eIF4A1的表达水平明显高于相应的癌旁正常组织eIF4A1的表达,癌组织的eIF4A1免疫组化积分明显高于癌旁正常组织[(8.34±3.21)vs.(0.65±1.65),P=0.00](图1A)。随机选择其中4对的标本,通过Western blot及RT-PCR技术进一步验证eIF4A1在胃癌组织中高表达,结果与免疫组化结果相一致(图1B-C)。
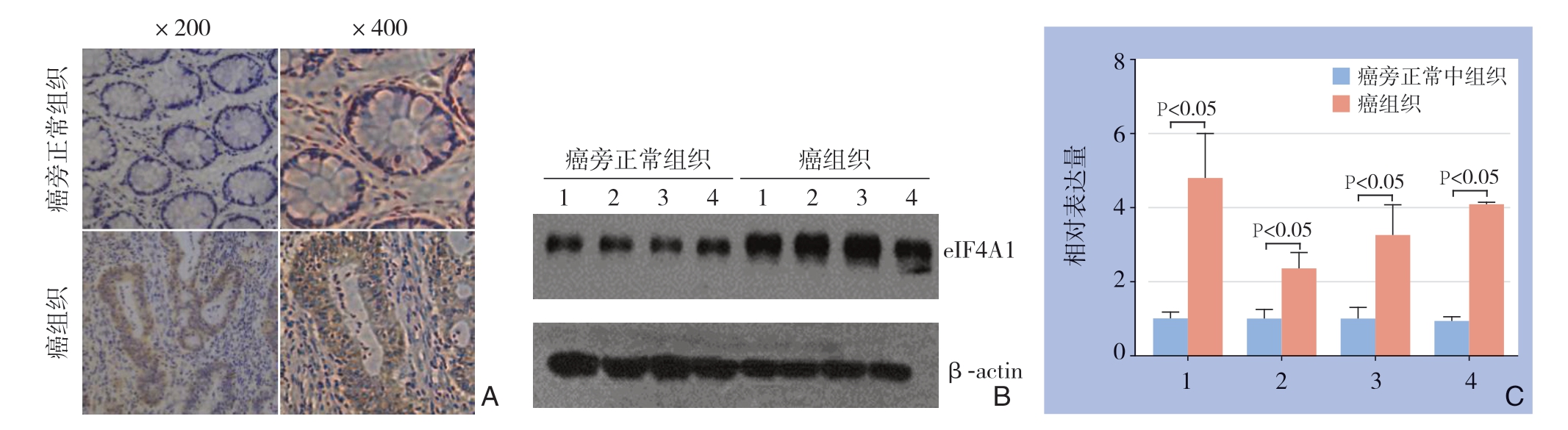
图1 eIF4A1在胃癌及癌旁正常组织中的表达
Figure 1 Expressions of eIF4A1 in gastric cancer and adjacent normal tissues analysis; C:RT-PCR results
A:免疫组化检测;B:Western blot检测;C:RT-PCR检测
A: Immunohistochemical staining; B: Western blot
2.2 hippuristanol对胃癌细胞及正常胃黏膜细胞增殖的影响
不同浓度hippuristanol处理胃癌细胞株AGS、MGC-803,不同时间点MTT法分析细胞的存活率,结果显示hippuristanol抑制胃癌细胞株的增殖呈浓度依赖及时间依赖关系;此外,为了研究hippuristanol对正常细胞的影响,本研究用不同浓度hippuristanol处理人胃黏膜上皮细胞(GES-1)24 h,结果显示,hippuristanol的浓度低于0.5 μmol/L时,对GES-1细胞的抑制效果不明显(图2)。综合以上结果发现,0.125 μmol/L的hippuristanol处理3种细胞(AGS、MGC-803及GES-1) 24 h,细胞存活率均高于50%,故后续的研究中hippuristanol的处理浓度为0.125 μM,处理时间 为24 h。
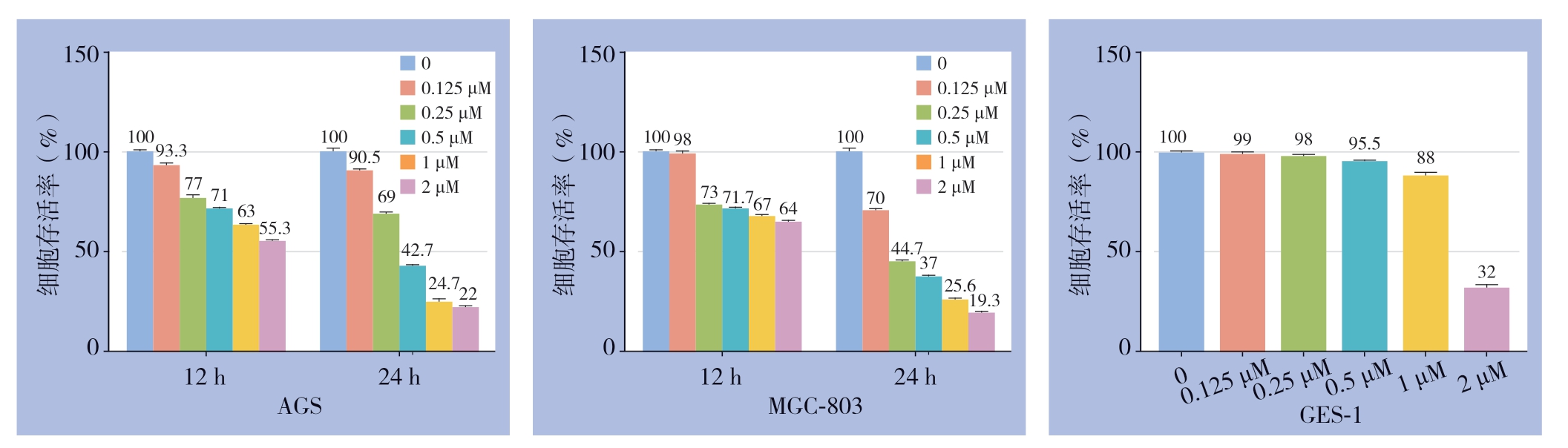
图2 hippuristanol对胃癌细胞及正常胃黏膜细胞增殖的影响
Figure 2 Influences of hippuristanol on proliferative abilities in gastric cells and normal gastric mucosa cells
2.3 hippuristanol对胃癌细株侵袭的影响
Transwell实验结果显示,0.125 μmol/L的hippuristanol处理24 h,胃癌细胞株AGS、MGC-803的侵袭能力明显减弱(均P<0.05)(图3)。
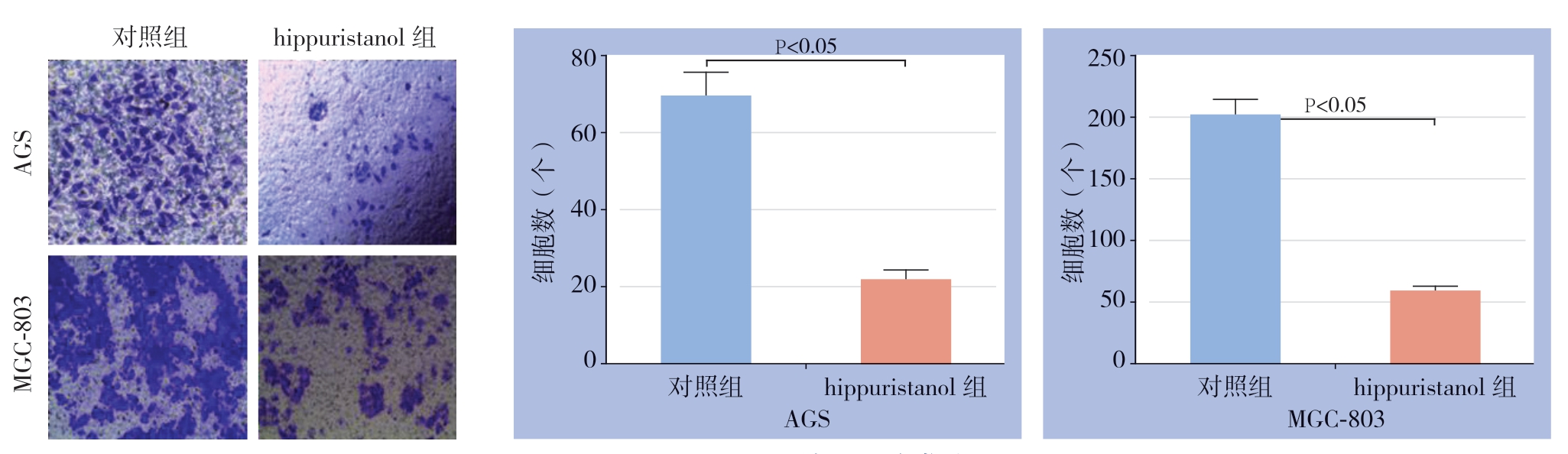
图3 Transwell实验检测细胞袭能力
Figure 3 Invasion ability of the cells determined by Transwell assay
2.4 hippuristanol对胃癌细胞株迁移能力的影响

图4 划痕实验检测细胞迁移能力
Figure 4 Migration ability of the cells determined by scratch assay
A:AGS;B:MGC-803
A:AGS;B:MGC-803
划痕实验结果显示,0.125 μmol/L的hippuristanol处理24 h,胃癌细胞株AGS、MGC-803的迁移能力被明显抑制(均P<0.05)(图4)。
3 讨 论
目前早期胃癌可以通过内镜或者手术切除,但对于局限性进展期胃癌来说,通过手术治疗辅以化疗的综合治疗方案仍是临床的一线治疗方案,术后化疗的成败是直接影响患者的复发、转移及生存预后的关键因素,成为制约胃癌治疗疗效的瓶颈。胃癌常用的化疗药是5-氟尿嘧啶,奥沙利铂,丝裂霉素,阿霉素等,易出现耐药。因此,发现新的抗肿瘤靶点,有助于开发新型抗肿瘤药物,提高胃癌的化疗效果。
失控的翻译进程会引起多种不良后果,包括引发癌症、维持癌症表型、支持血管生成和调节药物反应[3-4],如真核生物翻译起始因子eIF4F的功能异常与癌症的进展和转移有关,因此,控制癌细胞内失控的翻译可能是开发新型抗肿瘤药物的关键点。eIF4F是由eIF4A、eIF4E、eIF4G共同形成的复合体,负责招募核糖体到mRNA,形成预起始复合体,其中,eIF4A作为一种RNA解旋酶,重塑邻近mRNA帽子附近的二级结构[11-13],促进帽子依赖的mRNA的翻译。哺乳动物体内eIF4A有2种蛋白,分别为eIF4A1和eIF4A2[14],两者的序列相似度接近90%,但是功能却各异,eIF4A1的生物学功能更强,所以,通常说eIF4A的活性是指eIF4A1的活性[15-16]。多个研究团队发现,eIF4A1与癌症的恶性表型相关:在ER-的乳腺癌中eIF4A1的过表达,引起翻译图谱发生改变,与乳腺癌的恶性表型相关,且预后不良[17];成人T细胞白血病中,eIF4A在肿瘤细胞内的表达水平显著高于正常的外周血单核细胞中的表达[17]。抑制eIF4A1的活性,显著下调一些致癌基因的表达,包括MYC、cyclin D1、Bcl-x及MUC1[17-19]。
近年来,多种靶向eIF4A的小分子抑制剂被鉴定,包括silvestrol[20]、rocaglates[21]、hippuristanol[22]等。hippuristanol是一种天然提取物,能够选择性靶向eIF4A1[22],使eIF4A1处于紧密型的构象,不利于其与mRNA的结合,抑制eIF4A1的解旋酶活性,进而阻碍eIF4A1进入翻译起始过程[7]。hippuristanol作为单一的药剂已显示出抗肿瘤的前景,hippuristanol能够抵抗成人T细胞白血病[23];此外,在原发性渗出性淋巴瘤模型上,hippuristanol通过诱导翻译休止,并诱导细胞凋亡[10]。
国内学者韦尉元及谢东毅等[24-25]通过体外研究发现,eIF4A抑制剂silvestrol不影响胃癌细胞株SGC-7901的增殖但抑制其侵袭和迁移能力,沉默eIF4A,会促进细胞凋亡,抑制胃癌细胞的增殖和迁移[25]。本文的研究结果显示,hippuristanol抑制胃癌细胞株的增殖呈时间依赖和浓度依赖,且会抑制胃癌细胞株的侵袭及迁移。这2种eIF4A抑制剂对胃癌细胞的增殖表现出不同的结果,可能归因于这2种抑制剂的来源不同,hippuristanol是一种来自海洋生物的提取物,silvestrol是一种来自植物的提取物。hippuristanol尽管对胃癌细胞有一定的抑制作用,但其对人胃黏膜上皮细胞的增殖的抑制作用不显著,这也证实了eIF4A被抑制,只会影响一部分mRNA翻译,造成翻译不成比例的选择性改变。
本研究发现,与正常胃黏膜相比,胃癌组织中eIF4A1的表达显著上调,预示eIF4A1可能有助于胃癌的进展。hippuristanol在血液性肿瘤中表现出较好的抗肿瘤效果,本研究选择胃癌作为研究对象,探讨hippuristanol对实体瘤的效果,体外实验结果显示,hippuristanol显著抑制胃癌细胞株的增殖,且呈时间依赖和浓度依赖关系,进一步研究发现hippuristanol抑制胃癌细胞的侵袭和迁移,下一步笔者将在胃癌异种移植瘤模型(patientderived tumor xenograft,PDX)上进一步验证hippuristanol对胃癌的抑制作用,同时,将探讨联合使用hippuristanol与奥沙利铂等抗肿瘤药物对肿瘤的协同致死作用。期以为胃癌药物的开发及化疗增敏提供理论基础。
[1]Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1):7-30. doi: 10.3322/caac.21442.
[2]Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. doi: 10.3322/caac.21492.
[3]Pelletier J, Graff J, Ruggero D, et al. Targeting the eIF4F translation initiation complex: a critical nexus for cancer development[J]. Cancer Res, 2015, 75(2):250-263. doi: 10.1158/0008-5472.CAN-14-2789.
[4]Bhat M, Robichaud N, Hulea L, et al. Targeting the translation machinery in cancer [J]. Nat Rev Drug Discov, 2015, 14(4): 261-278. doi: 10.1038/nrd4505.
[5]Cencic R, Pelletier J. Hippuristanol - A potent steroid inhibitor of eukaryotic initiation factor 4A[J]. Translation (Austin), 2016, 4(1):e1137381. doi: 10.1080/21690731.2015.1137381.
[6]Chu J, Pelletier J. Targeting the eIF4A RNA helicase as an antineoplastic approach[J]. Biochim Biophys Acta, 2015, 1849(7):781-791. doi: 10.1016/j.bbagrm.2014.09.006.
[7]Sun Y, Atas E, Lindqvist LM, et al. Single-molecule kinetics of the eukaryotic initiation factor 4AI upon RNA unwinding[J]. Structure, 2014, 22(7):941-948. doi: 10.1016/j.str.2014.04.014.
[8]Harms U, Andreou AZ, Gubaev A, et al. eIF4B, eIF4G and RNA regulate eIF4A activity in translation initiation by modulating the eIF4A conformational cycle[J]. Nucleic Acids Res, 2014, 42(12):7911-7922. doi: 10.1093/nar/gku440.
[9]Cole WG, Campbell PE, Rogers JG, et al. The clinical features of osteogenesis imperfecta resulting from a non-functional carboxy terminal pro alpha 1(I) propeptide of type I procollagen and a severe deficiency of normal type I collagen in tissues[J]. J Med Genet, 1990, 27(9): 545-551. doi: 10.1136/jmg.27.9.545.
[10]Ishikawa C, Tanaka J, Katano H, et al. Hippuristanol reduces the viability of primary effusion lymphoma cells both in vitro and in vivo[J]. Mar Drugs, 2013, 11(9):3410-3424. doi: 10.3390/md11093410.
[11]Villa N, Do A, Hershey JW, et al. Human eukaryotic initiation factor 4G (eIF4G) protein binds to eIF3c, -d, and -e to promote mRNA recruitment to the ribosome[J]. J Biol Chem, 2013, 288(46):32932-32940. doi: 10.1074/jbc.M113.517011.
[12]Korneeva NL, Lamphear BJ, Hennigan FL, et al. Mutually cooperative binding of eukaryotic translation initiation factor (eIF) 3 and eIF4A to human eIF4G-1[J]. J Biol Chem, 2000, 275(52):41369-41376. doi: 10.1074/jbc.M007525200.
[13]Lamphear BJ, Kirchweger R, Skern T, et al. Mapping of functional domains in eukaryotic protein synthesis initiation factor 4G (eIF4G) with picornaviral proteases. Implications for cap-dependent and cap-independent translational initiation[J]. J Biol Chem, 1995, 270(37):21975-21983. doi: 10.1074/jbc.270.37.21975.
[14]Nielsen PJ, Trachsel H. The mouse protein synthesis initiation factor 4A gene family includes two related functional genes which are differentially expressed[J]. EMBO J, 1988, 7(7):2097-2105.
[15]Nielsen PJ, McMaster GK, Trachsel H. Cloning of eukaryotic protein synthesis initiation factor genes: isolation and characterization of cDNA clones encoding factor eIF-4A[J]. Nucleic Acids Res, 1985, 13(19):6867-6880. doi: 10.1093/nar/13.19.6867.
[16]Galicia-Vázquez G, Chu J, Pelletier J. eIF4AII is dispensable for miRNA-mediated gene silencing[J]. RNA, 2015, 21(10):1826-1833. doi: 10.1261/rna.052225.115.
[17]Modelska A, Turro E, Russell R, et al. The malignant phenotype in breast cancer is driven by eIF4A1-mediated changes in the translational landscape[J]. Cell Death Dis, 2015, 6:e1603. doi: 10.1038/cddis.2014.542.
[18]Jin C, Rajabi H, Rodrigo CM, et al. Targeting the eIF4A RNA helicase blocks translation of the MUC1-C oncoprotein[J]. Oncogene, 2013, 32(17):2179-2188. doi: 10.1038/onc.2012.236.
[19]Castell A, Larsson LG. Targeting MYC Translation in Colorectal Cancer[J]. Cancer Discov, 2015, 5(7):701-703. doi: 10.1158/2159-8290.CD-15-0660.
[20]Hwang BY, Su BN, Chai H, et al. Silvestrol and episilvestrol, potential anticancer rocaglate derivatives from Aglaia silvestris[J]. J Org Chem, 2004, 69(10):3350-3358. doi: 10.1021/jo040120f.
[21]Chu J, Cencic R, Wang W, et al. Translation Inhibition by Rocaglates Is Independent of eIF4E Phosphorylation Status[J]. Mol Cancer Ther, 2016, 15(1):136-141. doi: 10.1158/1535-7163.MCT-15-0409.
[22]Bordeleau ME, Mori A, Oberer M, et al. Functional characterization of IRESes by an inhibitor of the RNA helicase eIF4A[J]. Nat Chem Biol, 2006, 2(4):213-220. doi: 10.1038/nchembio776.
[23]Tsumuraya T, Ishikawa C, Machijima Y, et al. Effects of hippuristanol, an inhibitor of eIF4A, on adult T-cell leukemia[J]. Biochem Pharmacol, 2011, 81(6):713-722. doi: 10.1016/j.bcp.2010.12.025.
[24]韦尉元, 陈建思, 覃宇周, 等. EIF4A1在胃癌组织中表达及其抑制剂对人胃癌细胞株增殖、存活、侵袭、迁移能力影响观察[J]. 山东医药, 2018, 58(39):9-12. doi:10.3969/j.issn.1002-266X.2018.39.003.Wei WY, Chen JS, Qin YZ, et al. Expression of EIF4A1 in gastric cancer and effects of EIF4A1 inhibitor on proliferation, invasion, and migration of human gastric cancer cells[J]. Shandong Medical Journal, 2018, 58(39):9-12. doi:10.3969/j.issn.1002-266X.2018.39.003.
[25]谢东毅, 韦尉元, 吴锟, 等. eIF4A1基因沉默对胃癌SGC-7901细胞生物学行为影响机制的探讨[J]. 中国临床新医学, 2018, 11(4):315-320. doi:10.3969/j.issn.1674-3806.2018.04.01. Xie DY, Wei WY, Wu K, et al. Effect of eIF4A1 gene silencing on biological behavior of SGC-7901 in gastric cancer[J]. Chinese Journal of New Clinical Medicine, 2018, 11(4):315-320. doi:10.3969/j.issn.1674-3806.2018.04.01.
