肝癌是人类最致命的恶性肿瘤之一,每年约有85万新病例发生,且逐年上升[1];是全球第二大癌症相关死亡原因,每年全球肝癌死亡人数超过 60万人[2-3]。肝切除术被认为是肝癌的标准治疗方法[4]。有研究[5-6]证实,肝切除是肝癌患者的最佳治疗选择,5年总生存率为50%~70%,可显著改善患者生活质量,并延长生存期。早在20世纪80年代之前,肝硬化患者行肝切除术的病死率相对较高,为10%~30%[7]。随着患者选择、手术技术和术后护理的改善,近10年来病死率显著降低[8]。文献[9]报道肝癌肝切除术后30 d的手术病死率为1.8%。肝癌肝切除术后早期病死率的高低与术后感染的发生密切相关,术后感染会严重影响患者预后[10],因此降低术后感染发生率是临床主要关注的问题之一。本研究回顾性总结回顾性总结患者的临床资料和术后情况,探讨术后感染发生率、感染患者的住院天数和治疗费用、病原菌的分布和构成比、药敏结果,分析感染的影响因素,以期为降低肝癌肝切除患者的早期病死率和延长远期生存提供有效的依据。
1 资料与方法
1.1 一般资料
选择2016年3月—2018年3月于我院确诊为肝癌且接受肝部分切除术的患者89例。纳入标准:⑴ 术后经病理诊断为原发性肝细胞癌;⑵ 满足肝部分切除手术指征;⑶ 肿瘤数目<3个;⑷ 无肝外转移;⑸ 肝肾肺功能正常;⑹ 病历资料完整。排除标准:⑴ 病理学证实为继发性肝肿瘤;⑵ 术中发生肿瘤破裂;⑶ 术中证实侵犯肝外组织;⑷ 病历资料不全;⑸ 随访资料不全。本研究经我院伦理委员会批准,且所有患者及家属知情同意并签署协议书。
1.2 方法
1.2.1 手术方法 肝段切除41例,半肝切除37例,扩大半肝切除11例。术后均给予保肝和抗炎等对症治疗。
1.2.2 采集患者资料 ⑴ 一般资料:性别、年龄、体质量指数、白蛋白(ALB)、丙氨酸转氨酶(ALT)、谷草转氨酶(AST)、肝功能分级、糖尿病、吸烟史;⑵ 手术资料:手术时间、术中失血量、输血量、术中损伤左右肝管情况、术后排气时间、术后排便时间;⑶ 病理资料:肿瘤数目、最大直径、分化程度;⑷ 术后情况:术后感染情况、住院天数、治疗费用、腹腔引流管留置时间。
1.2.3 感染标本来源 ⑴ 呼吸道感染患者采集痰液标本;⑵ 切口感染患者取切口周围脓液标本;⑶ 泌尿系统感染患者采集尿液标本;⑷ 腹腔感染患者收集腹腔引流液标本。
1.2.4 病原菌分析 采用法国生物梅里埃公司VITEK-2型仪器行细菌鉴定,采用K-B试纸条行药敏试验,依据NCCLS标准行药敏结果判断。
1.3 统计学处理
采用SPSS 20.0分析数据,计数资料采用率(%)表示,组间比较采用χ2检验;计量资料采用均数±标准差( ±s)表示,组间比较采用t检验;多因素分析采用Logistic多元回归分析法。以P<0.05为差异有统计学意义。
±s)表示,组间比较采用t检验;多因素分析采用Logistic多元回归分析法。以P<0.05为差异有统计学意义。
2 结 果
2.1 患者临床资料及术后感染率
肝癌肝切除89例患者的详细资料见表1,其中17例发生术后感染,感染率为19.1%。
2.2 术后感染患者与非感染患者的住院天数和治疗费用比较
感染患者的住院天数和治疗费用均较非感染患者高,差异有统计学意义(P<0.05)(表2)。
表1 肝癌肝切除患者资料(n=89)

项目数据性别[n(%)]男54(60.7) 女35(39.3)年龄[范围(images/BZ_15_1000_2138_1036_2179.png±s)]40~75(52.1±4.5)体质量指数(kg/m2)22.1±2.2 ALB(g/L,images/BZ_15_1000_2138_1036_2179.png±s)44.6±3.9 ALT(U/L,images/BZ_15_1000_2138_1036_2179.png±s)51.3±4.3 AST(U/L,images/BZ_15_1000_2138_1036_2179.png±s)57.4±5.1肝功能分级[n(%)]A级78(87.6) B级11(12.4)糖尿病[n(%)]有16(18.0) 无73(82.0)吸烟史[n(%)]有48(54.0) 无41(46.0)手术时间(min,images/BZ_15_1000_2138_1036_2179.png±s)219.3±15.7术中失血量(mL,images/BZ_15_1000_2138_1036_2179.png±s)1357.2±141.6输血量(mL,images/BZ_15_1000_2138_1036_2179.png±s)697.2±70.4术中损伤左右肝管[n(%)]有21(23.6) 无68(76.4)术后排气时间(h,images/BZ_15_1000_2138_1036_2179.png±s)51.2±4.6术后排便时间(h,images/BZ_15_1000_2138_1036_2179.png±s)62.7±7.2肿瘤数目(个,images/BZ_15_1000_2138_1036_2179.png±s)1.2±0.2最大直径(cm,images/BZ_15_1000_2138_1036_2179.png±s)5.1±0.5分化程度[n(%)]高44(49.4) 中25(28.1) 低20(22.5)住院天数(d,images/BZ_15_1000_2138_1036_2179.png±s)29.2±2.4治疗费用(元,images/BZ_15_1000_2138_1036_2179.png±s)62 348.7±4 518.5腹腔引流管留置时间(d,images/BZ_15_1000_2138_1036_2179.png±s)6.2±0.8
表2 感染患者与非感染患者的住院天数和治疗费用比较 ( ±s)
±s)
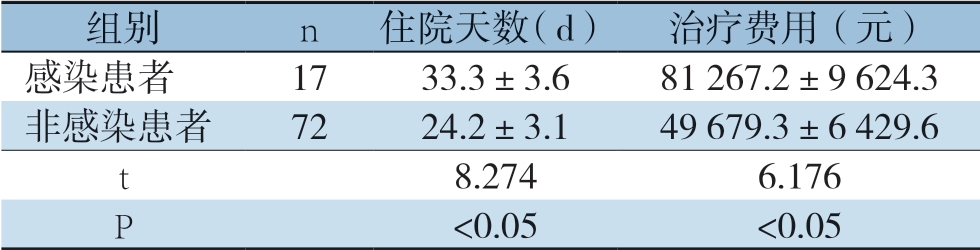
组别n住院天数(d)治疗费用(元)感染患者1733.3±3.681 267.2±9 624.3非感染患者7224.2±3.149 679.3±6 429.6 t 8.2746.176 P<0.05<0.05
2.3 术后感染病原菌分布分析
共培养分离病原菌41株,其中革兰氏阴性菌24株,占比58.5%;革兰氏阳性菌16株,占比39.0%;真菌1株,占比2.4%(表3)。
2.4 术后感染患者病原菌药敏结果分析
革兰氏阴性菌以大肠埃希菌为主,对头孢唑林、头孢曲松、氨苄西林耐药性较高,对头孢唑肟、亚胺培南、哌拉西林舒巴坦及头孢哌酮较敏感;革兰氏阳性菌以肠球菌为主,对氨苄西林、克林霉素耐药性较高,对万古霉素、替考拉宁、利福平较敏感。
表3 感染患者病原菌分布(n=41)
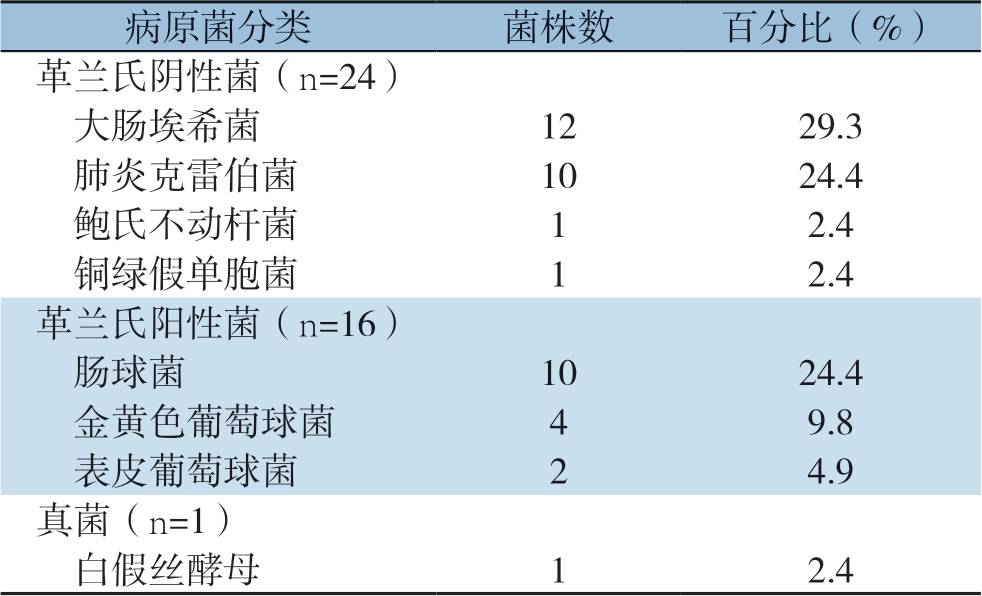
病原菌分类菌株数百分比(%)革兰氏阴性菌(n=24) 大肠埃希菌1229.3 肺炎克雷伯菌1024.4 鲍氏不动杆菌12.4 铜绿假单胞菌12.4革兰氏阳性菌(n=16) 肠球菌1024.4 金黄色葡萄球菌49.8 表皮葡萄球菌24.9真菌(n=1) 白假丝酵母12.4
2.5 术后感染患者的单因素分析
感染与非感染患者的年龄、ALB、肝功能分级、糖尿病、手术时间、术中失血量、输血量、术中损伤左右肝管、腹腔引流管留置时间对比有统计学差异(P<0.05)(表4)。
2.6 肝癌肝切除术后感染患者的多因素分析
Logistic多元回归模型分析结果显示年龄、ALB、糖尿病、术中失血量、输血量、术中损伤左右肝管、腹腔引流管留置时间为肝癌患者术后感染的独立危险因素(P<0.05)(表5)。
表4 肝癌肝切除术后感染患者的单因素分析
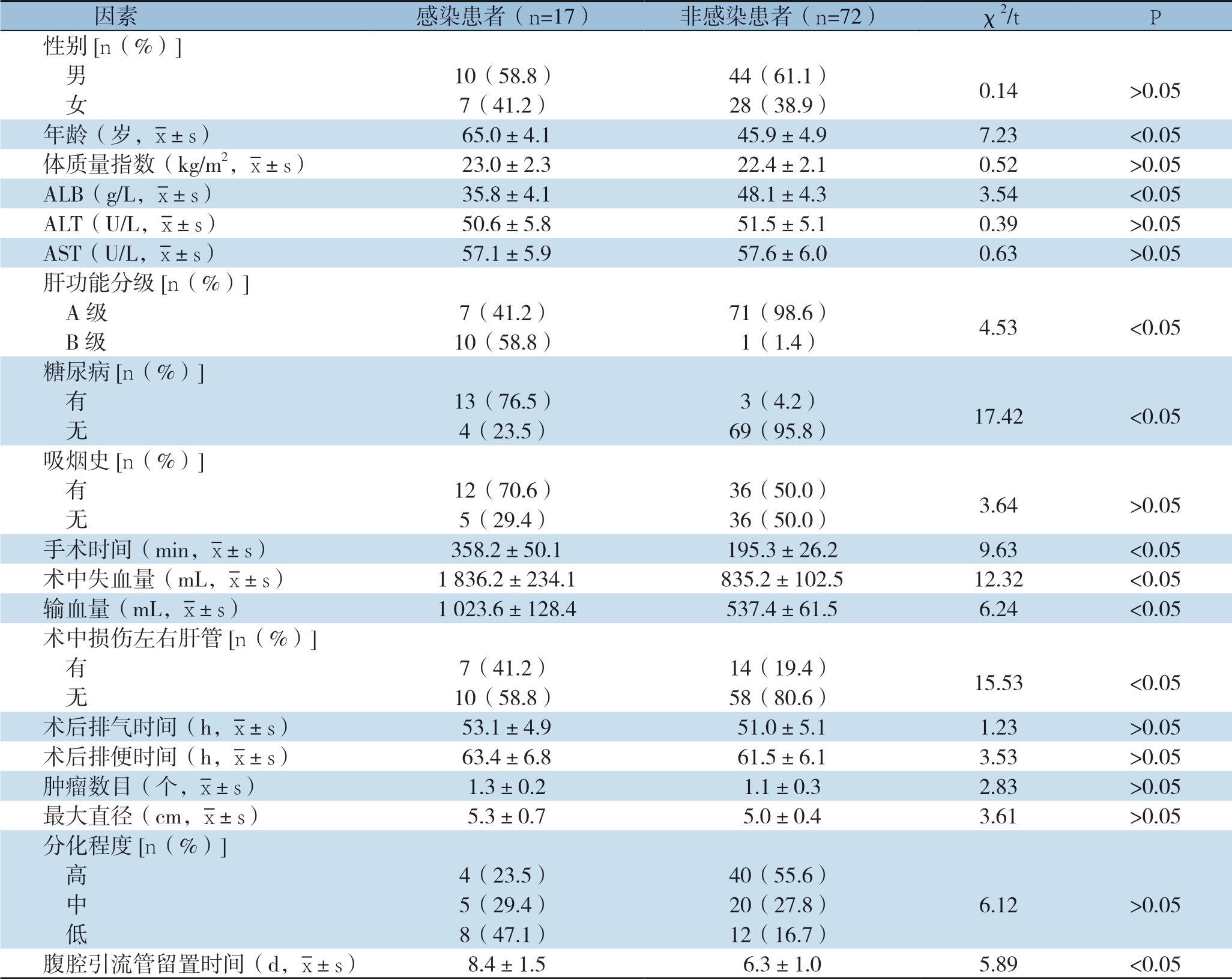
因素感染患者(n=17)非感染患者(n=72)χ2/tP性别[n(%)]男10(58.8)44(61.1)0.14>0.05 女7(41.2)28(38.9)年龄(岁,images/BZ_15_1000_2138_1036_2179.png±s)65.0±4.145.9±4.97.23<0.05体质量指数(kg/m2,images/BZ_15_1000_2138_1036_2179.png±s)23.0±2.322.4±2.10.52>0.05 ALB(g/L,images/BZ_15_1000_2138_1036_2179.png±s)35.8±4.148.1±4.33.54<0.05 ALT(U/L,images/BZ_15_1000_2138_1036_2179.png±s)50.6±5.851.5±5.10.39>0.05 AST(U/L,images/BZ_15_1000_2138_1036_2179.png±s)57.1±5.957.6±6.00.63>0.05肝功能分级[n(%)]A级7(41.2)71(98.6)4.53<0.05 B级10(58.8)1(1.4)糖尿病[n(%)]有13(76.5)3(4.2)17.42<0.05 无4(23.5)69(95.8)吸烟史[n(%)]有12(70.6)36(50.0)3.64>0.05 无5(29.4)36(50.0)手术时间(min,images/BZ_15_1000_2138_1036_2179.png±s)358.2±50.1195.3±26.29.63<0.05术中失血量(mL,images/BZ_15_1000_2138_1036_2179.png±s)1 836.2±234.1835.2±102.512.32<0.05输血量(mL,images/BZ_15_1000_2138_1036_2179.png±s)1 023.6±128.4537.4±61.56.24<0.05术中损伤左右肝管[n(%)]有7(41.2)14(19.4)15.53<0.05 无10(58.8)58(80.6)术后排气时间(h,images/BZ_15_1000_2138_1036_2179.png±s)53.1±4.951.0±5.11.23>0.05术后排便时间(h,images/BZ_15_1000_2138_1036_2179.png±s)63.4±6.861.5±6.13.53>0.05肿瘤数目(个,images/BZ_15_1000_2138_1036_2179.png±s)1.3±0.21.1±0.32.83>0.05最大直径(cm,images/BZ_15_1000_2138_1036_2179.png±s)5.3±0.75.0±0.43.61>0.05分化程度[n(%)]高4(23.5)40(55.6) 中5(29.4)20(27.8)6.12>0.05 低8(47.1)12(16.7)腹腔引流管留置时间(d,images/BZ_15_1000_2138_1036_2179.png±s)8.4±1.56.3±1.05.89<0.05
表5 术后感染患者的多因素分析
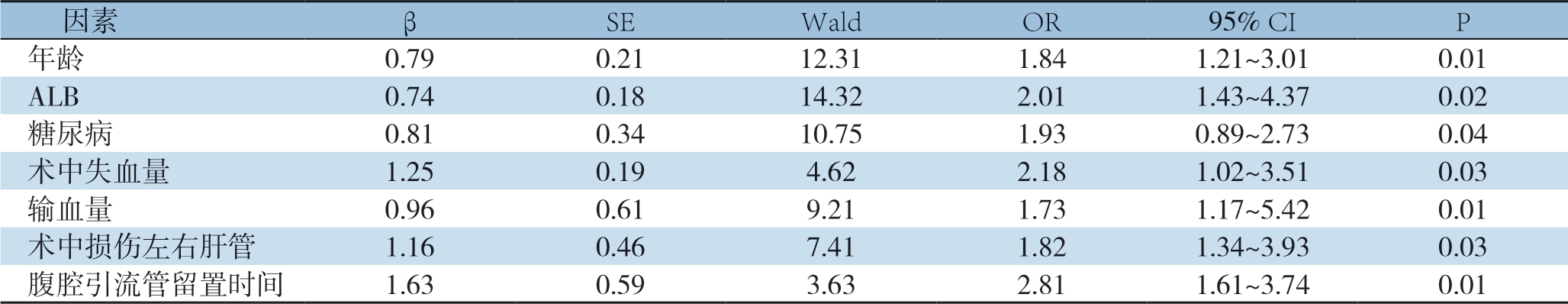
因素βSEWaldOR95% CIP年龄0.790.2112.311.841.21~3.010.01 ALB0.740.1814.322.011.43~4.370.02糖尿病0.810.3410.751.930.89~2.730.04术中失血量1.250.194.622.181.02~3.510.03输血量0.960.619.211.731.17~5.420.01术中损伤左右肝管1.160.467.411.821.34~3.930.03腹腔引流管留置时间1.630.593.632.811.61~3.740.01
3 讨 论
原发性肝癌包括肝细胞癌(hepatocellular carcinoma,HCC)是全球第五大最常诊断的癌症[11]。尽管亚洲国家中肝细胞癌病例占全球70%以上[12-13],但西方国家中其发病率和病死率的上升趋势已被报道[14]。手术切除仍然是患者最有效的治疗选择[15-17],术后感染与患者早期病死率和复发率相关,因此降低术后感染发生率至关重要[18],本研究旨在探讨肝癌肝切除术后感染的病原学特征与影响因素。
本研究回顾性分析了89例患者的临床资料发现,17例发生术后感染,感染率为19.1%。感染患者的住院天数和治疗费用均较非感染患者高,差异有统计学意义(P<0.05)。可见术后感染的发生会明显导致患者住院时间的延长及治疗费用的增加,消耗了紧缺的社会资源,并给家庭造成沉重的经济负担。
了解病原菌的分布情况,掌握病原菌的药敏结果,选择有效的治疗药物对于治疗术后感染非常关键[19-20]。在本研究中共培养分离病原菌41株,其中革兰氏阴性菌24株,占比58.5%;革兰氏阳性菌16株,占比39.0%;真菌1株,占比2.4%。革兰氏阴性菌以大肠埃希菌为主,对头孢唑肟、亚胺培南、哌拉西林舒巴坦及头孢哌酮较敏感;革兰氏阳性菌以肠球菌为主,对万古霉素、替考拉宁、利福平较敏感。与相关研究结果一致[21]。临床上根据细菌培养及药敏实验有针对性的选择敏感药物使所有感染患者得到有效治疗,未发现术后感染致死亡病例。
进一步分析感染患者的临床特征发现,感染与非感染患者的年龄、ALB、肝功能分级、糖尿病、手术时间、术中失血量、输血量、术中损伤左右肝管、腹腔引流管留置时间比较均有统计学差异(P<0.05)。Logistic多元回归模型分析结果显示年龄、ALB、糖尿病、术中失血量、输血量、术中损伤左右肝管、腹腔引流管留置时间为肝癌患者术后感染的独立危险因素(P<0.05)。具体分析如下:老年患者的机体免疫能力和各脏器功能相对较弱,术后恢复能力较差,因此患者年龄越大,术后并发感染的几率越大;ALB可反映患者的营养状况及肝脏的储备能力,因此ALB较低时术后感染发生率高;由于糖尿病患者本身易并发各种感染,故导致术后感染发生率增高;术中失血较多导致机体缺血,会损害肝细胞功能,并导致机体水电解质及酸碱平衡的紊乱,降低机体免疫力;短时间内大量输血会使患者循环负荷迅速增加,有可能引起应激反应和免疫反应,均可导致感染率的升高;术中损伤左右肝管对肝脏损伤的增大使机体恢复较慢,增加了感染发生的几率;长时间的放置引流管会增加感染风险。以上与相关研究结果[10,22-26]相符。肝功能分级可反映肿瘤恶性程度和肝脏炎症情况,因此B级患者的感染发生率较A级高,但多因素分析未显示其为术后感染的独立危险因素,与宋晨鑫等[10]研究不一致,可能与本资料病例数较少有关。尽管已有多项研究分析了肝癌肝切除患者术后危险因素,但本文分析的临床因素较多,以期更全面地总结风险因素,为临床提供完善的指导依据。
综上所述,肝癌是预后较差的恶性肿瘤[27],本研究系统分析了我院肝癌肝切除患者术后感染的病原菌分布、药敏结果,并深入剖析了术后感染的独立危险因素,发现肝癌患者术后感染比较常见,病原菌以革兰氏阴性菌为主,建议选择头孢唑肟、亚胺培南、哌拉西林舒巴坦及头孢哌酮等敏感药物控制感染,有助于降低住院天数和治疗费用。年龄、ALB、手术时间、术中失血量、输血量、腹腔引流管留置时间、术中损伤左右肝管、糖尿病为肝癌患者术后感染的独立危险因素,临床医生可提前针对伴有这些危险因素的患者进行密切观察或早期防治,有望降低术后感染的发生风险,以期降低肝癌肝切除患者术后早期病死率,有助于改善肝癌患者预后。
[1]Berretta M, Cavaliere C, Alessandrini L, et al. Serum and tissue markers in hepatocellular carcinoma and cholangiocarcinoma: clinical and prognostic implications[J]. Oncotarget, 2017, 8(8):14192-14220. doi: 10.18632/oncotarget.13929.
[2]Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5):E359-386. doi: 10.1002/ijc.29210.
[3]Lee Y, Park H, Lee H, et al. The clinicopathological and prognostic significance of the Gross classification of hepatocellular carcinoma[J]. J Pathol Transl Med, 2018, 52(2):85-92. doi: 10.4132/jptm.2017.11.13.
[4]Llovet JM, Zucman-Rossi J, Pikarsky E, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2016, 2:16018. doi: 10.1038/nrdp.2016.18.
[5]王煜, 王峰, 张爱芸, 等. 血清HBV-DNA载量与肝细胞癌患者手术风险的临床关系[J]. 中国普通外科杂志, 2017, 26(7):939-943. doi:10.3978/j.issn.1005-6947.2017.07.020.Wang Y, Wang F, Zhang AY, et al. Clinical relevance of quantity of serum HBV-DNA load and surgical risk of hepatocellular cancer patients[J]. Chinese Journal of General Surgery, 2017, 27(7):939-943. doi: 10.3978/j.issn.1005-6947.2017.07.020.
[6]Chen HW, Deng FW, Wang FJ, et al. Laparoscopic Right Hepatectomy Via an Anterior Approach for Hepatocellular Carcinoma[J]. JSLS, 2018, 22(1). pii: e2017.00084. doi: 10.4293/JSLS.2017.00084.
[7]Matsumata T, Kanematsu T, Shirabe K, et al. Decreased morbidity and mortality rates in surgical patients with hepatocellular carcinoma[J]. Br J Surg, 1990, 77(6):677-680.
[8]Lin HM, Lei LM, Zhu J, et al. Risk factor analysis of perioperative mortality after ruptured bleeding in hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(40):14921-14926. doi: 10.3748/wjg.v20.i40.14921.
[9]Lee CW, Tsai HI, Sung CM, et al. Risk factors for early mortality after hepatectomy for hepatocellular carcinoma[J]. Medicine (Baltimore), 2016, 95(39):e5028. doi: 10.1097/MD.0000000000005028.
[10]宋晨鑫, 丛明华, 邹宝华, 等. 肝癌肝部分切除术后并发感染危险因素分析[J]. 实用癌症杂志, 2018, 33(10):1593-1596. doi:10.3969/j.issn.1001-5930.2018.10.008.Song CX, Cong MH, Zou BH, et al. Analysis of Risk Factors of Infection after Partial Hepatectomy for Hepatocellular Carcinoma[J]. The Practical Journal of Cancer, 2018, 33(10):1593-1596. doi:10.3969/j.issn.1001-5930.2018.10.008.
[11]Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90. doi: 10.3322/caac.20107.
[12]Perz JF, Armstrong GL, Farrington LA, et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide[J]. J Hepatol, 2006, 45(4):529-538. doi: 10.1016/j.jhep.2006.05.013.
[13]Poon D, Anderson BO, Chen LT, et al. Management of hepatocellular carcinoma in Asia: consensus statement from the Asian Oncology Summit 2009 [J]. Lancet Oncol, 2009, 10(11):1111-1118. doi: 10.1016/S1470-2045(09)70241-4.
[14]Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108. doi: 10.3322/caac.21262.
[15]Mohkam K, Rayar M, Adam JP, et al. Evaluation of postoperative ascites after somatostatin infusion following hepatectomy for hepatocellular carcinoma by laparotomy: a multicenter randomized double-blind controlled trial (SOMAPROTECT)[J]. BMC Cancer, 2018, 18(1):844. doi: 10.1186/s12885-018-4667-0.
[16]Lee KF, Wong J, Cheung SYS, et al. Does Intermittent Pringle Maneuver Increase Postoperative Complications After Hepatectomy for Hepatocellular Carcinoma? A Randomized Controlled Trial[J]. World J Surg, 2018, 42(10):3302-3311. doi: 10.1007/s00268-018-4637-3.
[17]Wu X, Li B, Qiu J, et al. Hepatectomy versus hepatectomy with lymphadenectomy in hepatocellular carcinoma: A prospective, randomized controlled clinical tria[J]. J Clin Gastroenterol, 2015, 49(6):520-528. doi: 10.1097/MCG.0000000000000277.
[18]Doussot A, Lim C, Lahat E, et al. Complications after hepatectomy for hepatocellular carcinoma independently shorten survival: A western, single-center audit[J]. Ann Surg Oncol, 2017, 24(6):1569-1578. doi: 10.1245/s10434-016-5746-6.
[19]陈斌泽, 张媛媛, 薛荣利, 等. 某三级医院2012-2015年血培养病原菌分布及其耐药性[J]. 中国感染控制杂志, 2016, 15(3):164-167. doi:10.3969/j.issn.1671-9638.2016.03.005.Chen BZ, Zhang YY, Xue RL, et al. Distribution and antimicrobial resistance of pathogens in blood cultures in a tertiary hospital from 2012 to 2015[J]. Chinese Journal of Infection Control, 2016, 15(3):164-167. doi: 10.3969/j.issn.1671-9638.2016.03.005.
[20]邹颖, 徐晓刚, 郭庆兰, 等. 革兰阴性杆菌血流感染的病原菌分布、耐药性及碳青霉烯酶基因的检测与分析[J]. 中国感染与化疗杂志, 2016, 16(2):214-220. doi:10.16718/j.1009-7708.2016.02.016.Zou Y, Xu XG, Guo QL, et al. Distribution, antibiotic resistance and production of carbapenemases in gramnegative bacteria isolated from blood samples[J]. Chinese Journal of Infection and Chemotherapy, 2016, 16(2):214-220. doi:10.16718/j.1009-7708.2016.02.016.
[21]胡兴龙, 王胜智, 吴敏良, 等. 原发性肝癌患者术后医院感染病原学特点及危险因素分析[J]. 中华医院感染学杂志, 2017, 27(20):4588-4591. doi:10.11816/cn.ni.2017-170892.Hu XL, Wang SZ, Wu ML, et al. Pathogenic characteristics and risk factors of postoperative nosocomial infections in patients with primary hepatic carcinoma[J]. Chinese Journal of Nosocomiology, 2017, 27(20):4588-4591. doi:10.11816/cn.ni.2017-170892.
[22]张风华, 彭和平, 王宝枝, 等. 肝癌肝切除术后感染性并发症的危险因素分析[J]. 中国普通外科杂志, 2015, 24(1):133-135. doi:10.3978/j.issn.1005-6947.2015.01.026.Zhang FH, Peng HP, Wang BZ, et al. Infectious complications after hepatectomy for hepatic cancer: analysis of risk factors[J]. Chinese Journal of General Surgery, 2015, 24(1):133-135. doi:10.3978/j.issn.1005-6947.2015.01.026.
[23]刘清, 惠永丰, 卜稳平, 等. 肝癌患者肝部分切除术后感染相关因素分析[J]. 中华医院感染学杂志, 2017, 27(16):3719-3721. doi:10.11816/cn.ni.2017-170711. Liu Q, Hui YF, Bu WP, et al. Related risk factors for postoperative infections in hepatocellular carcinoma patients undergoing partial hepatectomy[J]. Chinese Journal of Nosocomiology, 2017, 27(16):3719-3721. doi:10.11816/cn.ni.2017-170711.
[24]李妍, 朱绍辉, 张彬. 肝癌患者肝切除术后感染性并发症的相关危险因素分析[J]. 新乡医学院学报, 2016, 33(9):767-769. doi:10.7683/xxyxyxb.2016.09.007.Li Y, Zhu SH, Zhang B. Analysis of the risk factors for infectious complications in patients with hepatocellular carcinoma after hepatectomy[J]. Journal of Xinxiang Medical University, 2016, 33(9):767-769. doi:10.7683/xxyxyxb.2016.09.007.
[25]李辉, 于淼, 刘成科, 等. 肝癌患者肝脏部分切除术后感染的影响因素分析[J]. 中华医院感染学杂志, 2017, 27(24):5611-5614. doi:10.11816/cn.ni.2017-173053.Li H, Yu M, Liu CK, et al. Analysis of influencing factors for infections after partial hepatectomy in patients with liver cancer[J]. Chinese Journal of Nosocomiology, 2017, 27(24):5611-5614. doi:10.11816/cn.ni.2017-173053.
[26]郑毅, 白霞, 许鑫, 等. 原发性肝癌肝切除术后严重并发症的危险因素分析[J]. 广西医科大学学报, 2017, 34(9):1313-1316. doi:10.16190/j.cnki.45-1211/r.2017.09.015.Zheng Y, Bai X, Xu X, et al. Analysis of risk factors for severe postoperative complications after hepatectomy in patients with primary liver cancer[J]. Journal of Guangxi Medical University, 2017, 34(9):1313-1316. doi:10.16190/j.cnki.45-1211/r.2017.09.015.
[27]陈世发, 赵礼金. 肝癌发生发展机制的研究进展及其治疗现状[J]. 中国普通外科杂志, 2018, 27(7):910-923. doi:10.3978/j.issn.1005-6947.2018.07.016.Chen SF, Zhao LJ. Research progress on mechanisms for occurrence of liver cancer and its treatment status[J]. Chinese Journal of General Surgery, 22018, 27(7):910-923. doi:10.3978/j.issn.1005-6947.2018.07.016.
