直肠癌是消化系统常见的恶性肿瘤之一,发病率高、致死率高[1-2],早期即可经淋巴结、血运转移。近些年随着饮食习惯、生活习惯和精神压力的增大,其发病率有增高和年轻化趋势[3-5]。直肠癌是威胁中老年人身心健康的重大疾病,给家庭和经济增加了巨大负担。目前研究已经证实免疫系统在肿瘤的发生和发展中具有重要作用。肿瘤浸润性树突状细胞(dendritic cells, DC)属于免疫系统中的抗原呈递细胞之一,功能最为强大,肿瘤浸润性树突状细胞在肿瘤患者中,可以将肿瘤细胞表面中的分子标志物和代谢产物等肿瘤特异性物质传递给机体的T细胞,刺激其分化和增殖,如产生细胞毒性T细胞,抑制肿瘤细胞的生长和转移,但是最近几年的研究显示肿瘤浸润性树突状细胞在其他肿瘤组织中表达异常,表现为数目较少,树突状细胞表面分子MHC-II、CD54下降,MHC-II、CD54是树突状细胞成熟的标志,其水平降低表明肿瘤组织中树突状细胞功能低下,多为不成熟的树突状细胞,抗原呈递能力下降[6-10]。肿瘤浸润性树突状细胞在直肠癌组织中的表达值得研究探讨,为此笔者前瞻性收集直肠癌患者50例 及同期直肠良性肿块50例组织标本,分析比较两者组织中肿瘤浸润性树突状细胞数量和表型差异,旨在探讨直肠癌组织中肿瘤浸润性树突状细胞数量和表型的改变及临床意义。
1 资料与方法
1.1 一般资料
前瞻性收集杭州市余杭区第二人民医院和杭州市第一人民医院2017年1月—2018年6月期间收治的直肠癌组织50例作为观察组,纳入标准:⑴ 直肠癌(直肠癌的诊断依据为病理诊断);⑵ 年龄18~65岁;⑶ 同意参与本研究。排除标准:⑴ 感染;⑵ 溃疡性结肠癌等免疫系统疾病;⑶ 其他恶性肿瘤;⑷ 复发性直肠癌;⑸ 直肠转移癌;⑹ 肝肾功能不全;⑺ 心脑肺等重要脏器功能不全。同期收集直肠良性肿块50例作为对照组 (因良性肿块行直肠肿块切除术,取良性肿块患者正常直肠黏膜组织作为检测样本),同时亦无上述重大疾病。两组年龄、性别、合并症等差异无统计学差异(P>0.05)(表1)。本研究已经征得医院伦理委员会批准。
表1 两组一般资料比较[n(%)]
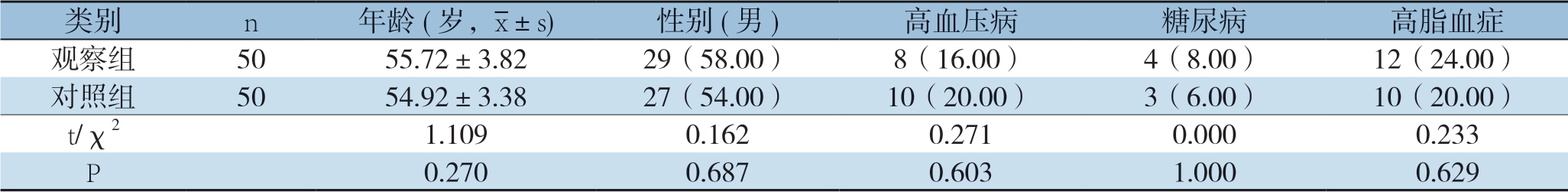
类别n 年龄(岁,images/BZ_15_1000_2138_1036_2179.png±s)性别(男)高血压病糖尿病高脂血症观察组5055.72±3.8229(58.00)8(16.00)4(8.00)12(24.00)对照组5054.92±3.3827(54.00)10(20.00)3(6.00)10(20.00)t/χ21.1090.1620.2710.0000.233 P 0.2700.6870.6031.0000.629
1.2 观察指标
⑴ 肿瘤浸润性树突状细胞、树突状细胞的MHC-II阳性百分比、树突状细胞CD54阳性百分比。⑵ 年龄、性别、合并症、TNM分期、分化程度、肿瘤最大直径、淋巴结转移。
1.3 检测方法
肿瘤浸润性树突状细胞:行直肠癌切除术,术中取直肠癌组织和良性肿块患者的正常直肠黏膜组织,直肠癌组织为距离癌灶边缘1.0 cm以上的直肠癌组织,行免疫组化法[采取鼠抗人单克隆抗体S-100(福州迈新公司),SP法染色]:石蜡包埋,石蜡切片脱蜡至水,孵育,蒸馏水冲洗,PBS浸泡,抗原修复,滴加一抗,37 ℃孵育1~2 h,PBS冲洗,滴加二抗,PBS冲洗,加入工作液,37 ℃孵育20 min,PBS冲洗,显色剂显色10 min,冲洗、复染、脱水、透明、封片,400倍镜下取5个视野,计数,取值作为该研究对象的肿瘤浸润性树突状细胞数目。同时取直肠癌组织和良性肿块患者的正常直肠黏膜组织,利用RPMI1640培养基对组织进行消化,去除血块、脂肪等组织,剪碎,制作成细胞悬液,250 r/min,离心6 min后弃掉上清液,PBS冲洗,混匀,调整细胞密度至1×106个/mL。取4 mL细胞悬液,加入淋巴细胞分离液(2 mL,质量密度1.077 g/mL),再加入淋巴细胞分离液(2 mL,质量密度1.055 g/mL),400 r/min,离心20 min,取位于分离液界面间的细胞。PBS溶液冲洗,250 r/min,离心6 min,2次。置入含10%人AB型血清的RPMI-1640培养液中(37 ℃,5%CO2培养过夜),收集悬浮细胞,调整细胞密度为1 × 106个/mL,加入Eppendorf管,100 μL/管,加入4 μL直接标记荧光抗体,置于4 ℃冰箱中避光标记30 min,PBS冲洗2次,利用Beckman coulter公司提供的Epics XL型流式细胞仪检测组织中肿瘤浸润性树突状细胞MHC-II和CD54阳性百分比。
1.4 统计学处理
采用SPSS22.0完成对本研究的数据分析,双侧检验下,设置α=0.05为检验标准。两组计量资料、计数资料分别采用t检验、χ2检验分析,分别以均值±标准差、百分比的形式呈现。
2 结 果
2.1 不同组织中肿瘤浸润性树突状细胞表达水平及表型
与对照组比较,观察组直肠癌组织中肿瘤浸润性树突状细胞密度降低(P=0.002);MHC-II 阳性DC(%)和CD54阳性DC(%)均降低(P=0.000)和(P=0.000)(表2)。
表2 两组肿瘤浸润性树突状细胞表达水平及表型( ±s)
±s)
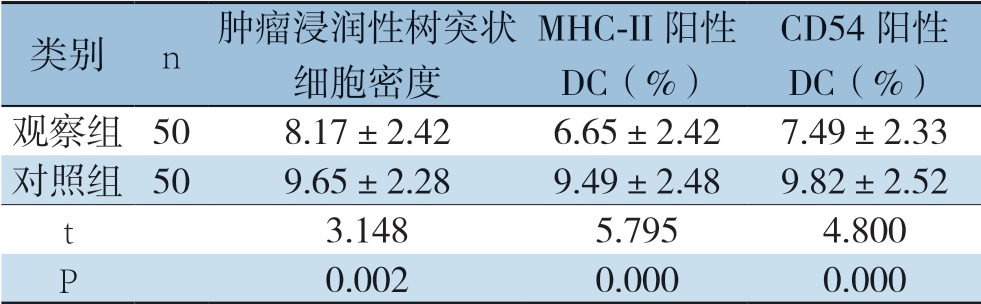
类别n肿瘤浸润性树突状 细胞密度MHC-II阳性DC(%)CD54阳性DC(%)观察组508.17±2.426.65±2.427.49±2.33对照组509.65±2.289.49±2.489.82±2.52 t 3.1485.7954.800 P 0.0020.0000.000
2.2 直肠癌组织中肿瘤浸润性树突状细胞表达水平、表型与临床病理特征的相关性
与TNM分期为I、II期的患者比较,III的患者肿瘤浸润性树突状细胞密度降低(P=0.042);MHC-II阳性DC百分比下降(P=0.000);CD54阳性DC百分比下降(P=0.023)。中低分化、高分化患者肿瘤浸润性树突状细胞密度、MHCII阳性DC百分比、CD54阳性DC百分比均无统计学差异(P>0.05)。与肿瘤最大直径<5 cm者比较,肿瘤最大直径≥5 cm者肿瘤浸润性树突状细胞密度降低(P=0.001);MHC-II阳性DC百分比下降(P=0.000);CD54阳性DC百分比下降(P=0.023)(表3)(图1)。
表3 直肠癌组织中肿瘤浸润性树突状细胞表达水平、表型与直肠癌患者临床病理特征的相关性( ±s)
±s)
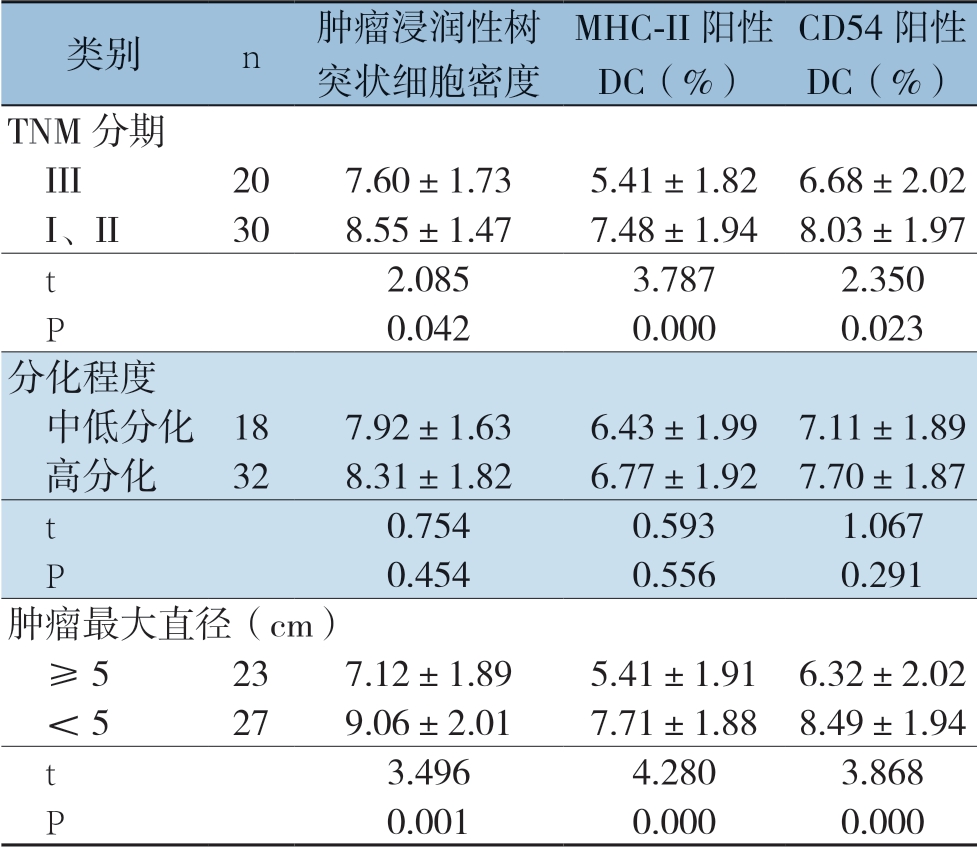
类别n肿瘤浸润性树突状细胞密度MHC-II阳性DC(%)CD54阳性DC(%)TNM分期 III207.60±1.735.41±1.826.68±2.02 I、II308.55±1.477.48±1.948.03±1.97 t2.0853.7872.350 P0.0420.0000.023分化程度 中低分化187.92±1.636.43±1.997.11±1.89 高分化328.31±1.826.77±1.927.70±1.87 t0.7540.5931.067 P0.4540.5560.291肿瘤最大直径(cm) ≥5237.12±1.895.41±1.916.32±2.02 <5279.06±2.017.71±1.888.49±1.94 t3.4964.2803.868 P0.0010.0000.000

图1 不同TNM分期患者CD54和MHC-II表达情况
A:TNM分期II;B:TNM分期I期;C-D:TNM分期III期
3 讨 论
直肠癌在我国中老年人中较为常见,且由于精神压力增大等社会因素,其发病率有上升趋势,目前已知免疫系统在直肠癌的发生和发展中具有重要意义。本研究探讨了直肠癌组织中肿瘤浸润性树突状细胞数量和表型改变情况,发现与良性肿块比较,直肠癌组织中肿瘤浸润性树突状细胞密度、MHC-II阳性DC(%)和CD54阳性DC(%)均降低,且肿瘤直径越大、TNM分期越高,这种现象越明显。
树突状细胞是加拿大学者Steinman在1937年发现,由于其成熟时伸出许多树突样或伪足样突起而得名,在抗原呈递细胞中功能最为强大,因此在免疫性疾病中一直是研究的一个热点和重点[11-14]。近些年来,学者们开始重视肿瘤浸润性树突状细胞在肿瘤患者中的作用,正常情况下,肿瘤浸润性树突状细胞可以通过多种途径达到杀伤肿瘤细胞的作用。首先,肿瘤浸润性树突状细胞可以高表达MHC-I类、MHC-II类分子,可以识别肿瘤相关抗原,动MHC-I类限制性细胞毒性T淋巴细胞反应和MHC-II类限制性的CD4+ Thl反应[15]。其次,树突状细胞可以增加共刺激分子的表达水平,为T细胞的增殖和活化提供信号[16-17];另外,树突状细胞可以分泌IL-2、IL-12等炎性因子,促进Th1/Th2细胞免疫向Th1免疫漂移,激活、增殖T细胞,生成大量的细胞毒性T细胞;最后,树突状细胞可以促进T细胞在肿瘤组织中的聚集,进而诱导IL-12、IFN-γ等抗血管生成物质,抑制肿瘤血管形成[18]。但最近有学者[6,19-21]发现,肿瘤浸润性树突状细胞在其他肿瘤组织中表达异常,表现为数目较少,不成熟细胞比例增加,即MHC-II阳性DC百分比、CD54阳性DC百分比下降,导致树突状细胞呈递抗原激活免疫系统的能力下降,最终导致肿瘤患者预后不良。这些结论均与本研究一致,本研究显示直肠癌组织中肿瘤浸润性树突状细胞密度、MHC-II阳性DC(%)和CD54阳性DC(%)均降低,且肿瘤直径越大、TNM分期越高,这种现象越明显。目前关于肿瘤浸润性树突状细胞在直肠癌组织中的研究尚缺乏,因此本研究具有一定临床意义,更可靠的理论证据有待今后更深入的研究佐证。
综上所述,肿瘤浸润性树突状细胞在直肠癌组织中低表达,不成熟细胞比例增加,与TNM分期和肿瘤直径有关。
[1]Tersteeg JJC, van Esch LM, Gobardhan PD, et al. Early local recurrence and one-year mortality of rectal cancer after restricting the neoadjuvant therapy regime[J]. Eur J Surg Oncol, 2019, 45(4):597-605. doi: 10.1016/j.ejso.2018.12.006.
[2]Quintana JM, González N, Lázaro S, et al. Predictors of 1- and 2-year mortality in patients with rectal cancer[J]. Colorectal Dis, 2018, 20(8):676-687. doi: 10.1111/codi.14250.
[3]Wang X, Cao W, Zheng C, et al. Marital status and survival in patients with rectal cancer: An analysis of the Surveillance, Epidemiology and End Results (SEER) database[J]. Cancer Epidemiol, 2018, 54:119-124. doi: 10.1016/j.canep.2018.04.007.
[4]Wolbert T, Leigh EC, Barry R, et al. Later Stage Disease and Earlier Onset of Rectal Cancer: Epidemiology and Outcomes Comparison of Rectal Cancer in a Rural Appalachian Area to State and National Rates[J]. Am Surg, 2018, 84(7):1229-1235.
[5]Wang XJ, Chi P, Zhang YY, et al. Survival outcome of adjuvant radiotherapy after local excision for T2 early rectal cancer: An analysis based on the surveillance, epidemiology, and end result registry database[J]. Eur J Surg Oncol, 2018, 44(12):1865-1872. doi: 10.1016/j.ejso.2018.08.024.
[6]Jiang L, Fang X, Wang H, et al. Ovarian Cancer-Intrinsic Fatty Acid Synthase Prevents Anti-tumor Immunity by Disrupting Tumor-Infiltrating Dendritic Cells[J]. Front Immunol, 2018, 9:2927. doi: 10.3389/fimmu.2018.02927.
[7]Zheng Y, Hu B, Xie S, et al. Dendritic cells infected by Adsh-SOCS1 enhance cytokine-induced killer (CIK) cell immunotherapeutic efficacy in cervical cancer models[J]. Cytotherapy, 2017, 19(5):617-628. doi: 10.1016/j.jcyt.2017.01.008.
[8]Zhang L, Mu Y, Zhang A, et al. Cytokine-induced killer cells/dendritic cells-cytokine induced killer cells immunotherapy combined with chemotherapy for treatment of colorectal cancer in China: a meta-analysis of 29 trials involving 2,610 patients[J]. Oncotarget, 2017, 8(28):45164-45177. doi: 10.18632/oncotarget.16665.
[9]Mosińska P, Gabryelska A, Zasada M, et al. Dual Functional Capability of Dendritic Cells - Cytokine-Induced Killer Cells in Improving Side Effects of Colorectal Cancer Therapy[J]. Front Pharmacol, 2017, 8:126. doi: 10.3389/fphar.2017.00126.
[10]Liu Y, Zheng Z, Zhang Q, et al. FOLFOX regimen plus dendritic cells-cytokine-induced killer cells immunotherapy for the treatment of colorectal cancer: a meta-analysis[J]. Onco Targets Ther, 2017, 10:2621-2633. doi: 10.2147/OTT.S138011.
[11]Wiegering V, Peter L, Frietsch M, et al. Differences of Immune Reconstitution of Dendritic Cells in Pediatric GvHD Patients After Allogenic Stem Cell Transplantation[J]. J Pediatr Hematol Oncol, 2019, 41(2):e101-107. doi: 10.1097/MPH.0000000000001342.
[12]Jeon JH, Lee BC, Kim D, et al. Hydrophilic Astragalin Galactoside Induces T Helper Type 1-Mediated Immune Responses via Dendritic Cells[J]. Int J Mol Sci, 2018, 19(10). pii: E3120. doi: 10.3390/ijms19103120.
[13]Luo S, Liu W, Zeng Z, et al. Toxic adjuvants alter the function and phenotype of dendritic cells to initiate adaptive immune responses induced by oral Helicobacter pylori vaccines[J]. Helicobacter, 2018, 23(6):e12536. doi: 10.1111/hel.12536.
[14]Sun NY, Chen YL, Lin HW, et al. Immune checkpoint Ab enhances the antigen-specific anti-tumor effects by modulating both dendritic cells and regulatory T lymphocytes[J]. Cancer Lett, 2019, 444:20-34. doi: 10.1016/j.canlet.2018.11.039.
[15]Takakura K, Koido S, Kan S, et al. Prognostic markers for patient outcome following vaccination with multiple MHC Class I/IIrestricted WT1 peptide-pulsed dendritic cells plus chemotherapy for pancreatic cancer[J]. Anticancer Res, 2015, 35(1):555-562.
[16]Marigo I, Zilio S, Desantis G, et al. T Cell Cancer Therapy Requires CD40-CD40L Activation of Tumor Necrosis Factor and Inducible Nitric-Oxide-Synthase-Producing Dendritic Cells[J]. Cancer Cell, 2016, 30(3):377-390. doi: 10.1016/j.ccell.2016.08.004.
[17]Mazorra Z, Lavastida A, Concha-Benavente F, et al. Nimotuzumab Induces NK Cell Activation, Cytotoxicity, Dendritic Cell Maturation and Expansion of EGFR-Specific T Cells in Head and Neck Cancer Patients[J]. Front Pharmacol, 2017, 8:382. doi: 10.3389/fphar.2017.00382.
[18]Martinet L, Filleron T, Le Guellec S, et al. High endothelial venule blood vessels for tumor-infiltrating lymphocytes are associated with lymphotoxin beta-producing dendritic cells in human breast cancer[J]. J Immunol, 2013, 191(4):2001-2008. doi: 10.4049/jimmunol.1300872.
[19]Pyfferoen L, Brabants E, Everaert C, et al. The transcriptome of lung tumor-infiltrating dendritic cells reveals a tumor-supporting phenotype and a microRNA signature with negative impact on clinical outcome[J]. Oncoimmunology, 2016, 6(1):e1253655. doi: 10.1080/2162402X.2016.1253655.
[20]Han N, Zhang Z, Liu S, et al. Increased tumor-infiltrating plasmacytoid dendritic cells predicts poor prognosis in oral squamous cell carcinoma[J]. Arch Oral Biol, 2017, 78:129-134. doi: 10.1016/j.archoralbio.2017.02.012.
[21]Aleksandrova E, Vlaykova T, Ananiev J, et al. Association of IL-12Bpro polymorphism with tumor-infiltrating dendritic cells in colorectal cancer[J]. J BUON, 2017, 22(4):888-893.
