肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是一种起源于胆管上皮细胞的原发性肿瘤,在原发性肝脏肿瘤中发病率排名第二[1-2]。近年来,我国ICC发病率逐步升高,其发病原因可能与胆管结石、肝炎病毒、胆管囊肿及肝硬化等因素有关。肝内胆管结石能够诱发ICC,其具体机制目前尚不清楚,多数学者认为结石的机械性刺激以及胆汁淤积引起的胆管慢性炎症能诱导ICC的发生[3-4]。由于ICC起病隐匿,易发生神经浸润和淋巴结转移,该疾病对放化疗敏感性低,也缺乏有效的早期诊断标志物,目前,根治性手术切除是治疗ICC最重要的方法,但术后易复发转移、预后差[5-7]。因此,探讨ICC术后复发及转移的相关机制,探索新的监测标志物,这对于提高ICC的早期诊断、临床治疗及降低肿瘤病死率有着重大意义。
TGF-β1是一种参与胚胎发育、器官形成、免疫反应等生理过程的重要细胞因子,也参与创伤后组织修复及组织纤维化过程的调控。survivin基因是一种具有抑制细胞凋亡并可以通过有丝分裂促进转化细胞异常增殖的凋亡抑制因子[8-9]。caspase-3是caspase家族中控制细胞凋亡的关键酶,通过线粒体途径和Fas/TNFR1介导的受体途径来控制机体细胞凋亡信号通路[10]。目前,关于TGF-β1、survivin与caspase-3在ICC组织中的研究文献报道较少。本实验应用免疫组化方法检测肝内胆管结石相关ICC组织中TGF-β1、survivin与caspase-3的表达及相关性,并探讨其与ICC临床病理特征及预后的关系,旨在为临床上治疗肝内胆管结石相关ICC的治疗寻找新的思路。
1 材料与方法
1.1 一般资料
收集我院病理科2013—2019年肝内胆管组织蜡块标本共112例,其中为肝内胆管结石并ICC的胆管组织标本(肿瘤组),包括男23例,女 29例;平均年龄和中位年龄分别为61.77岁和62岁,年龄范围为39~89岁。30例为肝内胆管结石切除的肝内胆管组织且镜下仅发现慢性炎症的胆管组织标本(炎症组),包括男17例,女13例;平均年龄和中位年龄分别为55.77岁和56.5岁,年龄范围为30~84岁。取同期因肝脏损伤手术切除的30例患者正常肝胆管组织标本作为对照(正常组),包括男14例,女16例;平均年龄和中位年龄分别为52.43岁和54岁,年龄范围为26~82岁。3组患者性别、年龄比较无统计学差异(均P>0.05)。所有标本均经10%甲醛固定,石蜡包埋,4 μm连续切片,分别作HE及免疫组化染色。HE切片由2名专业水平较高的病理科主治医师复诊证实。
1.2 试剂和仪器
免疫组化试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司;浓缩型兔抗人TGF-β1抗体、浓缩型兔抗人caspase-3抗体购自ABclonal公司;浓缩型兔抗人survivin单克隆抗体购自Abcam公司;光学显微镜购自日本奥林巴斯公司。
1.3 方法
1.3.1 免疫组化法(SP法) 石蜡标本切片,每份标本取4份切片,切片厚度为4 μm,常规烤片、脱蜡、梯度酒精脱水。3%H2O2孵育10 min,消除内源性过氧化物酶活性;蒸馏水冲洗,PBS冲洗5 min×3次;切片至于EDTA缓冲液中行高压抗原热修复预处理,分别加入一抗工作液,其中TGF-β1一抗按1:100稀释,survivin一抗按1:50稀释,caspase-3一抗按1:100稀释,4 ℃恒温下过夜,同时设立阴性对照组(以PBS代替),滴加生物素标记的二抗工作液后常温避光孵育 30 min,经PBS冲洗5 min×3次;滴加DAB显色剂,显微镜下观察显色情况,蒸馏水冲洗终止显色;苏木素复染5 min,蒸馏水冲洗后,梯度乙醇脱水,二甲苯透明,以中性树胶封片,于光学显微镜下判定染色结果。
1.3.2 结果判定标准[11-12] TGF-β1阳性判断标准:细胞质和/或核呈淡黄色细颗粒者明显高于背景色;survivin阳性判断标准:细胞质和/或核呈淡黄色细颗粒者明显高于背景色。caspase-3阳性判断标准:细胞质和/或核呈淡黄色细颗粒者明显高于背景色。由专业水平较高的病理科主治医师进行切片观察,并对免疫组化结果进行评价,医师仅作为观察者,不告知切片病理情况。采用半定量积分法判定结果:染色强度评分为4级,0分,无着色;1分,淡黄色;2分,棕黄色;3分,棕褐色。阳性细胞所占百分比:显微镜下随机选取 10个高倍镜视野,每个视野计数100个细胞,取10个视野的百分比平均数。0分,阳性细胞<10%;1分,阳性细胞:10%~25%;2分,阳性细胞:26%~50%;3分,阳性细胞:51%~75%;4分,阳性细胞:>75%;染色强度评分与阳性细胞所占百分比评分相乘,<2分为阴性(-),≥2分为阳性(+)。
1.4 随访
术后通过门诊随访、电话回访(回访日期截止2019年2月)了解患者生存、术后并发症等情况。截止目前,随访时间最短为1个月,最长为66个月。其中失访患者有6例,失访患者未纳入研究。
1.5 统计学处理
选取SPSS 19.0来分析数据,各组阳性表达情况比较选取χ2检验,两两比较选取χ2分割法,各组样本间计量资料比较采用Kruskal-Wallis H检验,相关性分析采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组化检测结果分析
各种蛋白在3种组织中均有不同程度的表达(图1)。半定量分析显示,各组间TGF-β1表达率有统计学差异(P<0.05);肿瘤组与炎症组比较(χ2=8.747)、肿瘤组与正常组比较(χ2=24.273)、炎症组与正常对照组比较(χ2=4.022),两两比较均有统计学差异(均P<0.05);TGF-β1的表达强弱关系为:肿瘤组>炎症组>正常组。各组间survivin表达率有统计学差异(P<0.05);肿瘤组与炎症组比较(χ2=5.306)、肿瘤组与正常对照组比较(χ2=21.026)、炎症组与正常组比较(χ2=5.079),两两比较均有统计学差异(均P<0.05);survivin的表达强弱关系为:肿瘤组>炎症组>正常组。各组间caspase-3表达率有统计学差异(P<0.05);肿瘤组与炎症组比较(χ2=4.518)、肿瘤组与正常对照组比较(χ2=17.994)、炎症组与正常组比较(χ2=4.812),两两比较差异均有统计学意义(均P<0.05);caspase-3的表达强弱关系为:肿瘤组<炎症组<正常组(表1)。

图1 免疫组化检测TGF-β1、survivin与caspase-3的表达(×200)
Figure1 Immunohistological staining for the expressions of TGF-β1,survivin and caspase-3 (×200)
表1 各组TGF-β1、survivin与caspase-3表达的比较[n(%)]
Table1 Comparison of the expressions of TGF-β1,survivin and caspase-3 among groups [n (%)]
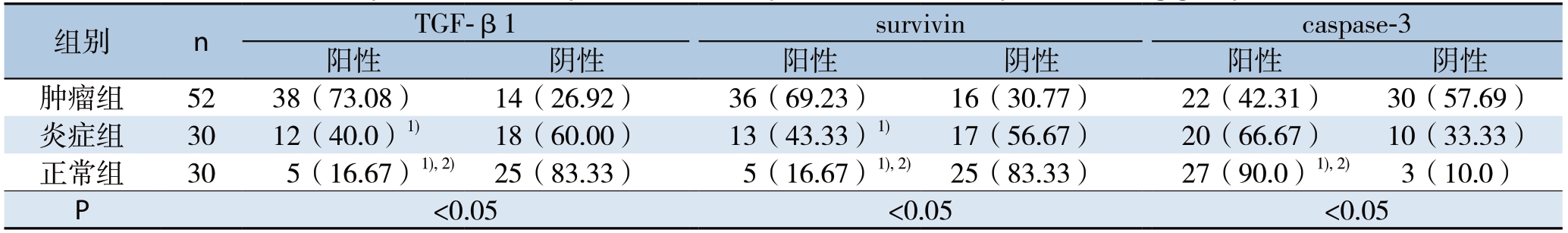
注:1)与正常组比较,P<0.05;2)与炎症组比较,P<0.05
Note:P<0.05 vs.normal group; 2) P<0.05 vs.inflammation group
?
2.2 ICC组织中TGF-β1、survivin和caspase-3蛋白阳性表达率的相关性
ICC组织中TGF-β1表达与caspase-3蛋白表达呈明显负相关(r=-0.890,P<0.01),TGF-β1表达与survivin表达呈明显正相关(r=0.917,P<0.01),survivin表达与caspase-3表达呈明显负相关(r=-0.894,P<0.01)(图2)。
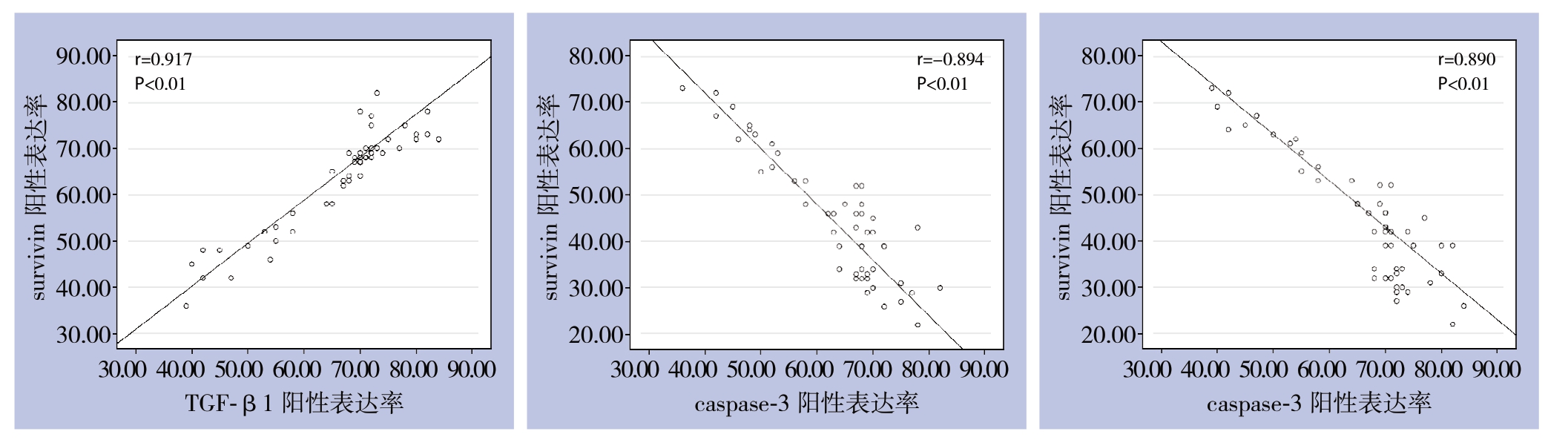
图2 TGF-β1、survivin与caspase-3表达相关性分析
Figure2 Analysis of the correlations among the expression of TGF-β1,surviving and caspase-3
2.3 TGF-β1、survivin与caspase-3蛋白表达与ICC临床病理特征的关系
TGF-β1、survivin与caspase-3阳性表达均与患者的年龄、性别、HbsAg表达情况、CA19-9水平、胆道结石等因素无关(均P>0.05);与淋巴结转移情况、肿瘤分化程度、AFP水平、肿瘤最大直径有关(均P<0.05)。其中,TGF-β1与caspase-3阳性表达与患者的肿瘤是否侵犯血管有关(均P<0.05)(表2)。
表2 TGF-β1、survivin与caspase-3表达与52例ICC患者临床病理特征的关系[n(%)]
Table2 Relations of the expressions of of TGF-β1,surviving and caspase-3 with clinicopathologic features of the 52 ICC patients [n (%)]
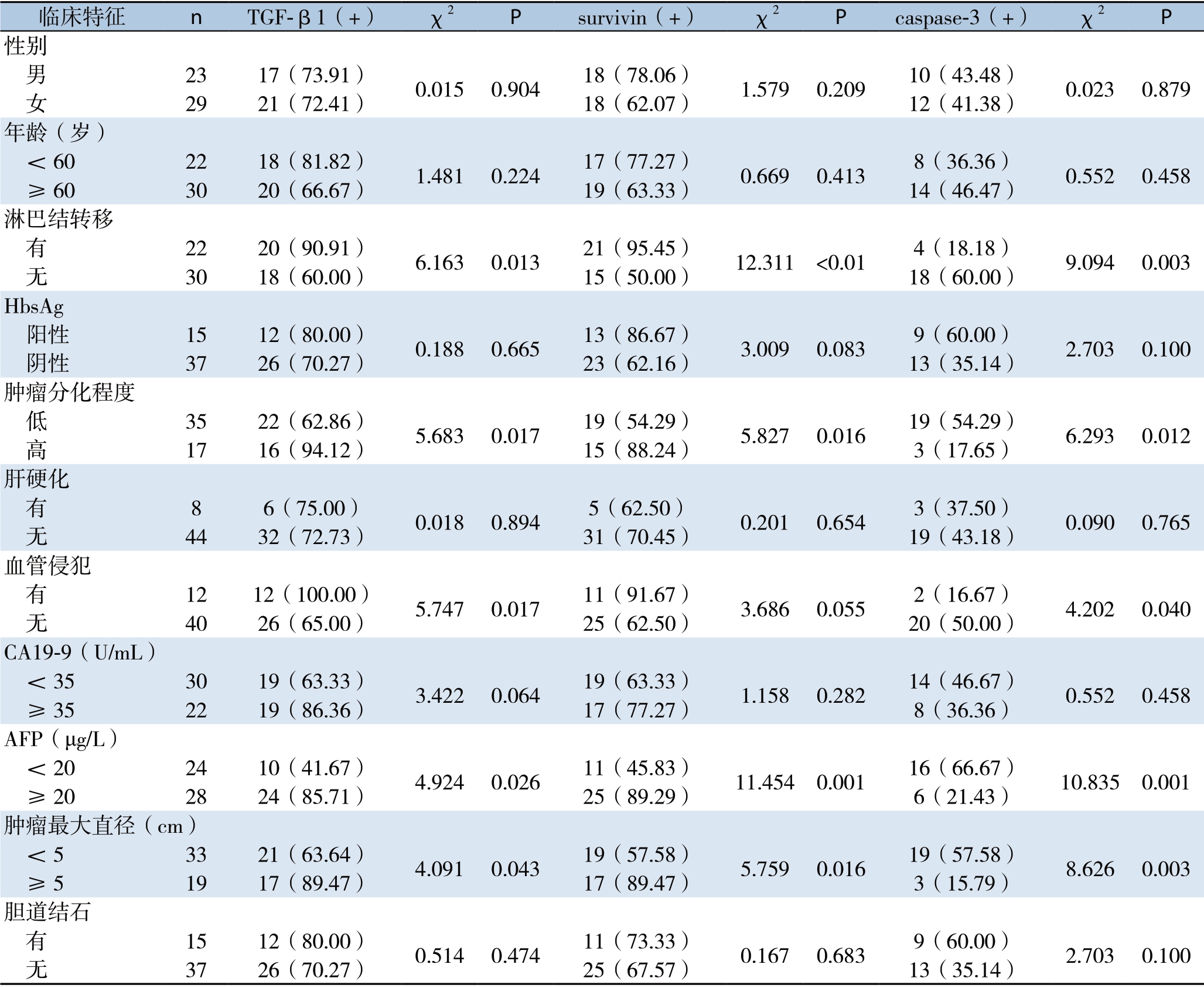
临床特征 n TGF-β1(+) χ2 P survivin(+) χ2 P caspase-3(+) χ2 P 性别 男 23 17(73.91) 0.015 0.904 18(78.06) 1.579 0.209 10(43.48) 0.023 0.879 女 29 21(72.41) 18(62.07) 12(41.38)年龄(岁) <60 22 18(81.82) 1.481 0.224 17(77.27) 0.669 0.413 8(36.36) 0.552 0.458 ≥60 30 20(66.67) 19(63.33) 14(46.47)淋巴结转移 有 22 20(90.91) 6.163 0.013 21(95.45) 12.311 <0.01 4(18.18) 9.094 0.003 无 30 18(60.00) 15(50.00) 18(60.00)HbsAg 阳性 15 12(80.00) 0.188 0.665 13(86.67) 3.009 0.083 9(60.00) 2.703 0.100 阴性 37 26(70.27) 23(62.16) 13(35.14)肿瘤分化程度 低 35 22(62.86) 5.683 0.017 19(54.29) 5.827 0.016 19(54.29) 6.293 0.012 高 17 16(94.12) 15(88.24) 3(17.65)肝硬化 有 8 6(75.00) 0.018 0.894 5(62.50) 0.201 0.654 3(37.50) 0.090 0.765 无 44 32(72.73) 31(70.45) 19(43.18)血管侵犯 有 12 12(100.00) 5.747 0.017 11(91.67) 3.686 0.055 2(16.67) 4.202 0.040 无 40 26(65.00) 25(62.50) 20(50.00)CA19-9(U/mL) <35 30 19(63.33) 3.422 0.064 19(63.33) 1.158 0.282 14(46.67) 0.552 0.458 ≥35 22 19(86.36) 17(77.27) 8(36.36)AFP(μg/L) <20 24 10(41.67) 4.924 0.026 11(45.83) 11.454 0.001 16(66.67) 10.835 0.001 ≥20 28 24(85.71) 25(89.29) 6(21.43)肿瘤最大直径(cm) <5 33 21(63.64) 4.091 0.043 19(57.58) 5.759 0.016 19(57.58) 8.626 0.003 ≥5 19 17(89.47) 17(89.47) 3(15.79)胆道结石 有 15 12(80.00) 0.514 0.474 11(73.33) 0.167 0.683 9(60.00) 2.703 0.100 无 37 26(70.27) 25(67.57) 13(35.14)
2.4 ICC患者预后与各种临床病理参数关系的单因素分析
单因素分析显示,ICC患者术后预后与淋巴结转移情况、肿瘤分化情况、血管侵犯、肿瘤最大直径、R0切除、CA19-9、AFP、TGF-β1、survivin及caspase-3表达等因素有关(均P<0.05);与年龄、性别、肝硬化、胆道结石、HbsAg表达等因素无关(均P>0.05)(表3)。
表3 ICC患者预后与各种临床病理参数关系的单因素分析
Table3 Univariate analysis of the relations of the clinicopathologic parameters with the prognosis of the ICC patients
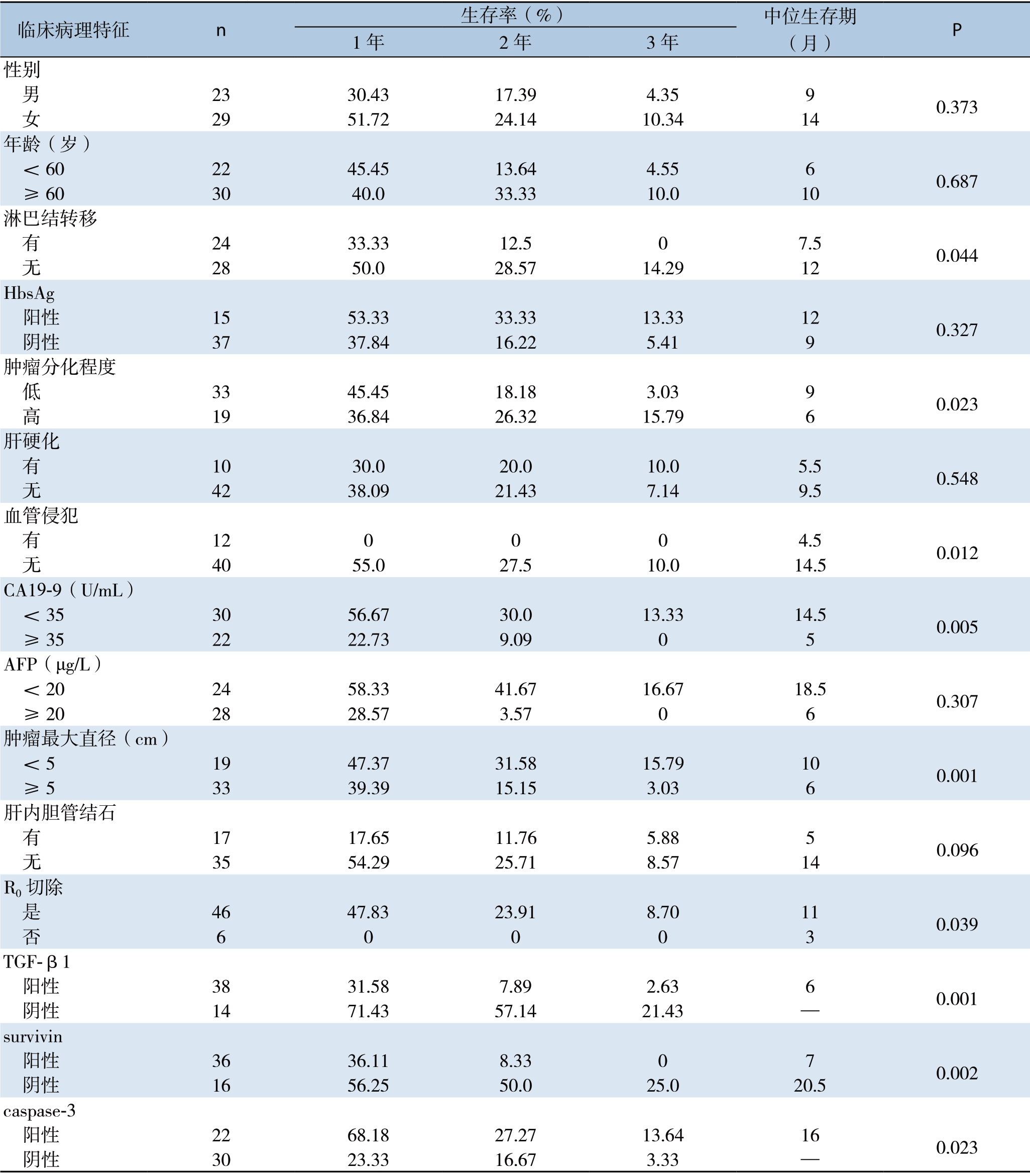
临床病理特征 n 生存率(%) 中位生存期(月) P 1年2年3年性别 男 23 30.43 17.39 4.35 9 0.373 女 29 51.72 24.14 10.34 14年龄(岁) <60 22 45.45 13.64 4.55 6 0.687 ≥60 30 40.0 33.33 10.0 10淋巴结转移 有 24 33.33 12.5 0 7.5 0.044 无 28 50.0 28.57 14.29 12 HbsAg 阳性 15 53.33 33.33 13.33 12 0.327 阴性 37 37.84 16.22 5.41 9肿瘤分化程度 低 33 45.45 18.18 3.03 9 0.023 高 19 36.84 26.32 15.79 6肝硬化 有 10 30.0 20.0 10.0 5.5 0.548 无 42 38.09 21.43 7.14 9.5血管侵犯 有 12 0 0 0 4.5 0.012 无 40 55.0 27.5 10.0 14.5 CA19-9(U/mL) <35 30 56.67 30.0 13.33 14.5 0.005 ≥35 22 22.73 9.09 0 5 AFP(μg/L) <20 24 58.33 41.67 16.67 18.5 0.307 ≥20 28 28.57 3.57 0 6肿瘤最大直径(cm) <5 19 47.37 31.58 15.79 10 0.001 ≥5 33 39.39 15.15 3.03 6肝内胆管结石 有 17 17.65 11.76 5.88 5 0.096 无 35 54.29 25.71 8.57 14 R0切除 是 46 47.83 23.91 8.70 11 0.039 否 6 0 0 0 3 TGF-β1 阳性 38 31.58 7.89 2.63 6 0.001 阴性 14 71.43 57.14 21.43 —survivin 阳性 36 36.11 8.33 0 7 0.002 阴性 16 56.25 50.0 25.0 20.5 caspase-3 阳性 22 68.18 27.27 13.64 16 0.023 阴性 30 23.33 16.67 3.33 —
2.5 ICC患者预后与各种临床病理参数关系的多因素分析
Cox比例风险模型分析表明是否R0切除、肿瘤分化情况、TGF-β1、survivin及caspase-3表达等因素是ICC患者术后生存期的独立影响因素(均P<0.05)(表4)。
表4 ICC患者预后与各种临床病理参数关系的多因素分析
Table4 Multivariate analysis of the relations of the clinicopathologic parameters with the prognosis of the ICC patients
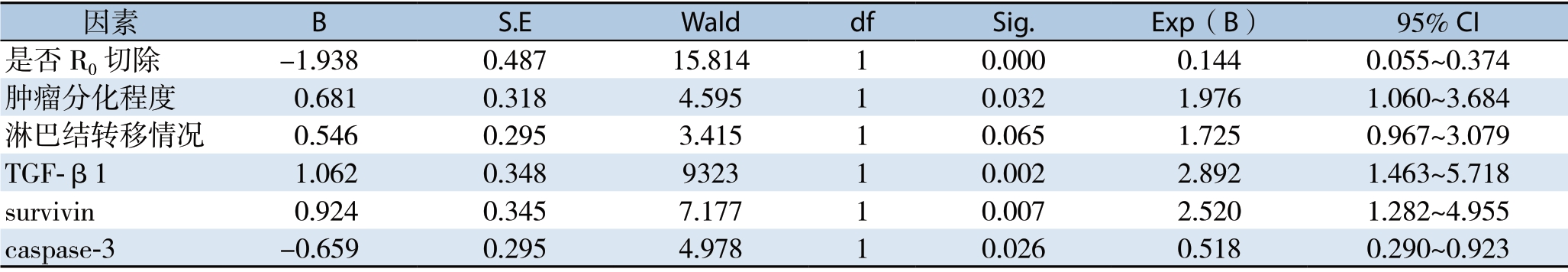
因素 B S.E Wald df Sig.Exp(B) 95% CI是否R0切除 -1.938 0.487 15.814 1 0.000 0.144 0.055~0.374肿瘤分化程度 0.681 0.318 4.595 1 0.032 1.976 1.060~3.684淋巴结转移情况 0.546 0.295 3.415 1 0.065 1.725 0.967~3.079 TGF-β1 1.062 0.348 9323 1 0.002 2.892 1.463~5.718 survivin 0.924 0.345 7.177 1 0.007 2.520 1.282~4.955 caspase-3 -0.659 0.295 4.978 1 0.026 0.518 0.290~0.923
2.6 TGF-β1、survivin及caspase-3表 达 与ICC患者术后预后的关系
对52例ICC患者采用电话方式进行随访,随访时间自患者接受手术之日起至2019年3月,患者死亡或失访日期(失访8例)。分析结果显示,TGF-β1阳性表达患者的生存率明显低于TGF-β1阴性表达患者(χ2=13.192,P=0.001);survivin阳性表达患者的生存率明显低于survivin阴性表达患者(χ2=10.536,P=0.002);caspase-3阳性表达患者的生存率明显高于caspase-3阴性表达患者(χ2=5.469,P=0.023)(图3)。
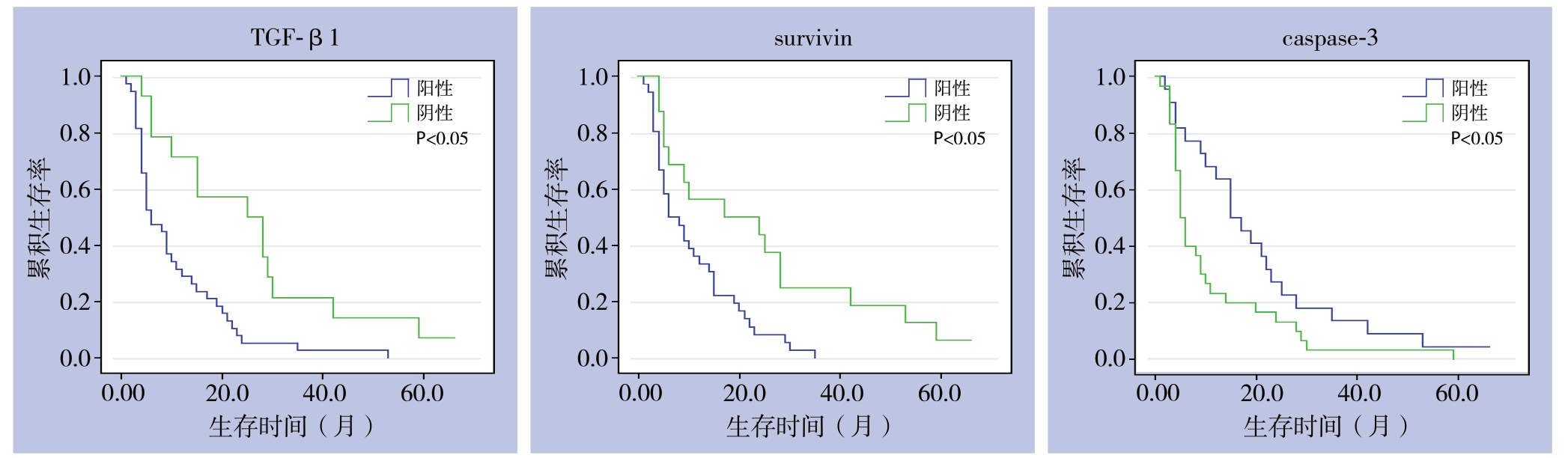
图3 不同TGF-β1、survivin与caspase-3表达状态ICC患者生存曲线
Figure3 The survival curves of ICC patients with different expression statuses of TGF-β1,surviving and caspase-3
3 讨 论
ICC的发生和发展是由多种因素共同参与、多步骤、多阶段的一个复杂过程。ICC由于解剖位置特殊,起病不易发现,恶性程度高,预后差,与肝细胞肝癌相比更易发生早期淋巴结转移与术后复发[13]。近年来,ICC的发病率逐年升高,由于该肿瘤异质性强,早期诊断困难,外科手术是当前可能治愈ICC的唯一的方法,但由于缺少有效的早期诊断方法,只有大约10%~15%的胆管癌患者适合手术治疗[14]。然而术后总体预后较差,针对ICC早期诊断和早期治疗的研究一直是临床上的重要难题[15-17]。
TGF-β1在肿瘤的发生与发展中发挥着双重作用,在肿瘤起始阶段,可抑制肿瘤细胞的增殖,诱导肿瘤细胞凋亡,但是在肿瘤进展期,则通过多种信号通路调控上皮间质转化(EMT),促进新生血管形成和肿瘤细胞侵袭和转移。有文献[18]报道,TGF-β1异常表达可影响ICC的恶性生物学行为,是判断预后的重要指标,同时还可以促进EMT的发生,影响胆管癌的发生发展[19]。本研究结果显示,TGF-β1在正常组、炎症组和肿瘤组中均有表达,各组平均阳性表达率分别是16.67%、40.0%、73.08%,TGF-β1阳性表达率在3组肝内胆管组织中存在统计学差异(P<0.05),且本文通过多因素分析发现TGF-β1表达水平是ICC患者术后生存期的不良独立预后因素,TGF-β1阳性表达与阴性表达患者生存曲线差异具有统计学意义(χ2=13.192,P=0.001),以上结果表明TGF-β1可作为ICC患者术后预后情况的独立指标之一。
survivin是目前已知最强的凋亡抑制因子,其表达跟肿瘤的分期及生物学功能有着重要联系[20]。国内学者秦兴雷等[21]通过检测胆管癌组织和癌旁组织中survivin蛋白的表达,发现肝外胆管癌组织中survivin蛋白阳性表达率要远远高于癌旁组织,两者阳性表达率分别为67.8%、20.0%。本研究结果显示,ICC组织中的survivin蛋白阳性表达率远高于炎症组和正常组患者,分别为69.23%、43.33%、16.67%,这与以上报道结果相一致。另外,许鹏等[22]研究发现,survivin蛋白的表达水平还与肿瘤的TNM分期,淋巴结转移、神经浸润呈正相关,与肿瘤的分化程度呈负相关。Grabowski等[23]和Rohayem等[24]报道显示,survivin蛋白的表达与肿瘤转移和复发行为呈正相关,可作为监测胆管癌患者术后预后情况的独立指标。这与本研究结果相一致,survivin阳性表达与阴性表达患者生存曲线差异具有统计学意义(χ2=10.536,P=0.002),且通过多因素分析发现,survivin蛋白表达水平是ICC患者术后生存期的不良独立预后因素。然而survivin是如何抑制肿瘤细胞凋亡的具体作用机制至今仍存在巨大争议,有研究[24-25]表明,survivin可能通过直接抑制凋亡终末效应器caspase-3和caspase-7的活性阻断各种刺激诱导的细胞凋亡过程[26];caspase-3是细胞凋亡通路中重要的执行分子之一,也是凋亡级联反应的最终效应蛋白,被认为是各种凋亡刺激因子激活的关键酶。在正常状况下,细胞胞质中的caspase-3无活性,但当细胞接受凋亡刺激时,它才会被激活,进而诱导细胞发生凋亡[27]。Friman[28]研究发现caspase-3与胃癌的发生、发展密切相关,是肿瘤恶性转移的重要原因。本实验结果显示,caspase-3蛋白在正常组胆管组织胞质中表达,而在炎症组和肿瘤组胆管组织阳性表达率则明显降低,在正常组、炎症组、肿瘤组中平均阳性表达率分别为90.0%、66.67%、42.31%,三者之间比较有统计学差异(P<0.05),本研究结果还显示,caspase-3阳性表达与阴性表达患者生存曲线差异具有统计学意义(χ2=5.469,P=0.023),survivin表达与caspase-3表达呈显著负相关(r= -0.894,P<0.01)。这与李杨钧等[29]研究结果相一致,他们认为 survivin在胆管细胞癌中的阳性表达率较高,但caspase-3较低,两者呈负相关,考虑可能是survivin抑制了caspase-3介导的细胞凋亡。以上研究结果表明survivin和caspase3的表达与ICC的发生存在密切关系,提示两者在ICC中的恶性转化及发生、发展机制中起关键作用。这与卢昕等[30]研究结果相一致,他们认为caspase-3和caspase-9在胆管癌组织中的表达水平和活性较低,这有利于胆管癌细胞逃逸,维持较高的增殖活性,促进肿瘤的发生和发展,其中,survivin可以通过促进procaspase-9的活化来阻止caspase-3的激活,从而抑制肿瘤细胞凋亡。
综上所述,在肝内胆管结石相关性ICC中TGF-β1、survivin阳性表达率升高,两者呈正相关,caspase-3阳性表达率降低,与前两者呈负相关。TGF-β1、survivin与caspase-3基因在ICC中的临床应用价值得期待,有望成为ICC分子标记物和治疗靶点。监测ICC组织中TGF-β1、survivin与caspase-3的水平,有助于判断患者的预后。但是,关于三者在ICC发生、发展中的具体作用机制,仍需进一步研究。
[1] 国际肝胆胰学会中国分会,中华医学会外科学分会肝脏外科学组.胆管癌诊断与治疗--外科专家共识[J].临床肝胆病杂志,2015,(1):12-16.doi:10.3969/j.issn.1001-5256.2015.01.003.
Chinese Chapter of International Hepato-pancreato-biliary Association,Liver Surgery Group of Society of Surgery of Chinese Medical Association.Diagnosis and treatment of cholangiocarcinoma:surgical expert consensus[J].Journal of Clinical Hepatology,2015,(1):12-16.doi:10.3969/j.issn.1001-5256.2015.01.003.
[2] Haga H,Patel T.Molecular diagnosis of intrahepatic cholangiocarcinoma[J].J Hepatobiliary Pancreat Sci,2015,22(2):114-123.doi:10.1002/jhbp.156.
[3] Sur MD,In H,Sharpe SM,et a1.Defining the Benefit of Adjuvant Therapy Following Resection for Intrahepatic Cholangiocarcinoma[J].Ann Surg Oncol,2015,22(7):2209-2217.doi:10.1245/s10434-014.4275-4.
[4] Wang Z,Sheng YY,Dong QZ,et a1.Hepatitis B virus and hepatitis C virus play different prognostic roles in intrahepatic cholangiocarcinoma:A meta-analysis[J].World J Gastroenterol,2016,22(10):3038-3051.doi:10.3748/wjg.v22.i10.3038.
[5] Razumilava N,Gores G J.Cholangiocarcinoma[J].Lancet,2014,383(9935):2168-2179.doi:10.1016/S0140-6736(13)61903-0.
[6] Rizvi S,Khan SA,Hallemeier CL,et al.Cholangiocarcinoma - evolving concepts and therapeutic strategies[J].Nat Rev Clin Oncol,2018,15(2):95-111.doi:10.1038/nrclinonc.2017.157.
[7] Charbel H,A1-Kawas FH.Cholangiocarcinoma:epidemiology,risk factors,pathogenesis,and diagnosis[J].Curr Gastroenterol Rep,2011,13(2):182-187.doi:10.1007/s11894-011-0178-8.
[8] Pei SG,Wang JX,Wang XL,et al.Correlation of survivin,p53 and Ki-67 in laryngeal cancer Hep-2 cell proliferation and invasion[J].Asian Pac J Trop Med,2015,8(8):636-642.doi:10.1016/j.apjtm.2015.07.007.
[9] Xu C,Yamamoto-Ibusuki M,Yamamoto Y,et al.High survivin mRNA expression is a predictor of poor prognosis in breast cancer:a comparative study at the mRNA and protein level[J].Breast Cancer,2014,21(4):482-490.doi:10.1007/s12282-012-0403-9.
[10] Jäger R,Zwacka RM.The enigmatic roles of caspases in tumor development[J].Cancers (Basel),2010,2(4):1952-1979.doi:10.3390/cancers2041952.
[11] 黄辉,耿小平,熊奇如.survivin与Caspase-3在胆管细胞癌中的表达及相关性研究[J].肝胆胰外科杂志,2008,20(6):403-406.doi:10.3969/j.issn.1007-1954.2008.06.008.
Huang H,Geng XP,Xiong QR.Expression of survivin and Caspase-3 in cholangiocarcinoma and the correlative research[J].Journal of Hepatopancreatobiliary Surgery,2008,20(6):403-406.doi:10.3969/j.issn.1007-1954.2008.06.008.
[12] 王文斌,乔子洋,刘兵,等.TGF-β1、Slug及E-cadherin在胆管癌组织中的表达及意义[J].河北医科大学学报,2017,38(11):1271-1274.doi:10.3969/j.issn.1007-3205.2017.11.007.
Wang WB,Qiao ZY,Liu B,et al.The expression and clinical significance of TGF-β1 、Slug and E-cadherin in cholangiocarcinoma[J].Journal of Hebei Medical University,2017,38(11):1271-1274.doi:10.3969/j.issn.1007-3205.2017.11.007.
[13] 杭轶,杨小勇,李文美.肝内胆管癌与肝细胞癌临床特征的比较研究[J].中国普通外科杂志,2015,24(2):175-179.doi:10.3978/j.issn.1005-6947.2015.02.004.
Hang Y,Yang XY,Li WM.Comparative study of clinical features between intrahepatic cholangiocarcinoma and hepatocellular carcinoma[J].Chinese Journal of General Surgery,2015,24(2):175-179.doi:10.3978/j.issn.1005-6947.2015.02.004.
[14] Nathan H,Pawlik TM,Wolfgang CL,et al.Trends in survival after surgery for cholangiocarcinoma:a 30-year population-based SEER database analysis[J].J Gastrointest Surg,2007,11(11):1488-1496.doi:10.1007/s11605-007-0282-0.
[15] Jusakul A,Cutcutache I,Yong CH,et al.Whole-Genome and Epigenomic Landscapes of Etiologically Distinct Subtypes of Cholangiocarcinom[J].Cancer Discov,2017,7(10):1116-1135.doi:10.1158/2159-8290.CD-17-0368.
[16] Chaisaingmongkol J,Budhu A,Dang H,et al.Common Molecular Subtypes Among Asian Hepatocellular Carcinoma and Cholangiocarcinoma[J].Cancer Cell,2017,32(1):57-70.doi:10.1016/j.ccell.2017.05.009.
[17] 李雪鹏,刘苏来,蒋波.肝内胆管癌分子水平研究进展[J].中国普通外科杂志,2019,28(2):219-226.doi:10.7659/j.issn.1005-6947.2019.02.013.
Li XP,Liu SL,Jiang B.Progress of molecular profiling of intrahepatic cholangiocarcinoma[J].Chinese Journal of General Surgery,2019,28(2):219-226.doi:10.7659/j.issn.1005-6947.2019.02.013.
[18] 彭彦辉,翟瑜,吕柏南,等.急性肠系膜上静脉血栓形成的诊治体会[J].河北医科大学学报,2005,26(4):287-288.doi:10.3969/j.issn.1007-3205.2005.04.021.
Peng YH,Zhai Y,Lu BN,et al.Experience in diagnosis and treatment of acute superior mesenteric venous thrombosis[J].Journal of Hebei Medical University,2005,26(4):287-288.doi:10.3969/j.issn.1007-3205.2005.04.021.
[19] Vietti Violi N,Fournier N,Duran R,et al.Acute mesenteric vein thrombosis:factors associated with evolution to chronic mesenteric vein thrombosis[J].AJR Am J Roentgenol,2014,203(1):54-61.doi:10.2214/AJR.13.11527.
[20] Li F.Role of survivin and its splice variants in tumorigenesis[J].Br J Cancer,2005,92(2):212-216.doi:10.1038/sj.bjc.6602340.
[21] 秦兴雷,薛焕洲,王作仁,等.survivin蛋白在肝外胆管癌组织中的表达及其与预后的关系[J].中华外科杂志,2009,47(24):1852-1856.doi:10.3760/cma.j.issn.0529-5815.2009.24.005.
Qin XL,Xue HZ,Wang ZR,et al.Expression of survivin protein in extrahepatic cholangiocarcinoma and its relationship with the prognosis[J].Chinese Journal of Surgery,2009,47(24):1852-1856.doi:10.3760/cma.j.issn.0529-5815.2009.24.005.
[22] 许鹏,黄强,刘臣海,等.胆管癌组织CIP2A和survivin蛋白表达及其与预后相关性的探讨[J].中华肿瘤防治杂志,2011,18(24):1933-1937.
Xu P,Huang Q,Liu CH,et al.Expression of CIP2A and survivin protein and correlation between them and prognosis of cholangiocarcinoma[J].Chinese Journal of Cancer Prevention and Treatment,2011,18(24):1933-1937.
[23] Grabowski P,Kühnel T,Mühr-Wilkenshoff F,et a1.Prognostic value of nuclear survivin expression in oesophageal squamous cell carcinoma[J].Br J Cancer,2003,88(1):115-1159.doi:10.1038/sj.bjc.6600696.
[24] Rohayem J,Diestelkoetter P,Weigle B,et al.Antibody response to the tumor-associated inhibitor of apoptosis protein survivin in cancer patients[J].Cancer Res,2000,60(7):1815-1817.
[25] Mesri M,Wall NR,Li J,et al.Cancer gene therapy using a survivin mutant adenovirus[J].J Clin Invest,2001,108(7):981-990.doi:10.1172/JCI12983.
[26] Olie RA,Simões-Wüst AP,Baumann B,et al.A novel antisense oligonucleotide targeting survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy[J].Cancer Res,2000,60(11):2805-2859.
[27] 唐滔,刘辉,阎玉矿,等.Caspase-3和Bcl-2/Bax在胆管癌组织中的表达及与临床病理特征的相关性研究[J].长江大学学报(自科版)医学卷,2009,6(4):24-26.doi:10.3969/j.issn.1673-1409(R).2009.04.010.
Tang T,Liu H,Yan YK,et al.Correlations of Caspase-3,Bcl-2/Bax Protein Expressions with Clinical Pathological Features of Cholangiocarcinoma[J].Journal of Yangtze University:Natural Science Edition,2009,6(4):24-26.doi:10.3969/j.issn.1673-1409(R).2009.04.010.
[28] Friman S.Cholangiocarcinoma--current treatment options[J].Scand J Surg,2011,100(1):30-34.doi:10.1177/145749691110000106.
[29] 李杨钧,章维.Expressions of surviving and caspase-3 in cholangiocarcinoma and their correlation[J].中国现代医生,2016,54(11):13-16.
Li YJ,Zhang W.Expression and correlation of survivin and Caspase-3 in cholangiocarcinoma[J].China Modern Doctor,2016,54(11):13-16.
[30] 卢昕,肖新波.survivin抑制人胆管癌细胞凋亡相关信号通路的实验研究[J].中国普通外科杂志,2012,21(2):164-168.
Lu X,Xiao XB.Inhibition of apoptosis-related signaling by survivin in human cholangiocarcinoma cells[J].Chinese Journal of General Surgery,2012,21(2):164-168.
