胰腺癌是一种恶性程度高,预后差的消化系恶性肿瘤,其发病率和病死率在世界范围内呈逐年上升趋势,严重危害人类健康。国内资料显示,胰腺癌的发病率居恶性肿瘤第9 位,病死率居第6位[1]。尽管近年来胰腺癌的诊治水平有显著提高,但其预后仍较差,总体5年生存率仅8%左右[2]。这主要归因于胰腺癌早期诊断困难,进展期手术切除率低、术后易复发和转移。最近的研究表明,胰腺癌干细胞(pancreatic cancer stem cells,PCSCs)参与胰腺癌的发生发展过程,是引起胰腺癌耐药、转移和复发的主要原因。业已证实,胰腺癌的发生发展过程中伴随诸多微小RNA(microRNA,miRNA)的异常表达,并参与调控PCSCs的分化、自我更新等生物学特性[3]。本文就miRNA调控胰腺癌干细胞的作用研究进展作一综述。
1 miRNA
miRNA 是一类长度为19-25 个核苷酸的单链RNA,通过与靶mRNA 的3'-非翻译区(3'-untranslated region,3'-UTR)中的“种子序列”结合起到降解mRNA或抑制翻译的作用,在转录后水平调控基因表达,在多种生物活动中起重要作用[4-5]。自1993年Lee 等[6]首次从秀丽隐杆线虫中发现,至今已经识别的miRNA多达38589种(www.mirbase.org)。2002年Calin等[7]提出miR-15a和miR-16在约65%的B细胞慢性淋巴细胞白血病患者中表达下调,首次揭示了miRNA与肿瘤相关。此后,越来越多的研究证实miRNA在多种肿瘤中异常表达,并且在肿瘤的增殖、分化、侵袭转移等生物学行为中扮演重要角色。与其它肿瘤一样,在胰腺癌组织、外周血和胰腺癌细胞系中也存在多种miRNA的表达差异,其中表达上调的包括miR-221,miR-181a,miR-155,miR-196a,miR-196b等,表达下调的包括miR-148a,miR-148b,miR-375等,这些异常表达的miRNAs可以作为抑癌基因或癌基因参与胰腺癌的发病机制[8-9]。
2 PCSCs
2.1 PCSCs 的特征
肿瘤干细胞(cancer stem cells,CSCs)是肿瘤组织中能够引起肿瘤生长和维持自我更新及分化潜能的一小群细胞,对放疗化疗均不敏感,其在肿瘤中虽只占很少部分,但确是肿瘤复发、转移和耐药的主要根源[10-11]。2007年Li等[12]第一次报道了在胰腺癌中存在CSCs,其通过流式细胞仪筛选出极少数CD44+、CD24+、ESA+胰腺癌细胞(约占0.2%~0.8%),进行动物体内移植后发现仅需100个细胞便能形成肿瘤,显示出极强的成瘤性。此外,PCSCs可以像正常的干细胞一样,具有自我更新、分化和不对称分裂的能力,是导致胰腺癌发生、进展、侵袭、转移和治疗后复发的一个重要因素[13-14]。然而,关于PCSCs的确切起源仍不清楚。一种理论认为肿瘤干细胞起源于正常干细胞中发生的累积突变,这些突变最终引发恶性转化。另外一些研究表明,分化程度较高的细胞经过突变可能会产生不受调节的自我更新和干细胞样特性的能力[15]。
2.2 PCSCs 的表面标记物
CSCs 表面的分子标记物对其分离鉴别尤为重要。在胰腺癌中,虽然C S C s 所占比例较低,但随着实验技术的发展,仍有一些胰腺癌干细胞的表面标志物被发现。Li等[12]研究发现CD44+、CD24+、ESA+胰腺癌细胞具有干细胞样的高成瘤性、自我更新能力以及多向分化特性,因此认为CD44+、CD24+、ESA+可作为PCSCs的表面标记物。数月后,Hermann等[16]证实在胰腺癌中存在CD133阳性表达的CSCs,且CXCR4可以作为一部分具有高转移倾向的CD133+ PCSCs的标志。同样,ALDH也被认为是胰腺癌中的干细胞标志物。在一些异种移植瘤中,具有高ALDH活性的细胞群可有效地启动肿瘤,且相对于低ALDH活性的CD133+细胞群而言,具有更强的成瘤潜力[17]。
随着研究的不断深入,胰腺癌细胞中阴性表达的分子也能成为CSCs表面标志物。Song等[18]研究发现在胰腺癌细胞中,FoxO1阴性细胞具有干细胞样的高致瘤性。FoxO1阴性细胞相对于FoxO1阳性细胞生长倍速的增加明显大于CD133阳性对CD133阴性细胞,或ALDH高对ALDH低表达的细胞,这表明FoxO1作为一种PCSCs标记的特异性比胰腺癌细胞中的CD133与ALDH更好。此外,人们普遍接受的PCSCs的表面标记物还应包括DCLK1、LGR5、CD44v6、c-Met、Tspan8、EpCAM、α6β4、CLD7和CD166等[19-22]。
3 miRNA 调控PCSCs 的作用
维持正常干细胞自我更新和分化的信号转导通路发生异常突变可导致细胞调控紊乱而过度增殖并形成肿瘤。PCSCs中异常的信号转导通路参与了胰腺癌的进程,主要包括Notch、Hedgehog、Wnt/β-catenin、PI3K/Akt等信号通路。近年来研究表明,胰腺癌中异常表达的miRNA可以通过相应靶基因调节以上信号通路(表1),从而促进或抑制PCSCs的分化和自我更新,参与介导胰腺癌的发生、复发、转移和耐药性[3]。
3.1 miRNA 对PCSCs 的促进作用
Tsukasa等[23]通过miRNA微阵列分析发现在CD133+胰腺癌细胞株Capan-1M9中敲减CD133基因表达后miR-30 家族的表达水平显著下降,选取miR-30家族中的miR-30a、-30b和-30c进行相应的细胞功能实验和EMT相关基因的检测,发现miR-30a、-30b和-30c的高表达促进了CD133+胰腺癌细胞的迁移和侵袭以及间充质标志物的升高。此外,根据靶基因预测软件TargetScan,预测CD133为miR-30家族的靶基因[23],CD133+胰腺癌细胞株Capan-1M9中的CD133敲除显著抑制了肿瘤在体内的侵袭和转移,进一步实验还发现CD133是通过与ERK通路的相互作用促进胰腺癌的上皮间质转化[24]。
Hasegawa等[25]在胰腺癌患者中发现miR-1246呈高表达,肿瘤抑制基因Cyclin G2(CCNG2)呈低表达,且它们负性相关。考虑到CCNG2参与抑制肿瘤的增殖、侵袭、分化和化疗抵抗(这是肿瘤干细胞的特征)以及CCNG2是miR-1246潜在的靶基因,他们通过相应的体内和体外实验证实miR-1246-CCNG2轴对化疗耐药至关重要,miR-1246可能通过靶向CCNG2对胰腺癌干细胞具有促进作用。
胰腺癌细胞群中的一小亚群(SP)细胞具有干细胞样特性,其能够在裸鼠体内诱导快速和侵袭性的肿瘤形成。基因表达谱分析显示,SP细胞中miR-21和miR-221的表达较其他胰腺癌细胞显著增高。随后在胰腺癌细胞中沉默miR-21和miR-221的表达可以抑制胰腺癌的发生、转移和化疗抵抗,同时显著降低了SP细胞的数量[26]。另外,有报道提出PCSCs中Notch-1的过度表达导致体外的miR-21表达增加[27],miR-21可通过调节FoxO1(胰腺癌干细胞标志物)实现对胰腺癌细胞的促进作用[18]。
3.2 miRNA 对PCSCs 的抑制作用
研究表明miR-30b在CD24、CD44和EPCAM三阳性胰腺癌干细胞中明显下调,miR-30b可通过靶向Snail以抑制PCSCs的上皮间质转化[28]。然而,之前的研究却认为miR-30b对CD133阳性胰腺癌干细胞的迁移及侵袭有促进作用[23],表明miR-30b对于具有不同表面标志物的胰腺癌干细胞可能具有不同的调控作用。Jiang等[29]发现miR-1181在胰腺癌组织和细胞中表达明显下调,低表达的miR-1181与胰腺癌患者整体生存率和无病生存率较低有关,通过对miR-1181的上调及下调证实miR-1181对PCSCs具有重要的调控作用。进一步研究发现,这一调控作用与miR-1181直接靶向抑制胰腺癌肿瘤干细胞中的转化因子(SOX2)和信号传导转录激活因子3(STAT3)的表达有关[29]。
一项研究中发现在胰腺非肿瘤干细胞中靶向抑制miR-17-92的表达可使这些细胞具有肿瘤干细胞样特征,如CD133的上调、肿瘤细胞的自我更新能力增强和随后的体外化疗抵抗[30]。更重要的是,miR-17-92的过度表达靶向多个信NODAL/ACTIVIN/TGF-beta1的级联成员以及直接抑制下游靶点p21、p57和tbx3,降低了肿瘤干细胞的自我更新能力、体内肿瘤发生率和化疗耐药性,因此认为mirR-17-92在胰腺癌干细胞中具有重要的抑制作用[30]。另一项研究发现,DNMT1对胰腺癌干细胞的维持作用是通过介导miR-17-92簇(由6个成员组成miR-17、18a、19a、19b、20a和92a)的甲基化来实现的[31]。
Ji等[32]研究表明miR-34通过调节其下游靶点Bcl-2和Notch,参与PCSCs的自我更新,在CD44+/CD133+胰腺癌细胞中提高miR-34的表达可显著抑制肿瘤生长以及体内肿瘤形成。最近,miR-137在CD133+胰腺癌细胞中的作用也被揭示出。He等[33]发现KLF12可作为miR-137靶点抑制胰腺癌的CSCs表型,且这一过程又与Wnt/beta-catenin信号通路相关,表明miRNA-137可能通过靶向KLF12抑制Wnt/beta-catenin信号通路降低胰腺癌细胞的干细胞特性。
在CD24+CD44+ESA+胰腺癌细胞中,miR-200c的过度表达通过抑制EMT对人PCSCs具有抑制作用[34-35]。表现为,转录因子ZEB1和Vimentin(间充质细胞标记物)的表达明显下调,E-钙粘蛋白(上皮细胞标记物)的表达上调,菌落形成、侵袭、化疗抵抗和异种移植生长下降。此外,miR-200a表达的缺失与EMT表型和干细胞特征相关,其特征在于细胞表面标志物CD24、CD44和ESA的表达增高[36]。
Gao等[37]研究发现,在胰腺癌中miR-335能够抑制OCT4阳性肿瘤干细胞的形成,OCT4被鉴定并确认为miR-335的直接功能靶点,这意味着miR-335可能抑制以OCT4为靶点的胰腺癌的进展和干细胞特性。此外miR-205的过度表达,在胰腺癌干细胞中亦具有抑制作用[38]。
表1 PCSCs 中异常表达的miRNA
Table 1 Summary of miRNAs dysregulated in PCSCs
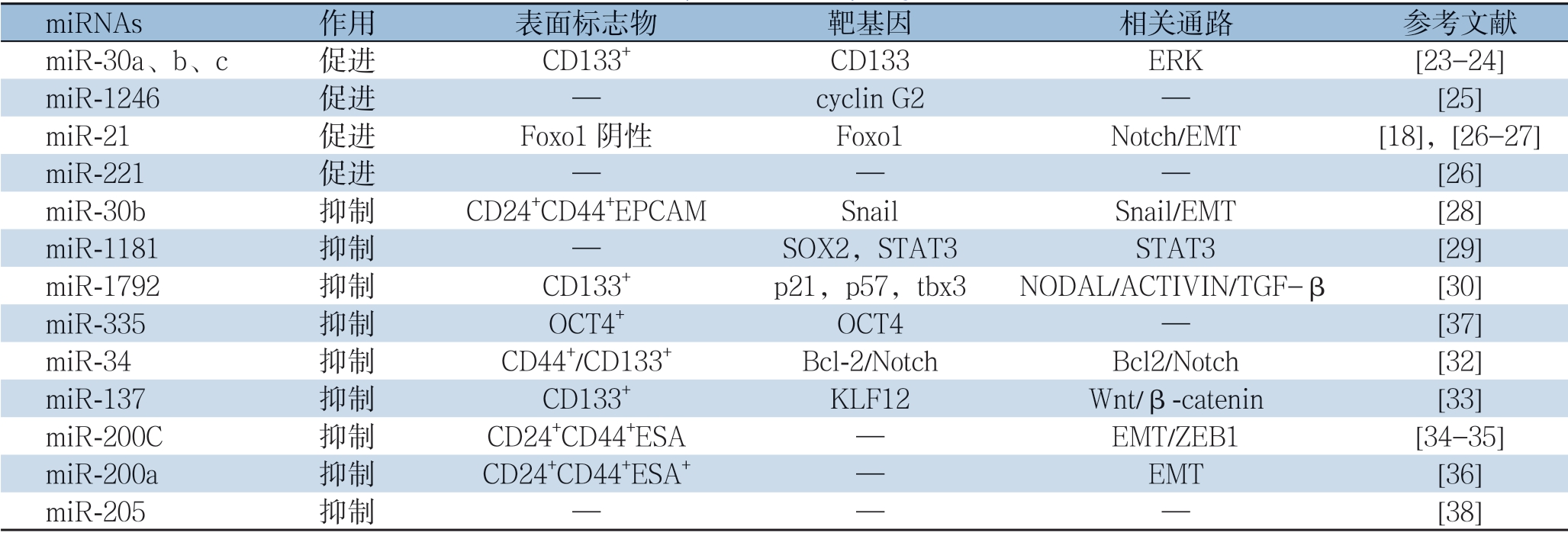
miRNAs 作用 表面标志物 靶基因 相关通路 参考文献miR-30a、b、c 促进 CD133+ CD133 ERK [23-24]miR-1246 促进 — cyclin G2 — [25]miR-21 促进 Foxo1 阴性 Foxo1 Notch/EMT [18],[26-27]miR-221 促进 — — — [26]miR-30b 抑制 CD24+CD44+EPCAM Snail Snail/EMT [28]miR-1181 抑制 — SOX2,STAT3 STAT3 [29]miR-1792 抑制 CD133+ p21,p57,tbx3 NODAL/ACTIVIN/TGF-β [30]miR-335 抑制 OCT4+ OCT4 — [37]miR-34 抑制 CD44+/CD133+ Bcl-2/Notch Bcl2/Notch [32]miR-137 抑制 CD133+ KLF12 Wnt/β-catenin [33]miR-200C 抑制 CD24+CD44+ESA — EMT/ZEB1 [34-35]miR-200a 抑制CD24+CD44+ESA+ — EMT [36]miR-205 抑制 — — — [38]
4 PCSCs 相关治疗策略
近年来的研究表明,一些非癌症相关药物对不同的人CSCs 具有抗癌作用,也可以作为治疗PCSCs的一种选择。Yin等[39]发现辛伐他汀对PCSCs具有抑制作用,并且增强了吉西他滨的疗效。在术前服用辛伐他汀可降低sonic hedgehog(shh)信号的下游介质和进展标志物(cMet,CxCR4 and Vimentin)的表达,表明其可用于预防和共同治疗胰腺癌。数月后Gupta等[40]提出洛伐他汀(另一种降脂药)联合紫杉醇治疗可降低CD133+胰腺癌小鼠中的肿瘤体积。此外,二甲双胍(降糖药)对CSCs的抑制作用也越来越引起人们的关注,使用各种癌症模型(包括乳腺癌、胰腺癌、前列腺癌和结肠癌)的研究已经证明了二甲双胍可通过靶向细胞分化、更新、转移和代谢的特定途径减轻CSCs的作用[41]。对于替吉环素(抗生素),最初是针对某些细菌的抗生素耐药性而开发的,后来却发现其可减少胰腺癌、乳腺癌、肺癌和前列腺癌中CSCs的球形形成[42]。
由于PCSCs中的信号通路及表面标志物对肿瘤的生长、侵袭、转移等具有重要的调节作用,因此可作为胰腺癌的潜在治疗靶点。一项研究显示,DCLK1抑制剂可抑制CHK1的磷酸化,与在细胞系模型中单独使用吉西他滨相比,联合使用吉西他滨和DCLK1抑制剂使胰腺癌患者的细胞存活率显著降低[43]。Ma等[44]发现shh的抑制药血根碱可通过抑制shh通路从而抑制PCSCs的自我更新、迁移及侵袭。另外,靶向药藤黄酚同样能显著抑制PCSCs细胞的自我更新和降低转移潜能,其作用机制是通过调节miR-200c下调Notch1信号[45]。
5 展 望
PCSCs是胰腺癌发生、转移及耐药的主要原因。miRNA对PCSCs具有重要的促进或抑制作用,深入研究miRNA 对PCSCs 生物学行为的调控作用,这将有助于发现PCSCs的起源、自我更新机制和胰腺癌发生发展的关键机制,也有助于研发更好的胰腺癌治疗靶点。相信随着研究的深入,以miRNA为靶分子改变PCSCs的生物学特性的肿瘤治疗策略有望实现。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.doi:10.3322/caac.21338.
[2]Siegel RL,Miller KD,Jemal A.Cancer statistics,2019[J].CA Cancer J Clin,2019,69(1):7-34.doi:10.3322/caac.21551.
[3]Xu YF,Hannafon BN,Ding WQ.microRNA regulation of human pancreatic cancer stem cells[J].Stem Cell Investig,2017,4:5.doi:10.21037/sci.2017.01.01.
[4]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.doi:10.1016/s0092-8674(04)00045-5.
[5]Ambros V.The functions of animal microRNAs[J].Nature,2004,431(7006):350-355.doi:10.1038/nature02871.
[6]Lee RC,Feinbaum RL,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.doi:10.1016/0092-8674(93)90529-y.
[7]Calin GA,Dumitru CD,Shimizu M,et al.Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia[J].Proc Natl Acad Sci USA,2002,99(24):15524-15529.doi:10.1073/pnas.242606799.
[8]胡伟,肖卫东.MicroRNA在胰腺癌中的研究进展[J].中华实验外科杂志,2013,30(1):182-183.doi:10.3760/cma.j.issn.1001-9030.2013.01.072.
Hu W,Xiao WD.Research progress of microRNA in pancreatic cancer[J].Chinese Journal of Experimental Surgery,2013,30(1):182-183.doi:10.3760/cma.j.issn.1001-9030.2013.01.072.
[9]Słotwiński R,Lech G,Słotwińska SM.MicroRNAs in pancreatic cancer diagnosis and therapy[J].Cent Eur J Immunol,2018,43(3):314-324.doi:10.5114/ceji.2018.80051.
[10]Barbato L,Bocchetti M,Di Biase A,et al.Cancer Stem Cells and Targeting Strategies[J].Cells,2019,8(8).pii:E926.doi:10.3390/cells8080926.
[11]Ishiwata T,Matsuda Y,Yoshimura H,et al.Pancreatic cancer stem cells:features and detection methods[J].Pathol Oncol Res,2018,24(4):797-805.doi:10.1007/s12253-018-0420-x.
[12]Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030-1037.doi:10.1158/0008-5472.CAN-06-2030.
[13]Ercan G,Karlitepe A,Ozpolat B.Pancreatic Cancer Stem Cells and Therapeutic Approaches[J].Anticancer Res,2017,37(6):2761-2775.doi:10.21873/anticanres.11628.
[14]Zhan HX,Xu JW,Wu D,et al.Pancreatic cancer stem cells:new insight into a stubborn disease[J].Cancer Lett,2015,357(2):429-437.doi:10.1016/j.canlet.2014.12.004.
[15]Zhou P,Li B,Liu F,et al.The epithelial to mesenchymal transition (EMT) and cancer stem cells:implication for treatment resistance in pancreatic cancer[J].Mol Cancer,2017,16(1):52.doi:10.1186/s12943-017-0624-9.
[16]Hermann PC,Huber SL,Herrler T,et al.Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J].Cell Stem Cell,2007,1(3):313-323.doi:10.1016/j.stem.2007.06.002.
[17]Kim MP,Fleming JB,Wang H,et al.ALDH activity selectively defines an enhanced tumor-initiating cell population relative to CD133 expression in human pancreatic adenocarcinoma[J].PLoS One,2011,6(6):e20636.doi:10.1371/journal.pone.0020636.
[18]Song W,Li Q,Wang L,et al.FoxO1-negative cells are cancer stemlike cells in pancreatic ductal adenocarcinoma[J].Sci Rep,2015,5:10081.doi:10.1038/srep10081.
[19]Rao CV,Mohammed A.New insights into pancreatic cancer stem cells[J].World J Stem Cells,2015,7(3):547-555.doi:10.4252/wjsc.v7.i3.547.
[20]Heiler S,Wang Z,Zöller M.Pancreatic cancer stem cell markers and exosomes - the incentive push[J].World J Gastroenterol,2016,22(26):5971-6007.doi:10.3748/wjg.v22.i26.5971.
[21]朱建伟,熊力,马望,等.胰腺癌干细胞研究进展[J].中国普通外科杂志,2015,24(9):1304-1309.doi:10.3978/j.issn.1005-6947.2015.09.019.
Zhu JW,Xiong L,Ma W,et al.Research progress of pancreatic cancer stem cells[J].Chinese Journal of General Surgery,2015,24(9):1304-1309.doi:10.3978/j.issn.1005-6947.2015.09.019.
[22]Gzil A,Zarebska I,Bursiewicz W,et al.Markers of pancreatic cancer stem cells and their clinical and therapeutic implications[J].Mol Biol Rep,2019,doi:10.1007/s11033-019-05058-1.[Epub ahead of print]
[23]Tsukasa K,Ding Q,Miyazaki Y,et al.miR-30 family promotes migratory and invasive abilities in CD133(+) pancreatic cancer stem-like cells[J].Hum Cell,2016,29(3):130-137.doi:10.1007/s13577-016-0137-7.
[24]Ding Q,Miyazaki Y,Tsukasa K,et al.CD133 facilitates epithelialmesenchymal transition through interaction with the ERK pathway in pancreatic cancer metastasis[J].Mol Cancer,2014,13:15.doi:10.1186/1476-4598-13-15.
[25]Hasegawa S,Eguchi H,Nagano H,et al.MicroRNA-1246 expression associated with CCNG2-mediated chemoresistance and stemness in pancreatic cancer[J].Br J Cancer,2014,111(8):1572-1580.doi:10.1038/bjc.2014.454.
[26]Zhao Y,Zhao L,Ischenko I,et al.Antisense inhibition of microRNA-21 and microRNA-221 in tumor-initiating stem-like cells modulates tumorigenesis,metastasis,and chemotherapy resistance in pancreatic cancer[J].Target Oncol,2015,10(4):535-548.doi:10.1007/s11523-015-0360-2.
[27]Bao B,Wang Z,Ali S,et al.Notch-1 induces epithelialmesenchymal transition consistent with cancer stem cell phenotype in pancreatic cancer cells[J].Cancer Lett,2011,307(1):26-36.doi:10.1016/j.canlet.2011.03.012.
[28]Xiong Y,Wang Y,Wang L,et al.MicroRNA-30b targets Snail to impede epithelial-mesenchymal transition in pancreatic cancer stem cells[J].J Cancer,2018,9(12):2147-2159.doi:10.7150/jca.25006.
[29]Jiang J,Li Z,Yu C,et al.MiR-1181 inhibits stem cell-like phenotypes and suppresses SOX2 and STAT3 in human pancreatic cancer[J].Cancer Lett,2015,356(2 Pt B):962-970.doi:10.1016/j.canlet.2014.11.007.
[30]CioffiM,Trabulo SM,Sanchez-Ripoll Y,et al.The miR-17-92 cluster counteracts quiescence and chemoresistance in a distinct subpopulation of pancreatic cancer stem cells[J].Gut,2015,64(12):1936-1948.doi:10.1136/gutjnl-2014-308470.
[31]Zagorac S,Alcala S,Fernandez Bayon G,et al.DNMT1 Inhibition Reprograms Pancreatic Cancer Stem Cells via Upregulation of the miR-17-92 Cluster[J].Cancer Res,2016,76(15):4546-4558.doi:10.1158/0008-5472.CAN-15-3268.
[32]Ji Q,Hao X,Zhang M,et al.MicroRNA miR-34 inhibits human pancreatic cancer tumor-initiating cells[J].PLoS One,2009,4(8):e6816.doi:10.1371/journal.pone.0006816.
[33]He Z,Guo X,Tian S,et al.MicroRNA-137 reduces stemness features of pancreatic cancer cells by targeting KLF12[J].J Exp Clin Cancer Res,2019,38(1):126.doi:10.1186/s13046-019-1105-3.
[34]Ma C,Ding YC,Yu W,et al.MicroRNA-200c overexpression plays an inhibitory role in human pancreatic cancer stem cells by regulating epithelial-mesenchymal transition[J].Minerva Med,2015,106(4):193-202.
[35]马超,黄涛,丁月超,等.microRNA-200c在胰腺癌干细胞中的表达及作用[J].中国普通外科杂志,2015,24(3):352-356.doi:10.3978/j.issn.1005-6947.2015.03.009.
Ma C,Huang T,Ding YC,et al.Expression of microRNA-200c in pancreatic cancer stem cells and its significance[J].Chinese Journal of General Surgery,2015,24(3):352-356.doi:10.3978/j.issn.1005-6947.2015.03.009.
[36]Lu Y,Lu J,Li X,et al.MiR-200a inhibits epithelial-mesenchymal transition of pancreatic cancer stem cell[J].BMC Cancer,2014,14:85.doi:10.1186/1471-2407-14-85.
[37]Gao L,Yang Y,Xu H,et al.MiR-335 functions as a tumor suppressor in pancreatic cancer by targeting OCT4[J].Tumour Biol,2014,35(8):8309-8318.doi:10.1007/s13277-014-2092-9.
[38]Chaudhary AK,Mondal G,Kumar V,et al.Chemosensitization and inhibition of pancreatic cancer stem cell proliferation by overexpression of microRNA-205[J].Cancer Lett,2017,402:1-8.doi:10.1016/j.canlet.2017.05.007.
[39]Yin Y,Liu L,Zhao Z,et al.Simvastatin inhibits sonic hedgehog signaling and stemness features of pancreatic cancer[J].Cancer Lett,2018,426:14-24.doi:10.1016/j.canlet.2018.04.001.
[40]Gupta VK,Sharma NS,Kesh K,et al.Metastasis and chemoresistance in CD133 expressing pancreatic cancer cells are dependent on their lipid raft integrity[J].Cancer Lett,2018,439:101-112.doi:10.1016/j.canlet.2018.09.028.
[41]Saini N,Yang X.Metformin as an anti-cancer agent:actions and mechanisms targeting cancer stem cells[J].Acta Biochim Biophys Sin (Shanghai),2018,50(2):133-143.doi:10.1093/abbs/gmx106.
[42]Renz BW,D'Haese JG,Werner J,et al.Repurposing Established Compounds to Target Pancreatic Cancer Stem Cells (CSCs)[J].Med Sci (Basel),2017,5(2).pii:E14.doi:10.3390/medsci5020014.
[43]Kawamura D,Takemoto Y,Nishimoto A,et al.Enhancement of cytotoxic effects of gemcitabine by Dclk1 inhibition through suppression of Chk1 phosphorylation in human pancreatic cancer cells[J].Oncol Rep,2017,38(5):3238-3244.doi:10.3892/or.2017.5974.
[44]Ma Y,Yu W,Shrivastava A,et al.Sanguinarine inhibits pancreatic cancer stem cell characteristics by inducing oxidative stress and suppressing sonic hedgehog-Gli-Nanog pathway[J].Carcinogenesis,2017,38(10):1047-1056.doi:10.1093/carcin/bgx070.
[45]Huang CC,Lin CM,Huang YJ,et al.Garcinol downregulates Notch1 signaling via modulating miR-200c and suppresses oncogenic properties of PANC-1 cancer stem-like cells[J].Biotechnol Appl Biochem,2017,64(2):165-173.doi:10.1002/bab.1446.
