肝细胞癌(hepatocellular carcinoma,HCC)是我国常见的恶性肿瘤,发病率和病死率分别排在第4位和第2位[1]。我国对于HCC的治疗主要以外科手术根治性切除为首选[2];在国际上,射频消融术(radiofrequency ablation,RFA)也作为早期HCC的一线选择,被认为能够达到根治效果[3-4]。肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolization,TACE)主要用于难以手术切除的中晚期HCC患者,该方法已被证明可以控制肿瘤并延长生存期[5]。然而,TACE是一种姑息性的而非根治性的治疗方法[6],其缺点是在多数情况下由于无法实现肿瘤完全坏死而导致远期效果不佳。此外,为了尽可能的摧毁肿瘤细胞需进行反复多次的TACE治疗,但其疗效仍有限,初期缓解后肿瘤复发率很高[7]。为进一步提高中晚期HCC患者TACE治疗效果,TACE与RFA的联合治疗方案也被用于临床,但由于中晚期HCC患者高度多样化的特点,有关TACE联合RFA治疗中晚期HCC患者的研究报道多为观察性研究,没有高质量的随机化研究来明确其临床疗效[8]。为了实现类似随机化研究的效果,本研究应用倾向得分匹配(propensity score matching,PSM)的方式来减少混杂偏倚影响[9],通过回顾性分析我院接受介入治疗的HCC患者的临床资料,评价TACE联合RFA治疗方案的疗效。
1 资料与方法
1.1 一般资料
纳入自2012年1月—2018年1月在西南医科大学附属医院肝胆外科接受介入治疗的HCC患者的临床资料。患者纳入标准:⑴ 符合原发性肝癌诊疗规范(2017年版)中肝癌临床诊断及分期标准的Ia期及以上;⑵ 符合巴塞罗那(Barcelona Clinic Liver Cancer,BCLC)肝癌临床分期系统中B期的诊断标准[10];⑶ 成功接受TACE与TACE联合RFA为初始治疗;⑷年龄≥20岁;⑸ 肿瘤个数≤7个,肿瘤最大直径≤7 cm。排除标准:⑴ 接受外科手术切除;⑵ 存在静脉癌栓及肝外转移灶;⑶ 肝功能为C级;⑷ 失访。较多肿瘤数量及肿瘤最大直径超过7 cm时会影响TACE和RFA效果,因此我们排除了肿瘤个数超过7个及最大直径>7 cm的患者[11]。通过CT或磁共振检查测量肿瘤个数及最大直径。
1.2 治疗方案
1.2.1 TACE 治疗 患者仰卧位,以右下肢腹股沟区股动脉搏动最强点为穿刺点,常规消毒铺巾,1% 的利多卡因做局部浸润麻醉,使用Seldinger技术穿刺右股动脉置导管鞘,并在泥鳅导丝引导下将5-F EH 导管引入腹腔干及肠系膜上动脉造影,找出肿瘤染色并明确肿瘤大小及供血动脉,并进一步将微导管插管至肿瘤主要供血动脉;造影证实导管位置良好后,灌注洛铂40 mg+氟尿嘧啶1.0 g,采用罂粟乙碘化油15 mL 与表柔比星10 mg 充分乳化后缓慢推注,再使用聚乙烯醇微球1 g 巩固栓塞,然后再造影检查肿瘤染色范围缩小及碘油沉积良好后证明栓塞成功,即退管、拔鞘、加压包扎穿刺点,结束手术。
1.2.2 TACE 联合RFA 治疗 是否联合RFA 是在科室治疗组内讨论后共同决定 ,并在TACE 治疗术后1~2 周内行RFA 治疗。RFA 使用美国ANGO公司的RITA 射频消融系统执行,术前静滴盐酸异丙嗪注射液25 mg+ 盐酸哌替啶注射液100 mg,根据患者肿瘤位置选择体位,通过CT 扫描确定体表进针点及进针方向和角度;消毒铺巾,1% 的利多卡因局部浸润麻醉,置入22 G 穿刺引导针,再次行CT 扫描确定位置后置入RFA 针于肿瘤内部,确认主针位置并根据肿瘤大小将子针展开2~5 cm,自动调节输出功率,消融10~15 min,完成后行针道消融;术后行胸腹CT 扫面观察病灶消融情况,并检查气胸、出血等并发症。
1.3 评估及随访
所有患者均在术后1个月复查增强CT,然后每2~3个月进行1次门诊随访,主要复查肝功能、肿瘤标志物及腹部CT或MRI等指标。患者生存时间定义为接受介入治疗到死亡;肿瘤复发按照实体肿瘤疗效标准[12]定义为随访期间肿瘤病灶在增强CT动脉期显影的直径总和较前增加20%或出现新发病灶。
1.4 统计学处理
连续性变量的数据采用中位数及极差[M(R)]表示,二分类资料采用频数(率)[n(%)]表示。连续性变量的分析采用Mann-Whitney U检验,分类变量在PSM前采用χ2检验。使用PSM对潜在的混杂(如年龄、性别、Child-Pugh分级、肿瘤最大直径、肿瘤数量、AFP、PIVKA-II等)因素进行调整,以减少本研究中的治疗选择偏倚和混杂因素的影响,两组间按照卡钳值±0.1进行1:1 匹配。完成PSM 后的连续性变量的分析采用Wilcoxon signed-rank检验,分类变量采用McNemar检验。通过绘制Kaplan-Meier生存曲线观察两种手术方式的生存曲线,并用Log-rank法比较两组患者的生存曲线是否有差异。以P<0.05为两组间差异有统计学意义。
2 结 果
2.1 匹配前后临床资料比较
根据纳入与排除标准共收集221例符合条件的患者,其中TACE组共127例,TACE联合RFA组(联合组)共94 例,所有患者均未出现肝脏出血、胆汁漏、肝功能衰竭等严重并发症。两组患者的临床资料比较见表1,包括:性别、年龄、BMI、HBV 感染与否、白蛋白、ALT、总胆红素(TBIL)、凝血酶原时间国际标准化比率(PT-INR)、Child 分级、AFP、异常凝血酶原(PIVKA-II)、肿瘤直径、肿瘤数量与随访时间,其中白蛋白差异具有统计学意义(P=0.01)。本研究通过采用PSM法来减小混杂因素后,匹配得到每组80例患者,两组临床背景资料差异均无统计学意义(均P>0.05)(表2)。
表1 PSM 前两组患者临床资料
Table1 The clinical data of two groups of patients before PSM
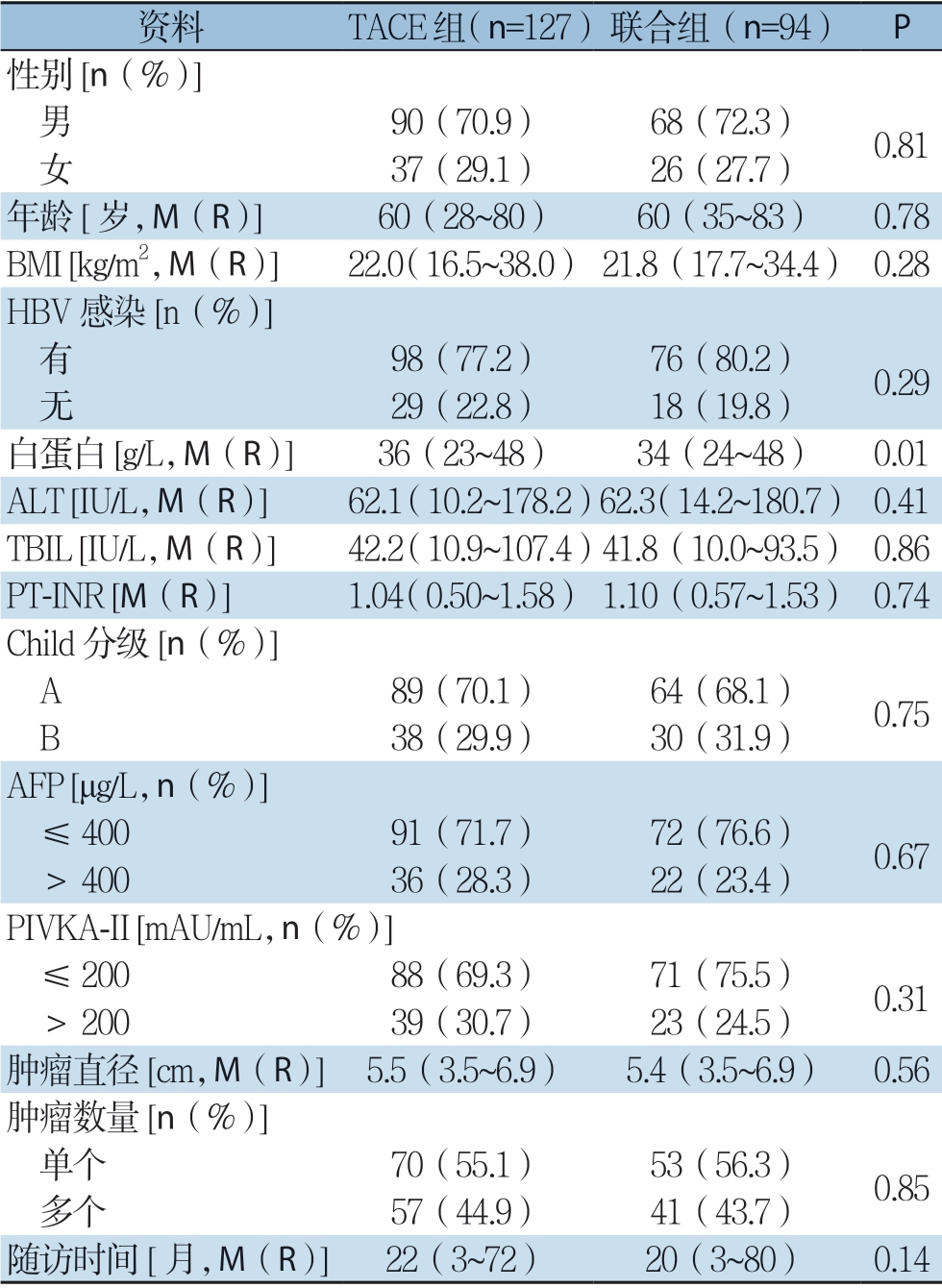
资料 TACE组(n=127)联合组(n=94) P 性别[n(%)] 男 90(70.9) 68(72.3) 0.81 女 37(29.1) 26(27.7)年龄[岁,M(R)] 60(28~80) 60(35~83) 0.78 BMI [kg/m2,M(R)] 22.0(16.5~38.0) 21.8(17.7~34.4) 0.28 HBV 感染[n(%)] 有 98(77.2) 76(80.2) 0.29 无 29(22.8) 18(19.8)白蛋白[g/L,M(R)] 36(23~48) 34(24~48) 0.01 ALT [IU/L,M(R)] 62.1(10.2~178.2)62.3(14.2~180.7) 0.41 TBIL [IU/L,M(R)] 42.2(10.9~107.4)41.8(10.0~93.5) 0.86 PT-INR [M(R)] 1.04(0.50~1.58) 1.10(0.57~1.53) 0.74 Child 分级[n(%)] A 89(70.1) 64(68.1) 0.75 B 38(29.9) 30(31.9)AFP [μg/L,n(%)] ≤40091(71.7) 72(76.6) 0.67 >40036(28.3) 22(23.4)PIVKA-II [mAU/mL,n(%)] ≤20088(69.3) 71(75.5) 0.31 >20039(30.7) 23(24.5)肿瘤直径[cm,M(R)] 5.5(3.5~6.9) 5.4(3.5~6.9) 0.56肿瘤数量[n(%)] 单个 70(55.1) 53(56.3) 0.85 多个 57(44.9) 41(43.7)随访时间[月,M(R)] 22(3~72) 20(3~80) 0.14
表2 PSM 后两组患者临床资料
Table2 The clinical data of two groups of patients after PSM
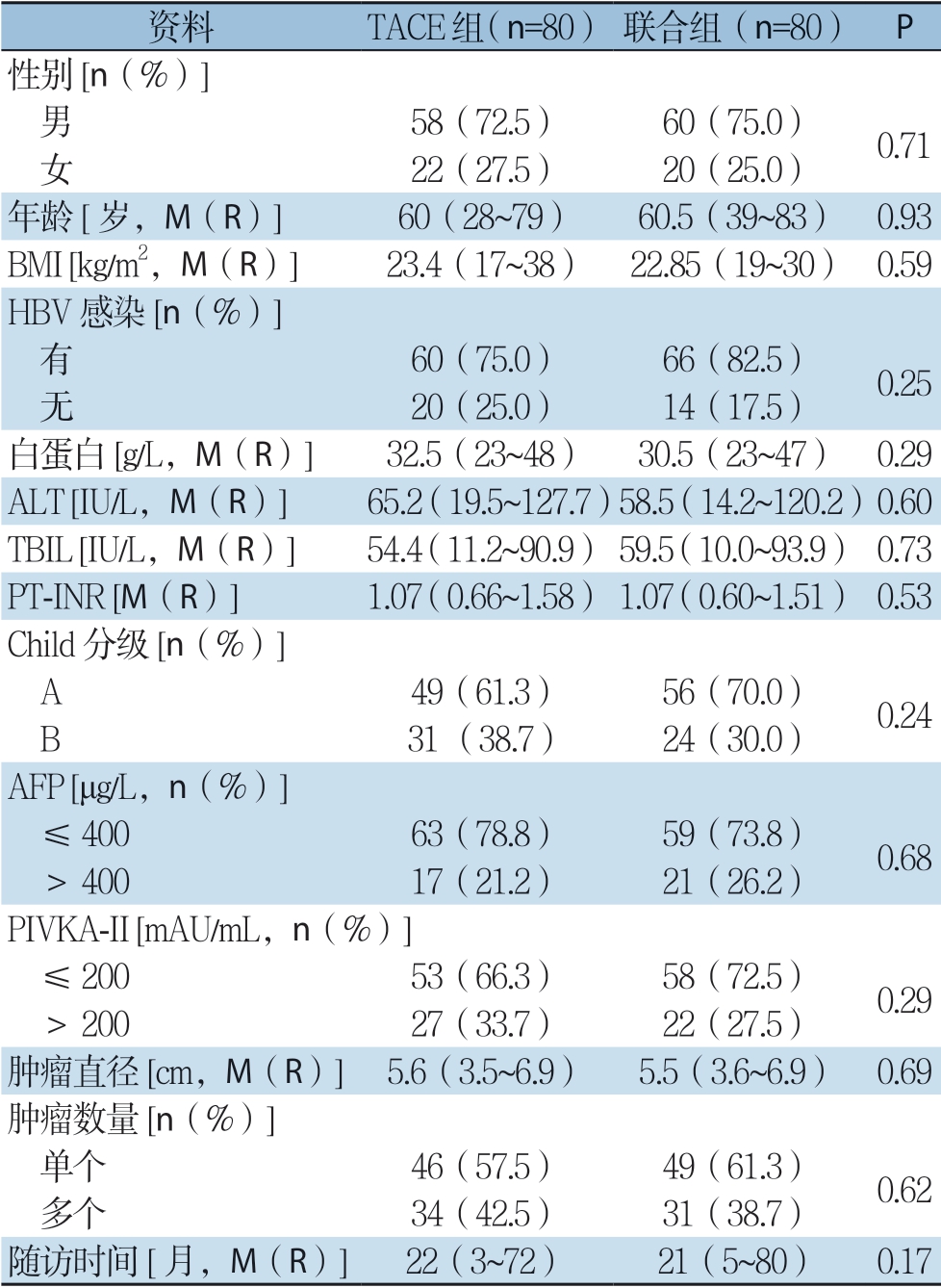
资料 TACE组(n=80) 联合组(n=80) P性别[n(%)] 男 58(72.5) 60(75.0) 0.71 女 22(27.5) 20(25.0)年龄[岁,M(R)] 60(28~79) 60.5(39~83) 0.93 BMI [kg/m2,M(R)] 23.4(17~38) 22.85(19~30) 0.59 HBV 感染[n(%)] 有 60(75.0) 66(82.5) 0.25 无 20(25.0) 14(17.5)白蛋白[g/L,M(R)] 32.5(23~48) 30.5(23~47) 0.29 ALT [IU/L,M(R)] 65.2(19.5~127.7)58.5(14.2~120.2)0.60 TBIL [IU/L,M(R)] 54.4(11.2~90.9) 59.5(10.0~93.9) 0.73 PT-INR [M(R)] 1.07(0.66~1.58) 1.07(0.60~1.51) 0.53 Child 分级[n(%)] A 49(61.3) 56(70.0) 0.24 B 31 (38.7) 24(30.0)AFP [μg/L,n(%)] ≤40063(78.8) 59(73.8) 0.68 >40017(21.2) 21(26.2)PIVKA-II [mAU/mL,n(%)] ≤20053(66.3) 58(72.5) 0.29 >20027(33.7) 22(27.5)肿瘤直径[cm,M(R)] 5.6(3.5~6.9) 5.5(3.6~6.9) 0.69肿瘤数量[n(%)] 单个 46(57.5) 49(61.3) 0.62 多个 34(42.5) 31(38.7)随访时间[月,M(R)] 22(3~72) 21(5~80) 0.17
2.2 匹配后两组生存率比较
匹配后,随访期间TACE组和TACE联合RFA组 的病死率分别为76.2%和71.2%;通过K a p l a n-Meier生存分析比较两组患者生存时间,中位生存时间分别18个月和22个月,1、2、3年生存率分别为91.3%、57.9%、16.1%、94.4%、66.2%、29.2%,差异具有统计学意义(P=0.024)(图1)。
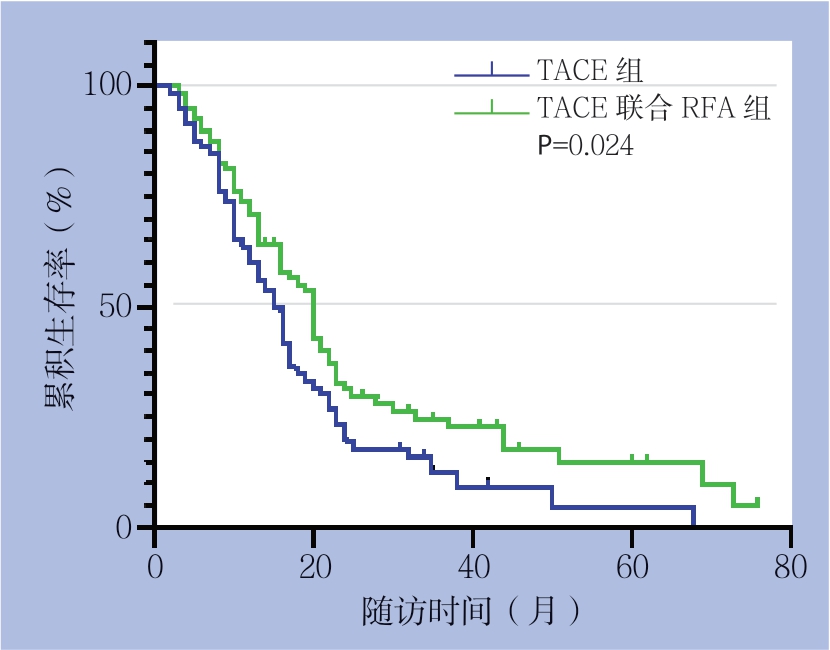
图1 两组患者的生存曲线
Figure1 Survival curves of the two groups of patients
2.3 亚组分析
为了明确TACE联合RFA治疗最适的患者类型,根据患者的A P F 含量、术前C h i l d 分级和肿瘤单发或多发情况对匹配后的两组进行亚组分析。当AFP≤400 μg/L时TACE联合RFA治疗组的生存时间明显优于TACE组,差异具有统计学意义(P=0.044)(图2A);AFP>400 μg/L时两组生存时间差异无统计学意义(P=0.099)(图2B)。 当肿瘤为单发时TACE 联合R F A 治疗组的生存时间明显优于TACE 组,差异具有统计学意义(P=0.037)(图3A);当肿瘤为多发时生存时间差异比较无统计学意义(P=0.062)(图3B)。两组患者Child评分在A级和B级时生存时间差异比较无统计学意义(P=0.097、P=0.441)。

图2 不同AFP 水平患者的生存曲线
Figure2 Survival curves of patients with different AFP levels
A:AFP ≤400 μg/L 患者;B:AFP>400 μg/L 时两组患者
A:Patients with AFP≤400 μg/L; B:Patients with AFP>400 μg/L

图3 不同肿瘤数目患者的生存曲线
Figure3 Survival curves of patients with different tumor numbers
A:单发肿瘤患者;B:多发肿瘤患者
A:Patients with solitary lesion; B:Patients with multiple lesions
3 讨 论
HCC是一种常见的恶性肿瘤。由于其起病隐匿,早期症状不明显,且进展迅速,确诊时大多数患者已经处于中晚期,丧失手术根治机会,非手术治疗是其重要的治疗方式[13]。TACE和RFA作为介入干预手段,在对丧失手术机会的中晚期肝癌患者的治疗效果和维持肝脏功能方面供了适当的平衡[14]。TACE通过超选择性的向肿瘤供血血管中注入抗肿瘤药物和栓塞血管,使肿瘤组织中药物浓度明显增高,明显加少肿瘤组织血液供应,能够有效杀伤癌细胞使肿瘤坏死、缩小[15]。RFA通过电极针发出的射频电波使周围癌组织震荡以此产生局部80~110 ℃的热量来杀死肿瘤组织[16]。
单独使用TACE和RFA有一定的局限性,在有多个肿瘤或肿瘤直径较大的HCC患者中肿瘤血供情况复杂,通常由多条供血动脉供血,所有供血动脉难以明确及完全栓塞,因此在许多病例中观察到了TACE术后肿瘤残留[17];在肿瘤位于大血管附近时邻近的血管的血液流动会对热凝血产生降温作用,使得消融面积有限,影响治疗效果[18-19]。既往的研究报道指出,与单独使用TACE治疗相比,TACE联合RFA 治疗可有效控制肿瘤及延长生存期,尤其是对于大肝癌患者;而且两种疗法的并发症方面没有显著的差别[20]。TACE联合RFA的优势在于,TACE阻断肝动脉血流可减小肿瘤体积,能够降低血流对RFA的降温作用,产生更大的坏死区域[21];在TACE中使用碘油和抗癌药物也提高了对微转移的检测和控制[22]。而且TACE手术后HCC组织通常会形成包膜,这样使得在RFA治疗使热量集中于肿瘤组织内,减少了对周围正常肝组织的损害,既提高了对肿瘤的损毁程度,又保护了正常肝脏[23]。因此在中晚期HCC患者中采用TACE联合RFA治疗可产生协同作用加强对肿瘤的杀灭,从而提高患者生存率[24]。本研究通过回顾性分析既往临床资料,证实了在中晚期HCC患者中,接受TACE联合RFA治疗的患者累计生存时间明显优于单独TACE治疗 。
由于中晚期HCC患者的复杂性,TACE联合RFA可能并不适用于所有的患者。因此,确定适合接受这种治疗的患者类型非常重要,所以在本研究中我们对不同类型的患者进行了亚组分析。在根据Child分级对患者进行亚组分析后,本研究发现在A级和B级的患者中,TACE联合RFA 治疗患者生存率并无明显差异。导致这一结果的原因可能是我们纳入研究的行介入治疗患者在该Child分级为A级和B级的预后差异性较小[25];另外可能由于两组数据的样本量较少,且随访观察时间较短,导致不能够检查出明显差异。在根据肿瘤单发或多发情况对患者进行亚组分析时发现,在单发肿瘤中TACE联合RFA 治疗效果优于单独TACE治疗,而当肿瘤为多发时两种治疗方式的患者累计生存时间并无明显区别。这可能是由于单发肝癌中TACE联合RFA治疗对肿瘤的损毁程度更彻底[26],所以对延长生成时间有着明显的与优势。而多发肝癌的恶性程度通常较高,常有肝内转移灶和不易发现的小肝癌病灶,复发转移率机率大[27],两种介入手术方式对多发转移病灶通常只能够处理较大的和CT下显影的病灶[28],对于肝内转移灶及隐匿病灶作用有限。研究[29]已证实,AFP水平能够反应HCC的恶性程度,AFP较高的各期HCC患者中复发率高,预后差。本研究发现当AFP≤400 μg/L时TACE联合RFA治疗组的生存时间明显优于TACE组,而当AFP>400 μg/L时,两组生存时间差异无统计学意义。
目前对于是否行TACE联合RFA治疗的方案,大多是依据HCC分期及肝功能等指标[21]。本研究结果指出在Child分级为A级和B级的患者中两种治疗方式的生存曲线无明显差异,这提示,在决定选择TACE 联合RFA 治疗方案时,患者A 级和B级肝功能可能并不是首要的参考因素。但是在AFP<400 μg/L或为单发的肿瘤患者中可优先选择TACE联合RFA治疗,以获得更好的治疗效果,而在AFP≥400 μg/L或多发肿瘤的患者中,由于肿瘤具有较高的恶性程度和易转移复发[30],TACE联合RFA治疗与单独TACE治疗相比并无明显优势,对于该类患者需考虑积极的靶向治疗及其它二线治疗。
本研究尚有很多不足之处,如本研究为小样本、单中心回顾性研究,随访观察时间短;且本研究主要着重于比较两种方式对患者生存情况获益情况,对于术后肿瘤的复发情况未作进一步分析;而且虽然本研究进行了PSM分析,但仍有可能存在选择性偏差。
[1] 高婷,李超,梁锌,等.中国癌症流行的国际比较[J].中国肿瘤,2016,25(6):409–414.doi:10.11735/j.issn.1004–0242.2016.06.A001.
Gao T,Li C,Liang X,et al.International Comparison of Cancer Incidence and Mortality in China[J].China Cancer,2016,25(6):409–414.doi:10.11735/j.issn.1004–0242.2016.06.A001.
[2] 李照,朱继业.《原发性肝癌诊疗规范(2017年版)》解读[J].临床肝胆病杂志,2017,33(9):1655–1657.doi:10.3969/j.issn.1001– 5256.2017.09.006.
Li Z,Zhu JY.An interpretation of diagnosis,management,and treatment of hepatocellular carcinoma (V2017) [J].Journal of Clinical Hepatology,2017,33(9):1655–1657.doi:10.3969/j.issn.1001–5256.2017.09.006.
[3] Lee S,Kang TW,Cha DI,et al.Radiofrequency ablation vs.surgery for perivascular hepatocellular carcinoma:Propensity score analyses of long-term outcomes[J].J Hepatol,2018,69(1):70–78.doi:10.1016/j.jhep.2018.02.026.
[4] Lersritwimanmaen P,Nimanong S.Hepatocellular Carcinoma Surveillance:Benefit of Serum Alfa-fetoprotein in Real-world Practice[J].Euroasian J Hepatogastroenterol,2018,8(1):83–87.doi:10.5005/jp-journals-10018–1268.
[5] Zhao Y,Zhu X,Wang H,et al.Safety and Efficacy of Transcatheter Arterial Chemoembolization Plus Radiotherapy Combined With Sorafenib in Hepatocellular Carcinoma Showing Macrovascular Invasion[J].Front Oncol,2019,9:1065.doi:10.3389/fonc.2019.01065.
[6] Liu J,Xie S,Duan X,et al.Assessment of efficacy and safety of the transcatheter arterial chemoembolization with or without apatinib in the treatment of large hepatocellular carcinoma[J].Cancer Chemother Pharmacol,2019.doi:10.1007/s00280–019–04004-z.[Epub ahead of print]
[7] Takayasu K,Arii S,Ikai I,et al.Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients[J].Gastroenterology,2006,131(2):461–469.doi:10.1053/j.gastro.2006.05.021.
[8] Azuma S,Asahina Y,Nishimura-Sakurai Y,et al.Efficacy of additional radiofrequency ablation after transcatheter arterial chemoembolization for intermediate hepatocellular carcinoma[J].Hepatol Res,2016,46(4):312–319.doi:10.1111/hepr.12566.
[9] Lin J,Gamalo-Siebers M,Tiwari R.Propensity score matched augmented controls in randomized clinical trials:A case study[J].Pharm Stat,2018,17(5):629–647.doi:10.1002/pst.1879.
[10] Bruix J,Sherman M,American Association for the Study of Liver Diseases.Management of hepatocellular carcinoma:an update[J].Hepatology,2011,53(3):1020–1022.doi:10.1002/hep.24199.
[11] Yan JY,Zhang JL,Wang MQ,et al.Combined transcatheter arterial chemoembolization and radiofrequency ablation in single-session for solitary hepatocellular carcinoma larger than 7 cm[J].Asia Pac J Clin Oncol,2018,14(4):300–309.doi:10.1111/ajco.12817.
[12] Lencioni R,Llovet JM.Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30(1):52–60.doi:10.1055/s-0030–1247132.
[13] Sarin SK,Kumar M,Lau GK,et al.Asian-Pacific clinical practice guidelines on the management of hepatitis B:a 2015 update[J].Hepatol Int,2016,10(1):1–98.doi:10.1007/s12072–015–9675–4.
[14] 中华医学会放射肿瘤学分会,中国生物医学工程学会精确放疗分会肝癌学组与消化系统肿瘤专家委员会,中国研究型医院学会放射肿瘤学分会肝癌学组.2016年原发性肝癌放疗共识[J].中华放射肿瘤学杂志,2016,25(11):1141–1150.doi:10.3760/cma.j.issn.1004–4221.2016.11.001.
Society of Radiation Oncology of Chinese Medical Association,Liver Cancer Group and Gastrointestinal Oncology Expert Committee,Precision Radiotherapy Branch,Chinese Society of Biomedical Engineering,Liver Cancer Group of Society of Radiation Oncology Chinese Research Hospital Association.Consensus on radiation therapy for primary liver cancer in 2016[J].Chinese Journal of Radiation Oncology,2016,25(11):1141–1150.doi:10.3760/cma.j.issn.1004–4221.2016.11.001.
[15] 魏晓平,胡明道,田大广,等.射频消融联合肝动脉化疗栓塞治疗肝癌合并动静脉分流[J].中国普通外科杂志,2013,22(7):867–870.doi:10.7659/j.issn.1005–6947.2013.07.010.
Wei XP,Hu MD,Tian DG.Radiofrequency ablation plus transarterial chemoembolization for hepatocelluar carcinoma with arteriovenous shunts[J].Chinese Journal of General Surgery,2013,22(7):867–870.doi:10.7659/j.issn.1005–6947.2013.07.010.
[16] 张汉洋,庄志彬,林春冬,等.经皮射频消融术与腹腔镜肝切除术治疗原发性小肝癌的疗效及预后比较[J].中国普通外科杂志,2019,28(1):24–30.doi:10.7659/j.issn.1005–6947.2019.01.004.
Zhang HY,Zhuang ZB,Lin CD,et al.Efficacy and prognosis comparison of percutaneous radiofrequency ablation and laparoscopic hepatectomy in treatment of small hepatocellular carcinoma[J].Chinese Journal of General Surgery,2019,28(1):24–30.doi:10.7659/j.issn.1005–6947.2019.01.004.
[17] Cho JY,Paik YH,Park HC,et al.The feasibility of combined transcatheter arterial chemoembolization and radiotherapy for advanced hepatocellular carcinoma[J].Liver Int,2014,34(5):795–801.doi:10.1111/liv.12445.
[18] Minami Y,Nishida N,Kudo M.Therapeutic response assessment of RFA for HCC:contrast-enhanced US,CT and MRI[J].World J Gastroenterol,2014,20(15):4160–4166.doi:10.3748/wjg.v20.i15.4160.
[19] 张磊,熊俊.腹腔镜下微波消融治疗巨大肝血管瘤:附86例报告[J].中国普通外科杂志,2017,26(7):902–906.doi:10.3978/j.issn.1005–6947.2017.07.014.
Zhang L,Xiong J.Laparoscopic microwave ablation for giant hepatic hemangioma:a report of 86 cases[J].Chinese Journal of General Surgery,2017,26(7):902–906.doi:10.3978/j.issn.1005–6947.2017.07.014.
[20] 赵鹏,郑加生,张洪海,等.肝动脉导管化疗栓塞联合 CT 引导精准微波消融治疗原发性肝癌的疗效及影响因素[J].中华肿瘤杂志,2016,38(2):138–145.doi:10.3760/cma.j.issn.0253–3766.2016.02.012.
Zhao P,Zheng JS,Zhang HH,et al.Efficacy evaluati on and exploration of TACE combined with CT-guided precision microwave ablation treatmen tf or pri mary liver cancer[J].Chinese Journal of Oncology,2016,38(2):138–145.doi:10.3760/cma.j.issn.0253–3766.2016.02.012.
[21] Rossi S,Garbagnati F,Lencioni R,et al.Percutaneous radiofrequency thermal ablation of nonresectable hepatocellular carcinoma after occlusion of tumor blood supply[J].Radiology,2000,217(1):119–126.doi:10.1148/radiology.217.1.r00se02119.
[22] Li JH,Wang Y,Xie XY,et al.Aspirin in combination with TACE in treatment of unresectable HCC:a matched-pairs analysis[J].Am J Cancer Res,2016,6(9):2109–2116.
[23] 牟廷刚,赖良,谢飞,等.TACE联合CT引导RFA治疗肝癌疗效评价[J].中国普通外科杂志,2014,23(7):996–999.doi:10.7659/j.issn.1005–6947.2014.07.028.
Mou TG,Lai L,Xie F,et al.Combination of TACE and CTguided radiofrenquency ablation in treatment of hepatocellular carcinoma[J].Chinese Journal of General Surgery,2014,23(7):996–999.doi:10.7659/j.issn.1005–6947.2014.07.028.
[24] Langenbach MC.RFA vs resection of HCC:exploring the past to improve the future[J].Eur Radiol,2019,29(5):2677–2678.doi:10.1007/s00330–019–6000-y.
[25] Chen RX,Gan YH,Ge NL,et al.A new prediction model for prognosis of patients with intermediate-stage HCC after conventional transarterial chemoembolization:an internally validated study[J].J Cancer,2019,10(26):6535–6542.doi:10.7150/jca.34064.
[26] Liu F,Chen M,Mei J,et al.Transarterial Chemoembolization Combined with Radiofrequency Ablation in the Treatment of Stage B1 Intermediate Hepatocellular Carcinoma[J].J Oncol,2019,2019:6298502.doi:10.1155/2019/6298502.
[27] He MK,Le Y,Li QJ,et al.Hepatic artery infusion chemotherapy using mFOLFOX versus transarterial chemoembolization for massive unresectable hepatocellular carcinoma:a prospective nonrandomized study[J].Chin J Cancer,2017,36(1):83.doi:10.1186/s40880–017–0251–2.
[28] Matsui O,Miyayama S,Sanada J,et al.Interventional oncology:new options for interstitial treatments and intravascular approaches:superselective TACE using iodized oil for HCC:rationale,technique and outcome[J].J Hepatobiliary Pancreat Sci,2010,17(4):407–409.doi:10.1007/s00534–009–0234-z.
[29] Ueno M,Hayami S,Shigekawa Y,et al.Prognostic impact of surgery and radiofrequency ablation on single nodular HCC 5 cm:Cohort study based on serum HCC markers[J].J Hepatol,2015,63(6):1352–1359.doi:10.1016/j.jhep.2015.07.013.
[30] Notarpaolo A,Layese R,Magistri P,et al.Validation of the AFP model as a predictor of HCC recurrence in patients with viral hepatitis-related cirrhosis who had received a liver transplant for HCC[J].J Hepatol,2017,66(3):552–559.doi:10.1016/j.jhep.2016.10.038.
