原发性肝癌是全球第六大常见癌症,同时也是全球癌症死亡的第四大原因,每年约有841000例 新发病例和782000例死亡[1]。其中,70%~90%的原发性肝癌是肝细胞癌(hepatocellular carcinoma,HCC),大约50%的HCC新发病例和死亡病例发生在中国。近年来,原发性肝癌的发病率呈逐渐上升趋势,已成为世界范围关注的健康问题。据报道[2-3],HCC的5年生存率仅为15%~40%。根治性肝切除仍然是现阶段提高HCC生存率的有效方法,同时肝癌的系统治疗已经进入靶向治疗和免疫治疗的进程,索拉非尼、仑伐替尼及纳武单抗等相继被批准用于晚期肝癌一线及二线治疗[4-6],鉴于此,寻找HCC 的有效的治疗靶点以及对术后生存时间评估,探究与肿瘤发生、发展及预后相关的肿瘤生物学指标具有一定的临床意义。胶质细胞成熟因子β(glia maturation factor β,GMFB)是一种17 kDa、高度保守的脑蛋白,其在神经系统发育过程中是神经胶质细胞的分化诱导剂,具有神经营养和神经保护功能[7]。GMFB通过磷酸化途径参与细胞内信号转导的调节[8]。近年来研究[9-11]发现,在胶质瘤、乳腺癌和卵巢癌等中GMFB高表达且与预后不良密切相关。Ki-67广泛存在于细胞有丝分裂的除G0外的各个时期,全面地反映细胞的增殖活性,并可指导乳腺癌、宫颈癌、肺癌等恶性肿瘤的转归及预后[12-13]。然而,HCC中GMFB与Ki-67表达相关性以及GMFB与临床病理资料间的关系目前国内外鲜有报道,本研究从GMFB的转录及蛋白质水平检测其在HCC组织中的表达,并探究GMFB与Ki-67在HCC的表达相关性及GMFB表达与HCC患者相关临床病理特征之间的关系。
1 材料与方法
1.1 标本来源
收集2012年1月—2016年12月安徽医科大学附属安徽省立医院肝脏外科行根治性肝切除术的91例HCC 组织及对应的癌旁组织(距离癌组织边缘 >2 cm)石蜡切片,临床病理资料包括患者性别、年龄、有无HBV感染、AFP、肿瘤数目、肝硬化、微血管侵犯(MVI)、Edmondson分级、BCLC分期以及随访资料。91例患者中男77例,女14例;年龄32~87岁,平均59岁;Edmondson分级I~II级63例、III~IV级28例;BCLC分期A~B期者27例,C~D期者64例。随访时间截止至2019年2月,所有患者均电话随访,失访率14%。另外收集2018年11月—2019年4月于安徽医科大学附属省立医院肝脏外科因HCC行肝切除术的患者的新鲜冷冻HCC组织及其配对癌旁组织36对,-80 ℃保存。石蜡组织切片及新鲜标本病理诊断均为HCC,所有病例术前均未接受放化疗、中医等治疗。本研究资料获得患者及家属知情同意及安徽医科大学附属省立医院临床试验伦理委员会批准(伦理批件号2017伦审第114号)。
1.2 主要试剂
兔抗人多克隆抗体GMFB(美国Proteintech公司);兔抗人多克隆抗体Ki-67(美国Proteintech公司);新型酶标羊抗鼠/兔IgG聚合物(福州迈新公司);DAB显色试剂盒(福州迈新公司);苏木素染色剂(北京中杉金桥公司);TRIzol试剂(美国Thermo公司),逆转录试剂盒(美国Thermo公司),qRT-PCR引物(上海擎科生物公司)。
1.3 实验方法
1.3.1 qRT-PCR 从HCC 与癌旁组织中提取总RNA,逆转录成cDNA。按照逆转录试剂盒进行PCR 扩增,一式三份进行。引物由上海擎科生物公司合成,GMFB 引物序列正向:5'-ATG TTG CCG AAG ATT TAG TGG AA-3', 反向:5'-CCA CCA GGC GTT TAT CCT TG T-3,内参设置18 s,引物序列正向:5'-CGG CGA CGA CCC ATT CGA AC-3',反向:5'-GAA TCG AAC CCT GAT TCC CCG TC-3';反应条件:94 ℃变性10 s,55 ℃退火1 min,72 ℃延伸30 s,共34 个循环,表达水平通过2-ΔΔCt 方法分析。
1.3.2 Western blot 将36 对新鲜冷冻HCC 组织及其配对癌旁组织裂解后提取总蛋白,Bradford 法定量蛋白质,调节各样品蛋白质浓度一致后加样,每孔30 μg,电泳分离,转至NC 膜上,含5% 脱脂奶粉的洗涤缓冲液室温下于摇床中封闭1 h,加入GMFB 抗体(1:1000)和内参蛋白GAPDH 抗体(1:1000),4 ℃过夜孵育,TBST 洗膜3 次,每次10 min,加二抗(1:1000)室温孵育2 h,再次洗膜后显影,采用Tanon 5200 Imaging System捕获印迹,使用Image-J 软件分析GMFB 蛋白和内参蛋白GAPDH 的灰度值,根据目标蛋白和内参蛋白灰度值的比值计算GMFB 的相对表达量。
1.3.3 免疫组化 采用免疫组化SP 法对91 例HCC 及癌旁组织中GMFB 和Ki-67 的表达情况进行检测,石蜡包埋标本4 μm 切片,在65 ℃烤箱中烘烤20 min,二甲苯脱蜡后经100%、95%、75% 梯度乙醇水化,PBS 漂洗后以柠檬酸钠缓冲液pH(6.0)高压容器中加热至沸腾,高压阀门喷气持续3 min 完成抗原修复。过氧化氢室温孵育10 min,以阻断内源性过氧化物酶活性,PBS 冲洗3 次,每次3 min;加入兔抗人GMFB 多克隆抗体(1:300)/兔抗人多克隆抗体Ki-67(1:8000)后室温孵育2 h,PBS 冲洗后加入二抗,室温孵育30 min后PBS 冲洗,显微镜控制下DAB 显色,最后苏木素复染,自来水冲洗后蓝化,梯度乙醇脱水,二甲苯透明,中性树胶封片,镜检。
1.3.4 结果判读 GMFB 蛋白主要定位于细胞质中,部分细胞核可见着色,Ki-67 蛋白主要定位于细胞核中,染色区域呈现出弥漫性棕黄色或黄褐色。免疫组化结果通过半定量法评估[11],高倍镜下取5 个视野观察阳性着色细胞所占区域百分比,记分:0 分(0~4%);1 分(5%~24%);2 分(25%~49%);3 分(50%~74%)或4 分(75%~100%)。染色的强度分级如下:0 分,阴性;1 分,弱;2 分,中等或3 分,强。通过将2 个得分相乘得到最终得分为 0 到12 分。将得分>5 分视为阳性表达,否则为阴性表达。每张切片的结果均由两位经验丰富的病理科主治医师采用双盲法进行判读。
1.4 统计学处理
使用SPSS 21.0及Graph Prism 8.0软件对数据进行统计学分析。qRT-PCR及Western blot结果为计量资料,以均数±标准差( ±s)表示;采用χ2检验分析GMFB表达与患者临床病理资料间的关系,并以Spearman等级相关分析两因素间的相关性。通过Kaplan-Meier方法绘制无病生存期(DFS)和总生存期(OS)曲线,并作Log-rank检验。Cox回归模型用于分析GMFB的表达与患者临床病理参数等多因素与HCC预后的关系。P<0.05为差异有统计学意义。
±s)表示;采用χ2检验分析GMFB表达与患者临床病理资料间的关系,并以Spearman等级相关分析两因素间的相关性。通过Kaplan-Meier方法绘制无病生存期(DFS)和总生存期(OS)曲线,并作Log-rank检验。Cox回归模型用于分析GMFB的表达与患者临床病理参数等多因素与HCC预后的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 HCC 及癌旁组织GMFB mRNA 表达
qRT-PCR结果显示,36对标本中的28 对GMFB在HCC组织中mRNA的表达量高于对应的癌旁组织。GMFB mRNA在HCC组织中的相对表达量为1.67±0.72,癌旁组织中的相对表达量为1.00±0.51,差异具有统计学意义(t=4.595,P<0.001)(图1)。
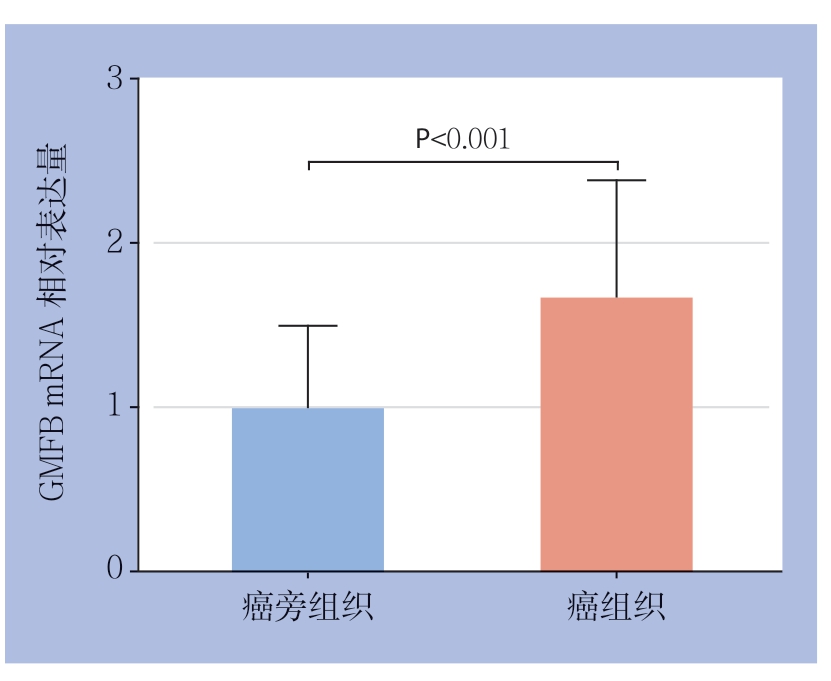
图1 qRT-PCR 检测GMFB mRNA 的表达
Figure1 Detection of GMFB mRNA expression by qRT-PCR
2.2 HCC 及癌旁组织GMFB 蛋白表达
Western blot结果显示,36对新鲜标本中的27对GMFB蛋白在HCC组织中的表达量高于对应的癌旁组织。GMFB蛋白在HCC组织中的相对表达量为1.54±0.65,癌旁组织中的相对表达量为0.90±0.55,差异有统计学意义(t=4.579,P<0.001)(图2)。
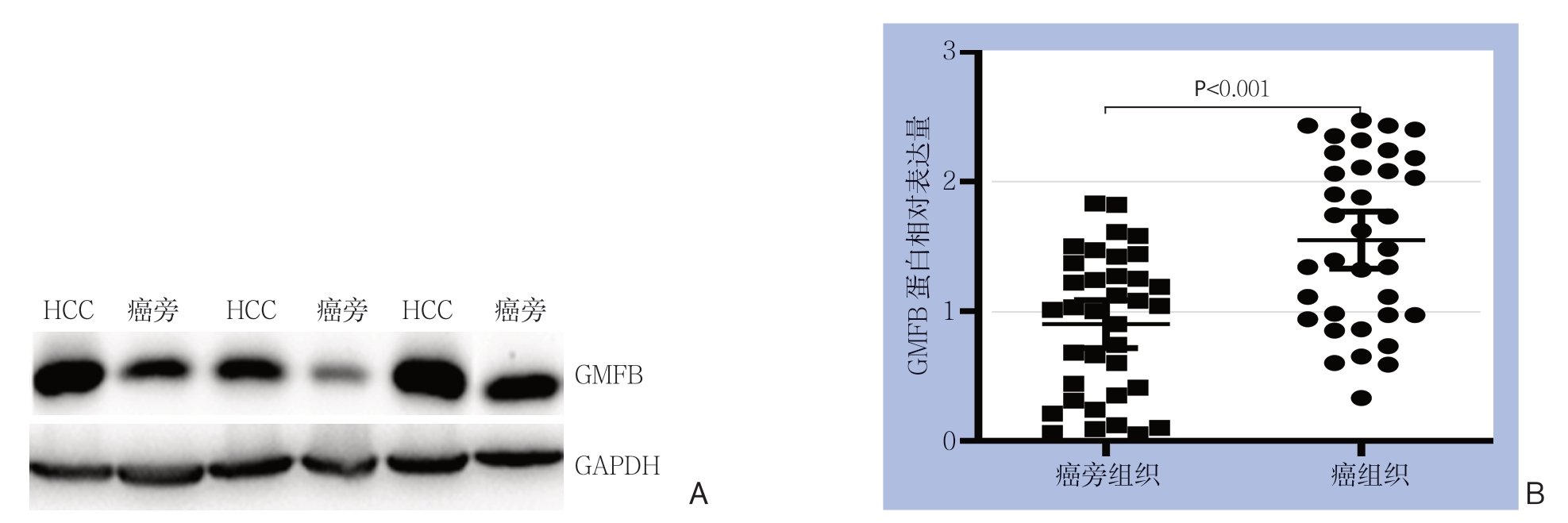
图2 Western blot 检测GMFB 蛋白表达
Figure2 Detection of GMFB protein expression by Western blot analysis
A:GMFB 蛋白在3 对代表性HCC 及癌旁组织中的表达;B:GMFB 蛋白在36 对HCC 及癌旁组织中的相对表达量
A:Expression of GMFB protein in 3 pairs of representative samples of HCC and adjacent tissue; B:Relative expression level of GMFB protein in 36 paired samples of HCC and adjacent tissue
2.3 GMFB 与Ki-67 在HCC 中的表达的相关性
GMFB主要定位于细胞质中,部分切片可见核质均表达,Ki-67主要定位于细胞核中,呈现弥漫性棕黄色或黄褐色,两者在HCC中的表达均显著高于对应的癌旁组织(图3)。91例HCC组织中GMFB、Ki-67的阳性率分别为70.33%(64/91)、67.03%(61/91),癌旁组织阳性表达率分别为21.98%(20/91)、19.78%(18/91),两者在HCC组织与癌旁组织中的阳性表达率差异均有统计学意义(χ2=42.803,P<0.001;χ2=41.357,P<0.001)(表1)。
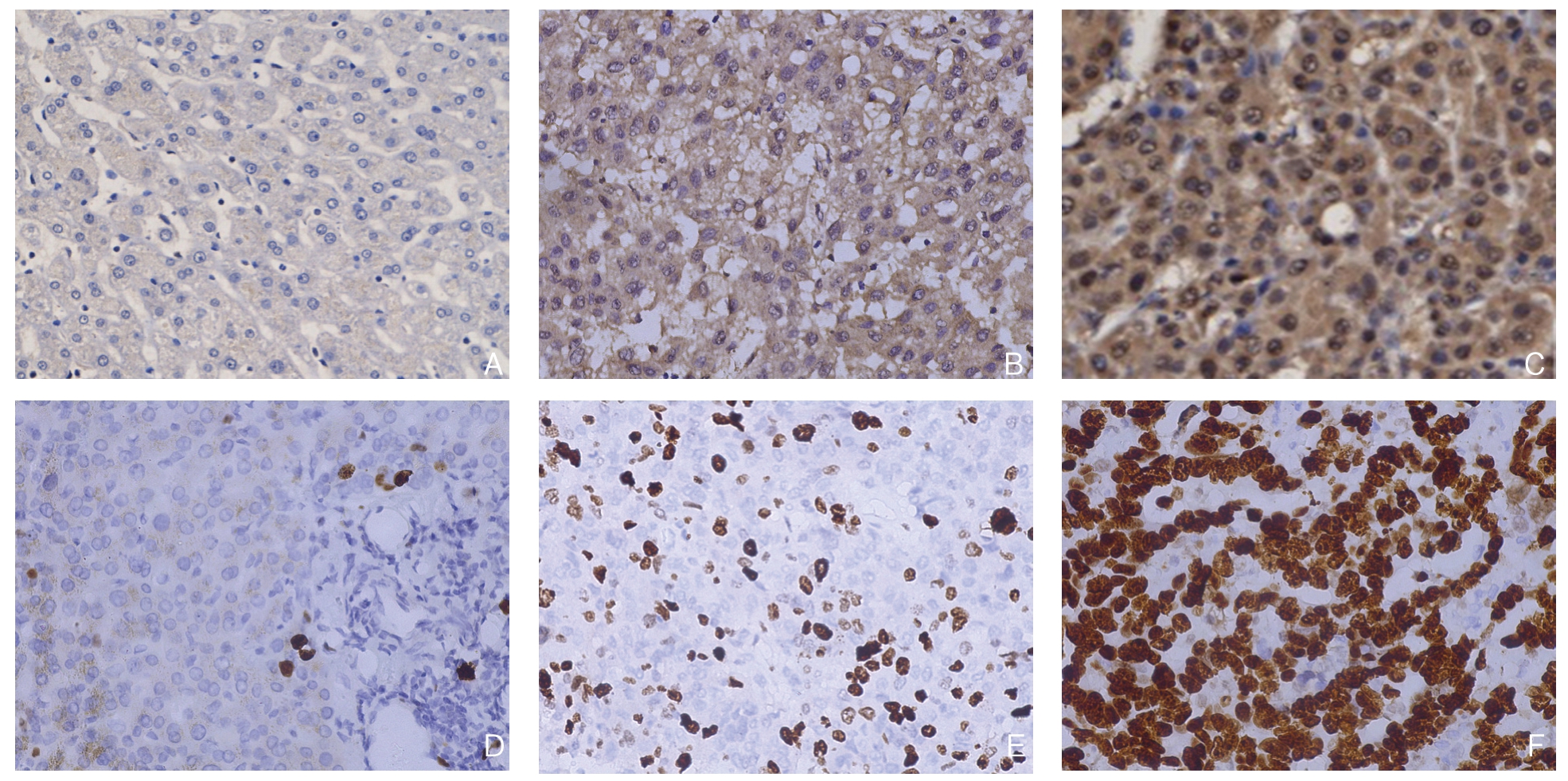
图3 免疫组化检测GMFB、Ki-67 的表达(×400)
Figure3 Immunohistochemical staining for GMFB and Ki-67 expressions (×400)
A:癌旁组织GMFB 表达;B:HCC 组织GMFB 低表达;C:HCC 组织GMFB 高表达;D:癌旁组织Ki-67 表达;E:HCC 组织Ki-67 低表达;F:HCC 组织Ki-67 高表达
A:GMFB expression in adjacent tissue; B:Low GMFB expression in HCC tissue; C:High GMFB expression in HCC tissue; D:Ki-67 expression in adjacent tissues; E:Low Ki-67 expression in HCC tissue; F:High Ki-67 expression in HCC tissue
表1 GMFB与Ki-67蛋白在HCC及癌旁组织的表达[n(%)]
Table1 Expressions of GMFB and Ki-67 protein in HCC and adjacent tissues [n (%)]
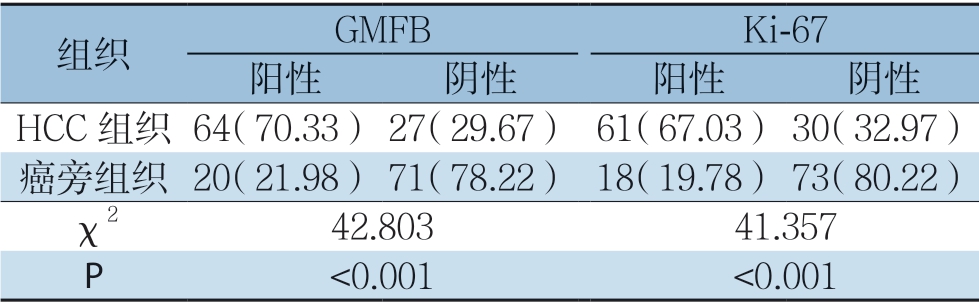
组织 GMFB Ki-67阳性 阴性 阳性 阴性HCC 组织64(70.33) 27(29.67) 61(67.03) 30(32.97)癌旁组织 20(21.98) 71(78.22) 18(19.78) 73(80.22)χ2 42.80341.357 P<0.001 <0.001
2.4 GMFB 的表达与临床病理特征的关系
GMFB 表达上调与HCC 肿瘤MVI(P=0.045)、Edmondson分级(P=0.032)及BCLC分期(P=0.012)明显有关。在合并MVI组(49/64,76.56%)GMFB表达明显高于无MVI组(15/27,55.56%),Edmondson分级III~IV级组(24/28,85.71%)GMFB表达高于I~II级组(40/63,63.49%),BCLC分期C~D期(50/64,78.13%)组GMFB表达同样高于A~B 期组(14/27,51.85%),而与性别、年龄、有无HBV感染、血清AFP水平、肿瘤数目及是否合并肝硬化无明显关系(均P>0.05)(表2)。
表2 GMFB 表达与患者临床病理特征的关系[n(%)]
Table2 Relations of GMFB expression and clinicopathological features of the patients [n (%)]
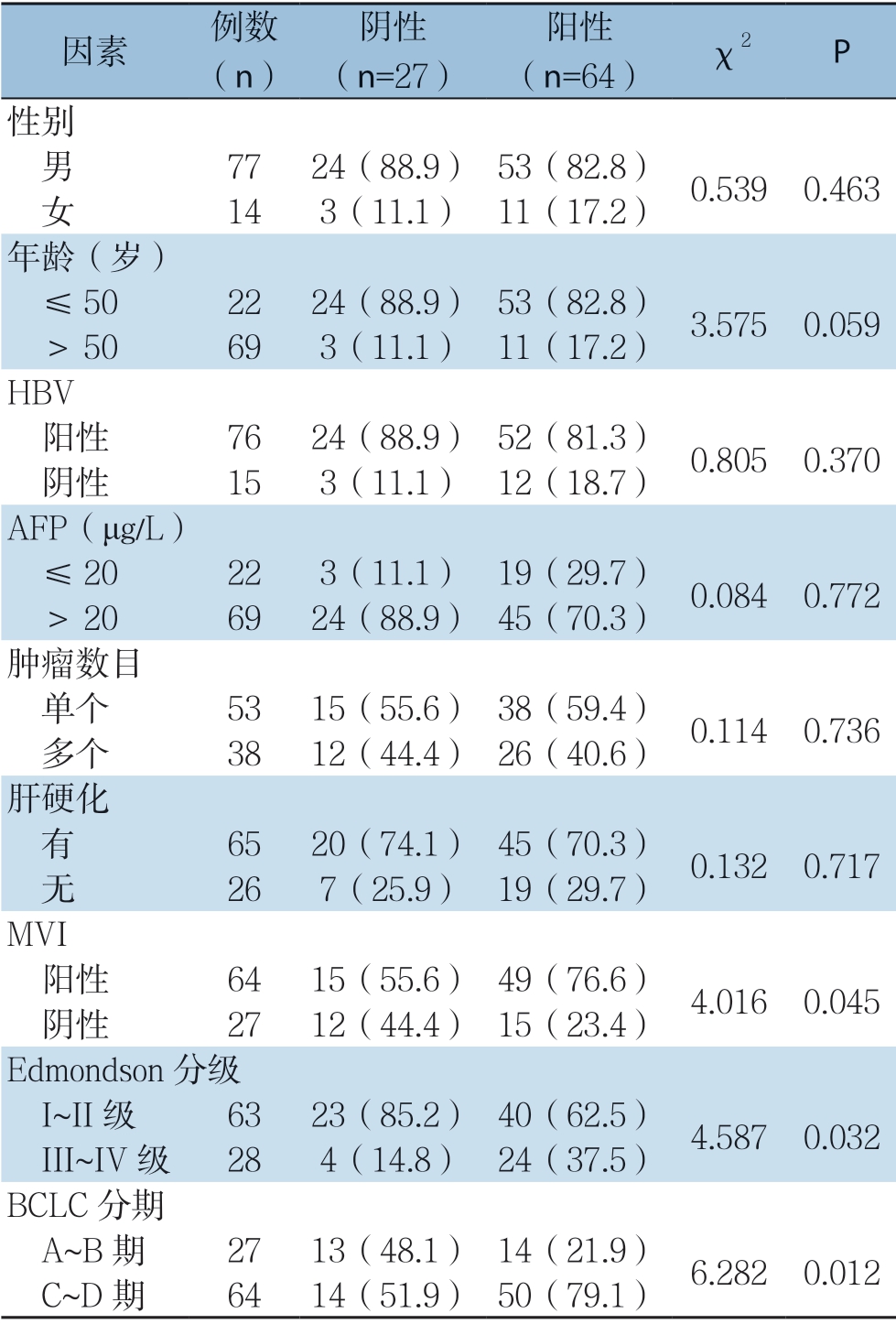
因素 例数(n)阴性(n=27)阳性(n=64) χ2 P性别 男 7724(88.9) 53(82.8) 0.5390.463 女 143(11.1) 11(17.2)年龄(岁) ≤502224(88.9) 53(82.8) 3.5750.059 >50693(11.1) 11(17.2) HBV 阳性 7624(88.9) 52(81.3) 0.8050.370 阴性 153(11.1) 12(18.7) AFP(μg/L) ≤20223(11.1) 19(29.7) 0.0840.772 >206924(88.9) 45(70.3) 肿瘤数目 单个 5315(55.6) 38(59.4) 0.1140.736 多个 3812(44.4) 26(40.6) 肝硬化 有 6520(74.1) 45(70.3) 0.1320.717 无 267(25.9) 19(29.7) MVI 阳性 6415(55.6) 49(76.6) 4.0160.045 阴性 2712(44.4) 15(23.4) Edmondson 分级 I~II 级 6323(85.2) 40(62.5) 4.5870.032 III~IV 级 284(14.8) 24(37.5) BCLC 分期 A~B 期 2713(48.1) 14(21.9) 6.2820.012 C~D 期 6414(51.9) 50(79.1)
2.5 GMFB、Ki-67 在HCC 中表达的相关性分析
Spearman相关分析显示,GMFB、Ki-67在HCC 组织中的表达呈明显正相关(r s=0.265,P<0.05)(表3)。
表3 GMFB 与Ki-67 在HCC 组织中表达的相关性[n(%)]
Table3 Correlation between expressions of GMFB and Ki-67 in HCC tissue [n(%)]
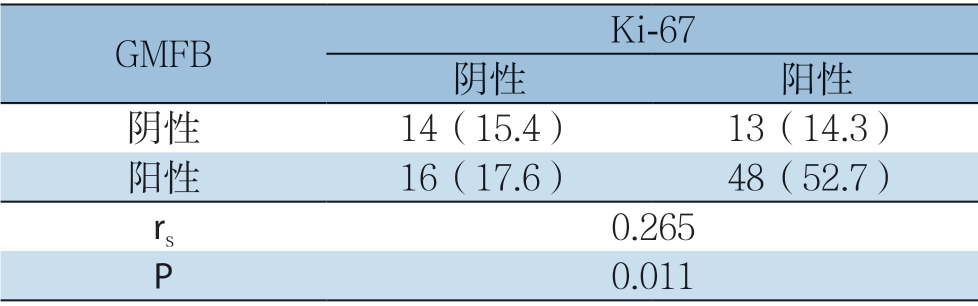
GMFB Ki-67阴性 阳性阴性 14(15.4) 13(14.3)阳性 16(17.6) 48(52.7)rs 0.265 P 0.011
2.6 生存分析
Kaplan-Meier生存分析显示,GMFB阳性表达的HCC患者的DFS(平均4.52个月)较GMFB阴性表达的HCC患者的DFS(平均10.48个月)明显降低(P=0.001);GMFB阳性表达的HCC患者的OS(平均27.67个月)较GMFB阴性表达的HCC患者的OS(平均39.75个月)明显降低(P=0.007)。Cox单因素回归分析显示,患者DFS与OS均与BCLC分期、Ki-67表达、GMFB表达明显有关,而MVI与患者OS明显有关(均P<0.05)(表4);进一步行Cox多因素回归分析显示,Ki-67与GMFB在HCC中高表达是HCC患者预后的独立危险因素(均P<0.05)(表5)。
表4 HCC 患者预后因素的单变量分析
Table4 Univariate analysis of prognostic factors for HCC patients
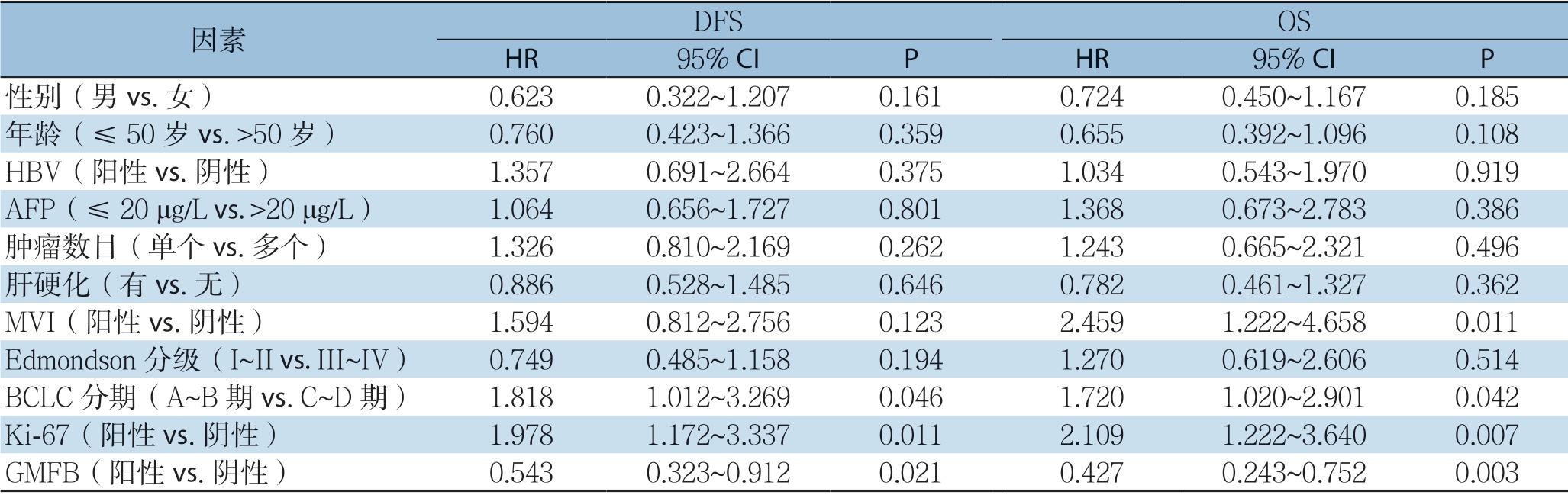
因素 DFS OS HR 95% CI P HR 95% CI P性别(男vs.女) 0.6230.322~1.2070.1610.7240.450~1.1670.185年龄(≤50 岁vs.>50 岁) 0.7600.423~1.3660.3590.6550.392~1.0960.108 HBV(阳性vs.阴性) 1.3570.691~2.6640.3751.0340.543~1.9700.919 AFP(≤20 μg/L vs.>20 μg/L) 1.0640.656~1.7270.8011.3680.673~2.7830.386肿瘤数目(单个vs.多个) 1.3260.810~2.1690.2621.2430.665~2.3210.496肝硬化(有vs.无) 0.8860.528~1.4850.6460.7820.461~1.3270.362 MVI(阳性vs.阴性) 1.5940.812~2.7560.1232.4591.222~4.6580.011 Edmondson 分级(I~II vs.III~IV) 0.7490.485~1.1580.1941.2700.619~2.6060.514 BCLC 分期(A~B 期vs.C~D 期) 1.8181.012~3.2690.0461.7201.020~2.9010.042 Ki-67(阳性vs.阴性) 1.9781.172~3.3370.0112.1091.222~3.6400.007 GMFB(阳性vs.阴性) 0.5430.323~0.9120.0210.4270.243~0.7520.003
表5 HCC 患者预后因素的多因素分析
Table5 Multivariate analysis of prognostic factors for HCC patients
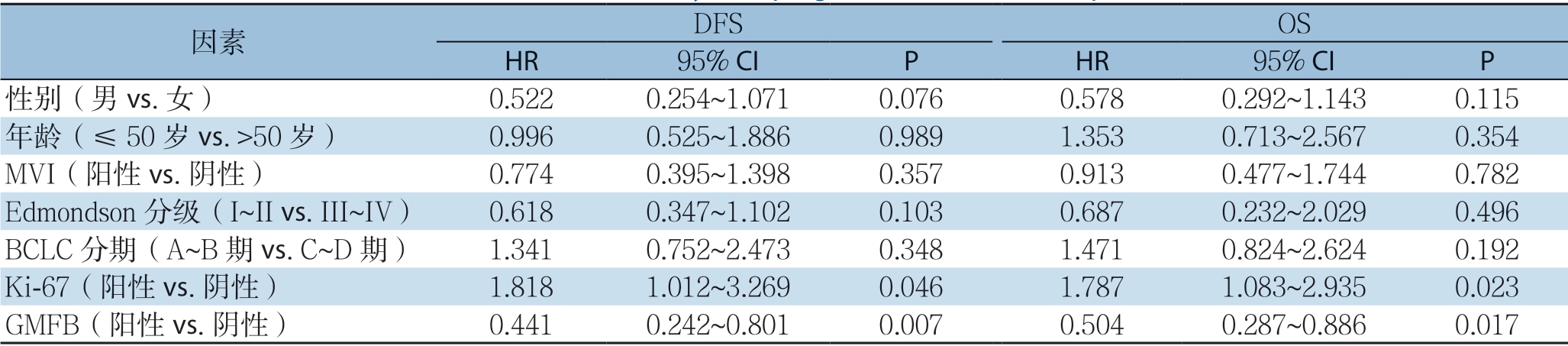
因素 DFS OS HR 95% CI P HR 95% CI P性别(男vs.女) 0.5220.254~1.0710.0760.5780.292~1.1430.115年龄(≤50 岁vs.>50 岁) 0.9960.525~1.8860.9891.3530.713~2.5670.354 MVI(阳性vs.阴性) 0.7740.395~1.3980.3570.9130.477~1.7440.782 Edmondson 分级(I~II vs.III~IV) 0.6180.347~1.1020.1030.6870.232~2.0290.496 BCLC 分期(A~B 期vs.C~D 期) 1.3410.752~2.4730.3481.4710.824~2.6240.192 Ki-67(阳性vs.阴性) 1.8181.012~3.2690.0461.7871.083~2.9350.023 GMFB(阳性vs.阴性) 0.4410.242~0.8010.0070.5040.287~0.8860.017
3 讨 论
HCC的治疗方式主要包括根治性肝切除、局部消融、TACE、肝移植、放射治疗以及全身治疗等[14]。对于难治性中晚期HCC的治疗需要以上治疗方式相辅相成、综合性治疗。随着SHARP和Oriental两大研究的成功开展[4-5],索拉非尼开启了晚期HCC靶向治疗新时代,寻求有效的治疗靶点成为了研究热点。人类GMFB基因位于人14号染色体的长臂上,有6个内含子和7个外显子,纯化的GMFB蛋白具有142个氨基酸残基。研究表明,GMFB可以在细胞内和细胞外充当信号分子,并且可以通过自分泌或旁分泌方式影响信号转导以及细胞通讯[15]。随着研究的深入,多项研究发现GMFB在多种疾病的发生、发展中起到重要作用。Yamazaki等[16]证实了胸腺瘤亚型中GMFB的显著高表达,并发现了GMFB通过诱导淋巴上皮间的相互作用在胸腺瘤的T细胞发育中发挥重要作用。Li等[11]通过免疫组织化学技术分析了246例卵巢病变揭示了GMFB在浆液性卵巢癌组织中的GMFB表达上调,并证实了表达明显高于正常上皮、良性浆液性腺瘤和交界性浆液性腺瘤组织,通过Cox单因素和多因素回归模型分析浆液性卵巢癌中GMFB高表达与DFS和OS的关系,提出GMFB可以被当作浆液性卵巢癌患者预后和生存的预测因子。Kuang等[9]应用GMFB和CD31的免疫组织化学双重染色,发现人胶质母细胞瘤细胞中GMFB的过表达通过引发恶性胶质瘤细胞内皮化过程促进新生血管形成,还通过敲低U87细胞中GMFB的表达发现抑制了胶质母细胞瘤U87细胞的增殖及小管的形成。与此同时,GMFB是一种细胞内源性蛋白,参与细胞信号转导调节。星形胶质细胞中GMFB的表达可能导致p38 MAPK的激活,随后激活NF-κB,最后导致GM-CSF和Cu-Zn SOD的表达,导致一些促炎细胞因子的过度表达及参与了氧化应激反应[17-18]。通过基因感染神经母细胞瘤N18细胞中过表达GMFB诱导GSK-3β激活介导的胱天蛋白酶依赖的细胞凋 亡[19]。Nwosu等[20]研究所得到HCC代谢靶点中筛选出GMFB基因,但目前关于GMFB在HCC中的表达的研究鲜有报道,与临床病理资料及患者预后间的关系未见阐述。
本研究通过Westernblot、qRT-PCR 检测GMFB在36对HCC及配对的癌旁组织中的表达,收集HCC及癌旁组织石蜡切片91例以免疫组化方式检测GMFB和Ki-67的表达,并分析两者表达的相关性,结果均显示GMFB在HCC中表达显著高于癌旁组织,Spearman相关分析GMFB表达与反映细胞增殖的Ki-67的表达显著相关。另外分析GMFB的表达与患者相关临床病理特征之间的关系及与患者预后间的关系,临床病理资料分析显示表达上调的GMFB与HCC肿瘤MVI、Edmondson分级及BCLC分期显著相关(P=0.045、P=0.032、P=0.012),MVI是术后早期复发的重要临床病理特征,可以作为一种重要的预后风险因素[21-22],因此,GMFB在预测术后复发和临床预后等方面值得进一步研究。同时,该研究通过Kaplan-Meier分析,结果表明GMFB表达上调组的无病生存期与总生存期较GMFB较低表达组明显缩短,多因素Cox回归模型表明上调的GMFB是HCC患者预后的独立危险因素。这表明GMFB可能对HCC的发生、发展有一定的意义。Ki-67是细胞增殖的标志物,对细胞周期的具有重要的影响,研究显示Ki-67高表达提示乳腺癌、消化道神经内分泌肿瘤、星形细胞瘤的预后不佳,高表达的Ki-67在HCC中提示肿瘤术后复发风险增加[23-24],本研究中GMFB表达与Ki-67表达显著相关,参考以往报道[8],过表达GMFB在胶质瘤细胞内皮化过程中促进新血管形成,表明GMFB与HCC的增殖相关。现阶段靶向治疗药物主要通过抑制肿瘤细胞增殖及抗血管生成发挥作用,血管生成与免疫抑制构成了血管的微环境,GMFB的表达可能与肿瘤血管生成相关。
综上所述,本研究揭示了GMFB mRNA及蛋白在HCC中的表达情况,进一步分析GMFB的表达与临床病理资料之间的相关性,得到GMFB可能会在HCC的预测早期复发和患者临床预后的预测中发挥作用,具有一定的临床应用价值。当然,GMFB在HCC发生发展中作用的具体机制仍需要进一步探索。小样本及单中心研究具有一定的局限性,进一步深入研究GMFB在HCC靶向治疗联合免疫治疗是未来的研究方向,GMFB有可能成为HCC系统治疗新的位点。
志谢:特别感谢中国科学技术大学生命科学院中国科学院先天免疫与慢性病重点实验室的技术支持、患者及其家属的知情同意以及安徽省立医院伦理委员会的批准。
[1] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394–424.doi:10.3322/caac.21492.
[2] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115–132.doi:10.3322/caac.21338.
[3] Chen W,Zheng R,Zhang S,et al.Cancer incidence and mortality in China in 2013:an analysis based on urbanization level[J].Chin J Cancer Res,2017,29(1):1–10.doi:10.21147/j.issn.1000–9604.2017.01.01.
[4] Llovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma[J].N Engl J Med,2008,359(4):378–390.doi:10.1056/NEJMoa0708857.
[5] Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase Ⅲrandomised,double-blind,placebo-controlled trial[J].Lancet Oncol,2009,10(1):25–34.doi:10.1016/S1470–2045(08)70285–7.
[6] El-Khoueiry AB,Sangro B,Yau T,et al.Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040):an openlabel,non-comparative,phase 1/2 dose escalation and expansion trial[J].Lancet,2017,389(10088):2492–2502.doi:10.1016/S0140–6736(17)31046–2.
[7] 买合木提·阿吾提,练春频,欧庆健,等.GMFB在氧化应激诱导的ARPE19细胞中的表达及意义[J].同济大学学报:医学版,2016,37(5):6–13.doi:10.16118/j.1008–0392.2016.05.002.
Maihemuti AWT,Lian CP,Ou QJ,et al.Expression of Glia maturation factor beta in ARPE19 cells and its relation to oxidative stress[J].Journal of Tongji University:Medical Science,2016,37(5):6–13.doi:10.16118/j.1008–0392.2016.05.002.
[8] Lim R,Miller JF,Zaheer A.Purification and characterization of glia maturation factor beta:a growth regulator for neurons and glia[J].P Proc Natl Acad Sci U S A,1989,86(10):3901–3905.doi:10.1073/pnas.86.10.3901.
[9] Kuang X,Jiang X,Chen C,et al.Expressions of glia maturation factor-β by tumor cells and endothelia correlate with neovascularization and poor prognosis in human glioma[J].Oncotarget,1949,7(52):85750–85763.doi:10.18632/oncotarget.5509.
[10] Alper OM,Chen CP,Akoa A,et al.Characterization of a novel monoclonal antibody to Glia maturation factor-beta showing significant clinical utility in the identification of breast carcinoma[J].Cancer Res,2012,72(8S:):Abstract 694.doi:10.1158/1538–7445.AM2012–694.
[11] Li YL,Ye F,Cheng XD ,et al.Identification of glia maturation factor beta as an independent prognostic predictor for serous ovarian cancer[J].Eur J Cancer,2010,46(11):2104–2118.doi:10.1016/j.ejca.2010.04.015.
[12] Miller I,Min M,Yang C,et al.Ki67 is a Graded Rather than a Binary Marker of Proliferation versus Quiescence[J].Cell Rep,2018,24(5):1105–1112.doi:10.1016/j.celrep.2018.06.110.
[13] Luo Y,Ren F,Liu Y,et al.Clinicopathological and prognostic significance of high Ki-67 labeling index in hepatocellular carcinoma patients:a meta-analysis [J].Int J Clin Exp Med,2015,8(7):10235–10247.
[14] 李民,熊俊.《原发性肝癌诊疗规范(2017年版)》解读[J].中国普通外科杂志,2019,28(7):785–789.doi:10.7659/j.issn.1005– 6947.2019.07.003.
Li M,Xiong J.Interpretation of guidelines for diagnosis and treatment of primary liver cancer (2017 edition)[J].Chinese Journal of General Surgery,2019,28(7):785–789.doi:10.7659/j.issn.1005–6947.2019.07.003.
[15] Fan J,Fong T,Chen X,et al.Glia maturation factor-β:a potential therapeutic target in neurodegeneration and neuroinflammation[J].Neuropsychiatr Dis Treat,2018,14:495–504.doi:10.2147/NDT.S157099.
[16] Yamazaki H,Tateyama H,Asai K,et al.Glia maturation factor-β is produced by thymoma and may promote intratumoral T-cell differentiation[J].Histopathology,2005,47(3):292–302.doi:10.1111/j.1365–2559.2005.02224.x.
[17] Lee SC,Liu W,Brosnan CF,et al.GM-CSF promotes proliferation of human fetal and adult microglia in primary cultures[J].Glia,1994,12(4):309–318.doi.org/10.1002/glia.440120407.
[18] Lim R,Zaheer A,Yorek MA,et al.Activation of nuclear factorkappaB in C6 rat glioma cells after transfection with glia maturation factor[J].J Neurochem,2000,74(2):596–602.doi:10.1046/j.1471–4159.2000.740596.x.
[19] Zaheer A,Knight S,Ahrens M,et al.Glia maturation factor overexpression in neuroblastoma cells activates glycogen synthase kinase-3beta and caspase-3[J].Brain Res,2008,1190:206–214.doi:10.1016/j.brainres.2007.11.011.
[20] Nwosu ZC,Megger DA,Hammad S,et al.Identification of the Consistently Altered Metabolic Targets in Human Hepatocellular Carcinoma[J].Cell Mol Gastroenterol Hepatol,2017,4(2):303–323.doi:10.1016/j.jcmgh.2017.05.004.
[21] Rodríguez-Perálvarez M,Luong TV,Andreana L,et al.A systematic review of microvascular invasion in hepatocellular carcinoma:diagnostic and prognostic variability[J].Ann Surg Oncol,2013,20(1):325–339.doi:10.1245/s10434–012–2513–1.
[22] 陈洁,黎乐群.术前预测肝细胞癌并微血管侵犯的研究进展[J].中国普通外科杂志,2017,26(7):921–925.doi:10.3978/j.issn.1005–6947.2017.07.017.
Chen J,Li LQ.Research progress of preoperative predicting microvascular invasion of hepatocellular carcinoma[J].Chinese Journal of General Surgery,2017,26(7):921–925.doi:10.3978/j.issn.1005–6947.2017.07.017.
[23] Li HH,Qi LN,Ma L,et al.Effect of KI-67 positive cellular index on prognosis after hepatectomy in Barcelona Clinic Liver Cancer stage A and B hepatocellular carcinoma with microvascular invasion[J].Onco Targets Ther,2018,11:4747–4754.doi:10.2147/OTT.S165244.
[24] 魏复群,罗柳平,梁东,等.Ki-67表达与原发性肝癌根治性切除术后行预防性肝动脉化疗栓塞患者预后的关系[J].中国普通外科杂志,2019,28(7):825–832.doi:10.7659/j.issn.1005– 6947.2019.07.008.
Wei FQ,Luo LP,Liang D,et al.Relationship between Ki-67 expression and prognosis of patients with primary liver cancer undergoing prophylactic transarterial chemoembolization after radical hepatectomy[J].Chinese Journal of General Surgery,2019,28(7):825–832.doi:10.7659/j.issn.1005–6947.2019.07.008.
