Lynch综合征(Lynch syndrome,LS)是由于MLH1、MSH2、MSH6、PMS2、EPCAM等错配修复系统相关基因突变引起的MMR蛋白表达缺失或者失活,导致微卫星不稳定(microsatellite instability,MSI),从而引起机体易发生肿瘤的一种常染色体遗传性疾病[1]。LS相关肿瘤主要包括结直肠癌、子宫内膜癌、卵巢癌和胃癌。目前,LS相关的结直肠癌,子宫内膜癌和卵巢癌,在筛查、监测和治疗方面已较为明确,而LS相关胃癌尚存在诸多争议之处[2]。由于LS相关胃癌发病风险在欧美等其他地区有所下降,而在亚洲人群中仍较高[3]。因此,笔者综述了近年来有关LS相关胃癌的研究资料,目的是对LS相关胃癌的流行病学、分子机制及临床病理、筛查诊断、监测、治疗、预防及预后进行综述,以期为充分认识LS相关胃癌、优化其预防决策、提高其诊治水平提供依据和参考。
1 流行病学特征
1.1 发病情况
LS相关胃癌患者发病年龄的中位年龄55岁[4-5],较Kim等[6]报道的非LS相关的胃癌患者的发病中位年龄52岁更晚,但较SEER数据库胃癌发病中位年龄68岁更年轻[7]。目前LS相关胃癌的发病率为1%~13%,低于LS相关结直肠癌(40%~80%)、子宫内膜癌(25%~60%)和卵巢癌(4%~24%)[8]。相比于欧美等地区,亚洲国家LS相关胃癌的发病风险相对较高[3],例如韩国的发病率为4.7%,荷兰为3.5%[9]。在我国,LS相关胃癌约占肠外肿瘤的28%,位居首位[10]。一般LS男性患者患胃癌的终生风险为8.0%,较高于女性的5.3%[5]。
LS相关胃癌的发病风险似乎和错配修复基因的类型相关。在错配修复过程中,MLH1和PMS2形成MutLα错配修复复合体,MSH2和MSH6形成MutSα错配修复复合体[11],MSH2和MLH1尤为重要,两者是错配修复复合体的必需蛋白,如果有MLH1或MSH2基因突变,通常也会有PMS2或MSH6蛋白的降解[12]。而EPCAM突变[1]会导致邻近MSH2启动子的甲基化,也造成MSH2蛋白表达缺失。LS患者数据库(Prospective Lynch Syndrome Database,PLSD)的前瞻性研究显示,在LS相关上消化道肿瘤中,胃癌的累积风险最高,到75岁时MLH1、MSH2、MSH6致病突变携带者胃癌累积风险分别为7.1%、7.7%、5.3%[1]。另一项荷兰的研究表明,MLH1和MSH2突变携带者的胃癌终生风险分别为4.8%和9%,MSH6突变携带者中没有发现有发生胃癌的患者[5]。可见与MLH1和MSH2突变携带者相比,MSH6突变携带者罹患胃癌的风险较低。这一点与LS相关结直肠癌相似,与LS相关子宫内膜癌相反,MSH6突变发生子宫内膜癌的风险是71%,高于MLH1和MSH2突变[13]。虽然两项研究均显示MSH2突变携带者患胃癌风险高于MLH1突变携带者,但风险差异无统计学意义[5,14]。
1.2 危险因素
亚裔是LS相关胃癌的经典危险因素[3,15-16],幽门螺旋杆菌(helicobacter pylori,HP)感染作为胃癌的高危因素,通常也被认为是LS相关胃癌的高危因素[2,17]。另外,LS个体为男性、年龄较大、致病性MLH1/MSH2突变、胃癌一级亲属数量等都与LS相关的胃癌患病独立相关[18],但LS相关的胃癌与胃癌二级亲属[6]无关。除此之外,有研究表明慢性萎缩性胃炎[19]、免疫性胃炎[20]也是LS相关胃癌的危险因素。
2 临床病理特征
研究表明所有LS相关的胃癌均表现出高频MSI(microsatellite instability-high,MSI-H)和MMR蛋白的丢失,涉及LS相关胃癌风险的主要有MLH1和MSH2两个基因发生变异[2]。根据Laurén的分类,胃癌组织学主要分“弥漫型”、“肠型”。大多数的LS相关的GC组织学上为肠型[5,14]。病变部位和侵袭行为的特点主要为,LS相关的胃癌多发生在胃体,占35%,胃窦部占15%,贲门部占23%;LS患者中73%的胃癌一般会侵入固有层、肌层或更深处,其中有27%的患者会累及淋巴结[5]。
3 LS的筛查诊断
3.1 临床标准
目前常用的有Amesterdam II和改良的Bethesda标准(表1)以确定哪些患者需要进行分子检测。
表1 LS 临床诊断标准
Table1 Clinical diagnostic criterion of LS

临床标准 诊断条件Amsterdam II 标准[21] 1.家系中有≥3例亲属确诊LS相关肿瘤(包括结直肠癌、子宫内膜癌、输尿管癌等);2.其中1例是另外2例的一级亲属;3.至少连续累及2代人;4.至少1例发病年龄<50岁;5.在结直肠癌病例中应排除家族性腺瘤性息肉病(FAP)。改良的Bethesda 标准[22] 1.确诊结直肠癌的年龄<50岁;2.发生同时或异时性LS相关肿瘤;3.60岁前有患者组织学确诊MSI-H的结直肠癌;4.一级亲属中至少1例被诊断为LS相关的肿瘤,且其中一种肿瘤在50岁前确诊;5.至少2例一级或二级亲属诊断出结直肠癌。
由于现阶段中国独生子女数量多,家庭成员少,且许多患者先前行过结肠镜检查及息肉切除术,所以通过以上临床标准判断无法可靠地将可疑LS患者纳入检测,再加上收集家族史很困难,所以越来越多的专家建议对结直肠癌患者普查LS,从而同时监测LS相关胃癌[23]。具体流程如图1。
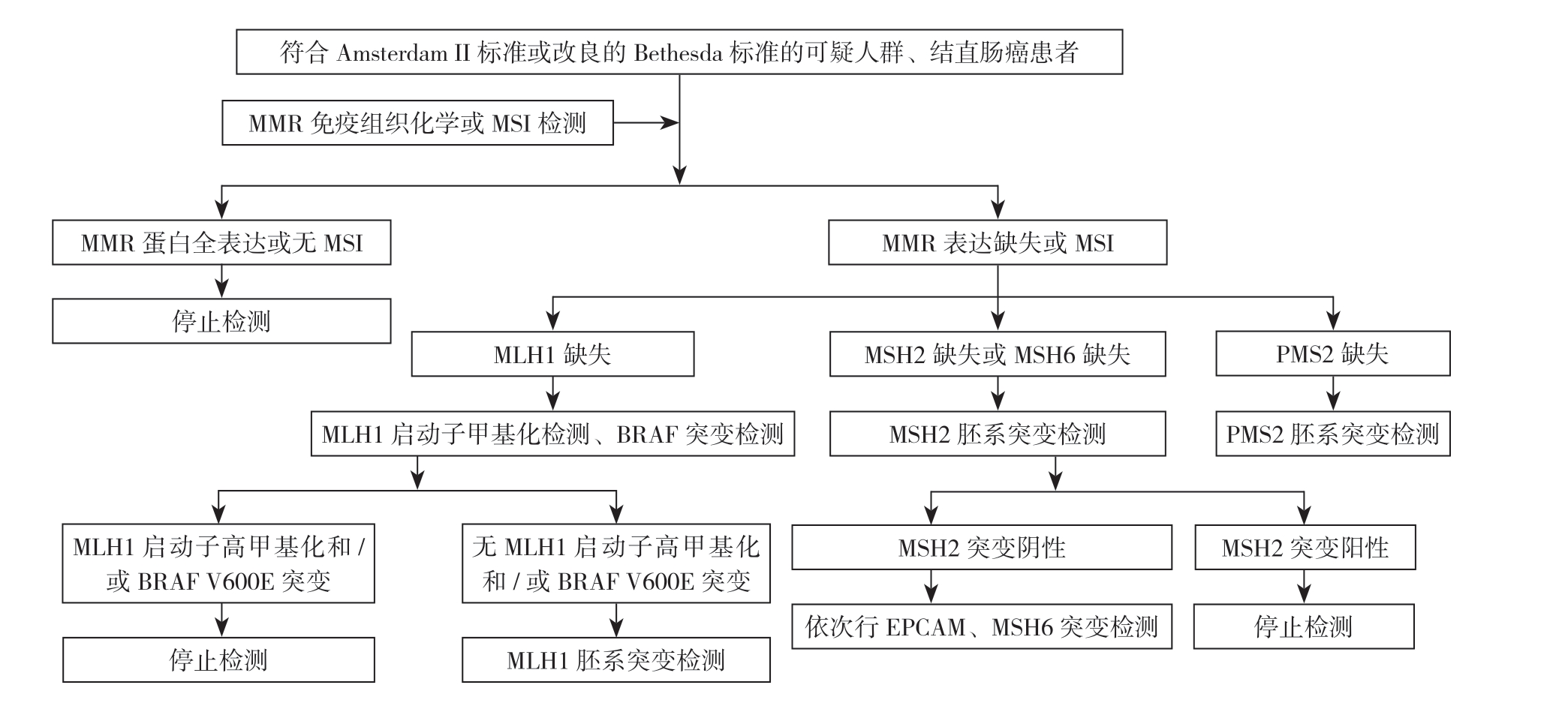
图1 LS筛查流程
Figure1 Screening process for LS
3.2 免疫组织化学
检测4种蛋白缺失情况,若结果显示MLH1蛋白表达缺失则需要明确是否存在MLH1启动子高甲基化和/或BRAF V600E突变,这两者均与散发性肿瘤一致[17]。另外推荐对MSH2/MSH6免疫组化阴性的患者先行MSH2基因突变检测,检测阴性者再依次行EPCAM、MSH6突变检测[22]。
3.3 MSI检测
用5对引物进行聚合酶链反应,完成2个单核苷酸重复序列和3个双核苷酸重复序列(BAT25和BAT26;D2S123、D5S346和D17S250)的PCR检测。这5个微卫星序列中如有2个或以上位点突变则称为MSI-H,如果只有1个位点突变称为低频MSI(microsatellite instability-low,MSI-L),如果这5个微卫星序列均无突变称为微卫星稳定。研究表明PCR法MSI检测和免疫组织化学检测一致性较高[24],大于90%的LS肿瘤(LS相关的胃癌为100%[2])是MSI-H和/或IHC缺乏至少一种MMR蛋白的表达[17]。
3.4 BRAF 基因突变检测
BRAFV600E突变可导致MMR蛋白表达缺失,而LS相关性肿瘤中该突变罕见。如果BRAF突变,则不进行MLH1突变检测。
3.5 甲基化检测
目前应用较多的是二代甲基化特异性PCR法及特异性甲基化多重连接依赖的探针扩增,可检出非遗传性的后天甲基化位点,两种技术均使60%以上的患者免于MLH1突变检测[22]。有报道[25]MLH1启动子区域甲基化同时存在突变的情况,所以存在启动子甲基化并不能完全除外LS。
3.6 诊断性检测
对先证者缺失的MMR基因行胚系突变检测、DNA测序或多重连接探针扩增[22]。研究表明,在上消化道肿瘤中二代测序技术可作为检测微卫星不稳定性和LS的一线技术手段[26],不仅有助于诊断LS,还可提供可能治疗的靶点。
3.7 RNA遗传学检测
近年,Karam等[27]提出进行RNA遗传学检测(RNA genetic testing,RGT)作为DNA遗传学检测(DNA genetic testing,DGT)的补充,改善了遗传性癌症易感基因检测的结果,明确了88%的未确诊病例,数据表明平均43例患者中约有1例可能受益于RGT。明确不明意义的突变(variants of uncertain significance,VUS)改善了对患者及其家属的管理,减轻医疗保健系统的压力,从而使癌症筛查和治疗的资源得到更适当的分配。
4 监 测
尽管尚无明确的证据[17],如定期监测有助于降低发病风险来支持对胃癌进行筛查。有部分欧洲专家表示,鉴于目前没有研究评估胃癌监测的有效性,在胃癌风险相对较低的国家,不建议任何MMR突变对胃癌进行常规上消化道内镜检查监测[15,28]。但LS患者胃癌发病风险较高,大部分专家尤其是亚洲专家,认为监测LS相关的胃癌非常必要,并且推荐LS患者胃癌监测策略[4,29]。
4.1 根除HP
HP感染是胃癌最常见的病因,全球共有80%的胃癌病例与幽门螺旋杆菌感染有关[30]。HP感染LS患者更容易发生胃癌[2],这可能与环境因素有关,所以有必要对LS相关胃癌进行HP监测。欧洲专家也推荐对LS高危人群进行HP检测并治疗HP感染患者[15,31]。Adar等[20]特别推荐将HP感染的筛查纳入年轻LS个体的监测方案中[20]。最近的ASCO/ESMO支持所有LS个体检测和根除HP。特别是在世界上胃癌发病率较高的地区,LS家族发生胃癌的风险也较高[5],我国胃癌发病率较高[32],根除HP将有利于减少胃癌的风险[33]。
4.2 内镜检查
在日本,LS患者70岁时胃癌的发病风险约为40%,LS患者胃癌的标准化发病率与普通人口的标准化发病率之比约为20[4];在韩国,LS患者及其一级亲属胃癌的保险统计风险是一般人群2.1倍[29]。LS发生胃癌的相对和绝对风险相当大,且大多数LS患者为肠道型,常规上消化道内镜检查可以早期发现癌前病变并对其进行针对性治疗,所以建议高风险人群进行内镜监测[2,34]。
有学者[14]提出HP感染、慢性胃炎和肠化生作为增加癌症风险的标志,无论家族史如何,都应考虑上消化道内镜检查。在日本的LS患者一级亲属中最早发生胃癌的年龄为35岁,所以建议LS个体在30~35岁之间开始进行上消化道内镜检查[4]。梅奥诊所的专家[35]也推荐高危人群从30~35岁开始,每3~5年进行1次食管胃十二指肠镜检查。但在欧洲LS相关胃癌的累积风险不高[15],且考虑到平均发病年龄较大,所以专家建议45岁开始进行消化道内镜筛查[5]。
在我国,目前参照中国抗癌协会大肠癌专业委员会遗传学组推荐的LS相关胃癌管理策略[21],建议从30~35岁开始行十二指肠胃镜检查,检查频率为1~2年1次。尤其是高危的LS个体或家庭,开始筛查年龄应不超过30岁[36]。对于PMS2突变的LS,一项多中心的队列研究表明,杂合子的PMS2突变携带者患结肠直肠癌和子宫内膜癌的风险增加较小,且其他LS相关肿瘤的风险没有增加,明确提出PMS2突变的LS不用特别筛查胃癌[37]。
2002年芬兰的一项研究,对73例MLH1突变的LS患者和32名无突变的家庭成员进行监测比较胃镜检查的价值。发现LS患者与对照组间的潜在癌前病变如HP感染、萎缩、肠上皮化生等无统计学意义。他们认为上消化道内窥镜检查对MLH1突变携带者可能没有益处[38],但这项研究较早且纳入样本较少,仍然需要一个大型随机的前瞻性研究来明确。目前仍认为MLH1突变个体属于高危人群[1,5],需要进行内镜监测。
5 治 疗
5.1 手术治疗
目前,手术切除是胃癌的主要治疗方式,也是胃癌治愈的唯一手段,可切除胃癌[39]的治疗以临床分期评估为基础。胃癌早期患者的治疗主要选择内镜治疗。对于不适合内镜治疗的患者,可以进行开腹手术及腹腔镜手术。胃癌根治性切除术应当完整切除原发灶,彻底清扫区域淋巴结,同时遵循无瘤原则。
遗传性胃癌手术治疗的报道[40]指出,发生胃癌的LS个体,由于病灶最初可能是多灶性的,且再患异时性胃癌风险增加,再加上近年残胃癌的发生率上升[41-42],所以,应行扩大的肿瘤根治术,如全胃切除术、胃次全切除术,对于病灶明确满足胃部分切除的患者行全胃切除术,对需要内镜下再次治疗的异时性胃癌患者行胃切除术。
5.2 化疗
胃癌的围手术期治疗方式在东西方地区存在显著差异,可能由人种差异引起[43],在亚洲新辅助化疗的价值尚未得到充分证实[44-45]。CSCO对所有胃癌的治疗指南指出[39],术后病理证实为转移淋巴结的患者,应进行辅助化疗。局部进展期胃癌的标准治疗方案是D2胃切除术加术后化疗。然而CLASSIC研究的后续分析显示,D2式胃切除术后的II/Ш期MSI-H胃癌患者XELOX(卡培他滨加奥沙利铂)辅助化疗与单纯D2胃切除术治疗相比,患者无法从辅助化疗中获益[46],MAGIC研究结果也显示,MSI-H或MMR缺失患者在接受围手术期化疗后总生存可能更差[47],所以不推荐可手术的LS相关GC患者进行化疗。对于可切除肿瘤但因个体因素不适合手术的患者,放化疗是一种选择[39]。
5.3 免疫治疗
在胃肠道肿瘤中,MMR状态是可以预测免疫治疗效果的生物标记物[48-49]。MMR缺失的肿瘤可能产生大量与突变相关的新抗原,这些新抗原可以被免疫系统识别[50],所以免疫治疗在MMR肿瘤中反应率高。在PD-1对晚期12种MMR缺陷的不同实体瘤疗效的研究中[51],MMR缺失的肿瘤对PD-1治疗的影像学客观缓解率高达53%,影像学完全缓解率达21%。关于围手术期的辅助治疗是否可以考虑免疫治疗,目前MSI局限性胃癌患者围手术期免疫治疗代替化疗:GERCOR NEONIPIGA II期研究,开始招募患者,等待其研究结果。值得注意的是,选择时应考虑到免疫治疗相关心脏等不良事件的严重性。
6 预 防
每天服用常规剂量阿司匹林(≥75 mg)降低常见的各种肿瘤引起的死亡风险,但是降低胃癌的风险需在5年以后才能体现出来[21]。LS相关胃癌是LS相关消化道肿瘤,参考LS相关结直肠癌的专家共识[21],不推荐已患胃癌的LS患者使用阿司匹林,而突变携带者可能会从中获益,可根据危险因素考虑使用,使用剂量和时长目前尚未明确。
目前尚未见文献报道LS行预防性胃切除术,LS相关的胃癌发病率不高,生存率尚可,且残胃是胃癌的一个危险因素,不推荐在未发生胃癌的个体中进行预防性切除术[40]。
7 预后
2018年的研究数据显示LS相关所有肿瘤中胃癌生存时间居中[1],胃癌总体5年生存率为61%,而1997年的数据显示[14]总体5年生存率为15%,根治性手术患者的5年生存率为48%,可见近年LS相关胃癌的得到了有效的治疗,5年生存率有所提高。最近的CLASSIC研究的后续分析显示[46]无论PD-L1表达如何,MSI-H胃癌预后良好,无论是否接受辅助化疗,估计II/III期MSI-H胃癌5年无病生存率均超过80%,明显高于微卫星稳定的患者。
8 总 结
由于L S相关胃癌在亚洲人群的发病风险较高,需要提升对LS相关胃癌的认识和管理,在临床中对符合Amesterdam II和改良的Bethesda标准的人群及所有结直肠癌患者进行MMR蛋白和基因相关检查。同时,还需要加强高危人群的监测,推荐MLH1和MSH2等较高危人群突变携带者从30~35岁开始,对于特别高危的家庭最迟不超过30岁进行筛查,推荐的监测方式为每1~2年1次胃镜检查。在治疗方面,免疫治疗具有较好的潜力,但仍尚缺乏多中心的研究证据。总体而言,LS相关胃癌患者预后好,总体5年生存率超过60%。根据我国LS相关胃癌的特点,在未来需要进一步关注慢性萎缩性胃炎,尤其是自身免疫性胃炎的评估,针对LS相关胃癌发病情况、监测及预后方面加强研究,以获得更多符合我国人群特点的高质量证据。
[1]Møller P,Seppälä TT,Bernstein I,et al.Cancer risk and survival in path_MMR carriers by gene and gender up to 75 years of age:a report from the Prospective Lynch Syndrome Database[J].Gut,2018,67(7):1306-1316.doi:10.1136/gutjnl-2017-314057.
[2]Fornasarig M,Magris R,De Re V,et al.Molecular and Pathological Features of Gastric Cancer in Lynch Syndrome and Familial Adenomatous Polyposis[J].Int J Mol Sci,2018,19(6):1682.doi:10.3390/ijms19061682.
[3]Boland CR,Yurgelun MB.Historical Perspective on Familial Gastric Cancer[J].Cell Mol Gastroenterol Hepatol,2017,3(2):192-200.doi:10.1016/j.jcmgh.2016.12.003.
[4]Ikenoue T,Arai M,Ishioka C,et al.Importance of gastric cancer for the diagnosis and surveillance of Japanese Lynch syndrome patients[J].J Hum Genet,2019,64(12):1187-1194.doi:10.1038/s10038-019-0674-5.
[5]Capelle LG,Van Grieken NC,Lingsma HF,et al.Risk and epidemiological time trends of gastric cancer in Lynch syndrome carriers in the Netherlands[J].Gastroenterology,2010,138(2):487-492.doi:10.1053/j.gastro.2009.10.051.
[6]Kim J,Braun D,Ukaegbu C,et al.Clinical Factors Associated With Gastric Cancer in Individuals With Lynch Syndrome[J].Clin Gastroenterol Hepatol,2020,18(4):830-837.doi:10.1016/j.cgh.2019.07.012.
[7]National Cancer Institute.SEER Cancer Stat Facts:Stomach Cancer[EB/OL].[accessed on 21 March 2020].Available online.http://seer.cancer.gov/statfacts/html/stomach.html.
[8]Hampel H,Bennett RL,Buchanan A,et al.A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors:referral indications for cancer predisposition assessment[J].Genet Med,2015,17(1):70-87.doi:10.1038/gim.2014.147.
[9]Park JG,Park YJ,Wijnen JT,et al.Gene-environment interaction in hereditary nonpolyposis colorectal cancer with implications for diagnosis and genetic testing[J].Int J Cancer,1999,82(4):516-519 doi:10.1002/(sici)1097-0215(19990812)82:4<516::aidijc8>3.0.co;2-u.
[10]Zhang YZ,Sheng JQ,Li SR,et al.Clinical phenotype and prevalence of hereditary nonpolyposis colorectal cancer syndrome in Chinese population[J].World J Gastroenterol,2005,11(10):1481-1488.doi:10.3748/wjg.v11.i10.1481.
[11]孙玉琳,赵晓航.结直肠癌的分子分型及精准医学时代展望[J].中华结直肠疾病电子杂志,2018,7(5):412-419.doi:10.3877/cma.j.issn.2095-3224.2018.05.003.
Sun YL,Zhao XH.The molecular subtypes and their clinical relevance of colorectal cancer[J].Chinese Journal of Colorectal Diseases,2018,7(5):412-419.doi:10.3877/cma.j.issn.2095-3224.2018.05.003.
[12]唐伟森,廖明媚,屈展,等.结直肠癌肿瘤组织PMS2蛋白表达状态与其临床病理特征的关系[J].中国普通外科杂志,2019,28(10):1297-1301.doi:10.7659/j.issn.1005-6947.2019.10.019.
Tang WS,Liao MM,Qu Z,et al.Expression status of PMS2 protein in colorectal cancer tumor tissue and the relationship with its clinicopathological characteristics[J].Chinese Journal of General Surgery,2019,28(10):1297-1301.doi:10.7659/j.issn.1005-6947.2019.10.019.
[13]Giardiello FM,Allen JI,Axilbund JE,et al.Guidelines on genetic evaluation and management of Lynch syndrome:a consensus statement by the US Multi-society Task Force on colorectal cancer[J].Am J Gastroenterol,2014,109(8):1159-1179.doi:10.1038/ajg.2014.186.
[14]Aarnio M,Salovaara R,Aaltonen LA,et al.Features of gastric cancer in hereditary non-polyposis colorectal cancer syndrome[J].Int J Cancer,1997,74(5):551-555.doi:10.1002/(sici)1097-0215(19971021)74:5<551::aid-ijc13>3.0.co;2-9.
[15]Vasen HF,Blanco I,Aktan-Collan K,et al.Revised guidelines for the clinical management of Lynch syndrome (HNPCC):recommendations by a group of European experts[J].Gut,2013,62(6):812-823.doi:10.1136/gutjnl-2012-304356.
[16]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.doi:10.3322/caac.21492.
[17]Provenzale D,Gupta S,Ahnen DJ,et al.Genetic/Familial High-Risk Assessment:Colorectal Version 1.2016,NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr Canc Netw,2016,14(8):1010-1030.doi:10.6004/jnccn.2016.0108.
[18]Mankaney G,Macaron C,Burke CA.Refining Risk Factors for Gastric Cancer in Patients With Lynch Syndrome to Optimize Surveillance Esophagogastroduodenoscopy[J].Clin Gastroenterol Hepatol,2020,18(4):780-782.doi:10.1016/j.cgh.2019.10.003.
[19]Cho H,Yamada M,Sekine S,et al.Gastric cancer is highly prevalent in Lynch syndrome patients with atrophic gastritis[J].Gastric Cancer,2020,doi:10.1007/s10120-020-01113-0.[Epub ahead of print]
[20]Adar T,Friedman M,Rodgers LH,et al.Gastric cancer in Lynch syndrome is associated with underlying immune gastritis[J].J Med Genet,2019,56(12):844-845.doi:10.1136/jmedgenet-2018-105757.
[21]中国抗癌协会大肠癌专业委员会遗传学组.遗传性结直肠癌临床诊治和家系管理中国专家共识[J].实用肿瘤杂志,2018,33(1):3-16.
Genetics Group of the Committee of Colorectal Cancer,China Anticancer Association.The Chinese expert consensus on clinical diagnosis,treatment and pedigree management of hereditary colorectal cancer[J].Journal of Practical Oncology,2018,33(1):3-16.
[22]王雯邈,董林,李文斌,等.Lynch综合征相关结直肠癌的遗传基因及分子病理筛查策略[J].中华结直肠疾病电子杂志,2018,7(2):176-180.doi:10.3877/cma.j.issn.2095-3224.2018.02.015.
Wang WM,Dong L,Li WB,et al.Screening strategy for Lynch syndrome associated colorectal cancer through genetic and molecular pathology technique[J].Chinese Journal of Colorectal Diseases,2018,7(2):176-180.doi:10.3877/cma.j.issn.2095-3224.2018.02.015.
[23]高显华,张卫,白辰光.免疫组化筛查林奇综合征的缺陷和应对策略[J].中华结直肠疾病电子杂志,2019,8(5):439-446.doi:10.3877/cma.j.issn.2095-3224.2019.05.002.
Gao XH,Zhang W,Bai CG.Defects of screening Lynch syndrome by immunohistochemistry and corresponding solution[J].Chinese Journal of Colorectal Diseases,2019,8(5):439-446.doi:10.3877/cma.j.issn.2095-3224.2019.05.002.
[24]王畅.微卫星状态对结肠癌术后辅助化疗决策的影响[J].中华结直肠疾病电子杂志,2018,7(3):207-213.doi:10.3877/cma.j.issn.2095-3224.2018.03.002.
Wang C.The impact of microsatellite status on decision-making of adjuvant chemotherapy in colon cancer[J].Chinese Journal of Colorectal Diseases,2018,7(3):207-213.doi:10.3877/cma.j.issn.2095-3224.2018.03.002.
[25]Raymond VM,Morris AM,Hafez KS,et al.MLH1 promotor hypermethylation does not rule out a diagnosis of Lynch syndrome:a case report[J].Fam Cancer,2015,14(1):77-80.doi:10.1007/s10689-014-9753-0.
[26]Christakis AG,Papke DJ,Nowak JA,et al.Targeted Cancer Next-Generation Sequencing as a Primary Screening Tool for Microsatellite Instability and Lynch Syndrome in Upper Gastrointestinal Tract Cancers[J].Cancer Epidemiol Biomarkers Prev,2019,28(7):1246-1251.doi:10.1158/1055-9965.
[27]Karam R,Conner B,LaDuca H,et al.Assessment of Diagnostic Outcomes of RNA Genetic Testing for Hereditary Cancer[J].JAMA Netw Open,2019,2(10):e1913900.doi:10.1001/jamanetworkopen.2019.13900.
[28]Soer EC,Leicher LW,Langers AM,et al.Equivalent Helicobacter pylori infection rates in Lynch syndrome mutation carriers with and without a first-degree relative with gastric cancer[J].Int J Colorectal Dis,2016,31(3):693-697.doi:10.1007/s00384-016-2524-7.
[29]Park YJ,Shin KH,Park JG.Risk of Gastric Cancer in Hereditary Nonpolyposis Colorectal Cancer in Korea[J].Clin Cancer Res,2000,6(8):2994-2998.
[30]Rasch S,Algül H.A clinical perspective on the role of chronic inflammation in gastrointestinal cancer[J].Clin Exp Gastroenterol,2014,7:261-272.doi:10.2147/CEG.S43457.
[31]Monahan KJ,Bradshaw N,Dolwani S,et al.Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG)[J].Gut,2020,69(3):411-444.doi:10.1136/gutjnl-2019-319915.
[32]Wang R,Bai D,Xiang W,et al.Helicobacter pylori prevalence in the Southwest of China:A protocol for systematic review[J].Medicine (Baltimore),2020,99(11):e19369.doi:10.1097/MD.0000000000019369.
[33]Xie Y,Song C,Cheng H,et al.Long-term follow-up of Helicobacter pylori reinfection and its risk factors after initial eradication:a large-scale multicentre,prospective open cohort,observational study[J].Emerg Microbes Infect,2020,9(1):548-557.doi:10.1080/22221751.2020.1737579.
[34]Kumar S,Dudzik CM,Reed M,et al.Upper Endoscopic Surveillance in Lynch Syndrome Detects Gastric and Duodenal Adenocarcinomas[J].Cancer Prev Res (Phila),2020,doi:10.1158/1940-6207.CAPR-20-0269.[Epub ahead of print]
[35]Samadder NJ,Baffy N,Giridhar KV,et al.Hereditary Cancer Syndromes-A Primer on Diagnosis and Management,Part 2:Gastrointestinal Cancer Syndromes[J].Mayo Clin Proc,2019,94(6):1099-1116.doi:10.1016/j.mayocp.2019.01.042.
[36]Ladigan-Badura S,Vangala DB,Engel C,et al.Value of upper GI endoscopy for gastric cancer surveillance in patients with Lynch syndrome[J].Int J Cancer,2020,doi:10.1002/ijc.33294.[Epub ahead of print]
[37]Ten Broeke SW,van der Klift HM,Tops CMJ,et al.Cancer Risks for PMS2-Associated Lynch Syndrome[J].J Clin Oncol,2018,36(29):2961-2968.doi:10.1200/JCO.2018.78.4777.
[38]Renkonen-Sinisalo L,Sipponen P,Aarnio M,et al.No support for endoscopic surveillance for gastric cancer in hereditary nonpolyposis colorectal cancer[J].Scand J Gastroenterol,2002,37(5):574-577.doi:10.1080/00365520252903134.
[39]Wang FH,Shen L,Li J,et al.The Chinese Society of Clinical Oncology (CSCO):clinical guidelines for the diagnosis and treatment of gastric cancer[J].Cancer Commun (Lond),2019,39(1):10.doi:10.1186/s40880-019-0349-9.
[40]Vogelsang HE.Prophylactic Surgery and Extended Oncologic Radicality in Gastric and Colorectal Hereditary Cancer Syndromes[J].Visc Med,2019,35(4):231-239.doi:10.1159/000501919.
[41]马凯,刘宏斌,孙建兵,等.达芬奇机器人手术系统在残胃癌治疗中的应用:附8例报告[J].中国普通外科杂志,2019,28(4):417-422.doi:10.7659/j.issn.1005-6947.2019.04.006.
Ma K,Liu HB,Sun JB,et al.Application of DaVinci surgical system in treatment of gastric stump cancer:a reportof 8 cases[J].Chinese Journal of General Surgery,2019,28(4):417-422.doi:10.7659/j.issn.1005-6947.2019.04.006.
[42]张海峰,王俊青,王东杰,等.残胃癌的诊治研究进展[J].中国普通外科杂志,2020,29(2):248-254.doi:10.7659/j.issn.1005-6947.2020.02.017.
Zhang HF,Wang JQ,Wang DJ,et al.Research progress in diagnosis and treatment of gastric stump cancer[J].Chinese Journal of General Surgery,2020,29(2):248-254.doi:10.7659/j.issn.1005-6947.2020.02.017.
[43]Quach DT,Hiyama T,Gotoda T.Identifying high-risk individuals for gastric cancer surveillance from western and eastern perspectives:Lessons to learn and possibility to develop an integrated approach for daily practice[J].World J Gastroenterol,2019,25(27):3546-3562.doi:10.3748/wjg.v25.i27.3546.
[44]倪璐,邱萌.胃癌围手术期化疗的现状和研究进展[J].实用肿瘤杂志,2019,34(5):390-396.doi:10.13267/j.cnki.syzlzz.2019.05.002.
Ni L,Qiu M.Current status and research progress of perioperative chemotherapy of gastric cancer[J].Journal of Practical Oncology,2019,34(5):390-396.doi:10.13267/j.cnki.syzlzz.2019.05.002.
[45]刘琪,袁波,杜应莲.新辅助化疗联合腹腔镜手术治疗进展期胃癌的疗效及对患者预后的影响[J].中国普通外科杂志,2019,28(10):1302-1308.doi:10.7659/j.issn.1005-6947.2019.10.020.
Liu Q,Yuan B,Du YL.Therapeutic efficacy of neoadjuvant chemotherapy combined with laparoscopic surgical treatment of advanced stage of gastric cancer and the effect on patient prognosis [J].Chinese Journal of General Surgery,2019,28(10):1302-1308.doi:10.7659/j.issn.1005-6947.2019.10.020.
[46]Choi YY,Kim H,Shin SJ,et al.Microsatellite Instability and Programmed Cell Death-Ligand 1 Expression in Stage II/III Gastric Cancer:Post Hoc Analysis of the CLASSIC Randomized Controlled study[J].Ann Surg,2019,270(2):309-316.doi:10.1097/SLA.0000000000002803.
[47]Smyth EC,Wotherspoon A,Peckitt C,et al.Mismatch Repair Deficiency,Microsatellite Instability,and Survival:An Exploratory Analysis of the Medical Research Council Adjuvant Gastric Infusional Chemotherapy (MAGIC) Trial[J].JAMA Oncol,2017,3(9):1197-1203.doi:10.1001/jamaoncol.2016.6762.
[48]Park H,Chen B,Ciorba MA.Progress in PD-1-based Immunotherapy:New Mechanistic Insight May Provide Expanded Hope for Application to Colon and Gastrointestinal Cancers[J].Gastroenterology,2017,153(4):1162-1163.doi:10.1053/j.gastro.2017.08.050.
[49]冯道夫,章志翔.程序性细胞死亡蛋白配体1在结直肠癌免疫治疗中的研究进展[J].中国普通外科杂志,2020,29(4):473-479.doi:10.7659/j.issn.1005-6947.2020.04.011.
Feng DF,Zhang ZX.Research progress of programmed death ligand 1 in immunotherapy of colorectal carcinoma[J].Chinese Journal of General Surgery,2020,29(4):473-479.doi:10.7659/j.issn.1005-6947.2020.04.011.
[50]Zhao P,Li L,Jiang X,et al.Mismatch repair deficiency/microsatellite instability-high as a predictor for anti-PD-1/PDL1 immunotherapy efficacy[J].J Hematol Oncol,2019,12(1):54.doi:10.1186/s13045-019-0738-1.
[51]Le DT,Durham JN,Smith KN,et al.Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade[J].Science,2017,357(6349):409-413.doi:10.1126/science.aan6733.
