近年来,结直肠癌(colorectalcancer,CRC)的发病和病死率均出现逐年增长的趋势,无论在男性或女性中,CRC的新发病例数均位列前三[1]。CRC的发生和发展因素较为复杂,已知的相关因素有环境(如吸烟和高脂饮食等)、遗传(如结直肠息肉)、免疫和内分泌等[2],但上述各种因素仍未能明确CRC的病因和发病机制。人类肠道微生物群是一种极为复杂的微生物生态系统,定植在结直肠中的肠道菌群是维持肠道微生态系统稳定的重要组成成分,其数量超过100万亿,在人体内直接或间接参与了免疫调节、物质代谢和消化吸收等过程,在保护肠黏膜、维持肠道稳态和机体正常功能以及抵抗疾病等方面具有重要作用[3]。肠道菌群组分高度依赖于宿主生活和饮食习惯,也与宿主基因型相关,因此个体间差异极大,所以对维持肠道稳态、物质代谢或致癌作用的机制也不尽相同。研究[4]发现肠道菌群失调与CRC的发生发展密切相关,肠道菌群随着宿主的生活和饮食习惯进行动态调节,当其结构和功能受到破坏时,可以通过破坏肠黏膜上皮细胞、参与宿主机体代谢和产生致癌物质等方式增加异常隐窝病灶,最终诱发结直肠息肉和癌变。而结直肠手术又可损害肠屏障功能,导致术后肠道细菌易位[5]。除此之外,益生菌可通过降低肠道内潜在致病菌的丰度,纠正肠道菌群结构和功能的紊乱以降低CRC的发病风险[6]。全面了解肠道菌群与CRC的关系,可为CRC的生物预防与治疗提供理论依据。现就肠道菌群与CRC关系的研究进展作一综述。
1 肠道菌群概述
人体肠道微环境中生存着病毒、细菌、真菌等种类繁多且数量庞大的微生物群,其中约有10万亿个细菌定植在肠道,其所占比例最高,共同构成肠道菌群,主要包括拟杆菌门、厚壁菌门、放线菌门、梭杆菌门、疣微菌门和变形菌门等[7]。这些细菌大致可分为3类,即共生菌、中间菌和致病菌。根据肠道菌群的数量,又可将其分为优势和次要菌群,优势菌群(≥107~108 cfu/g)包括拟杆菌属、双歧杆菌属和梭菌属等;次要菌群(<107 cfu/g),包括链球菌和大肠杆菌等[8]。肠道内菌群以一定比例组合,既相互制约又相互依存,在质与量上保持动态平衡,共同维持人体微生态系统的稳定。当机会致病菌异常富集或致病菌异常入侵时可引起菌群失调。研究发现,肠道菌群失调与人体自身免疫性疾病[9]、代谢性疾病[10]甚至认知障碍性疾病[11]等有关。
肠道菌群对宿主的影响主要为以下几点:⑴ 增强肠黏膜屏障功能:共生菌可促进肠黏膜相关淋巴组织发育成熟、产生免疫应答,从而抵抗或抑杀致病菌[12];⑵ 参与物质代谢:参与蛋白质和膳食纤维等物质代谢,为宿主提供必需氨基酸和能量,此外,还可以提供必须的酶参与维生素的合成[13];⑶ 菌群“脑-肠”轴理论:肠道菌群可通过各种信号通路(如神经信号通路、5-羟色胺和色氨酸代谢通路等)或代谢产物影响胃肠道或大脑功能[14];⑷ 抗肿瘤作用:特异性肠道共生菌及其代谢产物可通过调控调节性T细胞的数量和功能起到抑制肿瘤的效果[15],同时还可提高抗肿瘤药物的疗效。
2 肠道菌群与CRC发生发展的关系及机制
已有研究[16]表明幽门螺杆菌可减弱胃黏膜的保护作用,进而使胃黏膜上皮细胞发生恶变,然而结直肠癌与肠道微生物的关系至今尚未明确。Thomas等[17]应用宏基因组学分析健康人群和CRC患者肠道菌群后发现,CRC患者样本中微生物丰度明显升高。研究[18]发现富集的拟杆菌属、双歧杆菌和大肠埃希菌等会增加CRC发生的风险,而双歧杆菌、乳酸杆菌和产丁酸盐的菌种却有利于肠黏膜保护、抗炎和抑癌等。常见肠道菌群在CRC发生中的作用见表1。
表1 肠道微生物的功能和对CRC发生发展的影响
Table1 Functions of intestinal microorganisms and their influences on the occurrence and development of CRC
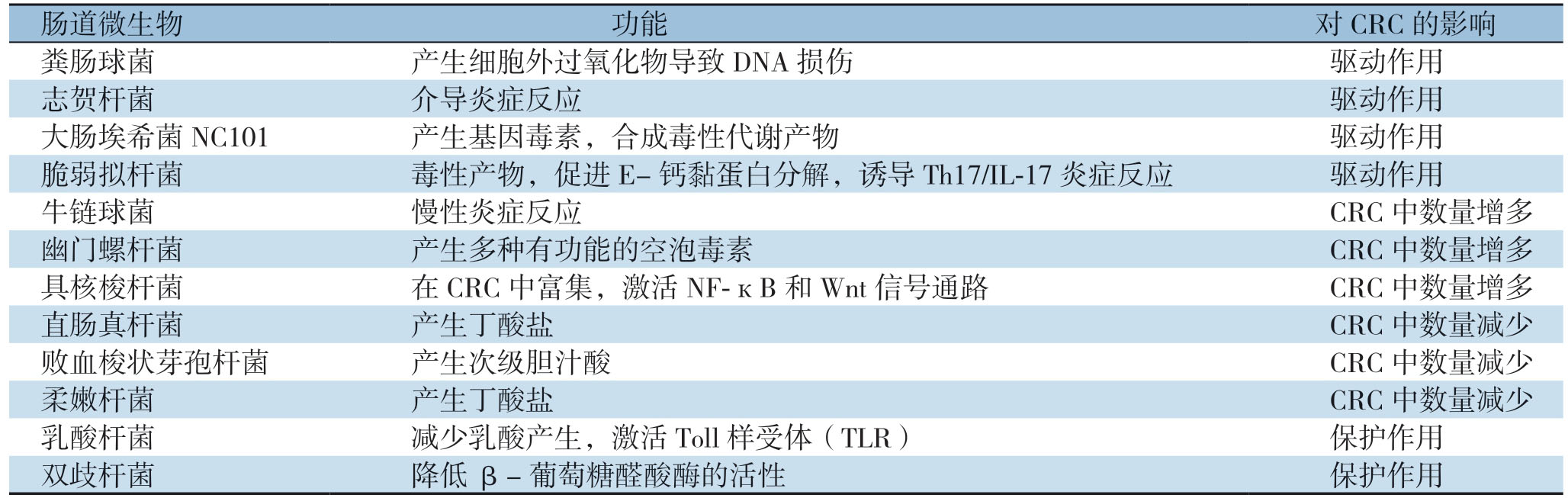
肠道微生物 功能 对CRC的影响粪肠球菌 产生细胞外过氧化物导致DNA 损伤 驱动作用志贺杆菌 介导炎症反应 驱动作用大肠埃希菌NC101 产生基因毒素,合成毒性代谢产物 驱动作用脆弱拟杆菌 毒性产物,促进E-钙黏蛋白分解,诱导Th17/IL-17 炎症反应 驱动作用牛链球菌 慢性炎症反应 CRC 中数量增多幽门螺杆菌 产生多种有功能的空泡毒素 CRC 中数量增多具核梭杆菌 在CRC 中富集,激活NF-кB和Wnt 信号通路 CRC 中数量增多直肠真杆菌 产生丁酸盐 CRC 中数量减少败血梭状芽孢杆菌 产生次级胆汁酸 CRC 中数量减少柔嫩杆菌 产生丁酸盐 CRC 中数量减少乳酸杆菌 减少乳酸产生,激活Toll 样受体(TLR)保护作用双歧杆菌 降低β-葡萄糖醛酸酶的活性 保护作用
2.1 肠道菌群通过免疫调节与炎症反应影响CRC的发生发展
肠道菌群失调可通过免疫应答参与肿瘤的形成,如肿瘤内的炎症环境通过激活SAT3HE和NF-кB信号传导并上调促增殖和细胞周期驱动基因等方式促进癌症发展[19]。Wampach等[20]研究发现顺产婴儿可通过母体纵向获得拟杆菌属和双歧杆菌属等有益菌群,并且这些菌群与肠道脂多糖(LPS)的合成密切相关,LPS可刺激机体免疫系统引起TNF-α和IL-18等炎性因子升高;而剖腹产婴儿体内却缺乏这一类菌群,从而影响免疫功能,表明肠道菌群在机体免疫系统形成阶段至关重要。脆弱拟杆菌(bacteroides fragilis)和携带pks基因组的大肠杆菌可诱导细胞DNA损伤,触发Th17/IL-17免疫应答,促进细胞癌变[21]。Mori等[22]通过比较健康人群与CRC患者的肠道菌群丰度发现,CRC患者肠道中致病性大肠杆菌、脆弱拟杆菌和具核梭杆菌(fusobacterium nucleatum,Fn)等相对丰度明显升高,而有益于维持肠道健康的产丁酸盐细菌相对丰度却明显降低。产肠毒素脆弱类杆菌和Fn等致病菌侵入结肠上皮细胞后,可减弱淋巴细胞和NK细胞的杀伤活性,从而增强癌细胞的免疫逃逸能力。
肠道菌群还可通过引起慢性炎症进而引发组织损伤并产生氧化应激,使上皮细胞DNA损伤逐渐累积,导致肠上皮细胞癌变。肠道菌群失调介导的慢性炎症主要与免疫细胞及其产生的细胞因子(如IL-6、IL-17、IL-23和TNF-α等)有关,在促进血管形成、抑制肿瘤免疫反应的同时参与肿瘤增殖。此外,肠道菌群还可激活TLR促进IL-1β和TNF-α等物质表达并产生COX-2,进而介导前列腺素E2合成、促进炎症反应和肿瘤形成。Uronis等[23]发现溃疡性结肠炎的小鼠在肠微生物失调后可出现向结肠癌的演变,而无菌小鼠则少有此演变过程,其原因可能是肠道菌群失调后炎症反应通过髓样分化因子88/Toll样受体信号通路得到促进,而炎症反应与CRC的发生发展密切相关。Sun等[24]研究发现,与正常肠上皮组织相比,结直肠癌患者肠道中Fn丰度显著升高,Fn的毒性因子可通过黏附素Fad-A与E-钙黏蛋白(E-cadherin)结合,激活Wnt/β-连环蛋白信号通路(Wnt/β-catenin),增加炎性细胞因子(如IL-6、IL-8、TGF-β和TNF-α等),诱导局部炎症,刺激结直肠癌细胞增殖[25]。此外,Bullman等[26]发现结直肠癌组织中Fn等致病菌群可随癌细胞同时转移,Fn可与其他种属细菌共同作用促进CRC的肝转移。Mima等[27]前瞻性队列研究发现结直肠癌组织中Fn-DNA的数量与肿瘤分期、转移情况和患者术后生存期等呈正相关。此外,Tsoi等[28] 发现在结肠癌和腺瘤组织中,厌氧链球菌与肠上皮细胞TLR2和TLR4相互作用,可提高活性氧(ROS)水平并促进胆固醇合成和细胞增殖,从而导致细胞癌变。Wong等[29]使用健康人和CRC患者的粪菌混合物分别喂养低菌和无菌小鼠,结果显示CRC粪菌移植后可激活肠黏膜免疫并诱发炎症反应,进而促进上皮细胞增殖和癌变。而Malik等[30]研究发现IL-33促进产生的IgA有利于维持肠道菌群稳态,从而间接限制CRC的发生。
2.2 肠道菌群通过基因毒性反应影响CRC的发生发展
有研究[31]认为结直肠的发生发展主要沿腺瘤-CRC轴进行,即正常肠黏膜上皮异型增生、腺瘤、CRC。除少数生殖细胞突变可引起CRC外,多数CRC主要由2种分子途径致病:⑴ APC、KRAS、Wnt、MYC、p53和MAPK沿腺瘤-癌序列发生突变形成CIS通路;⑵ MMR基因突变形成MSI通路。通过突变累积和表观遗传变化、肿瘤抑制基因丧失和癌基因功能增强最终导致细胞癌变。结合此发展进程与肠道菌群的变化关系有两种假说:⑴ 2011年Sears等[32]提出“alpha-bug”假说,认为脆弱拟杆菌(bacteroides fragilis,ETBF)等主要致病菌可导致肠道菌群重构并引起相关的基因毒性反应和炎症反应,从而导致肠上皮细胞增生或异型增生,最终导致CRC发生;⑵ 2012年Tjalsma等[33]提出“driver-passenger模型”假说,认为肠道内繁殖的驱动致病菌(bacteria driver)可产生基因毒素,诱发炎症反应并引起肠道微环境改变,导致肿瘤相关菌群丰度增加,进一步促进CRC的发生。由此可见,肠道菌群可在一定程度上影响遗传和表观遗传,菌群失调可导致发育延迟、肿瘤生长和形成侵袭性癌。机体内外环境改变(如年龄、生活习惯、精神、代谢和使用抗生素等)均会造成肠道内菌群改变,使有益菌减少、有害菌增殖、中性菌移位甚至优势菌群和次要菌群比例失衡等,从而改变细胞癌变进程。
2.3 肠道菌群通过代谢产物影响CRC的发生发展
在结直肠癌发生发展的过程中,肠道菌群的代谢产物也起到重要作用。肠道内产生的氨类、胺类、酚类、和硫化氢等化合物可通过组织细胞慢性炎症和DNA损伤参与CRC的发生发展过程[34]。Louis等[35]研究发现丙酸酯、丁酸酯和短链脂肪酸乙酸酯在抑制炎症和细胞癌变过程中起到重要作用,其他微生物代谢产物(如继发性胆汁酸等)可在促进癌症发生方面起作用,说明肠道菌群及其代谢产物同时具有抗炎和抗癌双重作用。肠道菌群及其代谢产物还可引起胆汁酸代谢紊乱,导致肠黏膜屏障损伤、诱导氧化应激反应并产生活性氧族代谢物,进而引起慢性炎症和细胞DNA损伤,增加抑癌基因和癌基因突变的概率[36]。Nguyen等[37]研究发现CRC患者粪便中7α-脱羟基梭菌浓度升高,7 α-脱羟基梭菌可促进生成次级胆汁酸,而次级胆汁酸水平升高又可导致肠道菌群紊乱。此外,在肠道细菌酶的作用下,胆汁酸可产生致癌性代谢产物(如刺激胆汁酸、硫化氢和活性氧族等)[38]。Ridlon等[39]研究发现,一种梭状芽胞杆菌(C.scindens)可以将初级胆汁酸转化为具有促肿瘤作用的毒性产物。一些具有抑癌作用的代谢产物也起到重要作用,如乙酸、丙酸、丁酸等短链脂肪酸可通过抑制抗凋亡Bcl-2,使原天冬氨酸酶转化为活性半胱天冬酶并与过氧化氢和亚硝胺等促癌物质结合;丁酸盐可通过调节细胞周期和增强肠上皮屏障完整性来抑制癌变[40]。
肠道菌群中,除致病菌可促进CRC发生外,一些益生菌(如枯草芽孢杆菌、酪酸梭状芽孢杆菌和丁酸梭菌等)还可通过减缓炎症反应、改善免疫稳态、促进细胞凋亡和诱导细胞扩增等方式抑制CRC的发生[41]。
3 肠道菌群在CRC诊断中的应用
目前,CRC的检查方法仍主要是血肿瘤标志物、粪便隐血检测(fecal occult blood testing,FOBT)和电子结肠镜检查。2014年,Zackular等[42]首次提出将肠道微生物作为CRC筛查的方法。粪便微生物检测作为一种无创非侵入性的肿瘤筛查方式,其发展前景极大。Xie等[43]研究发现粪便中共生梭菌(clostridium symbiosum,Cs)是CRC微生物检测的有效方法之一,并且与粪便中Fn、免疫组化和血肿瘤标志物检测合用时对检测能力有极大提升。此外,Nakatsu等[44]研究发现某些病毒可影响肠道菌群的稳态进而促进CRC的发生发展,因此,对CRC肠道微生物的检测不因局限于细菌,还应扩展到真菌或病毒等更广泛的微生物群体。然而,受限于地域人群、检测技术和肠道菌群结构差异等诸多因素影响,通过粪便中微生物筛查CRC的方法仍有待进一步研究完善。
4 肠道菌群在CRC治疗中的应用
4.1 肠道菌群在放、化疗中的作用
放疗、化疗和手术是肿瘤治疗的三大手段。放射治疗在直接损伤肿瘤细胞DNA的同时,也能通过产生氧自由基(reactive oxygen species,ROS)间接破坏肿瘤DNA;此外,放射线对非靶细胞产生的非靶向作用也能进一步造成DNA继发损伤[45]。研究[46]表明,肿瘤患者肠道菌群的变化与放疗密切相关,放射线影响肠道内菌群分布的同时,菌群本身也对肠道组织和细胞的放射敏感性有一定的调节作用。Ferreira等[47]发现,放射线能够诱导肠隐窝中细胞凋亡,在破坏肠黏膜屏障的同时改变肠道菌群结构(如放线菌和杆菌丰度上升、梭状芽孢杆菌丰度下降),从而增加放射性肠炎等其他并发症发生的风险。而益生菌和益生元等则符合肠道辐射防护剂的标准,能调节肠道菌群结构及其代谢功能,增强放疗患者肠道抗氧化能力,可有效缓解放疗引起的肠道损伤[48]。
肠道菌群对CRC化疗的影响表现为提高或降低化疗疗效和介导耐药或毒性反应。Alexander等[49]用“TIMER”概括肠道菌群影响肿瘤化疗的机制,即菌群移位(translocation)、免疫调节(immunomodulation)、代谢(metabolism)、酶降解(enzymatic degradation)、多样性降低和菌群失调(reduced diversity and ecological variation),其中免疫调节、代谢和酶降解与影响CRC 化疗机制关系密切。Deng 等[50]研究发现CRC患者手术后肠道菌群多样性显著降低,拟杆菌和厚壁菌的丰度也同时降低;而在化疗病人中发现萨特氏菌、殊异韦荣菌等一些特定菌株与化疗相关,提示一些肠道细菌可能与化疗抗性存在关联。Yu等[51]研究发现CRC化疗后复发患者肿瘤组织中Fn异常富集,且与肿瘤临床病理学特征相关,提示Fn可能与CRC化疗耐受有关。之前研究[26]亦证实,甲硝唑在减少Fn数量的同时,还能使肿瘤缩小,提示Fn阳性的CRC患者化疗前应用抗-Fn或者抗自噬治疗,可能会增强化疗效果。Roy等[52]研究发现肠道微生物的组成、形状、生理和基因表达可被细胞毒性化疗药物诱导而改变,从而进一步调节肠道菌群对药物代谢的影响。其他研究还发现,肠道菌群可增强CpG寡核苷酸和铂类等药物的化疗效果,并且化疗期间肠道内菌群稳态的改变可引起肠黏膜炎症[53]。Iida等[54]研究发现肠道菌群能辅助铂类抗肿瘤药物激活肿瘤相关炎症细胞产生活性氧(ROS),从而增强铂类药物杀伤肿瘤细胞DNA的作用。此外,化疗期间补充益生菌和益生元等肠道有益菌可降低活性氧含量和促炎性因子活性、加强肠上皮细胞间联系、降低肠壁通透性、促进肠上皮细胞分泌黏液和促进肠上皮细胞自我修复等,从而阻止致病菌和毒素等对肠黏膜的损害,缓解菌群失调,降低化疗相关副反应(如黏膜炎相关腹泻、恶心、呕吐和骨髓移植等)的发生[55]。
4.2 肠道菌群在免疫治疗中的作用
近年来免疫治疗成为结直肠肿瘤研究领域的热点,目前临床应用的疗法主要包括细胞过继性T细胞治疗(adoptive T cell therapy,ACT)和免疫检查点抑制剂(immune checkpoint inhibitor,ICI)。虽然免疫治疗可有效改善多数CRC患者的预后,但其临床疗效和不良反应却存在显著的个体差异。调节肠道菌群能使免疫治疗更加安全和有效。
肠道菌群可参与肠道内物质代谢和免疫应答等过程,因此微生物也能对CRC的免疫治疗起到积极作用。CRC的免疫治疗依赖于肠道内益生菌(如类杆菌和双歧杆菌等),它们可以增强树突状细胞的功能、增强CD8+T细胞的积聚和启动,还可以提高抗PD-L1效应从而增强抗肿瘤免疫力,起到抗癌作用[56]。之前研究发现在全身放疗的作用下,肠道细菌被诱导并移位至肠系膜淋巴结后通过TLR4信号转导进而增强ACT的疗效。近期研究[57] 发现,肠道菌群的天然组成、抗生素治疗或粪菌移植后的菌群改变均对ACT的疗效有显著影响,提示改变肠道菌群或可改善ACT的疗效和肿瘤患者的预后。
4.3 肠道菌群在其他生物治疗中的作用
根据肠道菌群与CRC发生发展的关系来看,调节人体肠道内菌群结构或可降低CRC患病的风险。⑴ 调整饮食结构:高脂和高蛋白饮食会破坏肠道菌群平衡,多纤维饮食有利于维持肠道菌群的稳态;⑵ 补充益生元和益生菌:低聚半乳糖和低聚果糖等益生元可以有效刺激有益共生菌群生;此外,选择性地促进肠道内益生菌(如乳酸杆菌、乳球杆菌、酪酸梭菌和双歧杆菌等)数量有利于肠道菌群稳态的维持;⑶ 肿瘤粪菌疗法(cancer fecal microbiota therapy,CFMT):将健康人粪便中功能菌群移植入患者胃肠道内,以此重建正常的肠道菌群,将改善CRC的转移与复发[58]。Matson等[59]分析42例转移性黑色素瘤患者的粪菌构成后发现,对PD-L1(PD-ligand 1)抑制剂疗效明显的患者肠道菌群中长双歧杆菌、产气柯林斯菌(collinsella aerofaciens)和屎肠球菌高度富集,将上述菌群移植给无菌小鼠能够显著增强肿瘤免疫应答并且抑制肿瘤生长。其他研究[60]同样证实粪菌移植能有效促进肠道神经内分泌系统和肠道免疫系统改变,增加结肠动力。近年来推出的粪菌干粉胶囊避免了既往通过鼻、胃管或肠镜灌肠等粪菌移植方式给患者带来的不适,同时也克服了冷冻菌液胶囊需低温保存的劣势,为CRC的临床治疗提供了新方法。
中医药研究方面,芪贞汤可逆转模型小鼠肠道中拟杆菌属和丹毒丝菌属等致癌菌种的优势地位,提高益生菌(如乳酸菌属和双歧杆菌属)比例从而改善肠道炎性反应和癌细胞增生情况,抑制肿瘤发生发展。此外,晚期结肠癌化疗阶段应用健脾渗湿汤亦能增加益生菌数量,改善患者精神状态,减轻化疗不适反应,提高患者生存质量。
5 肠道菌群在CRC 预防与疾病预后中的作用
通过分析CRC患者肠道菌群结构可以指导其预防以及预测其预后状况。CRC的不同解剖部位以及发生发展的不同阶段,肠道菌群的构成也会动态变化。Saffarian等[61]分析CRC患者肠隐窝和肠黏膜中的微生物结构后发现,近端和远端CRC的菌群结构存在明显差异,相比于左半结肠癌患者,右半结肠癌患者肠道菌群中梭杆菌(fusobacterium)和脆弱拟杆菌(bacteroides fragilis)丰度更高,而微小微单胞菌(parvimonas micra)的丰度则明显较低。Yachida等[62]研究发现,在疾病发展过程中,部分菌群(如具核梭杆菌、莫雷梭菌等)其丰度持续升高,而部分菌群(如极小链球菌等)却只可在疾病早期观察到其丰度的变化。其他研究[63]表明,肠道菌群与肿瘤预后具有相关性,具核梭杆菌、大肠杆菌和脆弱拟杆菌富集的肿瘤组织提示预后较差;而柔嫩梭菌(faecalibacterium prausnitzii,F.prausnitzii)富集的肿瘤组织则常见于预后较好的患者中。同一细菌富集在肠道的不同位置其预后状况也不尽相同,对于降结肠癌、横结肠癌和升结肠癌而言,使用奥沙利铂的化疗效果与肿瘤组织中具核梭杆菌的浓度呈正比,而这一结果却在乙状结肠癌与直肠癌患者中恰巧相反[64]。
6 小结与展望
综上所述,目前研究已证实肠道菌群与结直肠癌的发生发展密切相关。肠道菌群中有害菌可通过引起慢性炎症、介导免疫应答、造成DNA损伤和产生代谢产物等途径促进结直肠癌的发生发展,而有益菌在抑制细胞癌变的同时,还有利于增强结直肠癌放、化疗和免疫治疗的疗效。但肠道菌群在肿瘤发生发展中具体作用机制尚未明确阐明,有待进一步深入研究,以期为今后结直肠癌的预防和诊疗提供新思路和新方法。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2020[J].CA Cancer J Clin,2020,70(1):7-30.doi:10.3322/caac.21590.
[2]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.doi:10.3322/caac.21492.
[3]Wieczorska K,Stolarek M,Stec R.The Role of the Gut Microbiome in Colorectal Cancer:Where Are We? Where Are We Going?[J].Clin Colorectal Cancer,2020,19(1):5-12.doi:10.1016/j.clcc.2019.07.006.
[4]Zouggar A,Haebe JR,Benoit YD.Intestinal microbiota influences DNA methylome and susceptibility to colorectal cancer[J].Genes(Basel),2020,11(7):808.doi:10.3390/genes11070808.
[5]吴承堂,黄祥成,杨希山,等.大肠癌术后肠屏障功能变化的临床研究[J].中国普通外科杂志,2003,12(11):858-860.doi:10.3969/j.issn.1005-6947.2003.11.018.
Wu CT,Huang XC,Yang XS,et al.Clinical study of alteration of intestinal barrier function after colorectal operation[J].Chinese Journal of General Surgery,2003,12(11):858-860.doi:10.3969/j.issn.1005-6947.2003.11.018.
[6]何继德,孔程,高仁元,等.益生菌改善高脂膳食结构下小鼠肠道微生态异常及其干预结直肠癌发生的研究[J].中华胃肠外科杂志,2020,23(Z1):77-85.doi:10.3760/cma.j.cn.441530-20200417-00223.
He JD,Kong C,Gao RY,et al.Effects of probiotics on the intestinal microecological abnormalities and colorectal cancer of mice induced by high-fat diet[J].Chinses Journal of Gastrointestinal Surgery,2020,23(Z1):77-85.doi:10.3760/cma.j.cn.441530-20200417-00223.
[7]Sender R,Fuchs S,Milo R.Revised estimates for the number of human and bacteria cells in the body[J].PLoS Biol,2016,14(8):e1002533.doi:10.1371/journal.pbio.1002533.
[8]Blaser MJ,Falkow S.What are the consequences of the disappearing human microbiota?[J].Nat Rev Microbiol,2009,7(12):887-894.doi:10.1038/nrmicro2245.
[9]Isacco CG,Ballini A,De Vito D,et al.Rebalance the oral microbiota as efficacy tool in endocrine,metabolic,and immune disorders[J].Endocr Metab Immune Disord Drug Targets,2020,doi:10.2174/1871530320666200729142504.[Online ahead of print]
[10]Zhong X,Harrington JM,Millar SR,et al.Gut Microbiota Associations with Metabolic Health and Obesity Status in Older Adults[J].Nutrients,2020,12(8):2364.doi:10.3390/nu12082364.
[11]Ticinesi A,Nouvenne A,Tana C,et al.Gut Microbiota and Microbiota-Related Metabolites as Possible Biomarkers of Cognitive Aging[J].Adv Exp Med Biol,2019,1178:129-154.doi:10.1007/978-3-030-25650-0_8.
[12]欧阳晓玲,邢凤媛.肠道微生态改变与消化系统有关疾病的临床研究进展[J].检验医学与临床,2017,14(6):895-897.doi:10.3969/j.issn.1672-9455.2017.06.064.
Ouyang XL,Xing FY.Clinical research progress of intestinal microecological changes and diseases related to digestive system[J].Laboratory Medicine and Clinic,2017,14(6):895-897.doi:10.3969/j.issn.1672-9455.2017.06.064.
[13]Rowland I,Gibson G,Heinken A,et al.Gut microbiota functions:metabolism of nutrients and other food components[J].Eur J Nutr,2018,57(1):1-24.doi:10.1007/s00394-017-1445-8.
[14]Cryan JF,O'Riordan KJ,Cowan CSM,et al.The Microbiota-Gut-Brain Axis[J].Physiol Rev,2019,99(4):1877-2013.doi:10.1152/physrev.00018.2018.
[15]Geuking MB,Burkhard R.Microbial modulation of intestinal T helper cell responses and implications for disease and therapy[J].Mucosal Immunol,2020,13(6):855-866.doi:10.1038/s41385-020-00335-w.
[16]韩亮,陈国栋,曾莎莎,等.幽门螺杆菌Tipα通过激活IL-6/STAT3信号通路诱导胃癌细胞EMT的形成[J].免疫学杂志,2019,35(2):105-111.doi:10.13431/j.cnki.immunol.j.20190017.
Han L,Chen GD,Zeng SS,et al.TNF-α-inducing protein of Helicobacter Pylori induces epithelial-mesenchymal transition(EMT) in gastric cancer cells through activating IL-6/STAT3 signaling pathway[J].Immunological Journal,2019,35(2):105-111.doi:10.13431/j.cnki.immunol.j.20190017.
[17]Thomas AM,Manghi P,Asnicar F,et al.Metagenomic analysis of colorectal cancer datasets identifies cross-cohort microbial diagnostic signatures and a link with choline degradation[J].Nat Med,2019,25(4):667-678.doi:10.1038/s41591-019-0405-7.
[18]Cao H,Xu M,Dong W,et al.Secondary bile acid-induced dysbiosis promotes intestinal carcinogenesis[J].Int J Cancer,2017,140(11):2545-2556.doi:10.1002/ijc.30643.
[19]Lucas C,Barnich N,Nguyen HTT.Microbiota,Inflammation and Colorectal Cancer[J].Int J Mol Sci,2017,18(6):1310.doi:10.3390/ijms18061310.
[20]Wampach L,Heintz-Buschart A,Fritz JV,et al.Birth mode is associated with earliest strain-conferred gut microbiome functions and immunostimulatory potential[J].Nat Commun,2018,9(1):5091.doi:10.1038/s41467-018-07631-x.
[21]Sears CL,Geis AL,Housseau F.Bacteroides fragilis subverts mucosal biology:from symbiont to colon carcinogenesis[J].J Clin Invest,2014,124(10):4166-4172.doi:10.1172/JCI72334.
[22]Mori G,Rampelli S,Orena BS,et al.Shifts of faecal microbiota during sporadic colorectal carcinogenesis[J].Sci Rep,2018,8(1):10329.doi:10.1038/s41598-018-28671-9.
[23]Uronis JM,Mühlbauer M,Herfarth HH,et al.Modulation of the intestinal microbiota alters colitis-associated colorectal cancer susceptibility[J].PLoS One,2009,4(6):e6026.doi:10.1371/journal.pone.0006026.
[24]Sun CH,Li BB,Wang B,et al.The role of Fusobacterium nucleatum in colorectal cancer:from carcinogenesis to clinical management[J].Chronic Dis Transl Med,2019,5(3):178-187.doi:10.1016/j.cdtm.2019.09.001.
[25]Chen Y,Song W.Wnt/catenin β1/microRNA 183 predicts recurrence and prognosis of patients with colorectal cancer[J].Oncol Lett,2018,15(4):4451-4456.doi:10.3892/ol.2018.7886.
[26]Bullman S,Pedamallu CS,Sicinska E,et al.Analysis of Fusobacterium persistence and antibiotic response in colorectal cancer[J].Science,2017,358(6369):1443-1448.doi:10.1126/science.aal5240.
[27]Mima K,Nishihara R,Qian ZR,et al.Fusobacterium nucleatum in colorectal carcinoma tissue and patient prognosis[J].Gut,2016,65(12):1973-1980.doi:10.1136/gutjnl-2015-310101.
[28]Tsoi H,Chu ESH,Zhang X,et al.Peptostreptococcus anaerobius Induces Intracellular Cholesterol Biosynthesis in Colon Cells to Induce Proliferation and Causes Dysplasia in Mice[J].Gastroenterology,2017,152(6):1419-1433.doi:10.1053/j.gastro.2017.01.009.
[29]Wong SH,Zhao L,Zhang X,et al.Gavage of fecal samples from patients with colorectal cancer promotes intestinal carcinogenesis in germ-free and conventional mice[J].Gastroenterology,2017,153(6):1621-1633.doi:10.1053/j.gastro.2017.08.022.
[30]Malik A,Sharma D,Zhu Q,et al.IL-33 regulates the IgAmicrobiota axis to restrain IL-1α-dependent colitis and tumorigenesis[J].J Clin Invest,2016,126(12):4469-4481.doi:10.1172/JCI88625.
[31]Raskov H,Burcharth J,Pommergaard HC.Linking gut microbiota to colorectal cancer[J].J Cancer,2017,8(17):3378-3395.doi:10.7150/jca.20497.
[32]Sears CL,Pardoll DM.Perspective:alpha-bugs,their microbial partners,and the link to colon cancer[J].J Infect Dis,2011,203(3):306-311.doi:10.1093/jinfdis/jiq061.
[33]Tjalsma H,Boleij A,Marchesi JR,et al.A bacterial driver passenger model for colorectal cancer:beyond the usual suspects[J].Nat Rev Microbiol,2012,10(8):575-582.doi:10.1038/nrmicro2819.
[34]Marchesi JR,Adams DH,Fava F,et al.The gut microbiota and host health:a new clinical frontier[J].Gut,2016,65(2):330-339.doi:10.1136/gutjnl-2015-309990.
[35]Louis P,Hold GL,Flint HJ.The gut microbiota,bacterial metabolites and colorectal cancer[J].Nat Rev Microbiol,2014,12(10):661-672.doi:10.1038/nrmicro3344.
[36]党文呈,张有成.丁酸与胆固醇型胆结石形成的关系[J].中国普通外科杂志,2020,29(8):994-999.doi:10.7659/j.issn.1005-6947.2020.08.011.
Dang WC,Zhang YC.Relationship between butyrate and formation of cholesterol gallstones[J].Chinese Journal of General Surgery,2020,29(8):994-999.doi:10.7659/j.issn.1005-6947.2020.08.011.
[37]Nguyen TT,Ung TT,Kim NH,et al.Role of bile acids in colon carcinogenesis[J].World J Clin Cases,2018,6(13):577-588.doi:10.12998/wjcc.v6.i13.577.
[38]Ridlon JM,Alves JM,Hylemon PB,et al.Cirrhosis,bile acids and gut microbiota:unraveling a complex relationship[J].Gut Microbes,2013,4(5):382-387.doi:10.4161/gmic.25723.
[39]Ridlon JM,Wolf PG,Gaskins HR.Taurocholic acid metabolism by gut microbes and colon cancer[J].Gut Microbes,2016,7(3):201-215.doi:10.1080/19490976.2016.1150414.
[40]Geirnaert A,Calatayud M,Grootaert C,et al.Butyrate-producing bacteria supplemented in vitro to Crohn's disease patient microbiota increased butyrate production and enhanced intestinal epithelial barrier integrity[J].Sci Rep,2017,7(1):11450.doi:10.1038/s41598-017-11734-8.
[41]Bajramagic S,Hodzic E,Mulabdic A,et al.Usage of Probiotics and its Clinical Significance at Surgically Treated Patients Sufferig from Colorectal Carcinoma[J].Med Arch,2019,73(5):316-320.doi:10.5455/medarh.2019.73.316-320.
[42]Zackular JP,Rogers MA,Ruffin MT,et al.The human gut microbiome as a screening tool for colorectal cancer[J].Cancer Prev Res (Phila),2014,7(11):1112-1121.doi:10.1158/1940-6207.CAPR-14-0129.
[43]Xie YH,Gao QY,Cai GX,et al.Fecal clostridium symbiosum for noninvasive detection of early and advanced colorectal cancer:test and validation studies[J].EBioMedicine,2017,25:32-40.doi:10.1016/j.ebiom.2017.10.005.
[44]Nakatsu G,Zhou H,Wu WKK,et al.Alterations in enteric virome are associated with colorectal cancer and survival outcomes[J].Gastroenterology,2018,155(2):529-541.doi:10.1053/j.gastro.2018.04.018.
[45]Shemetun OV,Pilinska MA.Radiation-induced bystander effect-modeling,manifestation,mechanisms,persistence,cancer risks (literature review)[J].Probl Radiac Med Radiobiol,2019,24:65-92.doi:10.33145/2304-8336-2019-24-65-92.
[46]Al-Qadami G,Van Sebille Y,Le H,et al.Gut microbiota:implications for radiotherapy response and radiotherapy-induced mucositis[J].Expert Rev Gastroenterol Hepatol,2019,13(5):485-496.doi:10.1080/17474124.2019.1595586.
[47]Ferreira MR,Muls A,Dearnaley DP,et al.Microbiota and radiationinduced bowel toxicity:lessons from inflammatory bowel disease for the radiation oncologist[J].Lancet Oncol,2014,15(3):e139-147.doi:10.1016/S1470-2045(13)70504-7.
[48]朱长真,李元新.放射性肠炎与肠道微生态研究进展[J].中国医学科学院学报,2020,42(3):405-409.doi:10.3881/j.issn.1000-503X.11448.
Zhu CZ,Li YX.Radioactive enteritis and gut microecology[J].Acta Academiae Medicinae Sinicae,2020,42(3):405-409.doi:10.3881/j.issn.1000-503X.11448.
[49]Alexander JL,Wilson ID,Teare J,et al.Gut microbiota modulation of chemotherapy efficacy and toxicity[J].Nat Rev Gastroenterol Hepatol,2017,14(6):356-365.doi:10.1038/nrgastro.2017.20.
[50]Deng X,Li Z,Li G,et al.Comparison of Microbiota in Patients Treated by Surgery or Chemotherapy by 16S rRNA Sequencing Reveals Potential Biomarkers for Colorectal Cancer Therapy[J].Front Microbiol,2018,9:1607.doi:10.3389/fmicb.2018.01607.
[51]Yu T,Guo F,Yu Y,et al.Fusobacterium nucleatum Promotes Chemoresistance to Colorectal Cancer by Modulating Autophagy[J].Cell,2017,170(3):548-563.doi:10.1016/j.cell.2017.07.008.
[52]Roy S,Trinchieri G.Microbiota:a key orchestrator of cancer therapy[J].Nat Rev Cancer,2017,17(5):271-285.doi:10.1038/nrc.2017.13.
[53]Mármol I,Sánchez-de-Diego C,Pradilla Dieste A,et al.Colorectal Carcinoma:A General Overview and Future Perspectives in Colorectal Cancer[J].Int J Mol Sci,2017,18(1):197.doi:10.3390/ijms18010197.
[54]Iida N,Dzutsev A,Stewart CA,et al.Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment[J].Science,2013,342(6161):967-970.doi:10.1126/science.1240527.
[55]Wang YH,Yao N,Wei KK,et al.The efficacy and safety of probiotics for prevention of chemo-radiotherapy-induced diarrhea in people with abdominal and pelvic cancer:a systematic review and meta-analysis[J].Eur J Clin Nutr,2016,70(11):1246-1253.doi:10.1038/ejcn.2016.102.
[56]Drewes JL,Housseau F,Sears CL.Sporadic colorectal cancer:microbial contributors to disease prevention,development and therapy[J].Br J Cancer,2016,115(3):273-280.doi:10.1038/bjc.2016.189.
[57]Uribe-Herranz M,Bittinger K,Rafail S,et al.Gut microbiota modulates adoptive cell therapy via CD8α dendritic cells and IL-12[J].JCI Insight,2018,3(4):e94952.doi:10.1172/jci.insight.94952.
[58]McQuade JL,Daniel CR,Helmink BA,et al.Modulating the microbiome to improve therapeutic response in cancer[J].Lancet Oncol,2019,20(2):e77-91.doi:10.1016/S1470-2045(18)30952-5.
[59]Matson V,Fessler J,Bao R,et al.The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients[J].Science,2018,359(6371):104-108.doi:10.1126/science.aao3290.
[60]Grasa L,Abecia L,Forcén R,et al.Antibiotic-Induced Depletion of Murine Microbiota Induces Mild Inflammation and Changes in Toll-Like Receptor Patterns and Intestinal Motility[J].Microb Ecol,2015,70(3):835-848.doi:10.1007/s00248-015-0613-8.
[61]Saffarian A,Mulet C,Regnault B,et al.Crypt-and Mucosa-Associated Core Microbiotas in Humans and Their Alteration in Colon Cancer Patients[J].mBio,2019,10(4):e01315-319.doi:10.1128/mBio.01315-19.
[62]Yachida S,Mizutani S,Shiroma H,et al.Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer[J].Nat Med,2019,25(6):968-976.doi:10.1038/s41591-019-0458-7.
[63]Wei Z,Cao S,Liu S,et al.Could gut microbiota serve as prognostic biomarker associated with colorectal cancer patients' survival? A pilot study on relevant mechanism[J].Oncotarget,2016,7(29):46158-46172.doi:10.18632/oncotarget.10064.
[64]Oh HJ,Kim JH,Bae JM,et al.Prognostic Impact of Fusobacterium nucleatum Depends on Combined Tumor Location and Microsatellite Instability Status in Stage II/III Colorectal Cancers Treated with Adjuvant Chemotherapy[J].J Pathol Transl Med,2019,53(1):40-49.doi:10.4132/jptm.2018.11.29.
