紫杉醇和多西紫杉醇因其较低的水溶性,需加用其他有机溶剂进行溶解化疗药物方可使用;而加入的有机溶剂,容易导致患者发生多种毒副反应,一定程度上限制了紫杉类药物的临床使用。脂质体是具有双分子层囊状结构的人工膜,可用于药物制备。脂质体制剂具有靶向性和药物缓释作用,可降低药物毒性,提高药物稳定性。利用脂质体包裹的阿霉素或者紫杉醇抗癌药物,因其较低的药物毒副反应及过敏反应,已经得到广泛使用;其安全性和疗效也得到了临床的认可[1-5]。近年来,乳腺癌新辅助化疗方案成为讨论的热点[6]。随着密集化疗方案在辅助化疗中所取得的生存获益,越来越多的研究者考虑将密集化疗方案使用于新辅助化疗之中[7-11]。考虑到密集化疗方案较大的毒副反应,适当的使用改进型的化疗药物,降低毒副反应,成为了许多临床试验的优选[12-13]。本研究回顾性分析我院收治的局部晚期可手术非HER-2过表达乳腺癌患者的临床资料,所有患者均接受新辅助化疗,比较蒽环序贯多西紫杉醇和剂量密集型蒽环序贯紫杉醇脂质体的疗效及不良反应情况,现将结果报告如下。
1 资料与方法
1.1 患者资料
收集2017年1月—2018年12月的新发乳腺癌患者,根据入组标准和排除标准筛选患者。入组标准:⑴年龄18~70岁的女性,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分,病理确诊为浸润性乳腺癌;⑵原发肿瘤≥5 cm;⑶有完整病理和病历资料;⑷未接受过针对乳腺癌的任何治疗;⑸具有可进行疗效评价的客观指标。排除标准:⑴双乳癌;⑵特殊类型乳腺癌,如黏液癌,小叶癌,微乳头状癌等;⑶病理或病历资料不齐全;⑷新辅助化疗方案为AC或TC,或更换化疗方案的;⑸化疗剂量强度低于推荐剂量85%的患者;⑹原发IV期乳腺癌;⑺HER-2检测免疫组化(+++)或FISH检测阳性的。
1.2 治疗方案
注射用紫杉醇脂质体为南京绿叶思科药业有限公司产品。⑴新辅助化疗多西紫杉醇组采用AC-T序贯方案8周期:A为表柔比星90 mg/m2或吡柔比星50 mg/m2,C为环磷酰胺600 mg/m2,T为多西紫杉醇100 mg/m2,21 d/周期。⑵新辅助化疗紫杉醇脂质体组采用AC-P序贯方案8周期:A为表柔比星90 mg/m2或吡柔比星50 mg/m2,C为环磷酰胺600 mg/m2,P为紫杉醇脂质体175 mg/m2,14 d/周期。两组患者允许剂量减量1次,使用剂量不低于推荐剂量的85%。每个患者每周期允许进行预防性骨髓支持(注射粒细胞集落刺激因子100 μg/d,3~5 d)。每个周期化疗结束后定期进行血常规检查,如出现III度及以上骨髓抑制,则予以强化骨髓支持(注射粒细胞集落刺激因子200~300 μg/d),维持II度及以上的轻度骨髓抑制。
1.3 反应评价
根据术后石蜡病理结果,新辅助化疗疗效评价主要指标为病理完全缓解(p a t h o l o g i c a l completed response,pCR)。pCR的定义为乳腺未见癌残留或乳腺见导管内癌残留,无浸润性癌;同时腋窝淋巴结无癌残留。临床疗效根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD),客观缓解率(objective response rate,ORR)=(CR+PR)/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。根据美国国立癌症研究所不良事件常用术语评定标准(4.03版)将不良反应分为I~IV级。
1.4 统计学处理
采用STATA 12.0软件,进行倾向性评分匹配(propensity score matching,PSM),使得多西紫杉醇化疗组患者临床病理特征与紫杉醇脂质体化疗组患者的特征基本一致。计量资料用均数±标准差( ±s)表示,计数资料用例数(百分比)[n(%)]表示。两组的数据比较采用χ2检验或Fisher精确检验,P<0.05为差异有统计学意义。
±s)表示,计数资料用例数(百分比)[n(%)]表示。两组的数据比较采用χ2检验或Fisher精确检验,P<0.05为差异有统计学意义。
2 结果
2.1 PSM 后两组局部晚期乳腺癌患者的临床病理特征
符合入组标准的紫杉醇脂质体组的患者共4 8 例,多西紫杉醇组患者共1 9 6 例。通过P S M成功匹配4 8 例多西紫杉醇化疗方案患者。多西紫杉醇化疗组中,年龄3 4 ~6 4 岁,平均年龄(4 5.5 4±7.0 6)岁,肿瘤直径5 ~9 c m,平均(6.7 1±1.3 5)c m。紫杉醇脂质体组中,年龄32~68岁,平均年龄(46.25±9.36)岁,肿瘤直径5~8 cm,平均(6.85±0.93)cm。两组患者中,原发乳腺肿瘤均≥5 c m。在多西紫杉醇组中,淋巴结未扪及肿大者18.8%,淋巴结状态为N1者60.4%,淋巴结N2者20.8%;从分子分型来看,管腔型患者77.1%,三阴性乳腺癌22.9%。在紫杉醇脂质体组中,淋巴结未扪及肿大者25.0%,淋巴结状态为N1者56.3%,淋巴结N2者18.7%;从分子分型来看,管腔型患者72.9%,三阴性乳腺癌27.1%。两组在患者基本临床病理特征基本保持一致,组间比较差异均无统计学意义(均P>0.05)(表1)。
2.2 两组新辅助化疗疗效的比较
多西紫杉醇组中,p C R 患者为9 例(18.8%);紫杉醇脂质体组中,pCR患者为11例(22.9%)。紫杉醇脂质体组pCR优于多西紫杉醇化疗组,但无统计学意义(P>0.05)(表2)。多西紫杉醇组中,ORR为93.7%,DCR为100.0%;紫杉醇脂质体组中,O R R 为1 0 0.0%,D C R 为100.0%。两组中均未发生PD事件。
表1 两组新辅助化疗乳腺癌患者的基本临床病理特征[n=48,n(%)]
Table 1 Baseline characteristics of the two groups of patients undergoing neoadjuvant chemotherapy[n=48,n(%)]
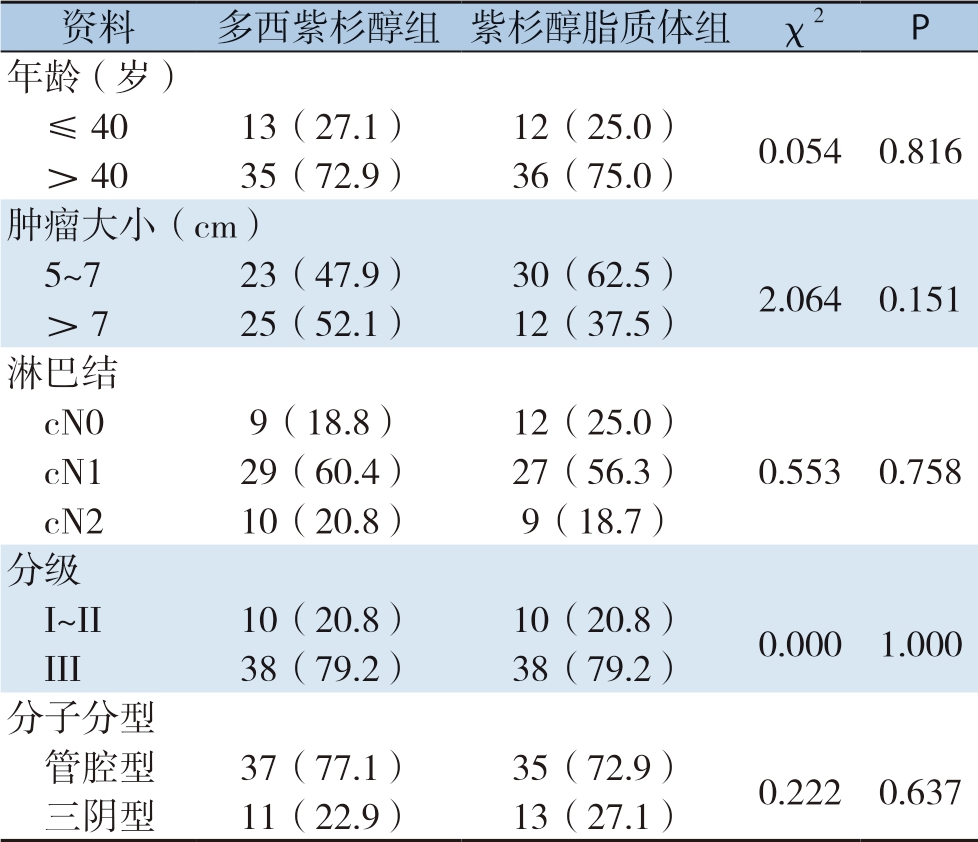
资料多西紫杉醇组 紫杉醇脂质体组 χ2P年龄(岁)≤4013(27.1)12(25.0)0.054 0.816>4035(72.9)36(75.0)肿瘤大小(cm)5~723(47.9)30(62.5)2.064 0.151>725(52.1)12(37.5)淋巴结cN09(18.8)12(25.0)cN129(60.4)27(56.3)0.553 0.758 cN210(20.8)9(18.7)分级I~II10(20.8)10(20.8)0.000 1.000 III38(79.2)38(79.2)分子分型管腔型37(77.1)35(72.9)0.222 0.637三阴型11(22.9)13(27.1)
表2 多西紫杉醇组和紫杉醇脂质体组的疗效比较[n=48,n(%)]
Table 2 Comparison of the efficacy variables between docetaxel group and paclitaxel liposome group[n=48,n(%)]
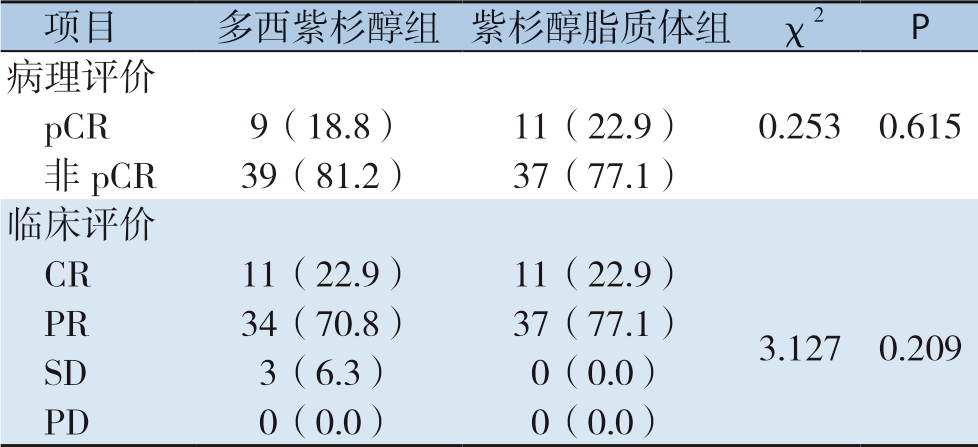
项目多西紫杉醇组 紫杉醇脂质体组 χ2P病理评价pCR9(18.8)11(22.9)0.253 0.615非pCR39(81.2)37(77.1)临床评价CR11(22.9)11(22.9)PR34(70.8)37(77.1)3.127 0.209 SD3(6.3)0(0.0)PD0(0.0)0(0.0)
2.3 两组新辅助化疗毒副反应比较
在多西紫杉醇组中,I I I ~I V 度血液学毒性发生率,高于紫杉醇脂质体组(P <0.0 5);多西紫杉醇组中,I I I ~I V 度白细胞降低发生1 8 例(3 7.5%),I I I ~I V 度中性粒细胞降低发生1 4 例(2 9.2%),高于在紫杉醇脂质体组的2例(4.2%)和2例(4.2%);多西紫杉醇化疗组III~IV度白细胞及中性粒细胞降低发生率明显高于紫杉醇脂质体组(均P<0.05);两组血小板降低均无III度及以上毒副反应发生;多西紫杉醇组6例I~II度血小板降低,紫杉醇脂质体组中无明显血小板降低现象;多西紫杉醇组4例非感染性发热(体温低于39 ℃),予以对症处理后好转,该发热患者同时出现IV度白细胞和中性粒细胞降低;两组患者非感染性发热、心脏毒副反应差异无统计学意义(P>0.05);在肝功能毒副反应上,多西紫杉醇组8例(16.7%)出现II度转氨酶异常,紫杉醇脂质体组无II度转氨酶异常患者;多西紫杉醇化疗组III~IV度恶心和呕吐发生率均高于紫杉醇脂质体化疗组(恶心:43.8% vs.20.8%;呕吐:43.8% vs.18.8%),两组间差异有统计学意义(P<0.05);脱发的发生率两组间差异无统计学意义(P>0.05);多西紫杉醇化疗组乏力和口腔黏膜炎发生率明显高于紫杉醇脂质体化疗组,差异有统计学意义(P<0.05)(表3)。
表3 多西紫杉醇组和紫杉醇脂质体组不良反应发生率比较[n=48,n(%)]
Table 3 Comparison of the incidence rates of adverse reactions between docetaxel group and paclitaxel liposome group[n=48,n(%)]
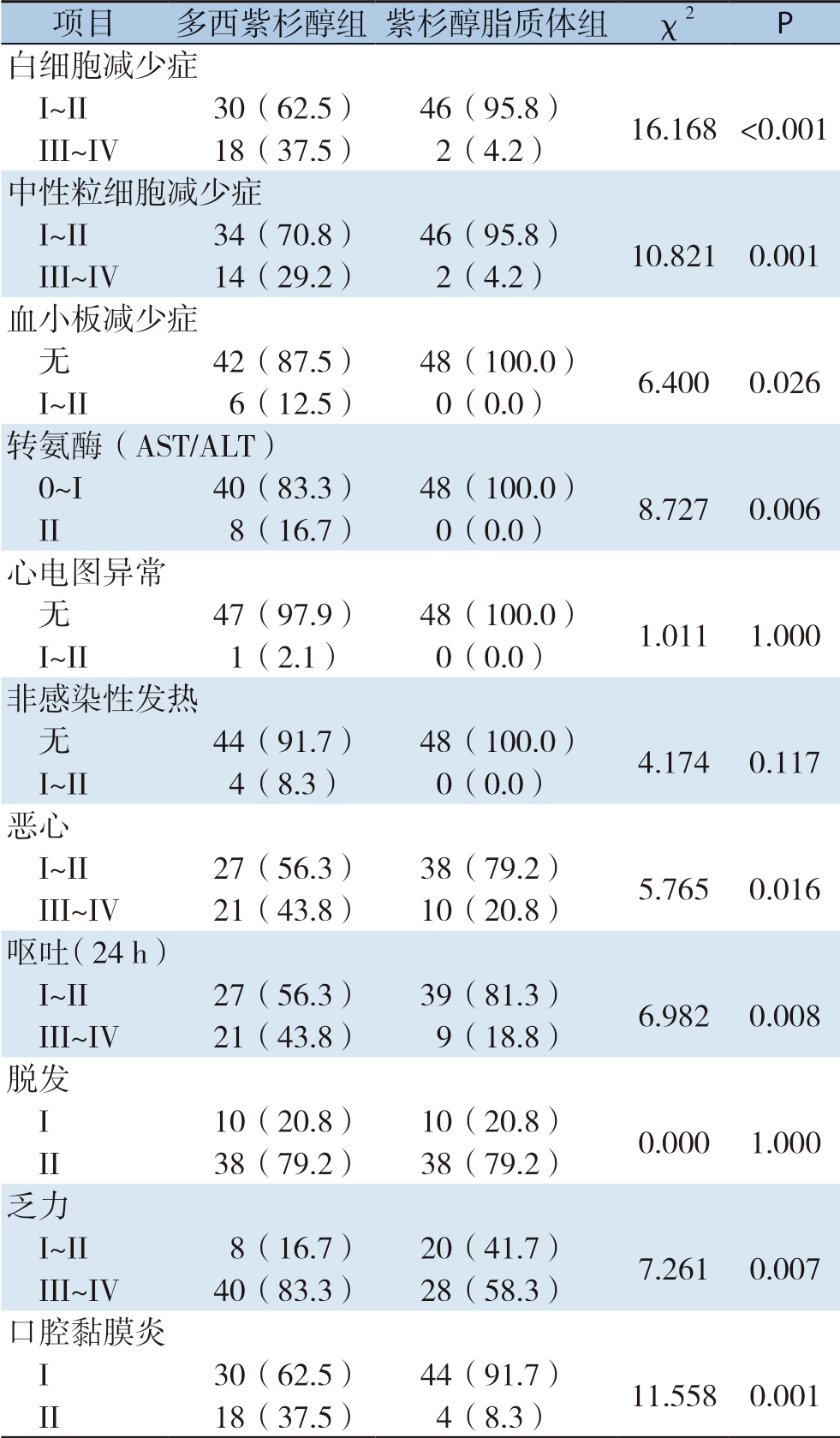
项目多西紫杉醇组紫杉醇脂质体组 χ2P白细胞减少症I~II30(62.5)46(95.8)16.168 <0.001 III~IV18(37.5)2(4.2)中性粒细胞减少症I~II34(70.8)46(95.8)10.821 0.001 III~IV14(29.2)2(4.2)血小板减少症无42(87.5)48(100.0)6.400 0.026 I~II6(12.5)0(0.0)转氨酶(AST/ALT)0~I40(83.3)48(100.0)8.727 0.006 II8(16.7)0(0.0)心电图异常无47(97.9)48(100.0)1.011 1.000 I~II1(2.1)0(0.0)非感染性发热无44(91.7)48(100.0)4.174 0.117 I~II4(8.3)0(0.0)恶心I~II27(56.3)38(79.2)5.765 0.016 III~IV21(43.8)10(20.8)呕吐(24 h)I~II27(56.3)39(81.3)6.982 0.008 III~IV21(43.8)9(18.8)脱发I 10(20.8)10(20.8)0.000 1.000 II38(79.2)38(79.2)乏力I~II8(16.7)20(41.7)7.261 0.007 III~IV40(83.3)28(58.3)口腔黏膜炎I 30(62.5)44(91.7)11.558 0.001 II18(37.5)4(8.3)
3 讨论
近些年来,乳腺癌的化学药物治疗得到了巨大的进步。随着蒽环类和紫杉类化疗药物的推出,乳腺癌患者预后也得到了明显的改善。不断改进化疗药物的剂型,并调整用药的方案和组合,减小化疗药物的毒副反应,也能提高患者的依从性,可以进一步改善患者的预后。紫杉醇化疗药物剂型的改进,国际上主要体现在利用白蛋白对紫杉醇药物进行包裹,从而降低紫杉醇化疗药物的毒副及过敏反应[14-15]。紫杉醇脂质体作为我国自主知识产权的新药,以卵磷脂等作为载体,将紫杉醇进行包裹,使药物稳定性更强,半衰期及体内平均滞留时间明显延长,降低了药物毒性及因溶媒导致的过敏反应[16]。有研究[17-18]同时利用白蛋白和脂质体的优点,拟进一步提高紫杉醇渗入肿瘤局部的微环境,提高肿瘤局部化疗药物浓度,进一步提高肿瘤治疗的疗效。在针对各种改进型的紫杉醇的研究中,研究者[1-2,19-21]发现与传统紫杉醇或多西紫杉醇相比较,白蛋白或是脂质体紫杉醇的抗肿瘤疗效相当甚至更好,但骨髓血液、体液潴留、口腔黏膜、过敏反应等药物毒副反应发生明显降低,患者获益明显。
蒽环类序贯紫杉醇是H E R-2 阴性乳腺癌新辅助化疗的标准方案之一。但是在乳腺癌新辅助化疗中使用紫杉醇脂质体的研究相对较少。已有少量研究[13,19]表明,在乳腺癌的新辅助化疗中,紫杉醇脂质体对肿瘤的抑制作用同紫杉醇和多西紫杉醇基本相同。这个结果和本研究的结果基本一致。本研究结果显示,多西紫杉醇组和紫杉醇脂质体组的pCR率分别为18.8%和22.9%,ORR分别为93.7%和100.0%,DCR分别为100.0%和100.0%,差异无统计学意义(P>0.05),两组疗效相当。但是在既往的研究中,其他学者报道的pCR率各有所不同,我们认为这可能是因为不同的入组人群所造成的。此外,研究[13]发现,紫杉醇脂质体对于腋窝转移性的淋巴结的疗效效果更为显著;接受了紫杉醇脂质体作为新辅助化疗,可能可以更多的豁免腋窝淋巴结清扫。在本回顾性研究中患者均采用的是改良根治术,故并未能得到相同或者相似的结论。总之,紫杉醇脂质体在新辅助化疗中,对比传统紫杉类药物显示其基本相同疗效。
近年来,辅助治疗中的剂量密集化疗方案让乳腺癌患者获得了生存获益;越来越多研究将剂量密集方案在术前使用,以达到快速降低肿瘤负荷的目的[10]。但是剂量密集的化疗方案存在较大毒副反应,适当降低副反应,保证患者的依从性,是一个重大的课题。鉴于紫杉醇脂质体较少的毒副反应,有必要探讨在密集化疗方案中其毒副反应相对于传统紫杉醇是否具有优势。本研究结果与既往的相关研究基本一致,紫杉醇脂质体的毒副反应明显少于传统紫杉醇[2,19]。从本研究结果显示,紫杉醇脂质体组患者的严重化疗毒副反应,例如血液学毒性、恶心呕吐、乏力和口腔黏膜炎发生率均低于多西紫杉醇化疗组(均P<0.05)。既往研究表明,剂量密集方案化疗,较常规3周方案化疗,更容易发生血液学相关毒性,如血小板减少、中性粒细胞减少和贫血[10,22],本研究中,即使使用剂量密集的紫杉醇脂质体化疗,无论是血液学毒性,还是消化道反应,相对多西紫杉醇方案而言,有显著的安全性优势。但无论多西紫杉醇或是紫杉醇脂质体组,总体安全性良好,毒副反应是可控。所以紫杉醇脂质体不仅可以在传统的方案中使用,在剂量密集化疗方案中安全性也是肯定的。
本研究显示,剂量密集的蒽环序贯紫杉醇脂质体可能显现出更好的p C R 率(2 2.9% vs.18.8%),但并没有统计学差异。在这一问题上,仍存在较多争议。有研究[23-24]表明,在新辅助化疗中,剂量密集型化疗方案能够显著性提高pCR率,甚至改善乳腺癌的无病生存期。但也有研究[25-26]认为,剂量密集的新辅助化疗方案还不足以提高pCR率和改善乳腺癌患者的预后。所以关于新辅助化疗中的剂量密集型化疗方案是否能替代标准的3周化疗方案,还需要更多的大型前瞻性临床试验提供更为详实的数据。
新辅助化疗能提高乳腺癌保乳率,为不可手术乳腺癌创造手术机会[27-29]。在本研究中,所有患者在新辅助化疗后,均采用的是改良根治性手术,主要是基于乳腺癌新辅助化疗后存在一些不确定性的问题,而采取的相对保守的手术方式。其一是新辅助化疗后肿瘤退缩模式的不确定性[30-31]。新辅助化疗后,肿瘤可以是向心性退缩,或者是筛状退缩。对于向心性退缩,根据新辅助化疗后的范围来行保乳手术是安全可行的;但是对于筛状退缩的肿瘤,必须根据新辅助化疗前的范围来进行手术,保乳不可行。由于不能在手术前完全准确的评估新辅助化疗后肿瘤的退缩模式,故本中心对于局部晚期的乳腺癌患者,均采取了乳房切除术,而不是保乳手术。其二,对于新辅助化疗后的乳腺癌患者,特别是化疗前腋窝淋巴结阳性的,新辅助化疗后腋窝淋巴结不再能被临床发现,是否可行前哨淋巴结活检也存在很多争议[32],故本中心的采取相对保守的手术方式,直接行腋窝淋巴结清扫。
本研究的不足之处主要有以下几点。第一,这是一个回顾性的临床研究,虽然本研究使用了倾向性评分匹配的方法降低减少误差,但不可避免的存在偏倚。第二,本研究的样本量较小,各组均48例,期待后续能继续入组更多患者,获取更多数据以夯实相关结果。第三,乳腺癌新辅助化疗的作用之一是为了降低乳房癌分期,进行保乳手术。但是在本研究中,所有入组的患者均行改良根治手术,无法评估新辅助化疗是否能给患者带来手术方式的改变。
综上所述,紫杉醇脂质体的剂量密集化疗方案与多西紫杉醇化疗方案相比,具有相当或是可能更优的抗肿瘤作用。紫杉醇脂质体的剂量密集方案降低了严重的血液学毒性及消化道毒副反应,一定程度上保证了患者对化疗的依从性,保证化疗规律足量的完成。因此,在乳腺癌剂量密集化疗方案中,紫杉醇脂质体因其良好的抗肿瘤疗效及较轻的不良反应,应成为乳腺癌化疗方案中紫杉醇类药物的优选。有必要进一步针对紫杉醇脂质体开展乳腺癌前瞻性新辅助化疗的临床研究。
[1]陈强,张其忠,刘健,等.紫杉醇脂质体与传统紫杉醇治疗乳腺癌和非小细胞肺癌的随机对照研究[J].中华肿瘤杂志,2003,25(2):190-192.doi:10.3760/j.issn:0253-3766.2003.02.027.
Chen Q,Zhang QZ,Liu J,et al.Multi-center prospective randomized trial on paclitaxel liposome and traditional taxol in the treatment of breast cancer and non-small-cell lung cancer[J].Chinese Journal of Oncology,2003,25(2):190-192.doi:10.3760/j.issn:0253-3766.2003.02.027.
[2]Liu SL,Sun XS,Li XY,et al.Liposomal paclitaxel versus docetaxel in induction chemotherapy using Taxanes,cisplatin and 5-fluorouracil for locally advanced nasopharyngeal carcinoma[J].BMC Cancer,2018,18(1):1279.doi:10.1186/s12885-018-5192-x.
[3]Alavi M,Hamidi M.Passive and active targeting in cancer therapy by liposomes and lipid nanoparticles[J].Drug Metab Pers Ther,2019,34(1):/j/dmdi.2019.34.issue-1/dmpt-2018-0032/dmpt-2018-0032.xml.doi:10.1515/dmpt-2018-0032.
[4]Roque MC,Franco MS,Vilela JMC,et al.Development of Long-Circulating and Fusogenic Liposomes Co-encapsulating Paclitaxel and Doxorubicin in Synergistic Ratio for the Treatment of Breast Cancer[J].Curr Drug Deliv,2019,16(9):829-838.doi:10.2174/156 7201816666191016112717.
[5]Franco MS,Roque MC,de Barros ALB,et al.Investigation of the antitumor activity and toxicity of long-circulating and fusogenic liposomes co-encapsulating paclitaxel and doxorubicin in a murine breast cancer animal model[J].Biomed Pharmacother,2019,109:1728-1739.doi:10.1016/j.biopha.2018.11.011.
[6]蔡耿喜,蔡子杰,陈前军,等.乳腺癌新辅助化疗的现状与进展——南方乳腺癌论坛主要议题与共识[J].中国普通外科杂志,2019,28(11):1309-1321.doi:10.7659/j.issn.1005-6947.2019.11.001.
Cai GX,Cai ZJ,Chen QJ,et al.Current status and development of chemotherapy of breast cancer:the main topics and agreements of China South Breast Cancer Symposium[J].Chinese Journal of General Surgery,2019,28(11):1309-1321.doi:10.7659/j.issn.1005-6947.2019.11.001.
[7]Early Breast Cancer Trialists' Collaborative Group(EBCTCG).Long-term outcomes for neoadjuvant versus adjuvant chemotherapy in early breast cancer:meta-analysis of individual patient data from ten randomised trials[J].Lancet Oncol,2018,19(1):27-39.doi:10.1016/S1470-2045(17)30777-5.
[8]Sparano JA,Wang M,Martino S,et al.Weekly paclitaxel in the adjuvant treatment of breast cancer[J].N Engl J Med,2008,358(16):1663-1671.doi:10.1056/NEJMoa0707056.
[9]Pathak M,Dwivedi SN,Deo SVS,et al.Neoadjuvant chemotherapy regimens in treatment of breast cancer:a systematic review and network meta-analysis protocol[J].Syst Rev,2018,7(1):89.doi:10.1186/s13643-018-0754-1.
[10]Reinisch M,Ataseven B,Kümmel S.Neoadjuvant Dose-Dense and Dose-Intensified Chemotherapy in Breast Cancer - Review of the Literature[J].Breast Care(Basel),2016,11(1):13-20.doi:10.1159/000444543.
[11]Blondeaux E,Poggio F,Del Mastro L.Role of dose-dense chemotherapy in high-risk early breast cancer[J].Curr Opin Oncol,2019,31(6):480-485.doi:10.1097/CCO.0000000000000571.
[12]Schneeweiss A,Möbus V,Tesch H,et al.Intense dose-dense epirubicin,paclitaxel,cyclophosphamide versus weekly paclitaxel,liposomal doxorubicin(plus carboplatin in triple-negative breast cancer)for neoadjuvant treatment of high-risk early breast cancer(GeparOcto-GBG 84):A randomised phase III trial[J].Eur J Cancer,2019,106:181-192.doi:10.1016/j.ejca.2018.10.015.
[13]Bi Z,Chen P,Liu YB,et al.Efficacy and safety analysis of paclitaxel,docetaxel and liposomal paclitaxel after neoadjuvant therapy in breast cancer[J].Breast Cancer Res Treat,2020,184(2):397-405.doi:10.1007/s10549-020-05851-8.
[14]Zong Y,Wu J,Shen K.et al.Nanoparticle albumin-bound paclitaxel as neoadjuvant chemotherapy of breast cancer:a systematic review and meta-analysis[J].Oncotarget,2017,8(10):17360-17372.doi:10.18632/oncotarget.14477.
[15]Gianni L,Mansutti M,Anton A,et al.Comparing Neoadjuvant Nab-paclitaxel vs Paclitaxel Both Followed by Anthracycline Regimens in Women With ERBB2/HER2-Negative Breast Cancer-The Evaluating Treatment With Neoadjuvant Abraxane(ETNA)Trial:A Randomized Phase 3 Clinical Trial[J].JAMA Oncol,2018,4(3):302-308.doi:10.1001/jamaoncol.2017.4612.
[16]Wang H,Cheng G,Du Y,et al.Hypersensitivity reaction studies of a polyethoxylated castor oil-free,liposome-based alternative paclitaxel formulation[J].Mol Med Rep,2013,7(3):947-952.doi:10.3892/mmr.2013.1264.
[17]Ruttala HB,Ko YT.Liposome encapsulated albumin-paclitaxel nanoparticle for enhanced antitumor efficacy[J].Pharm Res,2015,32(3):1002-1016.doi:10.1007/s11095-014-1512-2.
[18]Okamoto Y,Taguchi K,Sakuragi M,et al.Preparation,Characterization,and in Vitro/in Vivo Evaluation of Paclitaxel-Bound Albumin-Encapsulated Liposomes for the Treatment of Pancreatic Cancer[J].ACS Omega,2019,4(5):8693-8700.doi:10.1021/acsomega.9b00537.
[19]苏薇,张晟,李春艳,等.紫杉醇脂质体和多西紫杉醇在乳腺癌新辅助化疗中的应用效果及安全性[J].中华肿瘤杂志2015,37(5):379-382.doi:10.3760/cma.j.issn.0253-3766.2015.05.014.
Su W,Zhang S,Li CY,et al.Efficacy and safety analysis of paclitaxel liposome and docetaxel for the neoadjuvant chemotherapy of breast cancer[J].Chinese Journal of Oncology,2015,37(5):379-382.doi:10.3760/cma.j.issn.0253-3766.2015.05.014.
[20]Li X,Kwon H.Efficacy and Safety of Nanoparticle Albumin-Bound Paclitaxel in Elderly Patients with Metastatic Breast Cancer:A Meta-Analysis[J].J Clin Med,2019,8(10):1689.doi:10.3390/jcm8101689.
[21]Ross M,Geyer CE Jr.Nab-Paclitaxel:A New Standard of Care in Neoadjuvant Therapy of High-Risk Early Breast Cancer?[J].J Clin Oncol,2019,37(25):2196-2200.doi:10.1200/JCO.19.00877.
[22]de Almeida FK,Rosa DD.Adjuvant Dose-Dense Chemotherapy for Breast Cancer:Available Evidence and Recent Updates[J].Breast Care(Basel),2018,13(6):447-452.doi:10.1159/000488026.
[23]Untch M,Möbus V,Kuhn W,et al.Intensive dose-dense compared with conventionally scheduled preoperative chemotherapy for highrisk primary breast cancer[J].J Clin Oncol.2009,27(18):2938-2945.doi:10.1200/JCO.2008.20.3133.
[24]Green MC,Buzdar AU,Smith T,et al.Weekly paclitaxel improves pathologic complete remission in operable breast cancer when compared with paclitaxel once every 3 weeks[J].J Clin Oncol,2005,23(25):5983-5992.doi:10.1200/JCO.2005.06.232.
[25]Baldini E,Gardin G,Giannessi PG,et al.Accelerated versus standard cyclophosphamide,epirubicin and 5-fluorouracil or cyclophosphamide,methotrexate and 5-fluorouracil:a randomized phase III trial in locally advanced breast cancer[J].Ann Oncol,2003,14(2):227-232.doi:10.1093/annonc/mdg069.
[26]Walker LG,Eremin JM,Aloysius MM,et al.Effects on quality of life,anti-cancer responses,breast conserving surgery and survival with neoadjuvant docetaxel:a randomised study of sequential weekly versus three-weekly docetaxel following neoadjuvant doxorubicin and cyclophosphamide in women with primary breast cancer[J].BMC Cancer,2011,11:179.doi:10.1186/1471-2407-11-179.
[27]Derks MGM,van de Velde CJH.Neoadjuvant chemotherapy in breast cancer:more than just downsizing[J].Lancet Oncol,2018,19(1):2-3.doi:10.1016/S1470-2045(17)30914-2.
[28]Hamdy O.Neoadjuvant Therapy Should Be the Standard of Care for Every Node Positive Breast Cancer Patient[J].J Breast Cancer,2018,22(1):149-152.doi:10.4048/jbc.2019.22.e3.
[29]Man VC,Cheung PS.Neoadjuvant chemotherapy increases rates of breast-conserving surgery in early operable breast cancer[J].Hong Kong Med J,2017,23(3):251-257.doi:10.12809/hkmj164972.
[30]Ballesio L,Gigli S,Di Pastena F,et al.Magnetic resonance imaging tumor regression shrinkage patterns after neoadjuvant chemotherapy in patients with locally advanced breast cancer:Correlation with tumor biological subtypes and pathological response after therapy[J].Tumour Biol,2017,39(3):1010428317694540.doi:10.1177/1010428317694540.
[31]Fukada I,Araki K,Kobayashi K,et al.Pattern of Tumor Shrinkage during Neoadjuvant Chemotherapy Is Associated with Prognosis in Low-Grade Luminal Early Breast Cancer[J].Radiology,2018,286(1):49-57.doi:10.1148/radiol.2017161548.
[32]Racz JM,Caudle AS.Sentinel Node Lymph Node Surgery After Neoadjuvant Therapy:Principles and Techniques[J].Ann Surg Oncol,2019,26(10):3040-3045.doi:10.1245/s10434-019-07591-6.
