胰腺癌是消化系统中最严重的恶性肿瘤之一,具有早期不易发现、预后较差等临床特点,流行病学调查显示,其发病率和病死率呈逐年上升趋势,目前临床上对于胰腺癌患者首选有效治疗手段为手术治疗[1-3]。胰十二指肠切除术(pancreaticoduodenectomy,PD)是目前外科手段治疗胰腺恶性肿瘤最有效的手术方法,也是普通外科学里难度较大的手术之一。该类手术创伤大、并发症多,预后一般较差[4-5]。因此,如何降低PD的并发症发生率、提高患者术后恢复成为外科医生关注的热点。近年,随着临床医疗技术的巨大进步,微创手术逐渐兴起,PD的效果获得了较为显著的提高。本研究选取我院达芬奇机器人辅助下PD(robotic pancreaticoduodenectomy,RPD)患者的临床资料,与同期行腹腔镜P D(laparoscopic pancreaticoduodenectomy,LPD)患者进行围术期指标的比较,探讨达芬奇机器人手术系统在PD治疗中的实用性及应用价值。
1 资料与方法
1.1 一般资料
回顾性分析2016年1月—2019年5月收治于我院普同外科行微创PD治疗的61例原发性胰腺癌患者临床资料。其中24例行RPD(RPD组),37例行LPD(LPD组),术前均已充分告知患者及其家属机器人及腹腔镜手术的相关情况,征得同意后签署知情同意书。其中,纳入标准:⑴ 术前影像学检查发现胰腺占位性病变,术后病理确诊为胰腺癌;⑵ 无局部淋巴结转移和远处转移;⑶ 心、肺等重要脏器功能良好,无绝对手术禁忌证;⑷ 临床资料完整可靠。排除标准:⑴ 合并认知功能障碍,难以配合者;⑵ 术前接受放疗者或新辅助化疗者;⑶ 合并有其他脏器功能不全等严重影响生活质量的恶性肿瘤。本研究经本院医学伦理委员会审核批准,所选患者均自愿参加本研究,同意配合完成术后生活质量调查与随访,且已签署知情同意书。
1.2 术前准备
所有纳入患者术前均按我院常规术前准备处理,合并营养不良患者术前给予肠内外营养支持,维持患者水、电解质及酸碱平衡。
1.3 手术方法
1.3.1 RPD 组 麻醉及手术方法:⑴ 体位与麻醉:患者取头高脚低30°仰卧位,气管插管下全身麻醉后安装好机器人装置。⑵ 探查:常规先探查腹腔、肝脏及胰周围淋巴结有无转移,再探查肿瘤与门静脉、肝动脉、肠系膜上动脉之间的关系;⑶ 手术路径:初步探查完成后先分离胃结肠韧带、肝胃韧带、显露肝总动脉、肝动脉及胃十二指肠动脉,并结扎切断胃十二指肠动脉,再分离胰头与结肠肝曲区域,向左至肠系膜上静脉、肝静脉及门静脉区域,结扎Helen 干,沿胰颈部后方,门静脉前“隧道”分离胰颈部疏松组织,沿Kocher 切口弧形分离十二指肠,直至腔静脉左侧缘;沿胆囊底部逆行分离至胆囊管与胆总管汇合处,于胆囊管汇合处上约0.5 cm 处横断肝总管,将胆囊及胆总管整体由上向下分离至胰腺上缘,贯通“隧道”,用超声刀逐次切断胰颈部,切除时注意辨别主胰管位置并标识,于胃远端离幽门口约0.5 cm 处横断胃,离屈氏韧带远端15 cm 左右处切断空肠,并将离断的空肠分离后从肠系膜根部肠系膜上动脉后方拉置右侧,然后由下往上逐次分离切除胰腺钩突部组织,此时整个标本已顺利切除。此后按Child 法依次行胰-肠、胆-肠、胃-肠吻合重建消化道,并于上腹部剑突下开一约5.0 cm 的切口取出标本,于胰-肠吻合口处及小网膜囊处各留置1 根较粗的引流管,术毕(图1)。⑷ 术后处理:术后均予以对症支持处理及相关的营养支持治疗[6]。
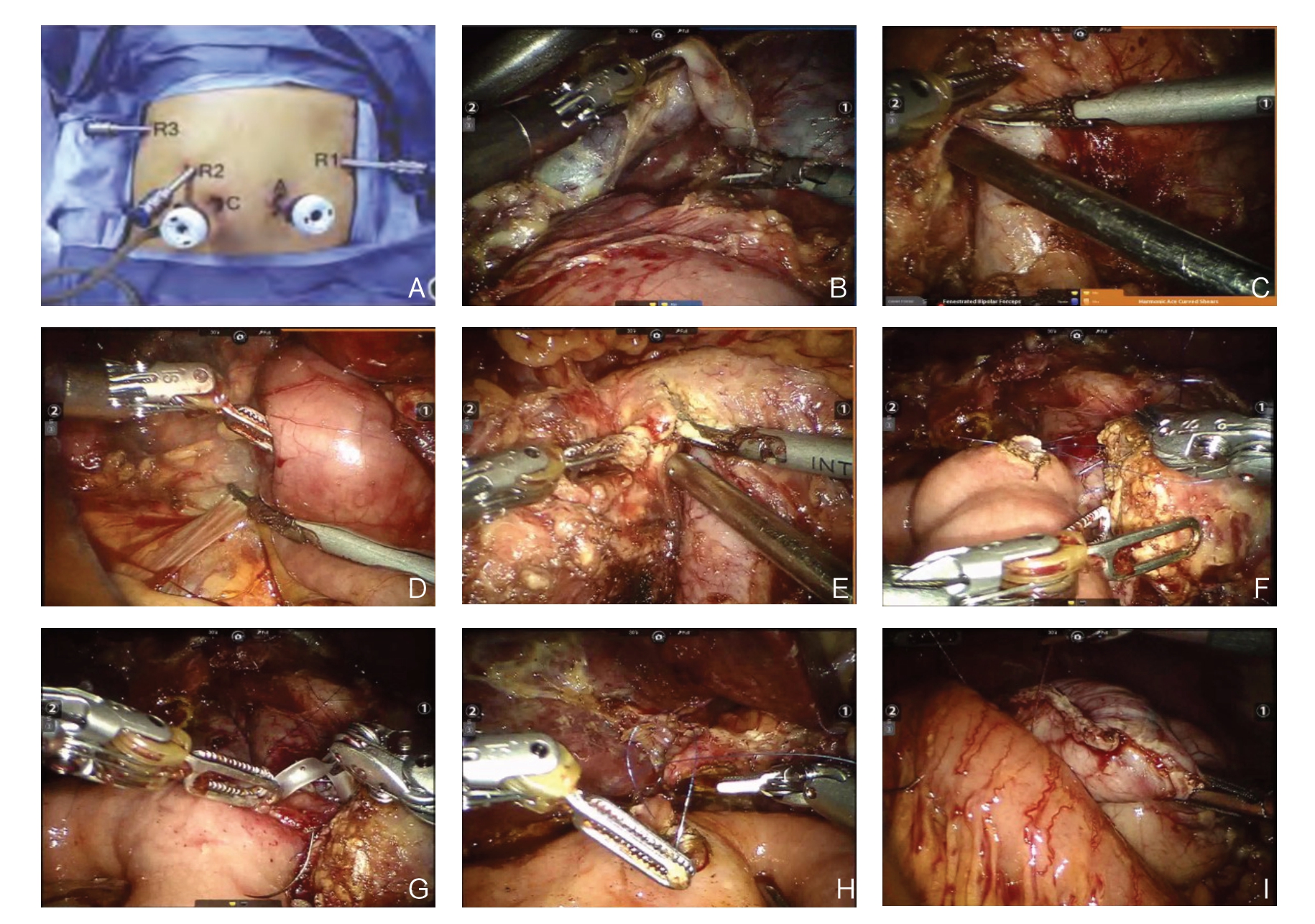
图1 RPD手术操作步骤 A:机器人Trocar位置;B:解剖游离胆囊管;C:探查胰腺下缘,游离肠系膜血管;D:打开Kocher切口,游离十二指肠;E:离断胰颈部;F:胰管对空肠黏膜端侧吻合;G:胰空肠留置支撑管;H:胆-肠吻合;I:胃-肠吻合
Figure 1 procedure of robotic pancreaticoduodenectomy A: Trocar positions for robot-assisted PD; B: Dissection and isolation of the cystic duct; C: Exploration of the lower margin of the pancreas and dissociation of the mesenteric vessels; D: Opening the Kocher's incision and isolating the duodenum; E: Division of the pancreatic neck; F: End-to-side anastomosis between the pancreatic duct and jejunal mucosa; G: Placement of supporting tubes; H: Bilioenteric anastomosis; I: Gastrointestinal anastomosis
1.3.2 LPD 组 RPD 组与LPD 组围术期准备及麻醉方法相同,麻醉后,患者取仰卧位,常规消毒铺单,置入Trocar 建立观察孔,探查腹腔肝脏及周围淋巴结,打开胃结肠韧带,进入网膜囊,切断胃右动脉及胃十二指肠,解剖肝十二指肠韧带;行Kocher 切口,游离胰腺下缘,分离肠系膜上静脉,悬吊胰颈;切断胃远端,分离Treitz 韧带及十二指肠水平段,后断离空肠,肠系膜血管后方拖出十二指肠和近端空肠;切除胰头后方组织及胰腺钩突部,切断胰颈部,近端断离胆总管,完成PD 后行消化道重建[6],消化道化道重建同RPD,蒸馏水及温盐水冲洗腹腔,常规放置腹腔引流管,逐层关腹,结束手术,术后处理同RPD。
1.4 观察指标
术中:手术时间、术中出血量、淋巴结清扫数,保脾情况;术后:24 h伤口引流量、肛门排气时间、术后下床时间、开始进流食天数、术后拔除引流管时间、术后住院时间、术后疼痛评分、术后总并发症发生率以及围术期费用进行比较。其中手术时间为麻醉成功后至手术结束后所需时间。
1.5 统计学处理
采用SPSS 22.0进行统计分析。比较两组样本前,采用Shapiro-W i l k 检验判断样本分布的正态性,若分布符合正态分布则采用均值±标准差(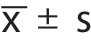 )描述,组间比较采用独立样本t 检验;若分布不符合正态分布,则采用中位数(四分位数间距)[M(Q R)]描述,组间比较采用Mann-Whitney U检验。计数资料用例(百分比)[n(%)]表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为有统计学意义。
)描述,组间比较采用独立样本t 检验;若分布不符合正态分布,则采用中位数(四分位数间距)[M(Q R)]描述,组间比较采用Mann-Whitney U检验。计数资料用例(百分比)[n(%)]表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为有统计学意义。
2 结 果
2.1 术前一般资料
两组患者一般情况对比研究,RPD组24例,LPD组37例,统计检验分析,两组患者性别、年龄、BMI、肿瘤分期、伴随其他疾病(糖尿病、高血压及其他心脑血管疾病)、CA19-9水平等情况均无统计学差异(均P>0.05)(表1)。
2.2 两组术中情况
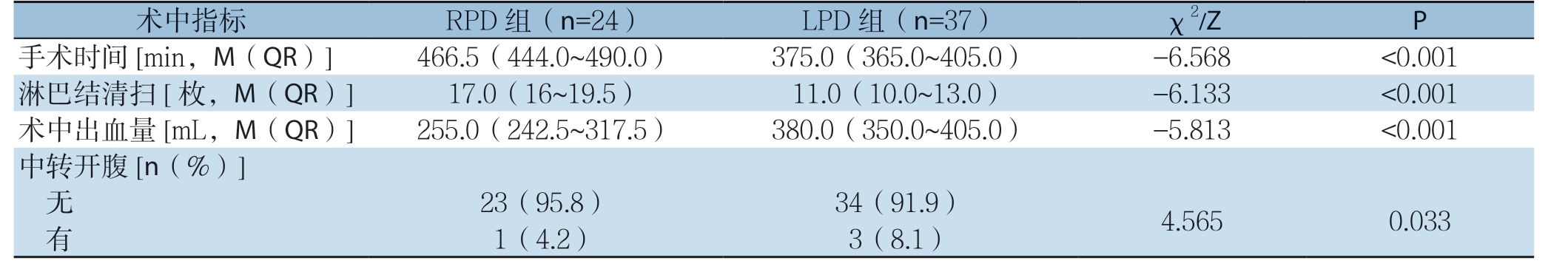
RPD 组1例中转开腹手术,LPD 组3 例,RPD组中转开腹比例较LPD组低(4.2% vs.8.1%,χ2=4.5 6 5,P=0.033)。RPD组手术时间长于LPD组(Z=-6.568,P<0.001);RPD组术中出血量小于LPD组(Z=-5.813,P<0.001);RPD组术中淋巴结清扫个数多于LPD组(Z=-6.133,P<0.001)(表2)。
表1 两组术前一般资料比较
Table 1 Comparison of the preoperative general data between the two groups

资料 RPD 组(n=24) LPD 组(n=37) χ2/Z/t P性别[n(%)]男女 11 31((54 45..28)) 21 07((54 45..19)) <0.001 0.993年BM龄I [(kg岁/m,2,x±M(s)Q R)] 20.0(64 1.0 8±.8~92.4 1.9) 20.4(61 1.0 9±.2~92.6 1.4) -10.1.5 837 2 0 0..52945肿瘤分期[n(%)]II~II I~I I期V期 11 13((45 54..82)) 11 98((54 18..46)) 0.177 0.674伴随其他疾病[n(%)]无有 177((2790..28)) 21 61((72 09..37)) 0.002 0.962 CA19-9[U/mL,n(%)]≤>22 77 11 13((45 54..82)) 12 61((45 36..28)) 0.04 0.842
表2 两组术中指标比较
Table 2 Comparison of intraoperative variables between the two groups
2.3 两组术后情况
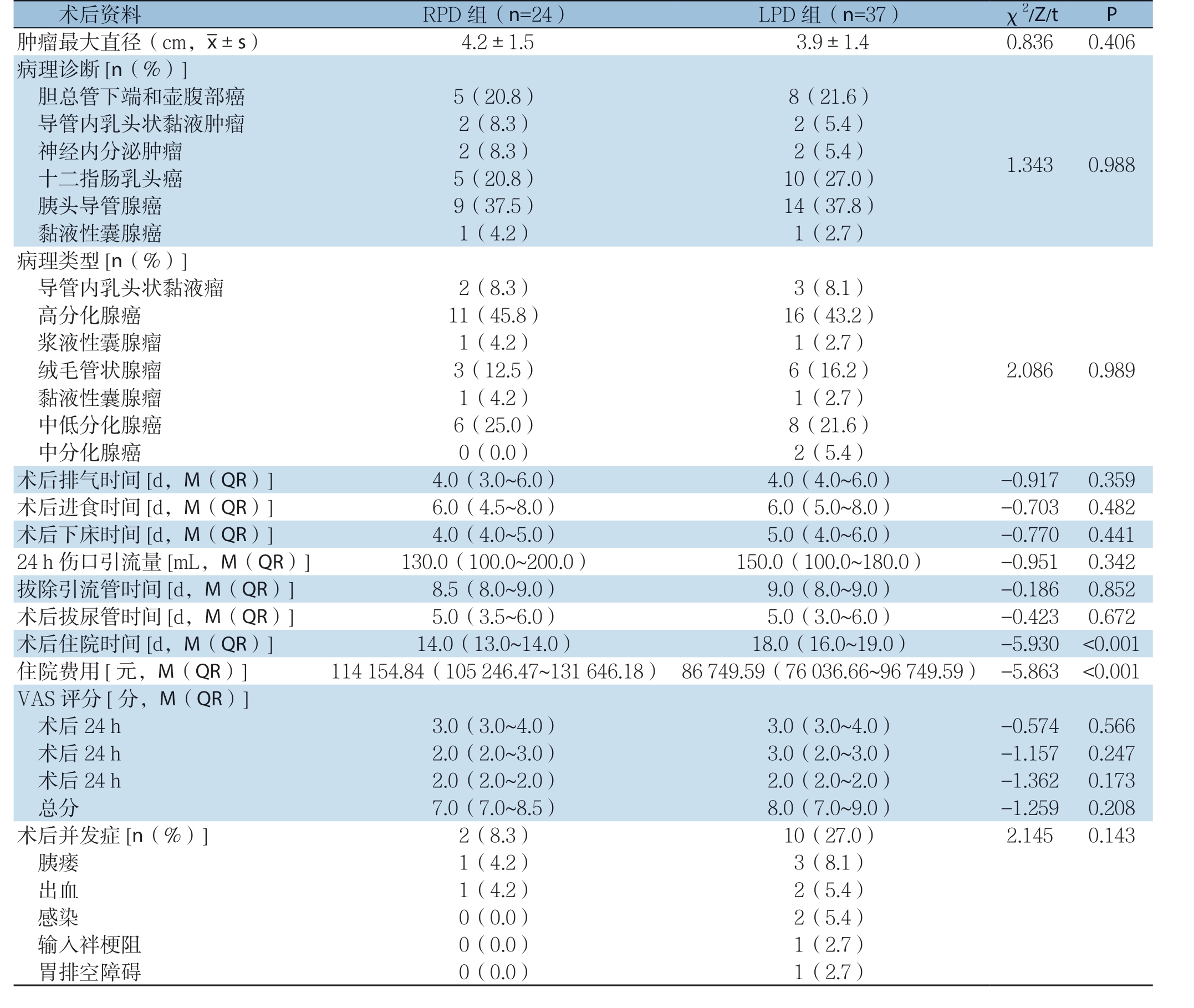
两组患者术后病理回报切缘均为阴性,两组术后病理情况无统计学差异(均P >0.05)。两组患者术后24 h引流量、肛门首次排气时间、术后进食时间、下床时间、术后拔尿管时间及术后拔伤口引流管时间差异均无统计学意义(均P >0.05);RPD 组的住院花费多于LPD 组(Z=-5.863,P<0.001),但RPD组的患者术后住院时间短于LPD组(Z=-5.930,P<0.001);两组患者术前均给予同样的疼痛知识宣教并发放指导手册,于手术前1 d访视患者并教授其充分了解视觉模拟评分系统(VAS)评分方法,并签署知情同意书,两组患者术后疼痛评估采用VAS描述,分别于手术结束后24、48、72 h在咳嗽时疼痛评估。术后24、48、72 h内,两组VAS评分差异无统计学意义(均P>0.05),但RPD组VAS评分略低于LPD 组;两组患者术后胰瘘(B 级及以上)、出血、输入袢梗阻、胃排空障碍、感染(伤口感染、肺部感染、消化道感染)等术后并发症发生率差异均无统计学意义(均P>0.05)。RPD组1例术后出现C级胰瘘,LPD组3例术后出现胰瘘(2例B级、1例C级),其中LPD组1例C级胰瘘再次手术引流后治愈,其余胰瘘均经保守治疗后治愈出院;RPD组共1例发生消化道出血,LPD组共2例出血消化道出血,两组经保守治疗后,均获治愈出院;LPD组2例患者术后出现感染(1例肺部感染、1例伤口感染),经合理抗生素治疗后,均治愈出院;LPD组1例输入袢梗阻,经再次手术治疗后康复出院;LPD组胃排空障碍1例,经保守治疗后治愈出院,两组患者围术期均无死亡(表3)。
表3 两组术后指标比较
Table 3 Comparison of postoperative variables between the two groups
2.4 随访情况
两组患者术后中位随访22个月,7例失访,24例行RPD手术患者随访成功21例,37例行LPD术患者随访成功33例。两组患者3年生存率无统计学差异(20.8% vs.24.3%,P>0.05),RPD组患者14(58.3%)例患者出现肿瘤远处转移,LPD组患者25(64.9%)例出现远处转移。
3 讨 论
1994年Gagner等[7]首次报道的LPD开启了微创PD的大门;自此,微创PD逐渐兴起,临床效果获得了较为显著的提高。目前腹腔镜技术在我国得到了普遍应用,凭借其创伤小、住院时间短、恢复快等优点,受到了外科医生的普遍认可[5, 8-9]。2003年Giulianotti等[10]首次报道的RPD开启了微创PD的高科技大门,但由于PD手术的复杂性,达芬奇机器人的稀缺性,微创PD进展仍缓慢。近几年来,随着腹腔镜胰腺外科手术经验的不断积累,高清腹腔镜和能量手术器械的普及,达芬奇机器人装机容量的扩展,LPD和RPD得到了快速发展,两者的出现改变了传统的手术操作模式,将外科微创手术带入新纪元[11-13]。达芬奇机器人手术系统在外科的应用逐渐增多,其相对于传统腹腔镜手术更具优势,如具有高分辨率的3D术野、高稳定性的手术操作机械臂等,可以让患者更多获益,但RPD是否真的可以让患者获益更多仍具争议[14]。
P D 术过程复杂,需要更加灵巧、稳定、精确的视野和操作。由于传统腹腔镜二维视野,器械的灵活性差,使医生因体位不适、有时需反向操作等,导致手术难度增大,风险增加,但达芬奇机器人技术能够克服许多传统腹腔镜技术的缺点,如放大倍数较高,清晰的三维成像系统,使外科医师对解剖结构能够进行更精确的辨认;机械臂可滤除人手在操作过程中的细微震颤;7个方向自由度的仿真手腕模仿人手在腹腔内操作;医师操作台为外科医师提供更舒适的位置。有研究[15-19]表明,上述优势能够弥补传统腹腔镜的缺陷。
本研究通过对比发现RPD组患者术中出血量和术后住院时间小于LPD组,以及中转开腹的比例均低于LPD组,淋巴结清扫数目均高于LPD组,以上这些优势可能与达芬奇机器人手术系统的高倍清晰视觉效果可以帮助术者更加清晰地辨别精细解剖结构,术者通过遥控端操作腹腔内手术器械,过滤了手部震颤,从而使灵活的器械臂对血管和组织的解剖及结扎等操作更精确有关,说明达芬奇机器人能够有效提高PD手术质量,与国外有关文献报道相似[20-22]。
本研究中,RPD组手术时间较传统腹腔镜手术组显著延长,这主要与机器人系统安装机械臂需花费额外时间以及操作医师的前期熟练程度有关。RPD组手术费用显著高于LPD手术组,可能与目前机器人手术系统整套设备依靠进口,价格较昂贵,且手术及耗材费用高所致[14]。由于我国人口众多,医疗条件相对落后,患者需自付机器人手术治疗费用,机器人手术系统的应用受到了限制,绝大部分患者无法应用这种技术。但相信随着国产自主研发的机器人手术系统的上市,围术期的相关费用会逐渐下降,使更多的患者有能力接受机器人手术系统的治疗。另外,两组患者术后24 h引流伤口引流量、肛门排气时间、术后进食时间、下床时间、术后拔尿管时间、术后拔引流管时间、术后72 h疼痛评估以及术后总并发症发生率差异均无统计学意义(均P>0.05),与国外研究基本一致[22-24]。因此可以认为在上述围术期指标上机器人手术能够获得与腹腔镜手术相同的效果。
近10 余年来,加速康复外科(enhanced recovery after surgery,ERAS)的理念及其路径在我国有了较为迅速的普及和应用。ERAS的临床实践表明,其理念及相关路径的实施必须以循证医学及多学科合作为基础,既要体现以加速康复为主要目的核心理念,也要兼顾患者基础疾病、手术类别、围手术期并发症等具体情况,更需要开展深入的临床研究以论证ERAS相关路径的安全性、可行性及必要性[25-26]。ERAS理念核心在于手术的精细化、微创化、减少应激和创伤[27]。微创手术通过减小创口和术后炎症因子的释放,降低神经体液激活,可使患者应激反应降低,与加速康复外科理念相得益彰。ERAS与微创外科是引领21世纪现代外科前进的两个重要发展方向[28]。本研究中,无论是LPD还是RPD,其在ERAS方面均有重要价值。但与LPD相比,RPD更符合精细化的理念。
综上所述,与传统腹腔镜手术相比,达芬奇机器人辅助P D 具有术中出血少、淋巴结清扫更彻底、中转开腹比例低及术后住院天数少等优势,在PD术中值得推广。但手术时间长、手术费用高,这些暂时阻碍了机器人手术系统的广泛普及。相信随着技术的进步,机器人微创手术系统今后必将造福更多患者。该研究的局限性在于纳入的病例数目较少,且回顾性研究存在很多不确定干扰因素,这必定会导致该研究的结果参考价值欠佳,故仍需要扩大样本量、多中心合作进一步前瞻性随机对照去验证两者的近远期预后。
[1] Pindak D, Tomas M, Dolnik J, et al.Morbidity, mortality and long term survival in patients with vascular resection in pancreatic cancer-single center experience[J].Neoplasma, 2017, 64(3):460-463.doi: 10.4149/neo_2017_318.
[2] Mierke F, Hempel S, Distler M, et al.Impact of Portal Vein Involvement from Pancreatic Cancer on Metastatic Pattern After Surgical Resection[J].Ann Surg Oncol, 2016, 23(Suppl 5):730-736.doi: 10.1245/s10434-016-5515-6.
[3] Tempero MA, Malafa MP, Al-Hawary M, et al.Pancreatic Adenocarcinoma, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr Canc Netw, 2017 15(8):1028-1061.doi: 10.6004/jnccn.2017.0131.
[4] Diringer MN, Zazulia AR.Aneurysmal Subarachnoid Hemorrhage:Strategies for Preventing Vasospasm in the Intensive Care Unit[J[.Semin Respir Crit Care Med, 2017, 38(6):760-767.doi: 10.1055/s-0037-1607990.
[5] Wang M, Cai Y, Li Y, et al.Robotic Pancreaticoduodenectomy:Single-Surgeon Initial Experience[J].Indian J Surg, 2018, 80(1):42-47.doi: 10.1007/s12262-016-1555-1.
[6] 胡海, 余枭, 胡桂, 等.机器人辅助下胰十二指肠切除术: 附18例报告[J].中国普通外科杂志, 2019, 28(3):260-266.doi:10.7659/j.issn.1005-6947.2019.03.002.Hu H, Yu X, Hu G, et al.Performance experiences in roboticassisted pancreaticoduodenectomy: a report of 18 cases[J].Chinese Journal of General Surgery, 2019, 28(3):260-266.doi:10.7659/j.issn.1005-6947.2019.03.002.
[7] Gagner M, Pomp A.Laparoscopic pylorus-preserving pancreatoduodenectomy[J].Surg Endosc, 1994, 8(5):408-410.
[8] Croome KP, Farnell MB, Que FG, et al.Pancreaticoduodenectomy with major vascular resection: a comparison of laparoscopic versus open approaches[J].J Gastrointest Surg, 2015, 19(1):189-194.doi:10.1007/s11605-014-2644-8.
[9] Song KB, Kim SC, Hwang DW, et al.Matched Case-Control Analysis Comparing Laparoscopic and Open Pylorus-preserving Pancreaticoduodenectomy in Patients With Periampullary Tumors[J].Ann Surg, 2015, 262(1):146-155.doi: 10.1097/SLA.0000000000001079.
[10] Giulianotti PC, Coratti A, Angelini M, et al.Robotics in general surgery: personal experience in a large community hospital[J].Arch Surg, 2003, 138(7):777-784.doi: 10.1001/archsurg.138.7.777.
[11] Nassour I, Wang SC, Christie A, et al.Minimally Invasive Versus Open Pancreaticoduodenectomy: A Propensity-matched Study From a National Cohort of Patients[J].Ann Surg, 2018, 268(1):151-157.doi: 10.1097/SLA.0000000000002259.
[12] Peng L, Lin S, Li Y, et al.Systematic review and meta-analysis of robotic versus open pancreaticoduodenectomy[J].Surg Endosc,2017, 31(8):3085-3097.doi: 10.1007/s00464-016-5371-2.
[13] Walsh RM, Chalikonda S.How I Do It: Hybrid Laparoscopic and Robotic Pancreaticoduodenectomy[J].J Gastrointest Surg, 2016,20(9):1650-1657.doi: 10.1007/s11605-016-3170-7.
[14] Baker E H, Ross S W, Seshadri R, et al.Robotic pancreaticoduodenectomy for pancreatic adenocarcinoma: role in 2014 and beyond[J].J Gastrointest Oncol, 2015, 6(4):396-405.doi:10.3978/j.issn.2078-6891.2015.027.
[15] Doula C, Kostakis ID, Damaskos C, et al.Comparison Between Minimally Invasive and Open Pancreaticoduodenectomy: A Systematic Review[J].Surg Laparosc Endosc Percutan Tech, 2016,26(1):6-16.doi: 10.1097/SLE.0000000000000228.
[16] Lai EC, Yang GP, Tang CN.Robot-assisted laparoscopic pancreaticoduodenectomy versus open pancreaticoduodenectomy--a comparative study[J].Int J Surg, 2012, 10(9):475-479.doi:10.1016/j.ijsu.2012.06.003.
[17] Buchs NC, Addeo P, Bianco FM, et al.Robotic versus open pancreaticoduodenectomy: a comparative study at a single institution[J].World J Surg, 2011, 35(12):2739-2746.doi: 10.1007/s00268-011-1276-3.
[18] Kim HI, Park MS, Song KJ, et al.Rapid and safe learning of robotic gastrectomy for gastric cancer: multidimensional analysis in a comparison with laparoscopic gastrectomy[J].Eur J Surg Oncol,2014, 40(10):1346-1354.doi: 10.1016/j.ejso.2013.09.011.
[19] Kim YM, Son T, Kim HI, et al.Robotic D2 Lymph Node Dissection During Distal Subtotal Gastrectomy for Gastric Cancer: Toward Procedural Standardization[J].Ann Surg Oncol, 2016, 23(8):2409-2410.doi: 10.1245/s10434-016-5166-7.
[20] Boone BA, Zenati M, Hogg ME, et al.Assessment of quality outcomes for robotic pancreaticoduodenectomy: identification of the learning curve[J].JAMA Surg, 2015, 150(5):416-422.doi:10.1001/jamasurg.2015.17.
[21] Liu R, Zhang T, Zhao ZM, et al.The surgical outcomes of robotassisted laparoscopic pancreaticoduodenectomy versus laparoscopic pancreaticoduodenectomy for periampullary neoplasms: a comparative study of a single center[J].Surg Endosc, 2017,31(6):2380-2386.doi: 10.1007/s00464-016-5238-6.
[22] Zureikat AH, Postlewait LM, Liu Y, et al.A Multi-institutional Comparison of Perioperative Outcomes of Robotic and Open Pancreaticoduodenectomy[J].Ann Surg, 2016, 264(4):640-649.doi:10.1097/SLA.0000000000001869.
[23] Chen S, Zhan Q, Chen JZ, et al.Robotic approach improves spleen-preserving rate and shortens postoperative hospital stay of laparoscopic distal pancreatectomy: a matched cohort study[J].Surg Endosc, 2015, 29(12):3507-3518.doi: 10.1007/s00464-015-4101-5.
[24] Lai EC, Tang CN.Robotic distal pancreatectomy versus conventional laparoscopic distal pancreatectomy: a comparative study for short-term outcomes[J].Front Med, 2015, 9(3):356-360.doi: 10.1007/s11684-015-0404-0.
[25] 中华医学会外科学分会, 中华医学会麻醉学分会.加速康复外科中国专家共识及路径管理指南(2018版)[J].中国实用外科杂志, 2018, 38(1):1-20.doi: 10.19538/j.cjps.issn1005-2208-2018.01.01.Society of Surgery of Chinese Medical Association, Society of Anesthesiology of Chinese Medical Association.Chinese expert consensus on and guidelines for pathway management of enhanced recovery after surgery (2018 edition)[J].Chinese Journal of Practical Surgery, 2018, 38(1):1-20.doi: 10.19538/j.cjps.issn1005-2208-2018.01.01.
[26] 李幼生.加速康复外科:现状及今后需要关注的问题[J].中华医学杂志, 2017, 97(4):244-247.doi:10.3760/cma.j.issn.0376-2491.2017.04.002.Li YS.Enhanced recovery after surgery: merits attention and meticulous inspection in the future[J].National Medical Journal of China, 2017, 97(4):244-247.doi:10.3760/cma.j.issn.0376-2491.2017.04.002.
[27] Kehlet H.Surgery: Fast-track colonic surgery and the 'knowingdoing' gap[J].Nat Rev Gastroenterol Hepatol, 2011, 8(10):539-540.doi: 10.1038/nrgastro.2011.153.
[28] 刘丽.加速康复护理理念在腹腔镜胰十二指肠切除术围手术期的应用[J].中国临床护理, 2017, 9(5):401-403.doi:10.3969/j.issn.1674-3768.2017.05.011.Liu L.Application of ERAS nursing in patients undergoing laparoscopic pancreatoduodenectomy in the perioperation[J].Chinese Clinical Nursing, 2017, 9(5):401-403.doi:10.3969/j.issn.1674-3768.2017.05.011.
