急性胰腺炎(acute pancreatitis,AP)是一种常见的消化系统疾病,发病率呈逐年升高趋势[1],依据病情严重程度一般分为轻症(MAP)、中重症(MSAP)和重症急性胰腺炎(SAP)[1-3],其中SAP在所有AP中发病率为9%~20%[4-5]。尽管近年来诊断技术和治疗水平有所提高,但SAP的病死率仍高达20%~30%[3],多数患者仍需在重症监护病房进行积极的支持性治疗[6],已成为严重危及我国人民健康和生命的重大疾病之一。入院后最初24 h是SAP诊疗的最佳窗口期,能否及时给予恰当处置,将直接决定病情的最终转归[7],在诊断和治疗中的任何时机延误都会导致病死率的增加[8]。因此,在疾病的起步阶段准确评估病情严重程度和疾病走势,及早识别可能进展为SAP的患者,早期采取积极有效的干预措施,有望降低SAP的病死率和并发症发生率,对改善临床预后意义重大。
目前存在较多用于评估SAP病情严重程度和病死率的多因素评分系统[9-12](主要是基于临床、影像学证据和实验室检测)以及单因素评价指标[12-13](生物学标志物),虽然其侧重点和临床价值各不相同,但由于各种限制(如反应时间、患者依从性和敏感度等),这些评分大部分不能立即使用。因此,在发病早期需要一种快速、可靠的生物指标对患者进行评估,这将有助于识别SAP患者,进而予以临床干预,从而改善此类患者预后。
未成熟粒细胞百分率(immature granulocyte percentage,IG%)是一种新的炎性指标[14-17],大多数外科医师对其认识不足。外周血中未成熟粒细胞的检测是骨髓增生和严重感染的一个指标,而健康人群中通常不存在这种情况[14-16]。由于自动化血液学分析仪的技术进步,IG%可以通过常规全血细胞计数轻松、快速地测定[16]。最近的研究[17-20]表明,在预测感染严重程度方面,IG%比传统的指标如白细胞(WBC)计数、C-反应蛋白(CRP)和中性粒细胞淋巴细胞比值(NLR)更有效。本研究的目的是明确IG%作为炎性指标在SAP早期预测中的作用。
1 资料与方法
1.1 一般资料
本研究回顾性收集盘锦市中心医院普通外科2010年1月—2019年10月期间因AP入院治疗的521例患者临床资料,其中男345例,女176例。全部患者或患者家属知晓诊疗方案并签署治疗同意书。
患者入院后在未接受任何治疗方式前抽取静脉血,检测血常规、肝肾功、CRP、血淀粉酶等指标,以获取WBC计数、中性粒细胞计数、淋巴细胞计数和IG%、CRP、淀粉酶。
1.2 纳入排除标准和分组
符合A P 诊断标准[1-3]纳入本研究,排除标准:⑴ 伴有血液系统疾病或近1周内合并感染性疾病者;⑵ 入院72 h内没有完成腹部增强CT的患者;⑶ 转往其他医院或自行出院的患者。本研究仅纳入期间多次入院的患者的首次就诊数据,而不考虑就诊次数。根据《中国急性胰腺炎诊治指南(2019,沈阳)》将患者分为非SAP组(MAP和M SAP)和SAP组。分析全部患者临床特征及炎性指标(WBC、IG%、NLR、CRP),并进行两组比较。
1.3 统计学处理
应用SPSS 18.0统计软件进行分析,连续变量表示为均值±标准差( ),组间比较采用χ2检验和Mann Whitney U检验。进行受试者工作特征曲线(ROC)分析,以确定WBC、NLR、CRP和IG%等指标对SAP的评估价值和最佳临界值。根据获得的最佳临界值,计算阳性预测值(PPV)和阴性预测值(NPV),P<0.05为差异有统计学意义。
),组间比较采用χ2检验和Mann Whitney U检验。进行受试者工作特征曲线(ROC)分析,以确定WBC、NLR、CRP和IG%等指标对SAP的评估价值和最佳临界值。根据获得的最佳临界值,计算阳性预测值(PPV)和阴性预测值(NPV),P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者一般资料比较
521例AP患者中,非SAP组458例(87.9%)和SAP组63例(12.1%)。全组总计28例患者死于相关并发症,其中非SAP组10例(10/458,2.2%),SAP组18例(18/63,28.6%)。
两组患者在性别上差异无统计学意义(P=0.517);SAP组患者的年龄明显高于非SAP组(P=0.0 0 2);在ICU 接受治疗方面,SAP 组(59/63,93.7%)明显多于非SAP组(27/458,5.9%,P<0.001);在外科治疗方面,SAP组患者37例(58.7%)接受了手术治疗(坏死性切除、清创、灌洗、引流),比例明显高于非S A P 组(7.9%,P<0.001);在病因学上,全部患者中395例(75.8%)为胆源性病变,96例(18.4%)为高脂血症[1, 3, 21]所致,30例(5.8%)为酒精性病变,两组无统计学差异(P=0.279);SAP组住院治疗时间明显长于非SAP组(P=0.001)(表1)。
表1 两组患者临床病理特征的比较
Table 1 Comparison of clinicopathologic features between the two groups

变量 (例n数)(非nS=A 4 P 58 组) (S nA=P 6组3) P性别[n(%)]男女 3 1 4 7 5 6 3 1 0 5 1 7((6 3 5 4..7 3))4 1 4 9((6 3 9 0..8 2)) 0.517年龄(岁,x±s) 521 47.4±15.5 55.1±17.8 0.002是否入ICU[n(%)]有无 4 8 36 5 4 2 37 1((95 4.9.1)) 59 4((9 6 3.3.7)) <0.001手术治疗[n(%)]有 73 36(7.9) 37(58.7) <0.001无 448 403(92.1)26(41.3)病因[n(%)]胆源性 395 343(74.9)52(82.5)高脂血症 96 89(19.4) 7(11.1) 0.279酒精性 30 26(5.7) 4(6.3)住院时间(d,x±s) 521 9.2±4.8 14.4±10.9 0.001
2.2 两组患者炎性指标比较
SAP组WBC、NLR、CRP、IG%平均水平明显高于非SAP组(P=0.010、P=0.003、P=0.002、P<0.001),非SAP组与SAP组血清淀粉酶水平无统计学差异(P=0.163)(表2)。
表2 两组炎性指标和淀粉酶的比较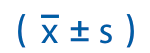
Table 2 Comparison of inflammation indicators and amylase levels between the two groups

WBC指(标1 0 9/L )(非11 n.S=6A±4 P 5 28组.)8(1 S 2nA.7=P±6组3 3).1 0.0 P 10 NLR 2.4±0.7 2.8±1.0 0.003 CRP(mg/L) 16.9±8.2 21.1±9.8 0.002 IG% 0.5±0.1 1.4±0.7 <0.001血淀粉酶水平(U/L) 345.8±107.4 323.5±119.2 0.163
2.3 SAP 组患者炎性指标比较
绘制SAP组患者ROC曲线,计算SAP组患者WBC、NLR、CRP、IG%的最佳临界值(图1)。各指标预测S A P 的有效性均有统计学意义(均P<0.05),但IG%对SAP组患者预测的强度高于其他指标(IG% AUC:0.973,敏感度为100%,特异度为93.8%);PPV 79.8%,NPV 100%,ROC曲线分析结果见表3。

图1 炎性指标诊断SAP 的ROC 曲线
Figure 1 ROC curves of the inflammatory indicators for diagnosis of SAP
表3 炎性指标对预测SAP 病情的ROC 分析
Table 3 ROC analysis of inflammation indicators for prediction of SAP

指标 AUC 95% CI 临界值 敏感度 特异度 PPV NPV P WBC 0.665 0.576~0.812 12.4 66.6 87.6 50.4 92.4 0.001 NLR 0.752 0.615~0.896 2.7 73.3 76.5 36.7 93.5 0.002 CRP 0.802 0.714~0.899 19 100 54.9 32.2 100 <0.001 IG% 0.973 0.955~1 0.9 100 93.8 79.8 100 <0.001
3 讨 论
在本研究中SAP比例为12.1%(63/521),与既往的文献[4-5]报道一致,而SAP患者的年龄、ICU入住率及外科手术治疗方面均明显高于非SAP组,其总住院时间和患者家庭所承担的医疗费用也是明显高于非SAP组患者。由此表明SAP是特别需要普外科、ICU及介入科等多学科、多种治疗模式支持的重症疾病,治疗过程困难重重且费用高昂,随着SAP病情的进展,多器官衰竭的发生率和病死率也随之增加[22-24]。因此,SAP的早期预测对于降低病死率和降低医疗费用具有极为重要的临床意义[3,24]。
针对SAP病情评估,现阶段存在各类评分系统,Ranson评分和Glasgow评分是较为经典的病情评分系统。SAP患者的病死率随Ranson评分总分的增加而升高,其判断预后不佳的灵敏度为70%~80%,但其缺陷也是非常明显的,一方面纳入指标过多,且比较繁琐,又未能将影像学的改变(如是否合并胰腺坏死)和器官衰竭对预后的重大影响纳入[25];另一方面需在入院48 h后进行,而SAP患者常在入院24 h内即出现多器官衰竭,故并不能早期预测病情的进展程度[26]。Glasgow评分与Ranson评分相似,都是基于实验室指标和人口学资料[27],但Glasgow评分的部分指标需在入院24 h后才可确定,故同样难以用于SAP的早期预测[28]。急性生理与慢性健康评分II(APACHE II)是危重症领域应用最广泛的评分系统[10,29],在起病8 h内评分上升即可提示进展为SAP的风险增加,同时也可每日重复评分以评估疾病发展的趋势。但有研究表明,入院24 h内APACHE II在预测SAP上的NPV可达86%,而PPV仅为43%,说明该评分用于排除SAP的临床价值明显优于预测SAP[30]。另外,由于评分计算的复杂性,临床应用受到一定限制[31]。
血清淀粉酶是临床工作中最为常见的胰腺炎相关标记物,一般在发病4~6 h后升高,并在3~5 d内逐步恢复到正常水平。淀粉酶水平对诊断很重要,但对病情的严重程度并不能有效评估[32]。本研究中非SAP组与SAP组血清淀粉酶水平无显著性差异(P=0.163),表明其在SAP诊疗的最佳时间窗内并无实际临床意义[33]。
近年来研究人员陆续发现CRP、CRP/白蛋白比值、NLR、降钙素原等炎性指标与胰腺炎病情相关[34-39]。其中常用于的指标是CRP,一种由肝细胞合成急性期反应物,其异常升高反应急性炎症和组织损伤时促炎细胞因子释放的过程[40]。有研究[34-35]报道称当CRP在最初48 h内达到1 500 mg/L的临界值时,其预测SAP的敏感度和特异度为80%,准确率为86%,但在本研究预测SAP时,CRP的临界值>19 mg/L,敏感度为100%,特异度为54.9%,说明其敏感度虽然可靠,但特异度不强。
全身炎症反应可导致循环中的白细胞成分平衡发生改变,分别介导中性粒细胞的增加和淋巴细胞数量的减少,而NLR被认为更优于WBC总数对病情的严重性的识别。因此有学者[41]提出NLR可作为全身炎症反应的代表性指标,而不是WBC总数。另有研究[42]认为,NLR升高表明SAP病情较重和可能伴有器官衰竭的存在,但这需要通过观察NLR持续变化才具有临床意义。在本研究中NLR的截止值>2.7,预测SAP的敏感度为73.3%,特异度为76.5%。因此,无论是NLR亦或是WBC总数仅对评估胰腺坏死的严重程度有重要意义,但在早期评估中的临床意义有限。
腹部增强CT尤其是薄层CT重建是评估SAP最有效的方法[3, 11, 43],随着胰腺组织坏死数量的增加,器官衰竭和病死率也随之增加[11]。这些研究还表明,通过增强CT检测到的胰腺形态学改变与患者的临床结果有很强的相关性。相关研究[43]认为,患者自发病72 h内实施腹部增强CT对AP的诊断和胰腺坏死等并发症的评估具有重要作用。在本研究SAP组中15例患者入院24 h内行腹部CT时并不支持SAP征象,至发病48 h后复查腹部CT才得以确诊,说明在SAP发病早期增强CT的敏感度是有限的。基于此,笔者单位近年来对所有AP患者入院后48~72 h内临床症状未改善的患者均行增强CT,以便指导临床制定个体化治疗方案。
综上,SAP的早期诊断迫切需要一种理想的能够独立应用于临床的指标,这种理想的生物指标应该具有早期、快速、简单、容易测量、高度准确和经济有效等特点,而以上指标或检查均存在自身的局限性。近年来IG%已被研究人员作为一个新型和有前途的炎性指标[15, 17],因为即便WBC总数和绝对中性粒细胞数在重症急性感染早期正常,IG%也会增加。此外,IG%也可反映重症感染病例治疗的疗效[15]。有研究[44]认为相较于其它炎性指标,IG%在SAP患者早期诊断中作用更佳。本研究发现非SAP组和SAP组的所有炎性指标(WBC、NLR、CRP和IG%)均有统计学差异,当IG%>0.9时,其敏感度为100%,特异度为93.8%,PPV为79.8%,NPV为100%,表明作为SAP早期识别指标,其临床价值明显优于其它炎性指标,具有较强的临床应用意义。本研究SAP组病死率为28.6%(18/63),但需指出的是其中72.2%(13/18)的患者为早年间病例,在近年来通过对IG%的充分认识,加之多学科模式的应用[45],使得部分患者在疾病早期即开始注重个体化治疗,其并发症发生和病死率明显下降。
本研究有几个局限性。一方面,由于SAP的患病率较低,虽然收集了近10年的资料,但SAP患者仅有63例,组间比较的选择性偏移无法避免。因此,为了评估IG%对SAP更准确的预测价值,还应进行大规模、多中心试验研究。另一方面,本研究是基于医疗记录的回顾性研究。在回顾性研究中,实验设计和统计分析并不能完全控制混杂因素,如本研究仅将伴有血液系统疾病和近期患有感染性疾病的患者排除,但无法除外潜在伴随者。
本研究结果显示,与WBC、NLR、CRP等传统炎性指标相比,IG%是一种更有效、更可靠的SAP早期预测指标,无需额外的时间和费用,且易于获得。在尚未确诊为SAP的患者中,血常规中IG%>0.9是胰腺坏死的重要早期指标,这一结果因患者血流动力学不稳定而无法完成腹部增强CT的情况下更为重要,外科医生应予以重视,应密切观察此类患者的病情变化,根据患者自身情况,制定个体化治疗方案,避免贻误治疗的最佳时机。
[1] 中华医学会消化病学分会胰腺疾病学组, 《中华胰腺病杂志》编辑委员会, 《中华消化杂志》编辑委员会.中国急性胰腺炎诊治指南(2019, 沈阳)[J].中华胰腺病杂志, 2019, 19(5):321-331.doi:10.3760/cma.j.issn.1674-1935.2019.05.001.Pancreas Study Group of Chinese Society of Gastroenterology of Chinese Medical Association, Editorial Board of Chinese Journal of Pancreatology Editorial Board of Chinese Journal of Digestion.Chinese guidelines for the treatment of acute pancreatitis (Shenyang,2019)[J].Chinese Journal of Pancreatology, 2019, 19(5):321-331.doi:10.3760/cma.j.issn.1674-1935.2019.05.001.
[2] 陈孝平, 汪建平, 赵继宗.外科学(第9版)[M].北京:人民卫生出版社, 2018:457-461.Chen XP, Wang JP, Zhao JZ.Surgery(9 Edition)[M].Beijing:People's Medical Publishing House, 2018:457-461.
[3] Leppäniemi A, Tolonen M, Tarasconi A, et al.2019 WSES guidelines for the management of severe acute pancreatitis[J].World J Emerg Surg, 2019, 14:27.doi: 10.1186/s13017-019-0247-0.
[4] Banks PA, Bollen TL, Dervenis C, et al.Classification of acute pancreatitis-2012: revision of the Atlanta classification and definitions by international consensus[J].Gut, 2013, 62(1):102-111.doi: 10.1136/gutjnl-2012-302779.
[5] Werge M, Novovic S, Schmidt PN, et al.Infection increases mortality in necrotizing pancreatitis: A systematic review and metaanalysis[J].Pancreatology, 2016, 16(5):698-707.doi: 10.1016/j.pan.2016.07.004.
[6] Sternby H, Hartman H, Johansen D, et al.Predictive Capacity of Biomarkers for Severe Acute Pancreatitis[J].Eur Surg Res, 2016,56(3/4):154-163.doi: 10.1159/000444141.
[7] 陈方莹, 柏小寅, 吴东.预测急性胰腺炎严重程度的评分系统及生物标志物[J].中华内科杂志, 2019, 58(8):615-619.doi:10.3760/cma.j.issn.0578-1426.2019.08.016.Chen FY, Bai XY, Wu D.The severity scoring system and prognostic biological markers of acute pancreatitis[J].Chinese Journal of Internal Medicine, 2019, 58(8):615-619.doi:10.3760/cma.j.issn.0578-1426.2019.08.016.
[8] Portelli M, Jones CD.Severe acute pancreatitis: pathogenesis,diagnosis and surgical management[J].Hepatobiliary Pancreat Dis Int, 2017, 16(2):155-159.doi: 10.1016/s1499-3872(16)60163-7.
[9] Buxbaum J, Quezada M, Chong B, et al.The Pancreatitis Activity Scoring System predicts clinical outcomes in acute pancreatitis:findings from a prospective cohort study[J].Am J Gastroenterol,2018, 113(5):755-764.doi: 10.1038/s41395-018-0048-1.
[10] Escobar-Arellano R, Guraieb-Barragán E, Mansanares-Hernández A, et al.Sensitivity, specificity and reliability of the POP score vs.APACHE II score as predictors of severe acute biliary pancreatitis[J].Cir Cir, 2019, 87(4):402-409.doi: 10.24875/CIRU.18000662.
[11] Kothari S, Kalinowski M, Kobeszko M, et al.Computed tomography scan imaging in diagnosing acute uncomplicated pancreatitis: Usefulness vs cost[J].World J Gastroenterol, 2019,25(9):1080-1087.doi: 10.3748/wjg.v25.i9.1080.
[12] Kubat Ö, Gökçek E, Kaydu A.An Analysis of Patients Followed Up in the Intensive Care Unit with the Diagnosis of Acute Respiratory Distress Syndrome[J].Turk J Anaesthesiol Reanim, 2019, 47(1):62-68.doi: 10.5152/TJAR.2018.27122.
[13] Park JH, Byeon HJ, Lee KH, et al.Delta neutrophil index (DNI) as a novel diagnostic and prognostic marker of infection: a systematic review and meta-analysis[J].Inflamm Res, 2017, 66(10):863-870.doi: 10.1007/s00011-017-1066-y.
[14] Hampson P, Dinsdale RJ, Wearn CM, et al.Neutrophil Dysfunction,Immature Granulocytes, and Cell-free DNA are Early Biomarkers of Sepsis in Burn-injured Patients: A Prospective Observational Cohort Study[J].Ann Surg, 2017, 265(6):1241-1249.doi: 10.1097/SLA.0000000000001807.
[15] Ayres LS, Sgnaolin V, Munhoz TP.Immature granulocytes index as early marker of sepsis[J].Int J Lab Hematol, 2019, 41(3):392-396.doi: 10.1111/ijlh.12990.
[16] Tailor H, Mackie I, Mellick A, et al.Evaluation of the Sysmex XN-550, a Novel Compact Haematologyanalyser from the XN-L®series, compared to the XN-20 system[J].Int J Lab Hematol, 2017,39(6):585-589.doi: 10.1111/ijlh.12701.
[17] Ünal Y.A new and early marker in the diagnosis of acute complicated appendicitis: immature granulocytes[J].Ulus Travma Acil Cerrahi Derg, 2018, 24(5):434-439.doi: 10.5505/tjtes.2018.91661.
[18] Biberci Keskin E, İnce AT, Sümbül Gültepe B, et al.The relationship between serum histon levels and the severity of acute pancreatitis[J].Turk J Gastroenterol, 2019, 30(9):807-810.doi:10.5152/tjg.2019.18592.
[19] Zulfikaroglu B, Isman FK, Bora G, et al.Serum levels of tumor necrosis factor-like weak inducer of apoptosis (TWEAK) in predicting the severity of acute pancreatitis[J].Eur J Trauma Emerg Surg, 2019, 45(3):539-543.doi: 10.1007/s00068-018-0938-3.
[20] Yalçın MS, Tas A, Kara B, et al.New predictor of acute necrotizing pancreatitis: Red cell distribution width[J].Adv Clin Exp Med,2018, 27(2):225-228.doi: 10.17219/acem/67590.
[21] 朱帅, 黄耿文.WSES重症急性胰腺炎管理指南(2019)解读[J].中国普通外科杂志, 2019, 28(9):1048-1053.doi:10.7659/j.issn.1005-6947.2019.09.003.Zhu S, Huang GW.Interpretation of 2019 WSES guidelines for the management of severe acute pancreatitis[J].Chinese Journal of General Surgery, 2019, 28(9):1048-1053.doi: 10.7659/j.issn.1005-6947.2019.09.003.
[22] Yano T, Taniguchi M, Shirasaka T, et al.Effectiveness of Soluble Recombinant Human Thrombomodulin in Patients with Severe Acute Pancreatitis Complicated by Disseminated Intravascular Coagulation[J].Turk J Anaesthesiol Reanim, 2019, 47(4):320-326.doi: 10.5152/TJAR.2019.42709.
[23] Ikeda S, Kagami T, Tani S, et al.Decompressive laparotomy for abdominal compartment syndrome resulting from severe acute pancreatitis: a case report[J].BMC Gastroenterol, 2019, 19(1):141-145.doi: 10.1186/s12876-019-1059-0.
[24] Pickens RC, Sulzer JK, Cochran A, et al.Retrospective Validation of an Algorithmic Treatment Pathway for Necrotizing Pancreatitis[J].Am Surg, 2019, 85(8):840-847.
[25] Arif A, Jaleel F, Rashid K.Accuracy of BISAP score in prediction of severe acute pancreatitis[J].Pak J Med Sci, 2019, 35(4):1008-1012.doi: 10.12669/pjms.35.4.1286.
[26] Abaylı B, Gençdal G, Değirmencioğlu Ş.Correlation between neutrophil/lymphocyte ratio and Ranson score in acute pancreatitis[J].J Clin Lab Anal, 2018, 32(6):e22437.doi: 10.1002/jcla.22437.
[27] Kemnitz V, Beitz A, Roos AB, et al.Early prediction of outcome in acute pancreatitis: a retrospective study on single parameters and scores[J].Pancreatology, 2016, 16(3 Suppl 1):S16.doi:10.1016/j.pan.2016.05.060.
[28] Biberci Keskin E, Taşlıdere B, Koçhan K, et al.Comparison of scoring systems used in acute pancreatitis for predicting major adverse events[J].Gastroenterol Hepatol, 2020, pii: S0210-5705(19)30264-X.doi: 10.1016/j.gastrohep.2019.10.008.[Epub ahead of print]
[29] 宋磊, 高明.胸腔积液联合血清MCP-1、sTREM-1对急性胰腺炎严重程度的早期评估价值[J].中国普通外科杂志, 2019,28(3):299-305.doi:10.7659/j.issn.1005-6947.2019.03.008.Song L, Gao M.Value of pleural effusion combined with serum MCP-1 and sTREM-1 detection in early predicting the severity of acute pancreatitis[J].Chinese Journal of General Surgery, 2019,28(3):299-305.doi:10.7659/j.issn.1005-6947.2019.03.008.
[30] Rathnakar SK, Vishnu VH, Muniyappa S, et al.Accuracy and Predictability of PANC-3 Scoring System over APACHE II in Acute Pancreatitis: A Prospective Study[J].J Clin Diagn Res, 2017,11(2):PC10-PC13.doi: 10.7860/JCDR/2017/23168.9375.
[31] Meyrignac O, Lagarde S, Bournet B, et al.Acute pancreatitis:extrapancreatic necrosis volume as early predictor of severity[J].Radiology, 2015, 276(1):119-128.doi:10.1148/radiol.15141494.
[32] Aljomah AS, Hammami MM.Superfluous amylase/lipase testing at a tertiary care hospital: a retrospective study[J].Ann Saudi Med,2019, 39(5):354-358.doi: 10.5144/0256-4947.2019.354.
[33] Ismail OZ, Bhayana V.Lipase or amylase for the diagnosis of acute pancreatitis?[J].Clin Biochem, 2017, 50(18):1275-1280.doi:10.1016/j.clinbiochem.2017.07.003.
[34] Staubli SM, Schäfer J, Rosenthal R, et al.The role of CRP and Pentraxin 3 in the prediction of systemic inflammatory response syndrome and death in acute pancreatitis[J].Sci Rep, 2019,9(1):18340.doi: 10.1038/s41598-019-54910-8.
[35] Kaplan M, Ates I, Akpinar M, et al.Predictive value of C-reactive protein/albumin ratio in acute pancreatitis[J].Hepatobiliary Pancreat Dis Int, 2017, 16(4):424-430.doi: 10.1016/S1499-3872(17)60007-9.
[36] Yılmaz EM, Kandemir A.Significance of red blood cell distribution width and C-reactive protein/albumin levels in predicting prognosis of acute pancreatitis[J].Ulus Travma Acil Cerrahi Derg, 2018,24(6):528-531.doi: 10.5505/tjtes.2018.98583.
[37] Cho SK, Jung S, Lee KJ, et al.Neutrophil to lymphocyte ratio and platelet to lymphocyte ratio can predict the severity of gallstone pancreatitis[J].BMC Gastroenterol, 2018, 18(1):18-24.doi:10.1186/s12876-018-0748-4.
[38] Park HS, In SG, Yoon HJ, et al.Predictive values of neutrophillymphocyte ratio as an early indicator for severe acute pancreatitis in the emergency department patients[J].J Lab Physicians, 2019,11(3):259-264.doi: 10.4103/JLP.JLP_82_19.
[39] Siriwardena AK, Jegatheeswaran S, Mason JM, et al.PROCalcitonin-based algorithm for antibiotic use in Acute Pancreatitis (PROCAP): study protocol for a randomised controlled trial[J].Trials, 2019, 20(1):463-474.doi: 10.1186/s13063-019-3549-3.
[40] Ćeranić DB, Zorman M, Skok P.Interleukins and inflammatory markers are useful in predicting the severity of acute pancreatitis[J].Bosn J Basic Med Sci, 2020, 20(1):99-105.doi: 10.17305/bjbms.2019.4253.
[41] Zhang FX, Li ZL, Zhang ZD, et al.Prognostic value of red blood cell distribution width for severe acute pancreatitis[J].World J Gastroenterol, 2019, 25(32):4739-4748.doi: 10.3748/wjg.v25.i32.4739.
[42] Jeon TJ, Park JY.Clinical significance of the neutrophil-lymphocyte ratio as an early predictive marker for adverse outcomes in patients with acute pancreatitis[J].World J Gastroenterol, 2017,23(21):3883-3889.doi: 10.3748/wjg.v23.i21.3883.
[43] 孙健, 林峥.CT灌注成像诊断急性胰腺炎的灵敏度和特异度分析[J].中国普通外科杂志, 2018, 27(11):1491-1494.doi:10.7659/j.issn.1005-6947.2018.11.020.Sun J, Lin Z.Analysis of sensitivity and specificity of CT perfusion imaging in diagnosis of acute pancreatitis[J].Chinese Journal of General Surgery, 2018, 27(11):1491-1494.doi:10.7659/j.issn.1005-6947.2018.11.020.
[44] Lipiński M, Rydzewska G.Immature granulocytes predict severe acute pancreatitis independently of systemic inflammatory response syndrome[J].Prz Gastroenterol, 2017, 12(2):140-144.doi: 10.5114/pg.2017.68116.
[45] 刘志勇, 黄耿文.重症急性胰腺炎2例死亡病例的多学科讨论[J].中国普通外科杂志, 2017, 26(3):352-358.doi:10.3978/j.issn.1005-6947.2017.03.013.Liu ZY, Huang GW.Multidisciplinary discussion on death of two cases of severe acute pancreatitis[J].Chinese Journal of General Surgery, 2017, 26(3):352-358.doi: 10.3978/j.issn.1005-6947.2017.03.013.
