结肠癌是最常见的恶性肿瘤之一,据全球癌症最新统计报告指出,2018年全球结肠癌新发病例数超过100万例,在恶性肿瘤发病率中排第3位, 位于肺癌、乳腺癌、前列腺癌之后。死亡例数约为55万例,在恶性肿瘤死亡率中排第5位,仅次于肺癌、肝癌、胃癌以及乳腺癌,发病例数及死亡人数较往年均有明显的增长且发病人群出现了明显的年轻化[1-3]。目前结肠癌的治疗手段主要以手术切除为主再辅以术前或术后的化疗。该治疗方式已十分成熟,对提高患者生存率起到了关键性的作用,但是由于结肠癌起病隐秘,发现较晚,很多患者未能得到及时有效的治疗,因此可供早期诊断的分子靶标的发现对结肠癌的诊疗工作有着非常重要及积极的意义[4-6]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度>200 bp且没有蛋白编码功能的RNA。近年来研究[7-10]表明,lncRNA可以在染色质、RNA及蛋白质等多个层面发挥作用,调控肿瘤细胞的增殖、迁移及凋亡等多种功能。目前已发现多种lncRNA在结肠癌中异常表达,并且介导调控了结肠癌细胞的增殖、侵袭、转移、凋亡及放化疗敏感性等各个方面的功能,有望为结肠癌的诊疗提供新的靶点[11-13]。
lncRNA MLK7-AS1是新发现致癌基因。迄今为止,lncRNA MLK7-AS1已被发现在胃癌及卵巢癌组织中表达上调,参与细胞增殖、侵袭、转移等多种功能的调控,且其表达水平与患者预后负相关[14-15]。然而尚未发现其在结肠癌中的表达及作用的相关报道。本文旨在研究lnRNA MLK7-AS1在结肠癌中的表达及其对结肠癌细胞增殖能力的影响,并初步探究其作用机制。
1 材料与方法
1.1 细胞与主要试剂
实验所用细胞均由广州医科大学附属肿瘤医院肿瘤研究所细胞库保存并提供;TRIzol试剂、Lipofectamine 3000购于美国Invitrogen公司;逆转录试剂盒(R R 0 4 7 A)及q R T-P C R 试剂盒(RR420)均购自日本Takara公司;DNA含量检测试剂盒(细胞周期)购于北京索莱宝科技有限公司;细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖激酶6(CDK6)、β-actin抗体以及鼠二抗均购于美国Abcam公司;RIPA蛋白裂解液购自上海碧云天公司;BCA蛋白定量试剂盒购自美国Bio-Rad公司;PVDF膜和ECL发光液购自美国Millipore公司;胰酶、RPMI1640培养基、胎牛血清均购于美国Gibcol公司;DMSO试剂购于美国Sigma-Aldrich公司;细胞培养板、移液管、细胞培养瓶以及冻存管等一次性耗材购自洁特公司;引物由广州天一辉远公司合成;无内毒素质粒提取试剂盒购于美国OMEGA公司;过表达及空白质粒由广州复能公司合成。
1.2 临床标本
所用21对结肠癌组织及癌旁组织均取自广州医科大学附属肿瘤医院胃肠外科冷冻组织库,标本离体后30 min内即被收集置入液氮中保存,所有标本均经术后病理确认为结肠癌,所有标本收集前均已经患者同意并签署了知情同意书。
1.3 方法
1.3.1 细胞培养 结肠癌细胞(DLD1、SW620、SW480、HCT116、HT29 与LOVO)和人结肠上皮细胞NCM460 用含10% 胎牛血清的1640 培养于37 ℃、5% CO2 的培养箱中,每3 天换液1 次,在细胞生长到约80% 汇合度时进行传代,取对数生长期细胞进行实验。
1.3.2 细胞转染与分组 取对数生长期的结肠癌细胞接种于6 孔板(5×105/ 孔)中,待生长至汇合度为70%~80% 时,将细胞分为两组:实验组和对照组,转入lncRNA MLK7-AS1 过表达质粒为实验组,转入空白对照质粒为对照组。遵照Lipofectamine3000 说明书要求分别转染lncRNA MLK7-AS1 过表达质粒与空白对照质粒,转染后24 h 后采用qRT-PCR 方法检测lncRNA MLK7-AS1 表达以确定转染效率。
1.3.3 总RNA 提取 取对数期细胞加入1 mL TRIzol 试 剂 充 分 消 化10 min; 加200 μL 氯 仿剧 烈 震 荡15 s, 室 温 静 置10 min,4 ℃离 心 (12 000 r/min,15 min); 取 上 清 并 按 等 体积加入异丙醇,颠倒混匀,4 ℃离心后收集沉淀,加1 mL 75% 乙醇洗涤后晾干;加DEPC 水溶解至适宜浓度后采用分光光度计测量总RNA浓 度,A260/280 在1.8~2.0 之 间 为 合 格 样 品。按Takara 公司逆转录试剂盒RR036A 说明书所 述 加 入 试 剂, 使 用SureCycler8800 PCR 仪(Agilent Technologie)行逆转录反应,逆转录成的cDNA,-20 ℃保存备用。
1.3.4 总RNA 提取与实时荧光定量PCR(qRTPCR) 检 测 按Takara 公 司qRT-PCR 试 剂 盒(RR420)说明书所述加入试剂,配置反应体系,在荧光定量PCR 仪(BioRad)上检测,程序如下:50 ℃ 2 min。95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s(40 个循环)。根据2-ΔΔct 计算相对表达量。MLK7-AS1 上游序列:TTA CCA GAC ACA ACC AAC CCC,MLK7-AS1 下游序列:ATC AGT CAG GCC CAT TGG TTT;cyclin D1 上 游 序 列:AAC TAC CTG GAC CGC TTC CT,cyclin D1 下游序列:CCA CTT GAG CTT GTT CAC CA;CDK6 上游序列:TGT CTG TTC GTG ACA CTG TGC,CDK6 下游 序 列:ATG CCG CTC TCC ACC AT;GAPDH上游序列:ATT CCA TGG CAC CGT CAA GGC TGA,GAPDH 下 游 序 列:TTC TCC ATG GTG GTG AAG ACG CCA。
1.3.5 细胞增殖能力检测(MTS) 取对数生长期细胞种于96 孔板中,每孔1 000 个细胞,各 5 个副孔,于37 ℃,5% CO2 培养箱培养。分别于1、2、3、4、5 d 加入20 μL MTS/ 孔,于培养箱中孵育3 h 后,在多功能酶标仪上检测各孔OD490。以时间为横坐标,均一化OD490 值为纵坐标绘制曲线。
1.3.6 平板单克隆实验 取对数期细胞,细胞计数后,接种于6 孔板中,每种细胞分别设置250、500、1 000 个/孔,3 个接种浓度,细胞放入37 ℃、5%CO2 细胞培养箱中培养,每隔2 天换液1 次,8 d 后去培养基,利用PBS 洗3 遍,每孔加入1 mL福尔马林液固定,放入-20 ℃冰箱静置30 min,固定细胞,再吸除福尔马林,每孔加入1 mL 1%结晶紫染色液,室温下染色10 min,吸去染色液,在水中漂洗。计算克隆形成数,并绘制图表。
1.3.7 流式细胞仪检测细胞周期实验 取对数期细胞,计数1×106 个细胞。1 000 r/min 离心 5 min,PBS 洗2 次,加3 mL 预冷的70%乙醇,混匀,置4 ℃冰箱过夜。次日,取固定过夜的单细胞悬液,PBS 洗2 次,离心弃上清,在细胞沉淀中加入50 μL RNAse A,37 ℃水浴30 min,加入450 μL PI 染色液,4 ℃孵育30 min,流式细胞仪上机检测。
1.3.8 Western blot 检测 使用RIPA 裂解液裂解对数期细胞并提取总蛋白质,BCA 法定量蛋白浓度,取总蛋白与等量的2× 上样缓冲液混匀后 100 ℃煮沸5 min。将蛋白质在10%SDS 聚丙烯酰胺凝胶上完全电泳,并转移到PVDF 膜上。将膜用5%脱脂牛奶封闭2 h,后将膜与一抗(cyclin D1, 1:1 000;CDK6,1:5 000;β-actin,1:5 000)在4 ℃温育过夜,然后将膜与鼠二抗(1:1 000)室温孵育1~2 h,ECL 发光液显影,置于暗室发光,胶片晾干扫描。
1.4 统计学处理
应用统计学软件SPSS 19.0进行统计分析,实验重复3次以上,数据均以均数±标准差(x±s)表示。两组均数比较采用t检验,P<0.05为差异有统计学差异。
2 结 果
2.1 lncRNA MLK7-AS1 在结肠癌中高表达
q R T-P C R 结果显示,在2 1 对组织标本中,lncRNA MLK7-AS1在结肠癌组织中表达明显高于癌旁正常组织(P<0.05)(图1A);lncRNA MLK7-AS1在结肠癌细胞系HCT116、SW480、DLD1、HT29、SW620、LOVO中的相对表达量分别为4.00±0.62、5.02±0.17、7.47±0.71、8.71±0.28、9.48±0.34、13.93±0.74,均高于人正常结肠上皮细胞系细胞NCM460(均P<0.05)(图1B)。
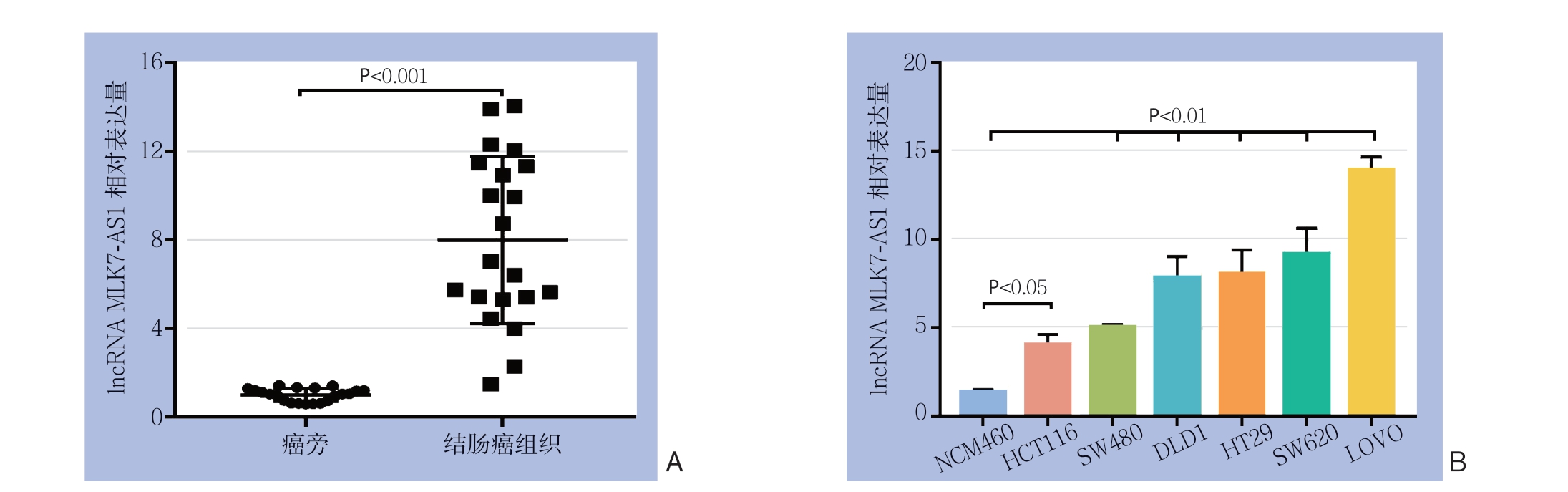
图1 lncRNA MLK7-AS1 表达量检测 A:lncRNA MLK7-AS1 在结肠癌组织与癌旁正常组织中的表达;B:lncRNA MLK7-AS1 在正常结肠上皮细胞及不同结肠癌细胞系中的相对表达量
Figure 1 Determination of the expression levels of lncRNA MLK7-AS1 A: The expressions of lncRNA MLK7-AS1 in colon cancer tissues and adjacent normal tissues; B: The relative expression levels of lncRNA MLK7-AS1 in normal colonic epithelial cells and different colon cancer cell lines
2.2 转染效率测定
选取lncRNA MLK7-AS1表达相对较低的结肠癌细胞系SW480及HCT116,将过表达质粒及空载质粒转入这2对细胞系后利用qRT-PCR技术检测转染效率。结果显示在SW480中,转入空载质粒后相对表达量为1.00±0.13,转入过表达质粒后lncRNA MLK7-AS1相对表达量为2.40±0.19;同时在HCT116中,转入空载质粒后相对表达量为1.00±0.19,转入过表达质粒后lncRNA MLK7-AS1相对表达量为3.37±0.28。差异均有统计学意义(均P<0.05)(图2)。
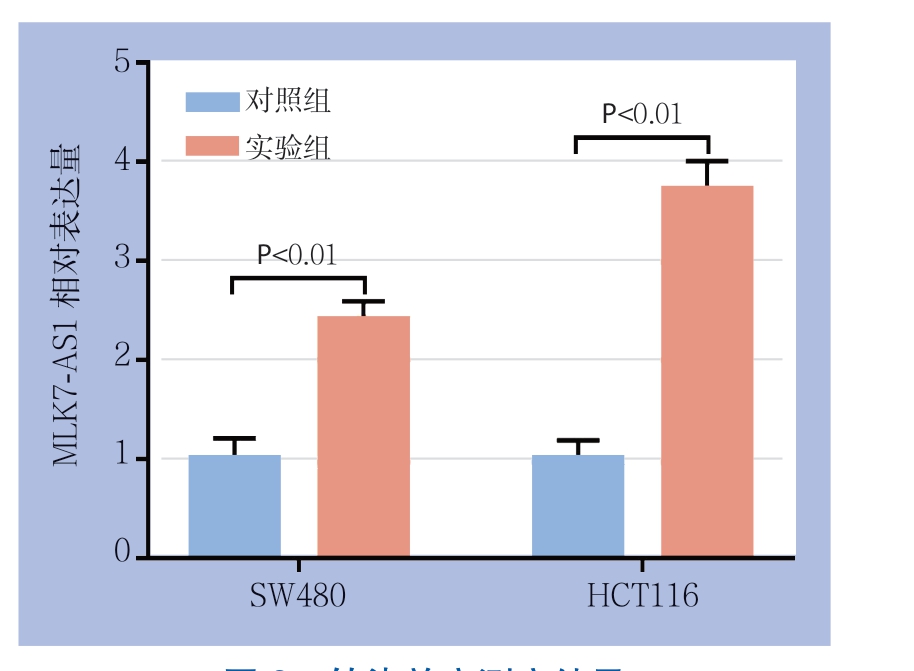
图2 转染效率测定结果
Figure 2 Results of transfection efficiency
2.3 过表达lncRNA MLK7-AS1 对结直肠癌细胞增殖能力的影响
转染24 h后,取对数期细胞铺板行MTS实验以及平板克隆实验检测过表达lncRNA MLK7-AS1对结直肠癌细胞活力及克隆形成能力的影响。根据MTS结果显示,过表达lncRNA MLK7-AS1后,与各自的对照组比较,两种细胞的OD490值在48 h后个时间点均明显升高(均P<0.05)(图3)。平板克隆结果显示,过表达lncRNA MLK7-AS1后,两种结肠癌细胞的平板克隆形成数在250、500、1 000这3个铺孔密度下较对照组均有不同程度的提高(均P<0.05)(图4)。
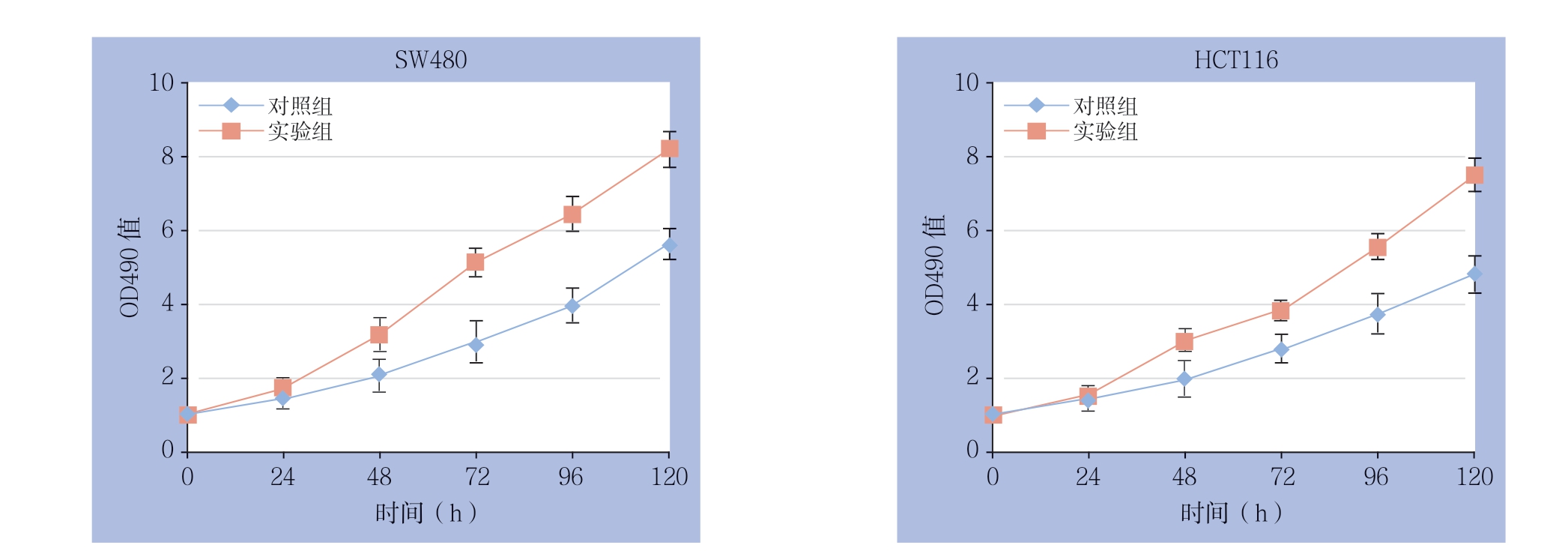
图3 MTS 实验检测细胞活力
Figure 3 The cell viabilities detected by MTS assay
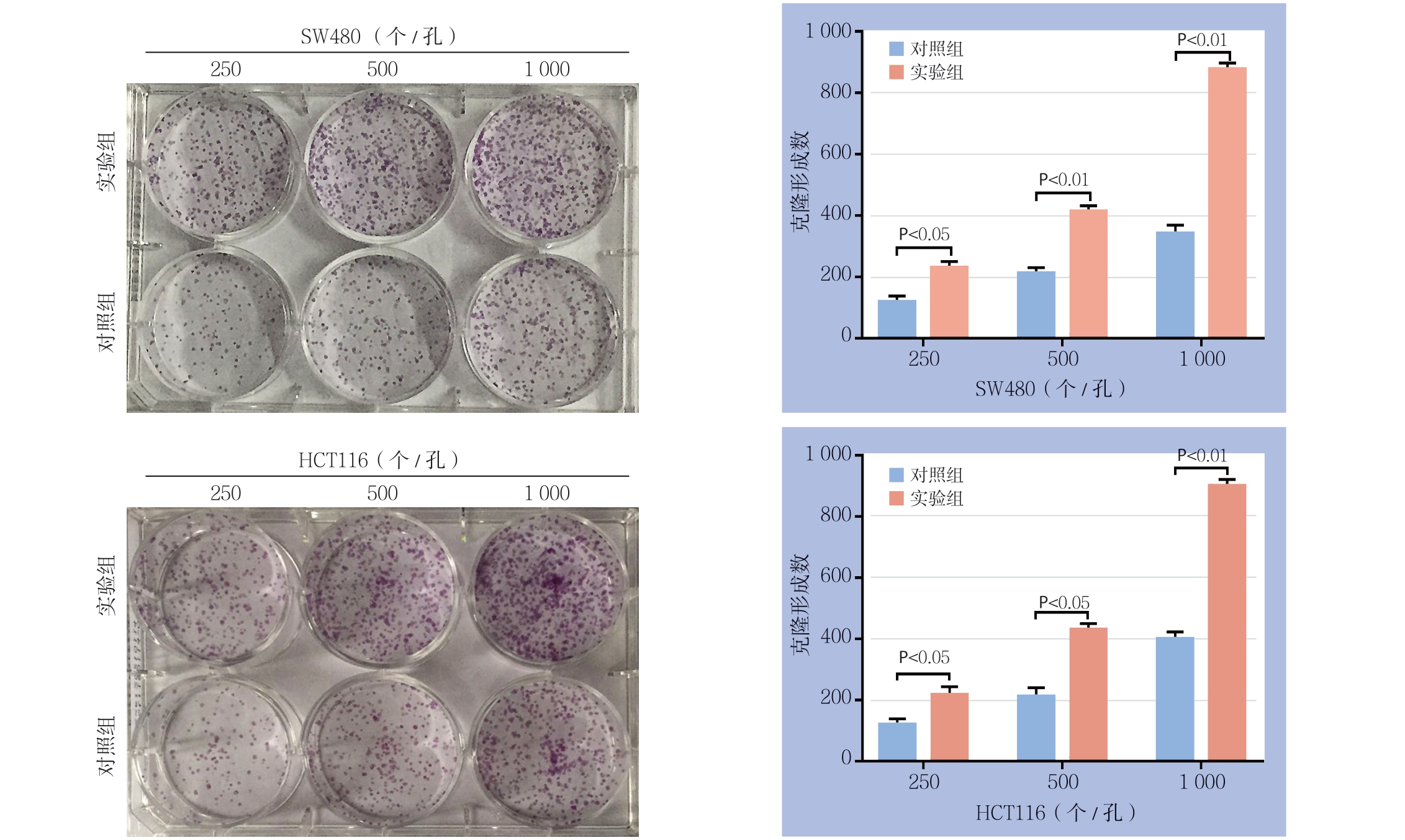
图4 平板克隆实验检测克隆形成能力
Figure 4 Colony-forming capacities determined by plate colony experiment
2.4 过表达lncRNA MLK7-AS1 对结直肠癌细胞的细胞周期影响
流式细胞仪检测细胞周期发现过表达lncRNA MLK7-AS1后,G1期细胞比例明显减少,S期细胞比例明显增加,经统计发现SW480过表达lncRNA M L K 7-A S 1 后,G1由(6 5.7 1±1.1 8)%减少至(45.98±0.92)%,S期由(28.06±1.78)%增加至(43.90±0.85)%。HCT116经过表达lncRNA MLK7-AS1后,G1期由(61.03±1.98)%减少至(39.99±0.98)%,S期由(36.21±1.32)%增加至(48.88+±0.57)%,均有统计学差异(均P<0.05)(图5)。

图5 流式细胞术检测细胞周期
Figure 5 Cell cycles analyzed by flow cytometry
2.5 过表达lncRNA MLK7-AS1 对细胞周期相关蛋白的作用
Western blot实验显示,在SW480及HCT116这两对细胞中,实验组cyclin D1及CDK6蛋白表达量均高于对照组;qRT-PCR检测也显示,两种细胞实验组的cyclin D1及CDK6较各自对照组相比表达量均明显升高(均P<0.05)(图6)。
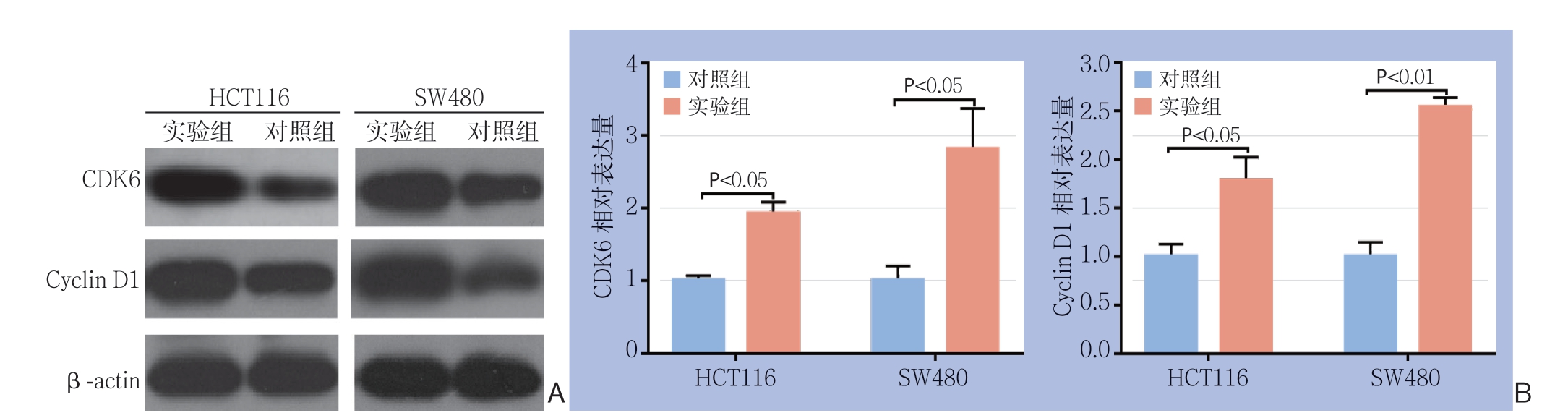
图6 周期相关蛋白检测 A:Western blot 检测结果;B:qRT-PCR 检测结果
Figure 6 Measurement of the cell cycle-related proteins A: Results of Western blot analysis; B: Results of qRT-PCR
3 讨 论
非编码R N A 的发现是一个非常重大的生物学突破,其重新定义了真核基因表达调控的多样性。其中lncRNA是非编码RNA中的一个重要分类,其特指碱基数>200 bp的非编码RNA。目前有大量研究报道提示lncRNA对人体内各种生理及病理过程有着非常复杂的调控作用,多种疾病的发生发展与lncRNA表达及功能的异常密切相关,结肠癌就是其中之一[16-18]。
3.1 lncRNA 在结肠癌中的研究现状
据研究表明单一的l n c R N A 可以对结肠癌发生发展过程中的包括增殖、侵袭、转移及化疗耐药在内等多种功能进行调节,同时结肠癌发生发展过程中的单一功能也可以受到多种lncRNA的调控。例如Yang等[19]发现lncRNA SNHG1与结肠癌细胞的增殖、凋亡、侵袭及迁移均密切相关;Li等[20]发现lncRNA-ZDHHC8P1可以通过与miR-34a结合促进结直肠癌的转移;Huang等[21]发现lncRNA PCAT6可以通过调节细胞凋亡相关蛋白表达抑制细胞凋亡;Jiang等[22]发现lncRNA GIHCG 与结肠癌细胞化学耐药密切相关。lncRNA的表达及功能的异常是结肠癌发生发展病理机制中的重要组成部分,发现更多的癌症相关lncRNA并且深入挖掘这些lncRNA的功能对完善结肠癌发生发展机制以及指导后续的诊疗均具有十分积极的意义[23-25]。lncRNA MLK7-AS1是新发现的肿瘤相关lncRNA,目前仅在胃癌及卵巢癌中有相关报道,其在结肠癌中发挥怎样的作用以及其具体的调控机制仍不清楚,需要进一步研究。
3.2 lncRNA MLK7-AS1 对结肠癌细胞增殖能力的影响
细胞增殖能力的改变是肿瘤细胞的重要标志之一,而细胞增殖的过程即表现为细胞在不同细胞周期的变迁。目前研究表明细胞周期调控分子主要包括细胞周期蛋白(cyclin)、依赖细胞周期蛋白激酶(cyclin-dependent kinases,CDK)和依赖细胞周期蛋白激酶抑制剂(cyclin-dependent kinase inhibitors,CKI),其中CDK需要与cyclin结合才能被激活发挥调节细胞周期的作用,同时又由于各个时相的cyclin的种类、表达量及结合的CDK的种类不同,其在细胞周期各个时相发挥的作用也不相同,这样就实现了对细胞周期各个时相精准调控。而CKI可以抑制CDK或cyclin/CDK复合物的活性,这样cyclin、CDK与CKI这三者就共同构成了细胞周期复杂的调控网络[26]。为研究lnRNA MLK7-AS1对结肠癌细胞增殖能力的影响及其作用机制,本研究首先通过qRT-PCR实验证实了其在结肠癌组织高表达,然后利用MTS以及平板克隆实验发现过表达lncRNA MLK7-AS1可以提高结肠癌细胞的增殖和克隆形成能力,同时利用流式细胞周期实验发现过表达lncRNA MLK7-A S 1 可以促进结直肠癌细胞由G1期进入S 期,最后通过Western blot及qRT-PCR实验提示,过表达lncRNA MLK7-AS1后cyclin D1及CDK6表达上升。其中cyclin D1在G1早期表达,是细胞周期启动因子,它也是生长因子感应器[27-28]。而CDK6可以与cyclin D1组装成有激酶活性的复合物,cyclin D1/CDK6复合物能使Rb磷酸化,使转录因子E2F从磷酸化的Rb蛋白上脱落下来,同时游离的E2F可促使与DNA合成有关的一系列基因表达,从而促使DNA合成,加速细胞从G1到S期转换,推动细胞周期的进展[29-31]。cyclin D1与CDK6表达的升高解释流式细胞周期的结果,同时也提示了lncRNA MLK7-AS1是通过促进cyclin D1与CDK6表达从而促进结直肠癌细胞增殖。
综上所述,本研究发现lncRNA MLK7-AS1可以上调cyclin D1及CDK6表达,从而促进肿瘤细胞由G1进入S期,提高结直肠癌细胞的增殖和克隆形成能力,发挥促癌基因功能。但是lncRNA MLK7-AS1对周期相关蛋白的具体调控机制研究仍不够明了,深入挖掘lncRNA MLK7-AS1对周期相关蛋白具体调控机制将是下一步研究的重点。同时lncRNA MLK7-AS1在正常人组织及结直肠癌患者组织中的表达是否有差异,且这种差异是否与患者的临床表现及预后差异相关同样也是今后的研究重点。这提示lncRNA MLK7-AS1可能是结肠癌诊疗的潜在靶标。
[1]Bray F, Ferlay J, Soerjomataram I, et al. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. doi: 10.3322/caac.21492.
[2]Weinberg BA, Marshall JL. Colon Cancer in Young Adults: Trends and Their Implications[J]. Curr Oncol Rep, 2019, 21(1):3. doi: 10.1007/s11912-019-0756-8.
[3]Bhurgri H, Samiullah S. Colon Cancer Screening - Is It Time Yet?[J]. J Coll Physicians Surg Pak, 2017, 27(6):327-328. doi: 2629.
[4]Benson AB 3rd, Venook AP, Cederquist L, et al. Colon Cancer, Version 1.2017, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2017, 15(3):370-398. doi: 10.6004/jnccn.2017.0036.
[5]Dienstmann R, Salazar R, Tabernero J. Personalizing colon cancer adjuvant therapy: selecting optimal treatments for individual patients[J]. J Clin Oncol, 2015, 33(16):1787-1796. doi: 10.1200/JCO.2014.60.0213.
[6]Hodgkinson N, Kruger CA, Abrahamse H. Targeted photodynamic therapy as potential treatment modality for the eradication of colon cancer and colon cancer stem cells[J]. Tumour Biol, 2017, 39(10):1010428317734691. doi: 10.1177/1010428317734691.
[7]Jarroux J, Morillon A, Pinskaya M. History, Discovery, and Classification of lncRNA[J]. Adv Exp Med Biol, 2017, 1008:1-46. doi: 10.1007/978-981-10-5203-3_1.
[8]胡走肖, 郑小林. 长链非编码RNA MIF-AS1在肝癌中表达及其与上皮-间充质转化的关系[J]. 中国普通外科杂志, 2019, 28(7):848-856. doi:10.7659/j.issn.1005-6947.2019.07.011. Hu ZX, Zheng XL. Expression of long non-coding RNA MIFAS1 in hepatocellular carcinoma and its association with epithelialmesenchymal transition[J]. Chinese Journal of General Surgery, 2019, 28(7):848-856. doi:10.7659/j.issn.1005-6947.2019.07.011.
[9]Huarte M. The emerging role of lncRNAs in cancer[J]. Nat Med, 2015, 21(11):1253-1261. doi:10.1038/nm.3981.
[10]陈伟业, 邢宏松, 江帆, 等. 长链非编码RNA HOST2对胰腺癌细胞增殖迁移和侵袭的影响[J]. 中国普通外科杂志, 2019, 28(3):285-291. doi:10.7659/j.issn.1005-6947.2019.03.006. Chen WY, Xing HS, Jiang F, et al. Effects of long non-coding RNA HOST2 on proliferation, migration and invasion in pancreatic cancer cells[J]. Chinese Journal of General Surgery, 2019, 28(3):285-291. doi:10.7659/j.issn.1005-6947.2019.03.006.
[11]Zhang R, Li J, Yan X, et al. Long Noncoding RNA Plasmacytoma Variant Translocation 1 (PVT1) Promotes Colon Cancer Progression via Endogenous Sponging miR-26b[J]. Med Sci Monit, 2018, 24:8685-8692. doi: 10.12659/MSM.910955.
[12]Rokavec M, Horst D, Hermeking H. Cellular Model of Colon Cancer Progression Reveals Signatures of mRNAs, miRNA, lncRNAs, and Epigenetic Modifications Associated with Metastasis[J]. Cancer Res, 2017, 77(8):1854-1867. doi: 10.1158/0008-5472.CAN-16-3236.
[13]姚凯, 朱光辉, 单远洲. 长链非编码RNA TUG1和UCA1在结肠癌组织中的表达及临床意义[J]. 中国普通外科杂志, 2018, 27(4):449-456. doi:10.3978/j.issn.1005-6947.2018.04.010. Yao K, Zhu GH, Shan YZ. Expressions of long noncoding RNA TUG1 and UCA1 in colon cancer tissue and their clinical significance[J]. Chinese Journal of General Surgery, 2018, 27(4):449-456. doi:10.3978/j.issn.1005-6947.2018.04.010.
[14]Quan Y, Zhang Y, Lin W, et al. Knockdown of long noncoding RNA MAP3K20 antisense RNA 1 inhibits gastric cancer growth through epigenetically regulating miR-375[J]. Biochem Biophys Res Commun, 2018, 497(2):527-534. doi: 10.1016/j.bbrc.2018.02.072.
[15]Yan H, Li H, Li P, et al. Long noncoding RNA MLK7-AS1 promotes ovarian cancer cells progression by modulating miR-375/YAP1 axis[J]. J Exp Clin Cancer Res, 2018, 37(1):237. doi: 10.1186/s13046-018-0910-4.
[16]Xue M, Zhuo Y, Shan B. MicroRNAs, Long Noncoding RNAs, and Their Functions in Human Disease[J]. Methods Mol Biol, 2017, 1617:1-25. doi: 10.1007/978-1-4939-7046-9_1.
[17]Batista PJ, Chang HY. Long noncoding RNAs: cellular address codes in development and disease[J]. Cell, 2013, 152(6):1298-1307. doi: 10.1016/j.cell.2013.02.012.
[18]Zhang X, Hong R, Chen W, et al. The role of long noncoding RNA in major human disease[J]. Bioorg Chem, 2019, 92:103214. doi: 10.1016/j.bioorg.2019.103214.
[19]Yang H, Wang S, Kang YJ, et al. Long non-coding RNA SNHG1 predicts a poor prognosis and promotes colon cancer tumorigenesis[J]. Oncol Rep, 2018, 40(1):261-271. doi: 10.3892/or.2018.6412.
[20]Li C, Liu T, Zhang Y, et al. LncRNA-ZDHHC8P1 promotes the progression and metastasis of colorectal cancer by targeting miR-34a[J]. Eur Rev Med Pharmacol Sci, 2019, 23(4):1476-1486. doi: 10.26355/eurrev _201902_17105.
[21]Huang W, Su G, Huang X, et al. Long noncoding RNA PCAT6 inhibits colon cancer cell apoptosis by regulating anti-apoptotic protein ARC expression via EZH2[J]. Cell Cycle, 2019, 18(1):69-83. doi: 10.1080/15384101.2018.1558872.
[22]Jiang X, Li Q, Zhang S, et al. Long noncoding RNA GIHCG induces cancer progression and chemoresistance and indicates poor prognosis in colorectal cancer[J]. Onco Targets Ther, 2019, 12:1059-1070. doi: 10.2147/OTT.S192290.
[23]Tang X, Qiao X, Chen C, et al. Regulation Mechanism of Long Noncoding RNAs in Colon Cancer Development and Progression[J]. Yonsei Med J, 2019, 60(4):319-325. doi: 10.3349/ymj.2019.60.4.319.
[24]Deng H, Wang JM, Li M, et al. Long non-coding RNAs: New biomarkers for prognosis and diagnosis of colon cancer[J]. Tumour Biol, 2017, 39(6):1010428317706332. doi: 10.1177/1010428317706332.
[25]Shi T, Gao G, Cao Y. Long Noncoding RNAs as Novel Biomarkers Have a Promising Future in Cancer Diagnostics[J]. Dis Markers, 2016, 2016:9085195. doi: 10.1155/2016/9085195.
[26]Lim S, Kaldis P. Cdks, cyclins and CKIs: roles beyond cell cycle regulation[J]. Development, 2013, 140(15):3079-3093. doi: 10.1242/dev.091744.
[27]John RR, Malathi N, Ravindran C, et al. Mini review: Multifaceted role played by cyclin D1 in tumor behavior[J]. Indian J Dent Res, 2017, 28(2):187-192. doi: 10.4103/ijdr.IJDR_697_16.
[28]Qie S, Diehl JA. Cyclin D1, cancer progression, and opportunities in cancer treatment[J]. J Mol Med (Berl), 2016, 94(12):1313-1326. doi: 10.1007/s00109-016-1475-3.
[29]Ferrer JL, Dupuy J, Borel F, et al. Structural basis for the modulation of CDK-dependent/independent activity of cyclin D1[J]. Cell Cycle, 2006, 5(23):2760-2768. doi: 10.4161/cc.5.23.3506.
[30]Johnson J, Thijssen B, McDermott U, et al. Targeting the RB-E2F pathway in breast cancer[J]. Oncogene, 2016, 35(37):4829-4835. doi: 10.1038/onc.2016.32.
[31]Fischer M, Müller GA. Cell cycle transcription control: DREAM/MuvB and RB-E2F complexes[J]. Crit Rev Biochem Mol Biol, 2017, 52(6):638-662. doi: 10.1080/10409238.2017.1360836.
