直肠癌约占全球每年诊断癌症和癌症相关死亡的10%。它是女性第二常见的癌症,男性第三常见的癌症。在女性中,发病率和病死率比男性约低25%。预计到2035年,全世界结直肠癌的发病率将增加到250万例[1-2]。直肠癌的预后与多种因素密切相关,包括肿瘤侵入肠壁的深度、肿瘤相关的淋巴结数目、肠壁外静脉侵犯(extramural v e n o u s i n v a s i o n,E M V I)、直肠中筋膜侵犯(involvement of the mesorectal fascia,MRF)和腹膜侵犯[3]。准确的术前评估这些预后因素对于选择新辅助治疗和制定手术方式以优化完全切除至关重要。为了改进患者个体化治疗方案的选择,亟待需要能够区分早期肿瘤和晚期肿瘤的精准成像技术。在直肠癌的术前评估中使用的方法包括计算机断层扫描(computed tomography,CT)、直肠腔内超声(endorectal ultrasound,EUS)和磁共振成像(magnetic resonance imaging,MRI)[4]。CT在直肠癌系统性扩散的评估中起着重要作用,但在局部区域分期中的作用有限。EUS适用于评估肿瘤侵袭的程度,尤其是早期或浅表性直肠癌[5-6]。 最近的指南推荐直肠EUS作为直肠癌MRI禁忌证病例分期的二线方法[7]。MRI常被用来评估术前分期和周围切缘受累,有助于为患者制定最佳治疗策略及评估复发风险[8-10]。相对于1.5T MRI,3.0T MRI具有更好的信噪比,可在不损害图像质量的前提下增加空间分辨率、薄层扫描、提高矩阵[11]。
基于上述,本研究旨在对比分析EUS与高分辨薄层直肠MRI新序列(3.0T RESOLVE-DWI)术前评估与直肠癌术后病理结果。
1 资料与方法
1.1 一般资料
前瞻性选择2016年2月—2018年5月于我院行E U S 与高分辨薄层直肠M R I 新序列检查且行直肠癌根治性切除术的8 9 例患者为研究对象,其 中 男5 3 例,女3 6 例,年 龄2 9 ~7 8 岁,平 均 年龄(6 0.1 2±9.5 3)岁;肿瘤下缘距肛缘距离(4.22±2.26)cm。本研究经我院伦理委员会同意,患者均签署知情同意书。
1.2 纳入排除标准
纳入标准:⑴ 术后病理确诊直肠癌;⑵ 行直肠癌根治性手术;⑶ 术前行EUS与MRI检查。排除标准:⑴ 术前联合放化疗;⑵ 有盆腔磁共振检查禁忌证;⑶ 未行直肠癌根治性手术;⑷ 影像学检查图像不清楚;⑸ 临床资料不全者。
1.3 检查与评估方法
1.3.1 EUS 所有患者均采用Mylab90 彩色超声仪(意大利百胜医疗有限公司),端扫式直肠腔内超声探头,频率5~10 Hz,患者清洁灌肠后行腔内超声检查[10-11]。
1.3.2 高分辨薄层直肠MRI 新序列扫描 采用Siemens 3.0T Skyra MR 扫描仪,Body 18 通道相控阵列线圈。检查前2 h 肛注开塞露清肠道,肠腔内不使用任何对比剂,检查时嘱患者尽量保持平静呼吸,减少身体运动[8]。
1.3.3 病理检查 全部手术标本经10%福尔马林溶液固定,常规石蜡包埋,5 μm 厚度切片,HE 染色[12]。
以上均由2名副高级以上影像医师或病理医师同时阅片,共同决定。
1.4 观察指标
分析EUS、高分辨薄层直肠MRI新序列检查对直肠癌的诊断效能,包括敏感度、特异度、准确度、阳性预测值、阴性预测值。
1.5 统计学处理
采用SPSS 20.0分析数据,计量资料采用均 数±标准差 )表示,计数资料采用率(%)表 示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
)表示,计数资料采用率(%)表 示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 EUS 和MRI 对直肠癌浸润深度(T 分期)的诊断价值
EUS对89例直肠癌T分期与术后病理分期比较分析发现,因为6例患者呈狭窄浸润型病变,超声探头无法进入;3例病灶较小,EUS未发现病变,所以9例患者未进行T分期。EUS和MRI对直肠癌的术前评估与术后病理T分期的对比详细数据见表1,分析发现EUS对直肠癌的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值在T1期分别为80.0%、90.8%、88.8%、66.7%、95.2%;T2期分别为28.6%、83.1%、68.8%、37.5%、76.6%;T3期分别为8 2.9%、6 9.2%、7 6.3%、7 3.9%、7 9.4%;T4期分别为0.0%、1 0 0.0%、9 6.3%、0.0%、96.3%(77/80)。MRI对直肠癌的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值在T1期分别为83.3%、95.8%、93.3%、83.3%、9 5.8%;T2期分别为5 4.5%、8 2.1%、7 5.3%、5 0.0%、8 4.6%;T3期分别为7 9.1%、8 4.8%、82.0%、82.9%、81.3%;T4期分别为100.0%、100.0%、100.0%、100.0%、100.0%(83/83) (表2)。E U S、M R I 对T 分期总准确度分别为6 5.0%、7 5.3%,组间比较有统计学差异(P<0.05)。EUS、MRI对T过高分期分别占15.0%、11.2%;EUS、MRI对T过低分期分别占20.0%、 13.5%;组间比较均无统计学差异(P>0.05)(表3)。
表1 EUS 和MRI 对直肠癌的术前评估与术后病理T 分期的对比
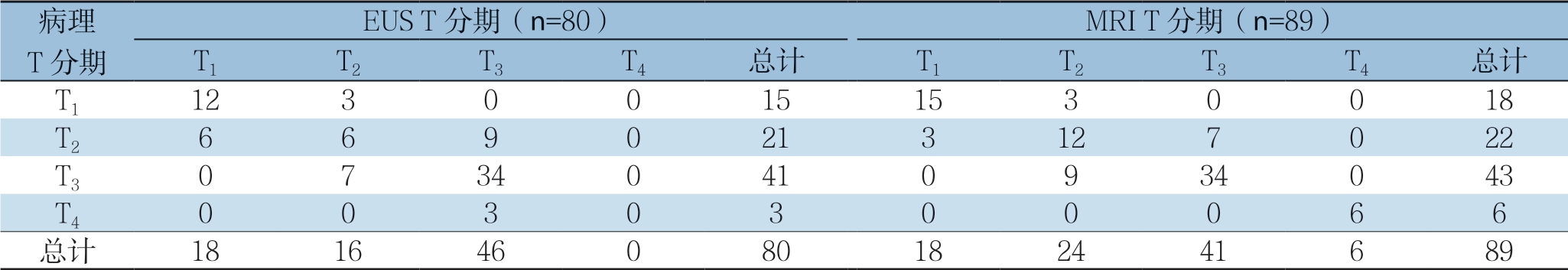
表2 EUS 和MRI 对直肠癌T1~T4 各分期的诊断价值比较(%)

表3 EUS 和MRI 对直肠癌T 分期评估准确、过高或过低的对比

2.2 EUS 和MRI 对癌淋巴结转移(N 分期)的诊断价值
EUS对89例直肠癌N分期与术后病理分期比较分析发现,9例患者因浸润型病变导致管腔狭窄或病变位置较高探头未探而未行N分期。EUS和MRI对直肠癌的术前评估与术后病理N分期的对比详细数据见表4,分析发现EUS对直肠癌N分期的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值分别为54.5%、75.9%、70.0%、46.2%、8 1.5%;M R I 分别为6 0.0%、8 4.4%、7 8.5%、60.0%、84.4%(表5)。EUS、MRI对N分期总准确度分别为70.0%、78.5%,组间比较无统计学差异(P>0.05)。EUS、MRI对N过高分期分别占17.5%(14/80)、11.2%(10/89),EUS、MRI对N过低分期分别占12.5%(10/80)、11.2%(10/89),组间比较无统计学差异(P>0.05)。
表4 EUS 和MRI 对直肠癌的术前评估与术后病理N 分期的对比
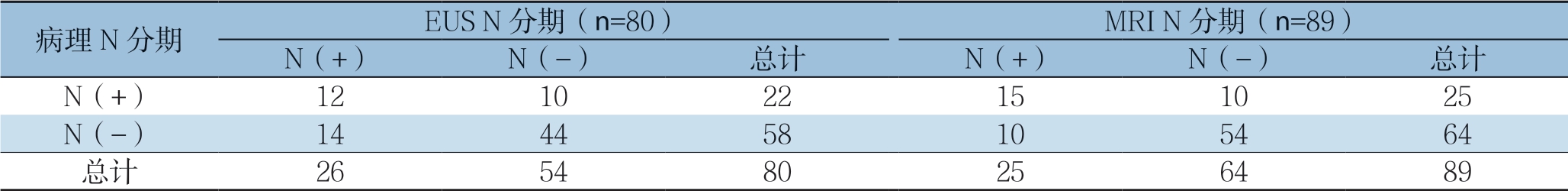
表5 EUS 和MRI 对直肠癌N 分期的诊断价值比较(%)

3 讨 论
结直肠癌是世界范围内的主要公共卫生问题,在美国,2 0 1 9 年大约有4 4 1 8 0 例直肠癌被诊断[13]。年轻人直肠癌的发病率日益增加[14]。来自监测、流行病学和最终结果数据库的资料[15]显示,从1974—2010年,50岁以下患者的结直肠癌诊断显著增加,并预测到2030年,20~34岁患者的直肠癌发病率将增加124.2%。直肠癌的影像学在过去20年里有了显著的发展,越来越多地应用于临床,其目的是帮助直肠癌检测、定性和分期。直肠癌的准确分期具有广泛的意义,包括治疗策略和预后。早期直肠癌的治疗目标是优化肿瘤预后,同时尽量减少治疗对生活质量的影响。手术治疗为直肠癌患者的治疗首选,而淋巴结清扫是直肠癌手术治疗的重要方面[16-20]。分期的改变可能导致术前需要新辅助治疗以降低复发的风险。评估直肠癌分期常用的方法有CT、EUS和MRI[21-26]。本研究旨在对比EUS与3.0T RESOLVE-DWI术前评估与直肠癌术后病理结果。
既往有研究[27]报道,EUS对直肠癌T分期的准确度为63%~96%。本研究中,EUS、MRI对直肠癌T分期总准确度分别为65.0%、75.3%,两者有统计学差异(P<0.05),显示MRI对T分期总准确度优于EUS。分析EUS和MRI对直肠癌T1~T4各分期的诊断价值数据发现,MRI和EUS差异无统计学意义,可见两者各具优势。Oien等[28]研究证实,MRI较EUS对术前T分期具有更高的诊断准确度,与本研究结果一致。任圣会等[7]研究显示,与MRI相比,E U S 检查对直肠癌术前T 分期诊断符合率高,与本研究结果相反,分析原因可能与EUS操作者的熟练高、经验丰富或者早期病例较多有关。此外,Maas等[29]发现EUS倾向于将T1肿瘤夸大为T2~T3(16/24),MRI会将多数腺瘤夸大为T1~T2肿瘤(18/22),我们研究中发现,EUS、MRI对 T过高分期分别占15.0%、11.2%;EUS、MRI对 T过低分期分别占20.0%、13.5%;组间无统计学差异(P>0.05)。证实EUS准确度略低的原因为过高分期和过低分期占比均较多,主要是由于对T2和T3期判断有误,分析原因为EUS无法准确区分病变周围炎性反应及肿瘤组织,MRI也存在类似问题。因此仍需要更大规模的研究来解决这些难题。
直肠癌的N 分期是通过评估直肠周围淋巴结在恶性浸润中的变化来确定的。EUS、MRI对 N 分期总准确度分别为7 0.0%、7 8.5%,组间无统计学差异(P>0.05)。卢凯等[30]研究也发现,MRI对N分期的诊断价值较好;Puli等[31]认为EUS在排除淋巴结侵犯方面比证实淋巴结阳性疾病更有效。E U S、M R I 对直肠癌N 分期过高分期分别占17.5%(14/80)、11.2%(10/89);EUS、MRI对N过低分期分别占12.5%(10/80)、11.2%(10/89);组间无统计学差异(P>0.05),可能是因为EUS对直肠周围区域的淋巴结显示不良 所致。
此外,本研究中M R I 对直肠癌的T 分期准确度较高,可能是因为3T-MRI能更好地区分T1~T2和交界性T3肿瘤,有助于区分T1~T2肿瘤中的结缔组织增生和T3肿瘤中的癌细胞滞留。分析文献进行总结发现,EUS的优势在于:⑴ 可以结合细针穿刺活检术(fine needle aspiration,FNA)行术前病理诊断;⑵ 对10 cm以下且表面平坦的直肠癌在早期阶段建议采用EUS分期[32]。劣势在于:⑴ 对操作者的依赖性较强;⑵ 对肠腔狭窄或位置较高的病变评估困难;⑶ 容易受角度、气体、粪石等因素影响;⑷ 无法观察直肠系膜及固有筋膜的情况;⑸ 无法显示远处淋巴结的情况;⑹ 无法辨识尚未形成典型形态学改变的微转移淋巴结。MRI的优势在于:⑴ 具有良好的软组织(直肠系膜及环周切缘)分辨能力;⑵ DWI技术和动态增强扫描有助于提高对良恶性淋巴结的鉴别能力;⑶ 不受病变位置及肠腔狭窄因素的影响;⑷ 可判断有无远处转移;⑸ 对操作者的依赖性较小。劣势在于:⑴ 对于有幽闭恐惧症或体内放置非钛金属物者禁止实施MRI检查; ⑵ 价格昂贵;⑶ 对于超低位病变显示效果不佳。两者共同的缺点为:难以鉴别肿瘤周围的炎性细胞浸润、结缔组织增生与肿瘤特别是微小肿瘤浸润而导致过度分期或分期不足。
综上,高分辨薄层直肠MRI新序列扫描对直肠癌T分期的准确度较EUS有一定优势。综合已有文献可见在发达国家,结直肠癌外科医生和肿瘤学家提交EUS分期的病例数量在过去10年中稳步下降,主要原因是高质量的最新一代MRI在指导手术计划和为T3/T4患者提供T期方面具有优势。只有在MRI检查后,需要确定T1/T2期,或在MRI上发现淋巴结时,外科或医学/放射肿瘤学家才需要提交EUS-FNA。虽然MRI技术的改进使其在某些临床情况下可与EUS相比,甚至优于EUS,但在许多实际情况中,EUS仍是一个更方便的选择。此外,MRI对患者的侵袭性较小,而EUS会引起患者不适。然而,可能有一些国家和医院没有新的MRI技术,但有1名经验丰富的内窥镜检查医生可执行EUS检查,那么EUS也是一个较好的选择。因此,究竟选择哪种检查方法,需综合考量患者、医院和医师的综合实力,因时因地制宜。在今后的研究中我们将纳入多中心患者,深入挖掘和分析各种术前检查方法的利弊,参照已有的专家共识,制定更科学有效的个体化治疗方案,为患者提供更好的医疗保障和生活质量。
[1]Dekker E, Tanis PJ, Vleugels JLA, et al. Colorectal cancer[J]. Lancet, 2019, 394(10207):1467-1480. doi: 10.1016/S0140-6736(19)32319-0.
[2]Rouleau-Fournier F, Brown CJ. Can less be more? Organ preservation strategies in the management of rectal cancer[J]. Curr Oncol, 2019, 26(Suppl 1):S16-23. doi: 10.3747/co.26.5841.
[3]Curvo-Semedo L. Rectal Cancer: Staging[J]. Magn Reson Imaging Clin N Am, 2020, 28(1):105-115. doi: 10.1016/j.mric.2019.09.003.
[4]Boot J, Gomez-Munoz F, Beets-Tan RGH. Imaging of rectal cancer[J]. Radiologe, 2019, 59(Suppl 1):46-50. doi: 10.1007/s00117-019-0579-5.
[5]Hasak S, Kushnir V. Rectal Endoscopic Ultrasound in Clinical Practice[J]. Curr Gastroenterol Rep, 2019, 21(4):18. doi: 10.1007/s11894-019-0682-9.
[6]魏珏, 沈杰, 胡志前, 等. 经肠超声内镜检查对直肠癌分期的诊断价值[J]. 中华消化杂志, 2018, 38(3):177-181. doi:10.3760/cma.j.issn.0254-1432.2018.03.008. Wei J, Shen J, Hu ZQ, et al. Diagnostic value of endoscopic ultrasonography in staging of rectal cancer[J]. Chinese Journal of Digestion, 2018, 38(3):177-181. doi: 10.3760/cma.j.issn.0254-1432.2018.03.008.
[7]任圣会, 孙晓峰, 王权, 等.直肠腔内超声与MRI检查对直肠癌术前T分期及环周切缘的评估价值[J]. 中华消化外科杂志, 2019, 18(1):96-101. doi:10.3760/cma.j.issn.1673-9752.2019.01.018. Ren SH, Sun XF, Wang Q, et al. Value of endorectal ultrasonography and MRI examination in the preoperative evaluation of T staging and circumferential resection margin of rectal cancer[J]. Chinese Journal of Digestive Surgery, 2019, 18(1):96-101. doi: 10.3760/cma.j.issn.1673-9752.2019.01.018.
[8]Krdzalic J, Maas M, Gollub MJ, et al. Guidelines for MR imaging in rectal cancer: Europe versus United States[J]. Abdom Radiol (NY), 2019, 44(11):3498-3507. doi: 10.1007/s00261-019-02251-5.
[9]Beets-Tan RGH, Lambregts DMJ, Maas M, et al. Magnetic resonance imaging for clinical management of rectal cancer: Updated recommendations from the 2016 European Society of Gastrointestinal and Abdominal Radiology (ESGAR) consensus meeting[J]. Eur Radiol, 2018, 28(4):1465-1475. doi: 10.1007/s00330-017-5026-2.
[10]Marone P, de Bellis M, D'Angelo V, et al. Role of endoscopic ultrasonography in the loco-regional staging of patients with rectal cancer[J]. World J Gastrointest Endosc, 2015, 7(7):688-701. doi: 10.4253/wjge.v7.i7.688.
[11]丁静静, 罗金龙, 曾瑞腾, 等. 高分辨薄层直肠核磁共振新序列(3.0T RESOLVE-DWI)在直肠癌临床分期中的价值评估[J]. 中华结直肠疾病电子杂志, 2018, 7(5):431-436. doi:10.3877/cma.j.issn.2095-3224.2018.05.005. Ding JJ, Luo JL, Zeng RT, et al. Evaluation of high resolution thin slice rectal magnetic resonance imaging (3.0T RESOLVEDWI) in clinical staging of rectal cancer[J]. Chinese Journal of Colorectal Diseases, 2018, 7(5):431-436. doi: 10.3877/cma.j.issn.2095-3224.2018.05.005.
[12]李静, 刘绍伟, 殷长俊. 小视野、薄层T2WI的直肠癌术前表现与病理结果的对比研究[J]. 医学影像学杂志, 2017, 27(11):2176-2179. Li J, Liu SW, Yin CJ. Small field of view and thin section T2-weighted imaging in rectal cancer with its pathological findings: a comparison study[J]. Journal of Medical Imaging, 2017, 27(11):2176-2179.
[13]Feeney G, Sehgal R, Sheehan M, et al. Neoadjuvant radiotherapy for rectal cancer management[J]. World J Gastroenterol, 2019, 25(33):4850-4869. doi: 10.3748/wjg.v25.i33.4850.
[14]徐谊, 赵晓牧, 王今. 年轻人结直肠癌的诊疗进展[J]. 中国普通外科杂志, 2018, 27(4):500-505. doi:10.3978/j.issn.1005-6947.2018.04.016. Xu Y, Zhao XM, Wang J. Advance in diagnosis and treatment of young-onset colorectal cancer[J]. Chinese Journal of General Surgery, 2018, 27(4):500-505. doi:10.3978/j.issn.1005-6947.2018.04.016.
[15]Bailey CE, Hu CY, You YN, et al. Increasing disparities in the agerelated incidences of colon and rectal cancers in the United States, 1975-2010[J]. JAMA Surg, 2015, 150(1):17-22. doi: 10.1001/jamasurg.2014.1756.
[16]Goldenberg BA, Holliday EB, Helewa RM, et al. Rectal Cancer in 2018: A Primer for the Gastroenterologist[J]. Am J Gastroenterol, 2018, 113(12):1763-1771. doi: 10.1038/s41395-018-0180-y.
[17]陈致奋. AJCC与JSCCR对直肠癌盆腔侧方淋巴结定义演变的解读[J]. 中国普通外科杂志, 2019, 28(4):387-391. doi:10.7659/j.issn.1005-6947.2019.04.002. Chen ZF. Interpretation of evolving definitions for lateral pelvic lymph nodes proposed by AJCC and JSCCR[J]. Chinese Journal of General Surgery, 2019, 28(4):387-391. doi:10.7659/j.issn.1005-6947.2019.04.002.
[18]Russo S, Anker CJ, Abdel-Wahab M, et al. Executive Summary of the American Radium Society Appropriate Use Criteria for Local Excision in Rectal Cancer[J]. Int J Radiat Oncol Biol Phys, 2019, 105(5):977-993. doi: 10.1016/j.ijrobp.2019.08.020.
[19]韩彩文, 闫沛静, 蔡辉, 等. 机器人辅助和腹腔镜手术治疗直肠癌疗效与安全性比较的meta分析[j]. 中国普通外科杂志, 2019, 28(4):399-406. doi:10.7659/j.issn.1005-6947.2019.04.004. Han CW, Yan PJ, Cai H, et al. Efficacy and safety of roboticassisted versus conventional laparoscopic proctectomy: a Metaanalysis[J]. Chinese Journal of General Surgery, 2019, 28(4):399-406. doi:10.7659/j.issn.1005-6947.2019.04.004.
[20]罗维民, 温翠婷, 胡丰良. 加速康复外科策略在老年结直肠癌腹腔镜手术治疗的应用及其对免疫功能和炎性因子的影响[J]. 中国普通外科杂志, 2019, 28(4):512-518. doi:10.7659/j.issn.1005-6947.2019.04.019. Luo WM, Wen CT, Hu FL. Implementation of enhanced recovery of surgery strategy in laparoscopic surgical treatment of colorectal cancer in elderly patients and its effect on immune function and inflammatory factors [J]. Chinese Journal of General Surgery, 2019, 28(4):512-518. doi:10.7659/j.issn.1005-6947.2019.04.019.
[21]Hoeffel C, Mulé S, Laurent V, et al. Current imaging of rectal cancer[J]. Clin Res Hepatol Gastroenterol, 2015, 39(2):168-173. doi: 10.1016/j.clinre.2014.07.014.
[22]Ortega CD, Perez RO. Role of magnetic resonance imaging in organ-preserving strategies for the management of patients with rectal cancer[J]. Insights Imaging, 2019, 10(1):59. doi: 10.1186/s13244-019-0742-6
[23]Nougaret S, Jhaveri K, Kassam Z, et al. Rectal cancer MR staging: pearls and pitfalls at baseline examination[J]. Abdom Radiol (NY), 2019, 44(11):3536-3548. doi: 10.1007/s00261-019-02024-0.
[24]Brown PJ, Hyland R, Quyn AJ, et al. Current concepts in imaging for local staging of advanced rectal cancer[J]. Clin Radiol, 2019, 74(8):623-636. doi: 10.1016/j.crad.2019.03.023.
[25]Schurink NW, Lambregts DMJ, Beets-Tan RGH. Diffusionweighted imaging in rectal cancer: current applications and future perspectives[J]. Br J Radiol, 2019, 92(1096):20180655. doi: 10.1259/bjr.20180655.
[26]Horvat N, Petkovska I, Gollub MJ. MR imaging of rectal cancer[J]. Radiol Clin North Am, 2018, 56(5):751-774. doi: 10.1016/j.rcl.2018.04.004.
[27]Marusch F, Koch A, Schmidt U, et al. Routine use of transrectal ultrasound in rectal carcinoma: results of a prospective multicenter study[J]. Endoscopy, 2002, 34(5):385-390. doi: 10.1055/s-2002-25292.
[28]Oien K, Forsmo HM, Rösler C, et al. Endorectal ultrasound and magnetic resonance imaging for staging of early rectal cancers: how well does it work in practice?[J]. Acta Oncol, 2019, 58(sup1):S49-54. doi: 10.1080/0284186X.2019.1569259.
[29]Maas M, Lambregts DM, Lahaye MJ, et al. T-staging of rectal cancer: accuracy of 3.0 Tesla MRI compared with 1.5 Tesla[J]. Abdom Imaging, 2012, 37(3):475-481. doi: 10.1007/s00261-011-9770-5.
[30]卢凯, 汪加亮, 毛芸, 等. 直肠腔内超声与MRI对直肠癌术前分期评价[J]. 临床放射学杂志, 2017, 36(5):682-686. Lu K, Wang JL, Mao Y, et al. The Evaluation of ERUS and MRI in Preoperative Staging of Rectal Cancer[J]. Journal of Clinical Radiology, 2017, 36(5):682-686.
[31]Puli SR, Reddy JB, Bechtold ML, et al. Accuracy of endoscopic ultrasound to diagnose nodal invasion by rectal cancers: a metaanalysis and systematic review[J]. Ann Surg Oncol, 2009, 16(5):1255-1265. doi: 10.1245/s10434-009-0337-4.
[32]范小晶. 磁共振成像在直肠癌诊断、分期的应用及与直肠腔内超声对直肠癌术前局部分期的价值比较[D]. 北京:北京协和医学院, 2013. Fan XJ. Application of T High-Resolution Magnetic Resonance Imaging in Preoperative TN Staging of Rectal Cancer[D]. Beijing: Peking Union Medical College, 2013.
