原发性肝癌是我国常见的恶性肿瘤之一,肝切除手术作为主要治疗方式要求在彻底清除病灶的同时保留足够的肝实质。剩余肝脏的功能会对肝切除患者短期预后产生决定性影响[1]。许多患者就诊时肿瘤体积较大,未来残余肝脏(future liver remnant,FLR)不足,面临着术后肝脏功能衰竭(post-hepatectomy liver failure,PHLF)的风险。PHLF是肝切除手术相关死亡的主要原因[2]。现有研究[3-4]认为术前门静脉栓塞术(portal vein embolism,PVE)和肝脏离段联合门静脉结扎二期肝切除术(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)是提高原发性肝癌患者肝脏储备功能的方式,但是有学者发现“体积”和“功能”的变化并不同步。因此术前准确评估肝脏区域功能有着重要意义,尤其需要注意评估预留侧肝叶储备功能[5-6]。在原发性肝癌患者中,其区域肝功能一般受到多种因素影响,肝实质功能并不均匀一致,此时单纯依靠电子计算机断层扫描(computed tomography,CT)进行体积测量无法区分功能性和非功能性的肝组织,而核医学显像技术在此方面具备优势[7-8]。放射性核素标记的半乳糖酰人血白蛋白(acid-galactosyl-human serum album,GSA)可以特异性地与肝细胞表面去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGP-R)结合,经过单光子发射型计算机断层显像扫描(single-photon emission computed tomography,SPECT)检查后,通过数学模型可以计算得到肝脏功能性指标[9]。目前已有99mTc-GSA研究表明,当胆道、门静脉、肝静脉受累时,其相应的区域肝功能会出现不同程度的下降[10-14]。当进行肝脏区域放疗时,肝功能也会受到不同程度损害[15-17]。现有研究表明荷瘤肝叶功能下降[12],但是体积较大的肿瘤对周围肝组织压迫导致的区域功能变化定量研究尚未见报道。本研究目的是探讨原发性肝癌的机械性压迫对邻近肝组织功能的影响。
1 资料与方法
1.1 一般资料
收集2010年1月—2014年12月解放军总医院45例原发性肝癌患者SPECT/CT影像学以及临床资料,其中男34例,女11例;年龄36~72岁,平均年龄(52±10)岁。45例患者中,原发性肝癌单发34例,多发11例;肿瘤位于肝左叶11例,位于肝右叶31例,位于双侧肝叶3例。14例患者入院影像学检查诊断或经术后病理证实门静脉、肝静脉、胆管存在癌栓和/或受到肿瘤侵犯和/或接受过肝脏放射治疗,设为肝功能受累组(受累组);31例患者术前影像学检查诊断门静脉、肝静脉、胆管形态结构正常且未接受过肝脏放射治疗,设为肝功能未受累组(未受累组)。本研究遵循赫尔辛基宣言原则,所有患者及家属均签署知情同意书并通过医院伦理委员会批准。
1.2 纳入标准和排除标准
纳入标准:⑴ 经影像学诊断或术后病理诊断为原发性肝癌;⑵ 影像学和临床资料完整;⑶ 住院期间进行过动态SPECT99mT-GSA检查。排除标准:⑴ 存在肝外占位性病变侵犯或压迫肝脏;⑵ 住院期间未行动态SPECT99mT-GSA检查;⑶ SPECT99mT-GSA检查前有化学治疗史;⑷ 影像学和临床资料缺失。
1.3 方法
1.3.1 动态SPECT/CT99mTc-GSA检查 SPECT/CT 成像仪器为Siemens Symbia T6,扫描方法参考文献[18],患者取仰卧位并且双手置于头侧,探头对准上腹部肝脏位置行CT 扫描,其后调整检查床到SPECT位置。SPECT 扫描使用低能高分辨准直器,双探头处于垂直位置,使用5 mCi99mTc 原液与3 mg GSA(北京师宏药物研制中心)配置成99mTc-GSA 静置10 min后,通过静脉弹丸注射,并立即启动动态断层采集程序,双探头距旋转中心26 cm 固定,围绕中心作时长1 min 的180°连续旋转采集。动态断层采集共26帧,前25帧每1 min 采集1帧,最后1帧为5 min 采集。后续分析处理以CT 与SPECT 第26帧断层图像的融合为基础,在设备自带的后处理工作站中进行。
1.3.2 形态学体积(morphological liver volume,MLV)的计算 在CT图像上距离肿瘤周边2、4、6 cm 画出D1、D2、D3区域(图1),利用PACS系统自动计算出相应区域的面积,再乘以相应的层厚,相加后便能计算出MLV。画出半肝区域后,同样方法可计算出左肝及右肝MLV。
1.3.3 功能性体积(functional liver volume,FLV)的计算 汇总最后5帧同一层面的重建图像,确定单个体素(voxel)的最大计数值。根据文献报告的模型[19],计算D1、D2、D3区域与左肝、右肝的FLV。
1.3.4 肝细胞摄取速率常数(hepatocyte uptake rate constant,GSA-K)的计算 依据C(t)=Cmax(1-e-kt)函数拟合各个目标区域的计数率C(t)-时间(t)曲线,t1/2 为到达曲线平台期值1/2 时的时间,利用t1/2 计算得出参数K,从而得到各目标区域的GSA-K。
1.3.5 功能性肝密度(functional liver density,FLD)的计算 根据文献[12],由MLV 和FLV 进一步计算出相应区域的FLD。
1.4 观察指标
⑴ 受累组两侧肝叶MLV、FLV、FLD和GSA-K的比较。⑵ 两组内D1~D3区域的MLV、FLV、FLD和GSA-K的比较。⑶ 影响未受累组原发性肝癌邻近肝组织功能相关影响因素分析:D1~D3区域FLD的相关影响因素,包括性别、年龄、BMI、Child-Pugh分级、肝硬化、PLT、TBIL、ALT、AFP、ICG-K、肿瘤直径、肿瘤体积、肿瘤TNM分期。评价标准:肿瘤分期参照AJCC和国际抗癌联盟(UICC)第8版肝癌TNM分期标准。
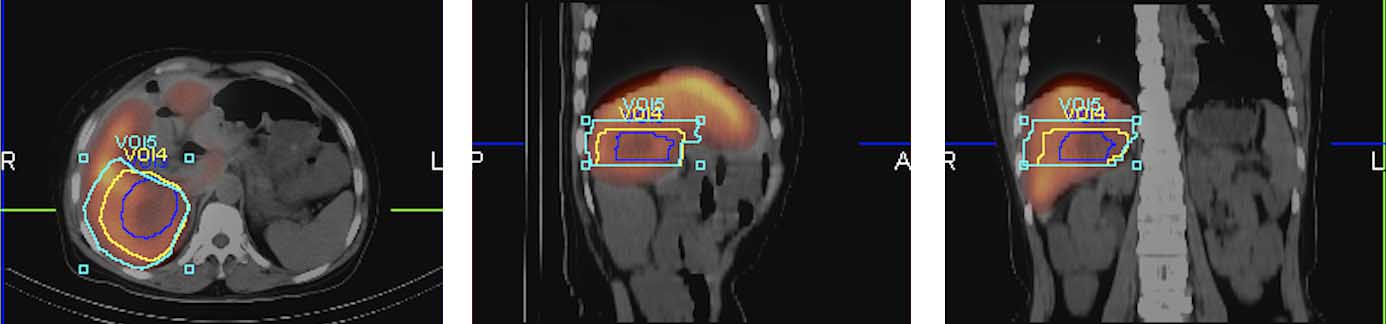
图1 肿瘤位于右肝(低摄取区域),肿瘤边缘与蓝色线围成区域为D1区域;蓝色线与黄色线之间为D2区域;黄色线与青绿色线之间为D3区域
Figure1 The tumor located in the right liver (low uptake area),D1:the area surrounded by the edge of the tumor and the blue line;D2:the area between the blue line and the yellow line;D3:the area between the yellow line and the cyan line
1.5 统计学处理
应用SPSS 25.0统计软件进行分析。正态分布的计量资料以均数±标准差(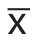 ±s)表示,两组间比较采用t检验,多组间比较采用方差分析。偏态分布的计量资料以中位数(M)表示,两组间比较采用Mann-Whitney U秩和检验,多组间比较采用Kruskal-Wallis H秩和检验。计数资料以绝对数表示,组间比较采用χ2检验或Fisher确切概率法。采用Pearson或Spearman分析进行相关性分析后,进一步使用多元线性回归(逐步回归)进行多因素分析。P<0.05为差异有统计学意义。
±s)表示,两组间比较采用t检验,多组间比较采用方差分析。偏态分布的计量资料以中位数(M)表示,两组间比较采用Mann-Whitney U秩和检验,多组间比较采用Kruskal-Wallis H秩和检验。计数资料以绝对数表示,组间比较采用χ2检验或Fisher确切概率法。采用Pearson或Spearman分析进行相关性分析后,进一步使用多元线性回归(逐步回归)进行多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 受累组两侧肝叶肝功能比较
受累组内2例患者因肿瘤体积较大完全占据一侧肝叶而排除,余下12例患者肿瘤占据侧肝叶MLV、FLV、GSA-K、FLD值结果分别为(801±351)mL、(241±116)mL、(0.20±0.06)/min、0.32±0.10,另一侧肝叶MLV、FLV、GSA-K、FLD值结果为(643±238)mL、(422±180)mL、(0.20±0.06)/min、0.66±0.14,两侧肝叶之间FLV、FLD值差异有统计学意义(t=2.937、6.869,均P<0.01),而MLV、GSA-K值之间差异无统计学意义(t=-1.290、0.284,均P>0.05)。
2.2 受累组与未受累组内区域肝功能比较
受累组内D1~D3区域MLV、FLD值之间差异有统计学意义(均P<0.05),而FLV、GSA-K值之间差异无统计学意义(均P>0.05)(表1)。进一步进行两组间多重比较发现,D1与D3区域相比MLV值差异有统计学意义(t=3.084,P<0.01),D1与D2、D1与D3区域相比FLD值差异有统计学意义(Z=-2.160、-2.068,均P<0.05)。
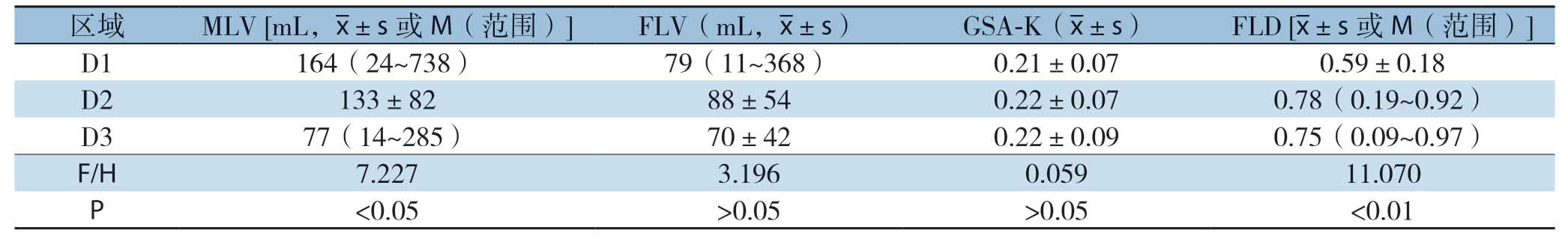
未受累组内D1~D3区域MLV、FLD值之间差异有统计学意义(P<0.05或P<0.01),而FLV、GSA-K值之间差异无统计学意义(均P >0.05)(表2)。进一步进行两组间多重比较发现,D1与D3区域相比MLV值差异有统计学意义(Z=-2.612,P<0.01),D1与D2、D1与D3区域相比FLD值差异有统计学意义(Z=-3.020、-2.654,P<0.01)。
表1 受累组不同区域肝功能指标的比较(n=14)
Table1 Comparison of liver function indexes in different regions of the affected group (n=14)
?
表2 未受累组不同区域肝功能指标的比较(n=31)
Table2 Comparison of liver function indexes in different regions of the non-affected group (n=31)
区域MLV [mL,images/BZ_83_475_811_508_856.png±s 或M(范围)]FLV(mL,images/BZ_83_475_811_508_856.png±s)GSA-K(images/BZ_83_475_811_508_856.png±s)FLD [images/BZ_83_475_811_508_856.png±s 或M(范围)]D1 164(24~738) 79(11~368) 0.21±0.07 0.59±0.18 D2 133±82 88±54 0.22±0.07 0.78(0.19~0.92)D3 77(14~285) 70±42 0.22±0.09 0.75(0.09~0.97)F/H 7.227 3.196 0.059 11.070 P<0.05 >0.05 >0.05 <0.01
2.3 未受累组区域肝功能影响因素分析
相关性分析结果显示:肿瘤直径、肿瘤体积是影响未受累组D1区域FLD值的相关因素(均P<0.05);Child-Pugh分级是影响未受累组D2区域FLD值的相关因素(P<0.05)(表3)。未受累组ICG-K值与D1、D2、D3区域的GSA-K值之间存在相关性(r=0.760,0.790,0.638,P<0.01)。
多元线性回归分析结果显示:肿瘤直径是影响未受累组D1区域FLD值的因素(P <0.05)(表4)。
表3 影响未受累组31例患者D1~D3区域FLD值的相关性分析
Table3 Correlation analysis of FLD values in D1-D3 region of the 31 patients in non-affected group
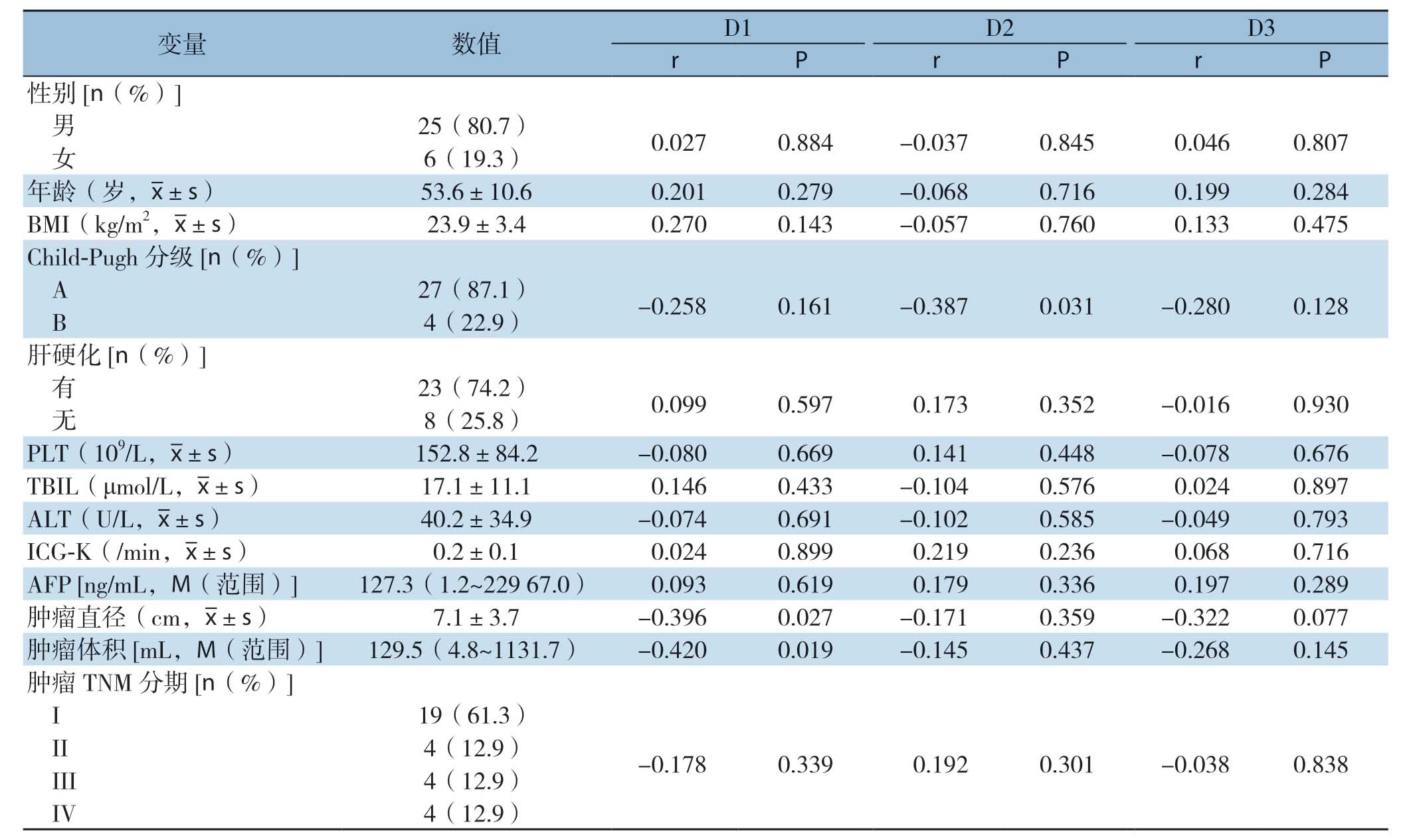
变量 数值 D1 D2 D3 r P r P r P性别[n(%)]男25(80.7) 0.027 0.884 -0.037 0.845 0.046 0.807女6(19.3)年龄(岁,images/BZ_83_475_811_508_856.png±s) 53.6±10.6 0.201 0.279 -0.068 0.716 0.199 0.284 BMI(kg/m2,images/BZ_83_475_811_508_856.png±s) 23.9±3.4 0.270 0.143 -0.057 0.760 0.133 0.475 Child-Pugh分级[n(%)]A 27(87.1) -0.258 0.161 -0.387 0.031 -0.280 0.128 B 4(22.9)肝硬化[n(%)]有23(74.2) 0.099 0.597 0.173 0.352 -0.016 0.930无8(25.8)PLT(109/L,images/BZ_83_475_811_508_856.png±s) 152.8±84.2 -0.080 0.669 0.141 0.448 -0.078 0.676 TBIL(μmol/L,images/BZ_83_475_811_508_856.png±s) 17.1±11.1 0.146 0.433 -0.104 0.576 0.024 0.897 ALT(U/L,images/BZ_83_475_811_508_856.png±s) 40.2±34.9 -0.074 0.691 -0.102 0.585 -0.049 0.793 ICG-K(/min,images/BZ_83_475_811_508_856.png±s) 0.2±0.1 0.024 0.899 0.219 0.236 0.068 0.716 AFP [ng/mL,M(范围)]127.3(1.2~229 67.0) 0.093 0.619 0.179 0.336 0.197 0.289肿瘤直径(cm,images/BZ_83_475_811_508_856.png±s) 7.1±3.7 -0.396 0.027 -0.171 0.359 -0.322 0.077肿瘤体积[mL,M(范围)]129.5(4.8~1131.7) -0.420 0.019 -0.145 0.437 -0.268 0.145肿瘤TNM分期[n(%)]I 19(61.3)II 4(12.9) -0.178 0.339 0.192 0.301 -0.038 0.838 III 4(12.9)IV 4(12.9)
表4 影响未受累组31例患者D1区域FLD值的多元线性回归分析
Table4 Multiple linear regression analysis of FLD values in D1 region of the 31 patients in nonaffected group
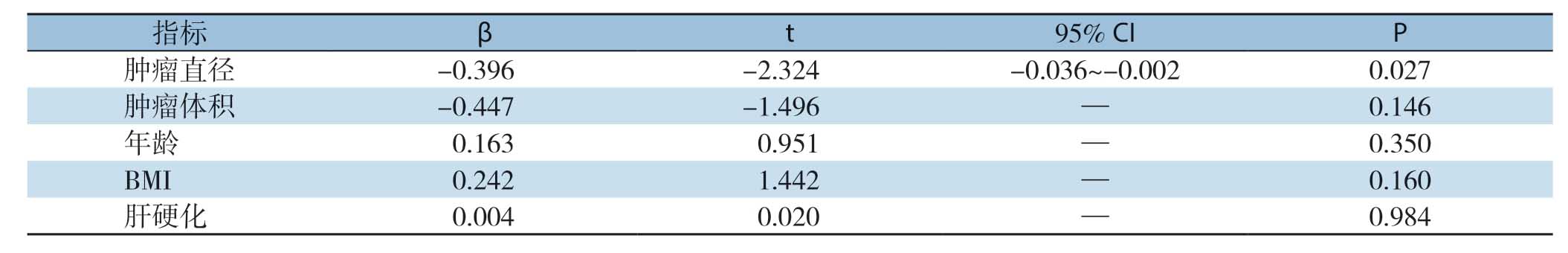
指标 β t 95% CI P肿瘤直径 -0.396 -2.324 -0.036~-0.002 0.027肿瘤体积 -0.447 -1.496 — 0.146年龄 0.163 0.951 — 0.350 BMI0.2421.442—0.160肝硬化 0.004 0.020 — 0.984
2.4 组织病理学改变
组织病理学显示距肿瘤2 cm内区域可观察到肝实质细胞受肿瘤压迫变形,而远离肿瘤区域肝小叶结构正常(图2)。
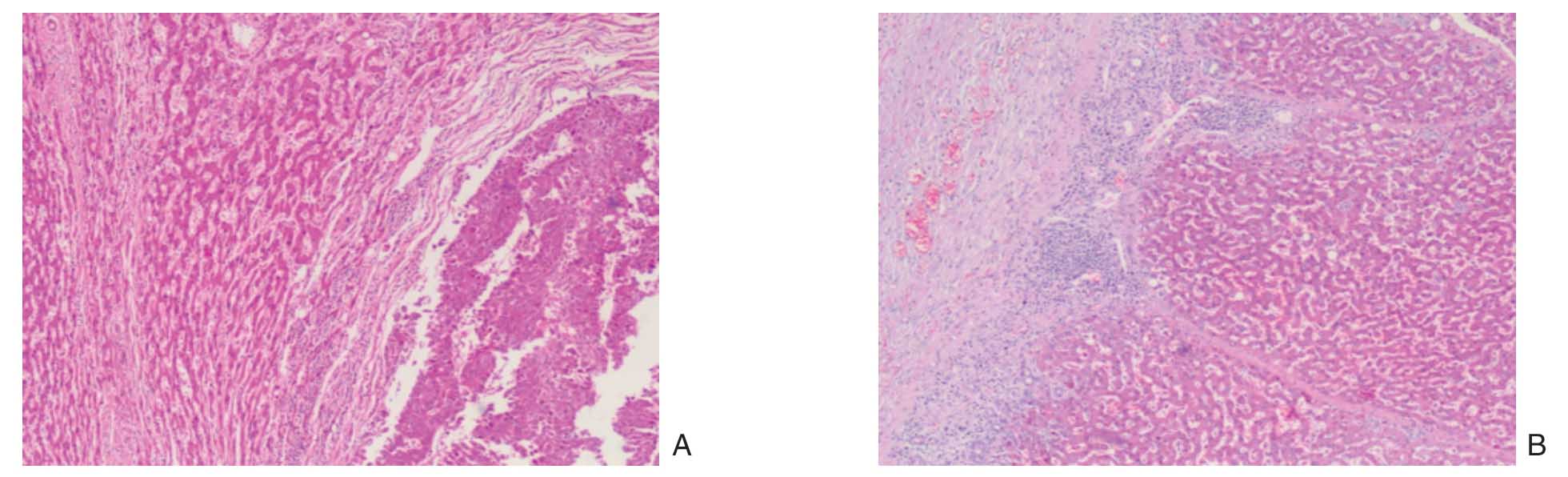
图2 组织病理学表现(HE ×100) A:距肿瘤2 cm 内区域可见肝实质细胞受肿瘤压迫;B:远离肿瘤区域肝小叶正常
Figure2 Histopathological findings (HE ×100) A:Hepatic parenchymal cells compressed by the tumor within 2 cm from the tumor;B:Normal hepatic lobules far away from the tumor
3 讨 论
肝脏区域功能的准确评估是精准外科的重要内容,对避免PHLF有着重要的意义。在肝功能均质的患者中,CT计算得出的形态学体积能准确反映区域肝功能。但是当区域肝功能不均质时,此时使用CT容积法计算的肝体积不能准确地反映出该区域的肝功能[20-21]。99mTc-GSA显像技术可以准确反应区域的功能性肝细胞数量,并计算肝细胞摄取率从而反映区域肝功能。已有研究表明,当胆道存在梗阻、门静脉或肝静脉血流受到影响或存在较大肿瘤的机械性压迫时,其相关肝段区域功能会出现不同程度的下降[10-14]。本研究结果亦显示:当存在脉管受累的情况时,受累侧肝叶FLV及FLD显著低于未受累侧肝叶。这也与笔者团队之前研究结果一致:当一侧门静脉主干受累时,受累侧肝叶/对侧肝叶的FLV比值低于相应的MLV的比值[18]。肝门部胆管癌患者行PVE后,栓塞肝叶FLV及FLD较栓塞前下降[22]。然而,肿瘤机械性压迫对邻近区域肝脏功能的影响尚未见系统性的研究。
本研究首次利用99mTc-GSA显像技术计算得到的FLV、FLD及GSA-K研究距离肿瘤6 cm以内区域的肝功能变化,结果显示,未受累组D1区域FLD显著低于D2和D3区域。这个结果表明肿瘤可能对区域肝脏功能造成影响。进一步分析发现,肿瘤直径与距离肿瘤2 cm的肝实质功能呈负相关,这个结果表明肿瘤压迫可能导致邻近区域肝脏功能下降。既往研究结果显示载瘤侧肝段的FLD均值小于非载瘤侧肝段FLD均值[12],本研究结果进一步定量验证了肿瘤机械性压迫可导致区域功能下降。组织病理学检测也得到一致的结果。已有研究[23-24]提示压迫区域功能改变的可能原因包括:肿瘤周围肝实质胆汁排泄功能障碍,炎症浸润、导管转化、门静脉周围纤维化以及Kupffer细胞增多。
目前随着CT三维重建软件的普及应用,外科医师可以对肿瘤直径>5 cm的原发性肝癌患者定量地进行物理肝体积的术前评估,从而安全地实施肝切除手术[25]。针对预留肝体积不足的原发性肝癌患者,术前增加FLR的方法以PVE和APPLS为主。Nagino等[26-27]研究表明PVE可以安全有效地应用于FLR<40%且总胆红素不高于85.5 μmol/L的胆管癌患者。Terasawa等[28]发现对于直径>5 cm的肝细胞肝癌患者,切除术前肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)联合PVE比单纯PVE可以更明显地刺激FLR增生肥大同时能获得更好的预后。Wang等[3]发现常规不可切除的肝细胞癌患者经过ALPPS不仅可以获得40%以上的FLR,并且术后远期生存率明显优于TACE。Chan等[29]的研究发现在148例肿瘤平均直径>7 cm的肝细胞癌患者中,ALPPS组患者具有较高的肿瘤切除率并且与PVE组患者的预后无明显差异。此外,有研究[30]报道一种改良后的APPLS治疗直径较大的原发性肝癌患者可以获得较高的FLR增长率及总体存活率。但是,目前临床上PVE和APPLS之后区域肝功能的评估存在不准确性。Beppu等[20]研究发现PVE术后FLR功能体积的增长超过了物理体积的增长,其结果提示了使用CT评估肝切除术前肝储备功能可能导致实际肝功能达标的患者选择了非手术治疗的方式。当存在肿瘤压迫时,切除侧的区域肝脏功能下降,使用CT评估时会高估肝实质切除率,同样可能导致手术适应证选择的偏倚,使得部分预留肝脏功能处于边缘状态的患者失去手术机会。
综上所述,本研究首次定量评估了大肝癌邻近肝组织区域的功能,肿瘤的机械性压迫被证实是影响肿瘤邻近肝组织功能,从而导致区域肝功能下降的重要因素。当肿瘤直径较大时,C T形态学体积评估的结果存在高估肝实质切除率的可能。然而本研究存在一些局限性,单中心回顾性研究以及样本量较小可能会对结果产生一定偏倚。此外,本研究入组患者诊断以肝细胞肝癌为主,其他病理类型的原发性肝癌可能需要进一步多中心、大样本的研究验证,以期明确不同类型的肿瘤压迫对周围肝组织功能的影响。
[1]董家鸿,郑树森,陈孝平,等.肝切除术前肝脏储备功能评估的专家共识(2011版)[J].中华消化外科杂志,2011,10(1):20-25.doi:10.3760/cma.j.issn.1673-9752.2011.01.006.
Dong JH,Zheng SS,Chen XP,et al.Consensus on evaluation of Hepatic functional reserve before hepatectomy(2011 edition)[J].Chinese Journal of Digestive Surgery,2011,10(1):20-25.doi:10.3760/cma.j.issn.1673-9752.2011.01.006.
[2]Rahbari NN,Garden OJ,Padbury R,et al.Posthepatectomy liver failure:a definition and grading by the International Study Group of Liver Surgery (ISGLS)[J].Surgery,2011,149(5):713-724.doi:10.1016/j.surg.2010.10.001.149:713-724.
[3]Wang Z,Peng Y,Hu J,et al.Associating Liver Partition and Portal Vein Ligation for Staged Hepatectomy for Unresectable Hepatitis B Virus-related Hepatocellular Carcinoma:A Single Center Study of 45 Patients[J].Ann Surg,2020,271(3):534-541.doi:10.1097/SLA.0000000000002942.
[4]Glantzounis GK,Tokidis E,Basourakos SP,et al.The role of portal vein embolization in the surgical management of primary hepatobiliary cancers.A systematic review[J].Eur J Surg Oncol,2017,43(1):32-41.doi:10.1016/j.ejso.2016.05.026.
[5]Itoh S,Yoshizumi T,Shirabe K,et al.Functional remnant liver assessment predicts liver-related morbidity after hepatic resection in patients with hepatocellular carcinoma[J].Hepatol Res,2017,47(5):398-404.doi:10.1111/hepr.12761.
[6]Asenbaum U,Kaczirek K,Ba-Ssalamah A,et al.Post-hepatectomy liver failure after major hepatic surgery:not only size matters[J].Eur Radiol,2018,28(11):4748-4756.doi:10.1007/s00330-018-5487-y.
[7]Bennink RJ,Tulchinsky M,de Graaf W,et al.Liver function testing with nuclear medicine techniques is coming of age[J].Semin Nucl Med,2012,42(2):124-137.doi:10.1053/j.semnuclmed.2011.10.003.
[8]陆华泽,王小波,黎乐群.原发性肝癌术前肝储备功能评估方法的研究进展[J].中国普通外科杂志,2020,29(1):85-96.doi:10.7659/j.issn.1005-6947.2020.01.011.
Lu HZ,Wang XB,Li LQ.Advances in preoperative assessment of liver functional reserve in patients with primary liver cancer[J].Chinese Journal of General Surgery,2020,29(1):85-96.doi:10.7659/j.issn.1005-6947.2020.01.011.
[9]de Graaf W,Bennink RJ,Vetelainen R,et al.Nuclear imaging techniques for the assessment of hepatic function in liver surgery and transplantation[J].J Nucl Med,2010,51(5):742-752.doi:10.2967/jnumed.109.069435.
[10]Sumiyoshi T,Shima Y,Okabayashi T,et al.Functional discrepancy between two liver lobes after hemilobe biliary drainage in patients with jaundice and bile duct cancer:an appraisal using (99m)Tc-GSA SPECT/CT fusion imaging[J].Radiology,2014,273(2):444-451.doi:10.1148/radiol.14132735.
[11]Huang X,Chen Y,Shao M,et al.The value of 99mTc-labeled galactosyl human serum albumin single-photon emission computerized tomography/computed tomography on regional liver function assessment and posthepatectomy failure prediction in patients with hilar cholangiocarcinoma[J].Nucl Med Commun,2020,41(11):1128-1135.doi:10.1097/MNM.0000000000001263.
[12]Xiang C,Chen Y,Shao M,et al.Three-Dimensional Quantitative Evaluation of the Segmental Functional Reserve in the Cirrhotic Liver Using Multi-Modality Imaging[J].Medicine (Baltimore),2016,95(9):e2719.doi:10.1097/MD.0000000000002719.
[13]Akaki S,Kanazawa S,Tsunoda M,et al.Nontumorous decrease in Tc-99m GSA accumulation[J].Ann Nucl Med,2000,14(6):477-483.doi:10.1007/BF02988294.
[14]Yoshida M,Beppu T,Shiraishi S,et al.Liver Function in Areas of Hepatic Venous Congestion After Hepatectomy for Liver Cancer:(99m)Tc-GSA SPECT/CT Fused Imaging Study[J].Anticancer Res,2018,38(5):3089-3095.doi:10.21873/anticanres.12567.
[15]Igaki H,Tokuuye K,Takeda T,et al.Sequential evaluation of hepatic functional reserve by 99mTechnetium-galactosyl human serum albumin scintigraphy after proton beam therapy:a report of three cases and a review of the literatures[J].Acta Oncol,2006,45(8):1102-1107.doi:10.1080/02841860600690347.
[16]Tanaka O,Miki K,Taniguchi T,et al.99m-Technetium galactosyl human serum albumin scanning to evaluate liver function after stereotactic body radiotherapy for hepatocellular carcinoma:A case report[J].Radiol Case Rep,2019,14(11):1410-1414.doi:10.1016/j.radcr.2019.09.002.
[17]Son SH,Kay CS,Song JH,et al.Dosimetric parameter predicting the deterioration of hepatic function after helical tomotherapy in patients with unresectable locally advanced hepatocellular carcinoma[J].Radiat Oncol,2013,8:11.doi:10.1186/1748-717X-8-11.
[18]项灿宏,陈英茂,邵明哲,等.动态SPECT 99mTc半乳糖人血清清蛋白显像技术评估硬化肝脏的储备功能[J].中华外科杂志,2013,51(7):592-595.doi:10.3760/cma.j.issn.0529-5815.2013.07.004.
Xiang CH,Chen YM,Shao MZ,et al.Assessment of hepatic reserve function of cirrhosis liver using dynamic SPECT 99mTcgalactosyl human serum albumin scintigraphy[J].Chinese Journal of Surgery,2013,51(7):592-595.doi:10.3760/cma.j.issn.0529-5815.2013.07.004.
[19]Satoh K,Yamamoto Y,Nishiyama Y,et al.99mTc-GSA liver dynamic SPECT for the preoperative assessment of hepatectomy[J].Ann Nucl Med,2003,17(1):61-67.doi:10.1007/BF02988261.
[20]Beppu T,Hayashi H,Okabe H,et al.Liver functional volumetry for portal vein embolization using a newly developed 99mTc-galactosyl human serum albumin scintigraphy SPECT-computed tomography fusion system[J].J Gastroenterol,2011,46(7):938-943.doi:10.1007/s00535-011-0406-x.
[21]Akaki S,Okumura Y,Sasai N,et al.Hepatectomy simulation discrepancy between radionuclide receptor imaging and CT volumetry:influence of decreased unilateral portal venous flow[J].Ann Nucl Med,2003,17(1):23-29.doi:10.1007/BF02988255.
[22]童翾,项灿宏,陈英茂,等.动态单光子发射计算机断层扫描99Tcm-乙二烯三胺五醋酸-半乳糖人血清白蛋白显像技术评估行门静脉栓塞术前后肝叶功能变化的应用价值[J].中华消化外科杂志,2018,17(3):279-284.doi:10.3760/cma.j.issn.1673-9752.2018.03.012.
Tong X,Xiang CH,Chen YM,et al.Application value of dynamic SPECT 99 Tcm-GSA scintigraphy assessing regional liver function changes before and after portal vein embolization[J].Chinese Journal of Digestive Surgery,2018,17(3):279-284.doi:10.3760/cma.j.issn.1673-9752.2018.03.012.
[23]Ishizawa T,Fukushima N,Shibahara J,et al.Real-time identification of liver cancers by using indocyanine green fluorescent imaging[J].Cancer,2009,115(11):2491-2504.doi:10.1002/cncr.24291.
[24]van der Vorst JR,Schaafsma BE,Hutteman M,et al.Near-infrared fluorescence-guided resection of colorectal liver metastases[J].Cancer,2013,119(18):3411-3418.doi:10.1002/cncr.28203.
[25]白军军,李航,孙宝震,等.数字化三维重建技术在肝癌精准肝切除术中的应用[J].中国普通外科杂志,2018,27(7):826-833.doi:10.3978/j.issn.1005-6947.2018.07.005.
Bai JJ,Li H,Sun BZ,et al.Application of digital 3D reconstruction technique in precise hepatectomy for liver cancer[J].Chinese Journal of General Surgery,2018,27(7):826-833.doi:10.3978/j.issn.1005-6947.2018.07.005.
[26]Nagino M,Kamiya J,Nishio H,et al.Two hundred forty consecutive portal vein embolizations before extended hepatectomy for biliary cancer:surgical outcome and long-term follow-up[J].Ann Surg,2006,243(3):364-372.doi:10.1097/01.sla.0000201482.11876.14.
[27]Ebata T,Yokoyama Y,Igami T,et al.Portal vein embolization before extended hepatectomy for biliary cancer:current technique and review of 494 consecutive embolizations[J].Dig Surg,2012,29(1):23-29.doi:10.1159/000335718.
[28]Terasawa M,Allard MA,Golse N,et al.Sequential transcatheter arterial chemoembolization and portal vein embolization versus portal vein embolization alone before major hepatectomy for patients with large hepatocellular carcinoma:An intent-totreat analysis[J].Surgery,2020,167(2):425-431.doi:10.1016/j.surg.2019.09.023.
[29]Chan A,Zhang WY,Chok K,et al.ALPPS Versus Portal Vein Embolization for Hepatitis-related Hepatocellular Carcinoma:A Changing Paradigm in Modulation of Future Liver Remnant Before Major Hepatectomy[J].Ann Surg,2019.doi:10.1097/SLA.0000000000003433.[Online ahead of print]
[30]López-López V,Robles-Campos R,Brusadin R,et al.Tourniquet-ALPPS is a promising treatment for very large hepatocellular carcinoma and intrahepatic cholangiocarcinoma[J].Oncotarget,2018,9(46):28267-28280.doi:10.18632/oncotarget.25538.
